修回日期: 2015-03-11
接受日期: 2015-03-18
在线出版日期: 2015-04-28
目的: 探讨间质细胞衍生因子-1α(stromal cell-derived factor-1α, SDF-1α)的表达与胃癌淋巴结转移的关系.
方法: 应用免疫组织化学检测SDF-1α在152例胃癌组织中的表达, 将表达结果与患者临床病理特征进行相关性分析, 并对胃癌淋巴结的转移危险因素进行单因素分析和多因素分析.
结果: SDF-1α表达与肿瘤淋巴管浸润(P = 0.016)和淋巴结转移(P = 0.003)密切相关, 而与患者年龄、性别、肿瘤部位、肿瘤大小、大体分型、浸润深度和组织分化程度(P>0.05)等无相关性; 未分化的组织学(HR = 3.312; 95%CI: 1.414-7.825, P = 0.008)、淋巴管浸润(HR = 11.215; 95%CI: 2.780-45.978, P = 0.002)和SDF-1α(HR = 3.194; 95%CI: 1.313-7.296, P = 0.013)是胃癌患者的危险因素; 未分化的组织学(HR = 3.054; 95%CI: 1.176-8.614, P = 0.039)、淋巴管浸润(HR = 8.651; 95%CI: 1.731-44.959, P = 0.008)和SDF-1α(HR = 2.219; 95%CI: 1.327-10.346, P = 0.015)是胃癌患者淋巴结转移的独立危险因素.
结论: SDF-1α可能是胃癌患者淋巴结转移的独立危险因素.
核心提示: 本文探讨了间质细胞衍生因子-1α(stromal cell-derived factor-1α, SDF-1α)的表达与胃癌淋巴结转移的关系, 结论是SDF-1α很可能是胃癌淋巴结转移的独立危险因素. 如果上述结论被证实, SDF-1α可以作为胃癌淋巴结转移的预测指标, 更准确地对胃癌患者分期, 对胃癌的治疗有极大的指导意义. 甚至可以通过抑制SDF-1α来达到治疗胃癌的目的.
引文著录: 刘超, 朱晨宇, 王广胜, 朱耀明. SDF-1α可能是胃癌淋巴结转移的独立危险因素. 世界华人消化杂志 2015; 23(12): 1897-1902
Revised: March 11, 2015
Accepted: March 18, 2015
Published online: April 28, 2015
AIM: To explore the relationship between the expression of stromal cell-derived factor-1α (SDF-1α) and lymph node metastasis in gastric cancer patients.
METHODS: The expression of SDF-1α in gastric cancer tissues from 152 patients was detected by immunohistochemistry. The correlations of SDF-1α with clinicopathologic features were analyzed.
RESULTS: SDF-1α expression was significantly correlated with tumor lymphatic vessel invasion (P = 0.016) and lymph node metastasis (P = 0.003), but not with patients age, gender, tumor size, gross type, depth of invasion or degree of differentiation (P = 0.003). Undifferentiated histology (HR = 3.312; 95%CI: 1.414-7.825, P = 0.008), lymphatic vessel invasion (HR = 11.215; 95%CI: 2.780-45.978, P = 0.002) and SDF-1α expression (HR = 3.194; 95%CI: 1.313-7.296, P = 0.013) were identified to be risk factors for gastric cancer. Undifferentiated histology (HR = 3.054; 95%CI: 1.176-8.614, P = 0.039), lymphatic vessel invasion (HR = 8.651; 95%CI: 1.731-44.959, P = 0.008) and SDF-1α expression (HR = 2.219; 95%CI: 1.327-10.346, P = 0.015) were also identified to be independent risk factors for lymph node metastasis in gastric cancer patients.
CONCLUSION: SDF-1α may be an independent risk factor for lymph node metastasis in gastric cancer.
- Citation: Liu C, Zhu CY, Wang GS, Zhu YM. SDF-1α may be an independent risk factor for lymph node metastasis in gastric cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(12): 1897-1902
- URL: https://www.wjgnet.com/1009-3079/full/v23/i12/1897.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i12.1897
胃癌是一个重大的公共卫生问题, 在我国, 胃癌已成为死亡率第三的癌症[1]. 手术切除仍是胃癌主要的治疗方法, 术后组织病理学特征, 如原发肿瘤浸润深度和淋巴结受累程度作为重要预后因素的应用指导着术后综合治疗, 提高了生存率, 但胃癌的总体生存期仍然不能令人满意, 而淋巴结是否转移被认为是影响胃癌预后的显著因素, 有淋巴结转移者的生存率明显低于无转移者[2]. 有研究[3]试图利用分子标记来评估胃癌的预后. 间质细胞衍生因子-1α(stromal cell-derived factor-1α, SDF-1α)是一种表达在多种恶性肿瘤中, 在肿瘤发生, 增殖, 血管生成等方面有显著作用的小型细胞因子样蛋白质[4,5]. SDF-1α由在肿瘤微环境内占很大比例的间质细胞和各种类型的肿瘤细胞产生, 通过其唯一生理受体趋化因子受体4(CXCR4)的相互作用而发挥其功能[6-12]. 最近, 许多研究[13,14]已经表明, CXCR4和SDF-1之间的相互作用在肿瘤的转移中起重要作用. Iwasa等[15]报道CXCR4和SDF-1在胃癌表达的增加与肝脏转移显著相关. 我们推测CXCR4/SDF-1轴也参与了胃癌的淋巴结转移. 据报道[16], 在胃癌的病例中, SDF-1α在原发癌中的表达是患者癌症不同阶段的独立预后因素, 这表明SDF-1α可以作为一种生物标志物. 本研究就是探寻SDF-1α的表达和胃癌淋巴结转移之间可能的相关性.
152例胃癌组织标本均来自2011-11/2013-10在宜昌市中心人民医院行胃癌切除患者, 术后经病理证实. 所有病例术前均未接受放疗和化疗. 组织标本离体后立即取材, 每例标本分为2份, 一份用于病理检测, 另一部分4%多聚甲醛固定准备行苏木素-伊红染色和免疫组织化学. 该患者人群包括男98例, 女54例, 年龄35-76岁(平均年龄57.8岁).
1.2.1 免疫组织化学操作步骤: 免疫组织化学染色使用单克隆抗-SDF-1α抗体(MAB350, R&D Systems公司, 明尼阿波利斯, 美国明尼苏达州)进行免疫组织化学染色, 胃癌组织微块被切成4 µm切片, 贴覆于经过防脱片处理的玻片上, 68 ℃烤片30 min; 二甲苯脱蜡, 酒精梯度脱水; 3%过氧化氢孵育30 min; PBS洗涤3次, 每次5 min; 将切片浸入0.01 mol/L枸橼酸缓冲液(pH 6.0)中煮沸(95 ℃, 15-20 min)进行抗原修复, 将切片自然冷却至室温, PBS洗涤3次, 每次5 min; 除去PBS, 滴加一抗, 室温孵育30 min, PBS液冲洗3 min×3次; 除去PBS, 滴加二抗, 室温孵育30 min, PBS液冲洗3 min×3次; 除去PBS, 滴加预备好的显色剂DAB工作液, 室温孵育5 min; 蒸馏水冲洗, 终止显色, 苏木精复染; 常规脱水, 透明, 干燥, 中性树胶封片, 显微镜下进行观察分析并拍照.
1.2.2 结果判定: 结果由两位以上病理科医师独立进行观察判断, 由IPP软件统计每张照片阳性细胞所占百分率. 阳性细胞占有<30%为阴性, 百分比≥30%为阳性[17].
统计学处理 采用SPSS19.0软件进行统计分析. SDF-1α的表达与临床病理特征的相关性评估采用χ2检验, 有关淋巴结转移的因素分析, 采用Logistic回归分析. P<0.05为差异有统计学意义.
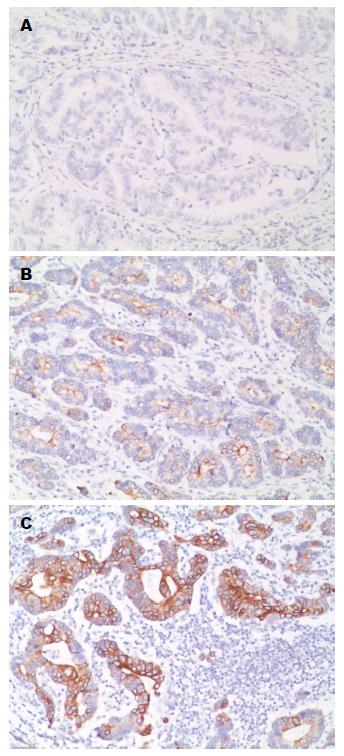
SDF-1α的表达(黄色为染色): 阴性(如图1A), 85例(55.9%), 阳性(如图1B, C), 67例(44.1%). 将患者按SDF-1α的表达分为两组, 在SDF-1α阳性组(n = 67)被定义为患者有SDF-1α的表达, 而SDF-1α阴性组(n = 85)定义为患者无SDF-1α的表达.
如表1, 年龄、性别、肿瘤部位、肿瘤大小、肿瘤大体分型、肿瘤浸润深度和组织分化程度等在SDF-1α阳性和阴性组差异无统计学意义. 然而, SDF-1α表达阳性组显著与淋巴管浸润(P = 0.016)和淋巴结转移(P = 0.003)相关.
| 特征 | SDF-1α阳性率%(n1/n) | χ2值 | P值 |
| 年龄(岁) | 1.754 | 0.185 | |
| ≤65 | 40.57(43/106) | ||
| >65 | 52.17(24/46) | ||
| 性别 | 0.744 | 0.388 | |
| 男 | 46.30(50/108) | ||
| 女 | 38.64(17/44) | ||
| 肿瘤部位 | 0.721 | 0.697 | |
| 胃底 | 28.57(2/7) | ||
| 胃体 | 44.58(37/83) | ||
| 胃窦 | 45.16(28/62) | ||
| 肿瘤大小(cm) | 0.357 | 0.550 | |
| ≤2 | 47.27(26/55) | ||
| >2 | 42.27(41/97) | ||
| 大体分型 | 3.013 | 0.390 | |
| 息肉样型 | 55.56(5/9) | ||
| 局限溃疡型 | 34.88(15/43) | ||
| 浸润溃疡型 | 45.45(40/88) | ||
| 弥漫浸润型 | 58.33(7/12) | ||
| 浸润深度 | 0.301 | 0.860 | |
| 黏膜及黏膜下 | 38.89(7/18) | ||
| 肌层及浆膜下 | 43.96(40/91) | ||
| 穿透浆膜 | 46.51(20/43) | ||
| 组织分化程度 | 0.003 | 0.953 | |
| 分化的 | 43.93(47/107) | ||
| 未分化的 | 44.44(20/45) | ||
| 淋巴管浸润 | 5.781 | 0.016 | |
| 无 | 31.58(18/57) | ||
| 有 | 51.58(49/95) | ||
| 淋巴结转移 | 8.776 | 0.003 | |
| 无 | 29.51(18/61) | ||
| 有 | 53.85(49/91) |
为了分析可能影响胃癌淋巴结转移的临床病理因素, 进行单因素分析. 如表2, 未分化组织学[风险比(HR) = 3.312; 95%CI: 1.414-7.825, P = 0.008], 淋巴管浸润(HR = 11.215; 95%CI: 2.780-45.978, P = 0.002)和SDF-1α阳性(HR = 3.194; 95%CI: 1.313-7.296, P = 0.013). 统计学上均是影响胃癌患者淋巴结转移的显著风险因素.
| 因素 | 风险比 | 95%CI | P值 |
| 年龄>65岁 | 1.423 | 0.575-3.352 | 0.498 |
| 男性 | 1.568 | 0.503-3.054 | 0.652 |
| 肿瘤部位(胃窦) | 1.071 | 0.457-2.488 | 0.846 |
| 肿瘤大小>2 cm | 2.654 | 0.898-6.479 | 0.081 |
| 大体分型(浸润溃疡型) | 1.902 | 0.605-5.913 | 0.310 |
| 浸润深度(肌层及浆膜下) | 2.316 | 0.283-16.977 | 0.511 |
| 组织分化程度(未分化) | 3.312 | 1.414-7.825 | 0.008 |
| 淋巴管浸润(有) | 11.215 | 2.780-45.978 | 0.002 |
| SDF-1α表达(阳性) | 3.194 | 1.313-7.296 | 0.013 |
为了确定这些变量独立的预后效果, 多变量分析采用Logistic回归分析进行. 结果再次表明, 未分化组织学(HR = 3.054; 95%CI: 1.176-8.614, P = 0.039), 淋巴管浸润(HR = 8.651, 95%CI: 1.731-44.959, P = 0.008)和SDF-1α阳性(HR = 2.219; 95%CI: 1.327-10.346, P = 0.015)是预测胃癌患者淋巴结转移的独立危险因素(表3).
| 因素 | 风险比 | 95%CI | P值 |
| 年龄>65岁 | 1.642 | 0.563-4.216 | 0.421 |
| 男性 | 1.723 | 0.561-4.268 | 0.432 |
| 肿瘤部位(胃窦) | 1.387 | 0.522-3.690 | 1.403 |
| 肿瘤大小>2 cm | 2.520 | 0.713-7.161 | 2.297 |
| 大体分型(浸润溃疡型) | 2.215 | 0.595-7.765 | 0.294 |
| 浸润深度(肌层及浆膜下) | 1.236 | 0.074-22.437 | 0.980 |
| 组织分化程度(未分化) | 3.054 | 1.176-8.614 | 0.039 |
| 淋巴管浸润(有) | 8.651 | 1.731-44.959 | 0.008 |
| SDF-1α表达(阳性) | 2.219 | 1.327-10.346 | 0.015 |
淋巴结转移被认为是影响胃癌患者5年生存率的最重要因素之一, 无淋巴结转移患者的5年生存率显著高于有淋巴结转移者[18]. 大量研究正在探寻胃癌淋巴结转移独特的生物学标志物.
SDF-1α通过与其特异性受体CXCR4相互作用促进肿瘤的进展, 研究[19]已经证明, CXCR4是在许多类型的癌症细胞表达的主要趋化因子受体. 并证明了CXCR4/SDF-1轴在细胞存活、增殖、迁移和肿瘤细胞黏附中扮演重要角色. CXCR4是肿瘤转移扩散到有SDF-1α表达的器官中必不可少的, 他使肿瘤细胞进入有利于肿瘤细胞存活和生长的环境[20]. Müller等[21]报道, 在人乳腺癌细胞系和原发性乳腺肿瘤以及转移淋巴结, 乳腺癌的代表性转移部位中都有高CXCR4的表达, 也有SDF-1α的高表达. Orimo等[22]报道, SDF-1α通过直接的旁分泌刺激显著影响CXCR4表达的人乳腺癌细胞. 因此, CXCR4和SDF-1α的表达可能代表了各种类型的癌症有价值的预后指标. 此外, 肿瘤模型中显示, CXCR4拮抗剂可能具有抗肿瘤活性, 这表明CXCR4和SDF-1α在各种不同的肿瘤的扩散和发展中起重要作用, 因此可能作为肿瘤新治疗的潜在目标[23].
最近, 某些报告已经表明, SDF-1α的表达与多种类型的癌症, 包括恶性神经胶质瘤、食道癌、非小细胞肺癌和大肠癌的进展和转移有关[24-28]. 在胃癌中, Sasaki等[26]报道, SDF-1α的表达显著与淋巴结转移、浸润深度、淋巴管浸润、肿瘤直径、更高的阶段有关. Sekiya等[29]还发现, SDF-1α在肠型胃癌的表达与淋巴管浸润和淋巴结及肝转移明显相关. 这些发现使人们猜测, SDF-1α是胃癌淋巴结转移的预测指标.
本研究中, 我们发现, SDF-1α在胃癌的表达显著与淋巴管浸润和淋巴结转移有关, 而与年龄、性别、肿瘤部位、肿瘤大小、大体类型、浸润深度或组织学无关(表1). 淋巴结转移危险因素的单因素分析结果显示, 淋巴管浸润、未分化的组织学和SDF-1α的表达是胃癌患者的危险因素(表2). 此外, 多因素分析清楚地表明, SDF-1α的表达是胃癌淋巴结转移的独立危险因素. 这些数据表明, SDF-1α的表达与胃癌患者淋巴结转移显著相关.
SDF-1α促进胃癌淋巴结转移的机制尚不清楚, 一种可能的解释是, SDF-1α参与肿瘤进展中的自分泌和/或旁分泌机制, 促使肿瘤细胞黏附在基底膜的层黏连蛋白上, 从而容易脱离原发灶, 侵入细胞外基质及基底膜, 进而穿过肿瘤内淋巴管[30,31]; 另一种可能的机制是, SDF-1α可能通过吸引内皮细胞到肿瘤微环境中促进肿瘤血管生成, 肿瘤细胞更具侵袭性, 表达趋化因子受体CXCR4的肿瘤细胞脱离原发肿瘤, 侵入淋巴结. 此外, 抑制SDF-1α/CXCR4受体途径可以抑制肿瘤的血管生成, 进而抑制胃癌的生长[32,33].
总之, 本研究表明, SDF-1α的表达可能是胃癌患者淋巴结转移的独立危险因素, 提示SDF-1α是一个有用的评估指标. 不过, 关于SDF-1α与胃癌淋巴结转移关系的机制, 还需更多的研究进一步阐明.
胃癌的死亡率逐年上升, 而淋巴结转移是影响胃癌患者5年生存率的最重要因素之一, 许多研究已经表明, 间质细胞衍生因子-1α(stromal cell-derived factor -1α, SDF-1α)的表达在肿瘤的转移中起重要作用, 另据报道, SDF-1α在胃癌表达的增加与肝脏转移显著相关. 我们推测SDF-1α也参与了胃癌的淋巴结转移. 这表明SDF-1α可以作为一种生物标志物. 本研究就是探寻SDF-1α的表达和胃癌淋巴结转移之间的相关性.
黄颖秋, 教授, 本溪钢铁(集团)总医院消化内科
SDF-1α通过与其特异性受体CXCR4相互作用促进肿瘤的进展, CXCR4是肿瘤转移扩散到有SDF-1α表达的器官中必不可少的, 他使肿瘤细胞进入有利于肿瘤细胞存活和生长的环境. 但SDF-1α和CXCR4相互作用的机制以及如何进一步促进胃癌进展, 包括淋巴结转移, 都尚不清楚. 此外, SDF-1α表达的测定是依赖免疫组织化学的, 更精确的方法如Western印迹, 定量mRNA表达, 或基因表达谱能否有同样的结论需要更多的实验去证实. 以上是当今研究的热点, 也是亟待解决的问题.
Arigami等报道, CXCR4表达显著与淋巴结转移有关. Yasumoto等报道, 体内和体外研究均表明CXCR4和/或SDF-1α在胃癌中的表达与腹膜转移相关. Ishigam等报道, SDF-1α的表达是胃癌的独立预后因素. 如本文所述, SDF-1α通过与CXCR4的相互作用促使肿瘤的进展和转移, 可能是胃癌淋巴结转移的独立危险因素.
本文探讨了SDF-1α与淋巴结转移的相关性, 证实了SDF-1α与胃癌淋巴结转移显著相关, 同时, 应用多变量分析的方法排除了其他因素的干扰, 确定了SDF-1α是胃癌淋巴结转移的独立危险因素, 进一步提高了SDF-1α潜在的临床研究价值.
本文的结论指出, SDF-1α很可能是胃癌淋巴结转移的独立危险因素. 如果最终应用多种研究方法证实了SDF-1α确实是胃癌淋巴结转移的独立危险因素, SDF-1α拮抗剂可能作为抗肿瘤药物用于动物实验, 进而临床试验, 甚至最终应用于临床治疗胃癌.
间质细胞衍生因子-1(SDF-1): 是一种强效的化学引诱物细胞因子, 具有各种生物功能, 例如干细胞动员、炎性细胞浸润和血管生成;
CXCR4/SDF-1轴: CXCR4是SDF-1在体内唯一的受体, CXCR4和SDF-1的相互作用促使了肿瘤的进展和转移, 把这种作用体系称为CXCR4/SDF-1轴.
本文探讨了SDF-1α表达与胃癌淋巴结转移的相关性, 对胃癌的预后评估有一定参考价值.
编辑: 郭鹏 电编:闫晋利
| 3. | 徐 秀连. Aurka、LGR5以及SDF-1在胃癌中的表达变化及其临床病理相关性的研究. 南充: 川北医学院 2013; . |
| 6. | 戴 伟钢, 董 文广, 王 天宝. SDF-1/CXCR4轴与肿瘤. 消化肿瘤杂志(电子版). 2010;2:115-118. |
| 7. | Tsuboi K, Kodera Y, Nakanishi H, Ito S, Mochizuki Y, Nakayama G, Koike M, Fujiwara M, Yamamura Y, Nakao A. Expression of CXCL12 and CXCR4 in pT3-stage gastric cancer does not correlate with peritoneal metastasis. Oncol Rep. 2008;20:1117-1123. [PubMed] |
| 8. | 王 静, 张 国新. OPN通过SDF-1/CXCR4轴调控胃癌细胞的生物学行为. 南京医科大学学报(自然科学版). 2013;33:1055-1059. |
| 9. | Lee HJ, Kim SW, Kim HY, Li S, Yun HJ, Song KS, Kim S, Jo DY. Chemokine receptor CXCR4 expression, function, and clinical implications in gastric cancer. Int J Oncol. 2009;34:473-480. [PubMed] |
| 10. | 邹 萍, 张 佐阳, 吴 继锋. 胃癌组织中CXCL12和CXCR4的表达及意义. 临床与实验病理学杂志. 2012;28:265-269. |
| 11. | 陈 友权, 于 燕妮. 趋化因子SDF-1及其受体CXCR4在进展期胃癌中的表达及临床意义. 2010;. |
| 12. | Lee HJ, Huang SM, Kim HY, Oh YS, Hwang JY, Liang ZL, Ki Min J, Yun HJ, Sul JY, Kim S. Evaluation of the combined expression of chemokine SDF-1α and its receptor CXCR4 as a prognostic marker for gastric cancer. Exp Ther Med. 2011;2:499-504. [PubMed] |
| 14. | Zhao BC, Zhao B, Han JG, Ma HC, Wang ZJ. Adipose-derived stem cells promote gastric cancer cell growth, migration and invasion through SDF-1/CXCR4 axis. Hepatogastroenterology. 2011;57:1382-1389. [PubMed] |
| 15. | Iwasa S, Yanagawa T, Fan J, Katoh R. Expression of CXCR4 and its ligand SDF-1 in intestinal-type gastric cancer is associated with lymph node and liver metastasis. Anticancer Res. 2009;29:4751-4758. [PubMed] |
| 16. | 陈 友权, 于 燕妮. 胃癌中SDF-1、CXCR4、MMP-2和MMP-9的表达及意义. 临床与实验病理学杂志. 2012;28:135-139, 143. |
| 17. | 杨 军, 康 安静, 苏 宝山, 陈 晓黎. 免疫组织化学检测结果判读进展. 中华临床医师杂志: 电子版. 2014;8:3699-3703. |
| 18. | Li C, Kim S, Lai JF, Oh SJ, Hyung WJ, Choi WH, Choi SH, Zhu ZG, Noh SH. Risk factors for lymph node metastasis in undifferentiated early gastric cancer. Ann Surg Oncol. 2008;15:764-769. [PubMed] |
| 19. | Bleul CC, Fuhlbrigge RC, Casasnovas JM, Aiuti A, Springer TA. A highly efficacious lymphocyte chemoattractant, stromal cell-derived factor 1 (SDF-1). J Exp Med. 1996;184:1101-1109. [PubMed] |
| 20. | Burger JA, Kipps TJ. CXCR4: a key receptor in the crosstalk between tumor cells and their microenvironment. Blood. 2006;107:1761-1767. [PubMed] [DOI] |
| 21. | Müller A, Homey B, Soto H, Ge N, Catron D, Buchanan ME, McClanahan T, Murphy E, Yuan W, Wagner SN. Involvement of chemokine receptors in breast cancer metastasis. Nature. 2001;410:50-56. [PubMed] |
| 22. | Orimo A, Gupta PB, Sgroi DC, Arenzana-Seisdedos F, Delaunay T, Naeem R, Carey VJ, Richardson AL, Weinberg RA. Stromal fibroblasts present in invasive human breast carcinomas promote tumor growth and angiogenesis through elevated SDF-1/CXCL12 secretion. Cell. 2005;121:335-348. [PubMed] [DOI] |
| 23. | Schimanski CC, Galle PR, Moehler M. Chemokine receptor CXCR4-prognostic factor for gastrointestinal tumors. World J Gastroenterol. 2008;14:4721-4724. [PubMed] [DOI] |
| 24. | Salmaggi A, Gelati M, Pollo B, Marras C, Silvani A, Balestrini MR, Eoli M, Fariselli L, Broggi G, Boiardi A. CXCL12 expression is predictive of a shorter time to tumor progression in low-grade glioma: a single-institution study in 50 patients. J Neurooncol. 2005;74:287-293. [PubMed] [DOI] |
| 25. | Calatozzolo C, Maderna E, Pollo B, Gelati M, Marras C, Silvani A, Croci D, Boiardi A, Salmaggi A. Prognostic value of CXCL12 expression in 40 low-grade oligodendrogliomas and oligoastrocytomas. Cancer Biol Ther. 2006;5:827-832. [PubMed] |
| 26. | Sasaki K, Natsugoe S, Ishigami S, Matsumoto M, Okumura H, Setoyama T, Uchikado Y, Kita Y, Tamotsu K, Hanazono K. Expression of CXCL12 and its receptor CXCR4 in esophageal squamous cell carcinoma. Oncol Rep. 2009;21:65-71. [PubMed] [DOI] |
| 27. | Wagner PL, Hyjek E, Vazquez MF, Meherally D, Liu YF, Chadwick PA, Rengifo T, Sica GL, Port JL, Lee PC. CXCL12 and CXCR4 in adenocarcinoma of the lung: association with metastasis and survival. J Thorac Cardiovasc Surg. 2009;137:615-621. [PubMed] [DOI] |
| 28. | Yoshitake N, Fukui H, Yamagishi H, Sekikawa A, Fujii S, Tomita S, Ichikawa K, Imura J, Hiraishi H, Fujimori T. Expression of SDF-1 alpha and nuclear CXCR4 predicts lymph node metastasis in colorectal cancer. Br J Cancer. 2008;98:1682-1689. [PubMed] |
| 29. | Sekiya R, Kajiyama H, Sakai K, Umezu T, Mizuno M, Shibata K, Yamamoto E, Fujiwara S, Nagasaka T, Kikkawa F. Expression of CXCR4 indicates poor prognosis in patients with clear cell carcinoma of the ovary. Hum Pathol. 2012;43:904-910. [PubMed] [DOI] |
| 30. | Rempel SA, Dudas S, Ge S, Gutiérrez JA. Identification and localization of the cytokine SDF1 and its receptor, CXC chemokine receptor 4, to regions of necrosis and angiogenesis in human glioblastoma. Clin Cancer Res. 2000;6:102-111. [PubMed] |
| 31. | Barbieri F, Bajetto A, Stumm R, Pattarozzi A, Porcile C, Zona G, Dorcaratto A, Ravetti JL, Minuto F, Spaziante R. Overexpression of stromal cell-derived factor 1 and its receptor CXCR4 induces autocrine/paracrine cell proliferation in human pituitary adenomas. Clin Cancer Res. 2008;14:5022-5032. [PubMed] [DOI] |
| 32. | Guleng B, Tateishi K, Ohta M, Kanai F, Jazag A, Ijichi H, Tanaka Y, Washida M, Morikane K, Fukushima Y. Blockade of the stromal cell-derived factor-1/CXCR4 axis attenuates in vivo tumor growth by inhibiting angiogenesis in a vascular endothelial growth factor-independent manner. Cancer Res. 2005;65:5864-5871. [PubMed] [DOI] |
| 33. | Yasumoto K, Koizumi K, Kawashima A, Saitoh Y, Arita Y, Shinohara K, Minami T, Nakayama T, Sakurai H, Takahashi Y. Role of the CXCL12/CXCR4 axis in peritoneal carcinomatosis of gastric cancer. Cancer Res. 2006;66:2181-2187. [PubMed] [DOI] |