修回日期: 2015-02-13
接受日期: 2015-03-09
在线出版日期: 2015-04-28
目的: 制备表面偶联抗表皮生长因子受体(epidermal growth factor receptor, EGFR)单抗的聚氰基丙烯酸正丁酯纳米微球(EGFR-grafted polybutylcyanoacrylate nanoparticles, EGFR-PBCA-NP), 研究负载吉西他滨(gemcitabine, GEM)的靶向纳米粒子对胰腺癌的治疗作用.
方法: (1)采用乳化聚合法制备负载GEM的纳米微球, 测定载药纳米粒的粒径、载药率、包封率; (2)建立裸鼠胰腺癌模型, 随机分为5组, 每组10只. 每3 d尾静脉给药1次, 治疗前测量肿瘤长径(a)和短径(b), 计算肿瘤体积. 治疗12 d停药后处死裸鼠剥离瘤体测量肿瘤大小, 对瘤体进行称质量并计算抑瘤率; (3)随机将荷瘤小鼠分为两组, 每组于给药后1、5、12 h处死, 提取肿瘤组织用于冰冻切片荧光观察.
结果: 与对照组相比各实验组移植瘤的瘤质量抑制率和体积差异具有统计学意义(P<0.05), 其中EGFR-GEM-PBCA-NP组显著优于其他各组. EGFR-Cy3-PBCA-NP组荧光强度于1、5、12 h均强于Cy3-PBCA-NP组, 并且实验组于5 h时荧光强度强于1、12 h.
结论: EGFR-GEM-PBCA-NP对EGFR阳性的裸鼠人胰腺癌移植瘤有明显的靶向性和显著的抑瘤作用.
核心提示: 聚氰基丙烯酸正丁酯毫微粒(polybutylcyanoacrylate nanoparticles)作为药物载体不但对药物有靶向传输功能还能有效克服化疗药物应用引起的相关不良反应. 我们严格限制纳米粒子粒径大小有效防止网状内皮系统(reticuloe endothelin system)对载药纳米粒子吞噬作用, 同时利用抗表皮生长因子受体(epidermal growth factor receptor, EGFR)单抗与胰腺癌表面EGFR特异性识别的特性发挥吉西他滨靶向治疗的作用.
引文著录: 李春梅, 张林, 侯艳红, 李楠, 车明环. 抗EGFR单抗偶联吉西他滨聚氰基丙烯酸正丁酯纳米粒对胰腺癌的靶向治疗. 世界华人消化杂志 2015; 23(12): 1890-1896
Revised: February 13, 2015
Accepted: March 9, 2015
Published online: April 28, 2015
AIM: To investigate the capability of epidermal growth factor receptor (EGFR)-grafted polybutylcyanoacrylate nanoparticles (EGFR-PBCA-NP) carrying gemcitabine (GEM) to treat pancreatic cancer.
METHODS: GEM nanoparticles were prepared by emulsion polymerization, and the particle size, drug-loading rate and encapsulation efficiency were characterized. Different numbers of PANC-1 cells in 100 μL PBS were inoculated subcutaneously into the right flank of Balb/c (nu/nu) mice to establish a xenograft model. The mice were divided into five groups (n = 10 each). The drugs were injected through the mouse tail vein to observe tumor inhibition. Every three days the short diameter and long diameter of tumors were measured to calculate tumor volume. After 12 d, the mice were killed. Tumor weight and volume were measured in nude mice bearing xenografts to calculate the tumor inhibition rate. Xenograft nude mice were randomly divided into two groups. Tumor tissues were removed from the mice which were sacrificed at 1, 5, and 12 h after the injection for frozen section fluorescence examinations.
RESULTS: As compared with the control group, the weight and volume of human pancreatic cancer xenografts of nude mice in the experimental group were decreased significantly (P < 0.05). The two indexes in the EGFR-GEM-PBCA-NP group were significantly better than those in other groups. In the experimental group (EGFR-Cy3-PBCA-NP), fluorescence intensity at 1, 5, and 12 h was stronger than that in the control group (Cy3-PBCA-NP), and fluorescence intensity in the experimental group at 5 h was stronger than that at 1 and 12 h.
CONCLUSION: EGFR-GEM-PBCA-NP shows a good receptor targeting ability and a significant inhibitory effect on human pancreatic cancer.
- Citation: Li CM, Zhang L, Hou YH, Li N, Che MH. Targeted delivery of gemcitabine to pancreatic adenocarcinoma using anti-EGFR antibody as a targeting agent. Shijie Huaren Xiaohua Zazhi 2015; 23(12): 1890-1896
- URL: https://www.wjgnet.com/1009-3079/full/v23/i12/1890.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i12.1890
胰腺癌恶性程度高且预后极差, 目前发病率呈不断的上升趋势, 其早期症状不典型, 至出现明显症状时多已进入晚期, 大多已失去了手术根治机会. 另外由于胰腺癌位置深, 周围有胃肠、脊髓等器官组织对放疗敏感性差且耐受剂量低, 故放疗效果亦不理想. 因此化疗作为中晚期胰腺癌的主要治疗措施受到广泛关注和重视. 尽管不断有新的抗肿瘤药物问世, 目前对于胰腺癌疗效最为肯定的仍是吉西他滨(gemcitabine, GEM)[1]. GEM是一种破坏细胞复制的二氟核苷类抗代谢物抗癌药, 目前主要用于晚期胰腺癌、晚期非小细胞肺癌、局限期或转移性膀胱癌及转移性乳腺癌的治疗[2-6]. 然而GEM给药后杀伤癌细胞的同时也损伤正常组织, 并且可能引发骨髓抑制和胃肠道毒性等严重不良反应[7], 以上因素均限制了该药在临床上的应用. 近来纳米粒载药系统的开发利用为实现抗肿瘤药的靶向及可控释放指明了新的方向[8,9]. 量子点[10]、磁性铁氧化物[11]、纳米金[12]以及可生物降解的聚合物[13]等纳米颗粒已经被开发用于癌症的诊断及治疗[8]. 氰基丙烯酸酯是目前研究最多的可生物降解材料之一, 代谢产物主要为CO2、NH3、尿素、尿酸等且均可经过自身代谢排出体外. 聚氰基丙烯酸正丁酯毫微粒(polybutylcyanoacrylate nanoparticles, PBCA-NP)是以氰基丙烯酸酯为单体通过控制其聚合条件制备出的毫微粒, 因其表面具有丰富的COOR、CN等基团, 不同特性的药物可通过聚合渗入运载于纳米粒子内部或利用化学与物理吸附的方式牢固地附着于纳米粒子表面. 然而, 粒径>100 nm纳米颗粒易受网状内皮系统(reticuloe endothelin system, RES)吞噬导致肿瘤部位药物浓度较低. 为了达到更好的生物利用度, PBCA纳米粒子通常偶联特异性单抗、转铁蛋白或肿瘤靶向短肽等物质实现物质主动靶向治疗的目的[14-16]. 表皮生长因子受体(epidermal growth factor receptor, EGFR)信号通路在细胞存活、增殖和分化的调节中具有重要作用[17-19]. 研究[20]发现在胰腺癌中EGFR表达上调, 他为癌症检测和治疗提供了靶向作用点. 因此, 将EGFR标记于PBCA纳米粒子表面将是一个靶向药物递送很好的介体. 本研究中我们成功制备了表面偶联抗EGFR单抗的载药PBCA-NP, 将EGFR的靶向识别作用与PBCA运载功能相结合, 就负载GEM的靶向纳米粒子对胰腺癌的治疗作用进行了初步的研究.
α-氰基丙烯酸正丁酯(BCA)(北京瞬康医用胶有限公司); Dextran-70、PluronicF-127(德国BASF公司); 西妥昔单抗(默克公司); 吲哚菁绿(Cy3, 上海晶纯生化科技股份有限公司); 其他试剂为国产分析纯. 85-2恒温加热磁力搅拌器(上海志威电器有限公司); 微孔滤膜(欣惠泽奥有限公司), Zeta sizer Nano ZS90型激光粒径分析仪(英国马尔文公司); H-600透射电镜(日本Hitachi公司); IX71荧光显微镜(日本Olympus公司). 人胰腺癌细胞株PANC-1(北京富众科技发展有限公司), 细胞培养于含胎牛血清、青霉素、链霉素的DMEM培养液中; 5-6周龄♂Balb/c-nu裸鼠由中国人民解放军309医院结核研究所动物实验室提供, 分笼饲养于SPF级动物实验室; FA604A电子天平(上海精天电子仪器有限公司); 游标卡尺(Mitutoyo/三丰).
1.2.1 纳米粒子的制备: GEM-PBCA-NP的制备: 称取Dxtran-70 100 mg、PluronicF-127 75 mg及GEM置于10 mL烧杯中加蒸馏水溶解, 用0.1 mol/L盐酸溶液调节pH至1.4, 定容至5 mL, 在25 ℃电磁600 r/min搅拌下缓加入0.06 mL α-BCA单体, 搅拌5 h后, 用0.1 mol/L NaOH溶液调节pH至7.0, 继续搅拌0.5 h, 用微孔滤膜过滤, 即得乳白色胶体溶液. 将微球稀释到合适的浓度后, 用激光散射粒度分析仪来观察微球粒径的大小及分布. GEM-PBCA-NP纳米粒子中GEM的含量用光谱法测定. EGFR-GEM-PBCA-NP的包封率和载药率由下述公式分别计算: 载药量 = 纳米粒子中GEM质量/纳米粒子质量×100%, 包封率 = 纳米粒子中GEM质量/GEM×100%投药量.
EGFR-GEM-PBCA-NP的制备: 将GEM-PBCA-NP与抗EGFR单克隆抗体溶于pH 7.4的SBF溶液中, 之后于一定转速磁力搅拌下按一定比例加入碳二亚胺溶液, 将所得溶液离心分离, 超声分散后用去离子水洗涤3遍, 冷冻干燥后可得到GEM-PBCA-NP与抗EGFR单克隆抗体的交联物EGFR-GEM-PBCA-NP. 用激光散射粒度分析仪来观察微球粒径的大小及分布. 并计算包封率及载药率.
荧光纳米粒子的制备: 将Dxtran-70、PluronicF-127及Cy3用蒸馏水溶解后作为水相, 余制备方式同GEM-PBCA-NP的制备. 将制备好的含荧光Cy3-PBCA-NP(含量: 0.5 mg/mL)用于制备含荧光的EGFR-Cy3-PBCA-NP, 方式同EGFR-GEM-PBCA-NP的制备.
1.2.2 胰腺癌裸鼠模型的构建: 取对数生长期的人胰腺癌PANC-1细胞株悬液, 调整细胞浓度至1×107个/mL供皮下接种. 取4-6周龄的裸鼠, 遵循无菌操作的原则, 于每只裸鼠右侧肩胛部皮下种植细胞悬液0.1 mL(含l×106个细胞). 建立荷人胰腺癌裸鼠皮下移植瘤模型. 裸鼠造模成功后第14天计算出每组裸鼠瘤体体积的平均值.
1.2.3 EGFR-GEM-PBCA-NP治疗裸鼠人胰腺癌模型: 50只裸鼠造模成功第14天后将荷瘤裸鼠随机分为5组. 组1: 西妥昔单抗偶联GEM聚氰基丙烯酸正丁酯纳米球组(EGFR-GEM-PBCA-NP, n = 10); 组2: GEM聚氰基丙烯酸正丁酯纳米球组(GEM-PBCA-NP, n = 10); 组3: GEM原料药组(GEM, n = 10); 组4: 聚氰基丙烯酸正丁酯纳米粒组(PBCA-NP, n = 10); 组5: 生理盐水组(NS). 其中组1、2、3每次给药时GEM的量均为2.5 mg/kg, 组4、5分别给予等量的纳米粒子溶液和生理盐水. 每3 d尾静脉给药1次. 利用游标卡尺测量治疗前(造模第14天)肿瘤长径(a)和短径(b), 每个径线均测3次取平均值计算肿瘤体积, 肿瘤体积V = a×b2×1/2. 同样利用游标卡尺于用药后计算肿瘤体积1次/3 d. 治疗12 d停药后处死裸鼠剥离瘤体测量肿瘤大小, 对瘤体进行称质量并计算抑瘤率, 抑瘤率 = (1-治疗组平均瘤质量/对照组平均瘤质量)×100%. 给药期间对裸鼠生存状态进行监测.
1.2.4 荧光纳米粒子于肿瘤组织的分布: 随机取6只荷瘤小鼠分为2组: 实验组注射EGFR-Cy3-PBCA-NP溶液(10 mg/kg)与对照组注射等量Cy3-PBCA-NP. 分别于1、5、12 h行颈椎脱臼处死小鼠, 取肿瘤组织, 用生理盐水洗净, 滤纸吸干多余水分, 迅速放入液氮中冷冻、随后将冰冻组织切片, 将组织切片贴于载玻片后, 用P0126封片, 置于倒置荧光显微镜下检测激发Cy3所发的荧光.
统计学处理 计量资料均以mean±SD表示, 应用SPSS16.0统计软件进行统计分析, 两组间均数的比较采用t检验, P<0.05为差异有统计学意义.
所得到的纳米颗粒为光滑和独特的球形, 药物均匀地分散在聚合物基质中. 具有或不具有表面修饰的纳米粒表现出相似的物理特性. GEM-PBCA-NP和EGFR-GEM-PBCA-NP纳米粒的平均尺寸分别为48.9 nm±3.05 nm和53.6 nm±2.24 nm. GEM的包封率和载药量在GEM-PBCA-NP和EGFR-GEM-PBCA-NP纳米粒分别为51.23%±2.96%、47.58%±1.97%、5.87%±0.81%、5.34%±0.75%, 可见表面修饰后纳米粒子并无明显变化. 同时成功制备了Cy3-PBCA-NP、EGFR-Cy3-PBCA-NP两种纳米粒子.
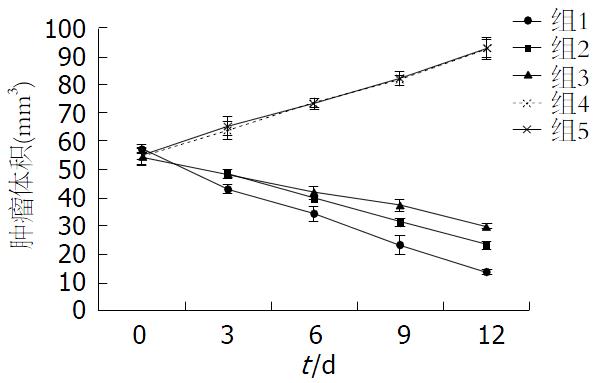
利用公式计算肿瘤体积, 于第12天完成最后1次测量后, 分别按分组对应记录肿瘤体积数据(表1, 图1)进行统计学分析, 第3、6、9、12天的GEM、GEM-PBCA-NP、EGFR-GEM-PBCA-NP组的肿瘤体积与生理盐水对照组比较差异有统计学意义(P<0.05). 其中EGFR-GEM-PBCA-NP抑瘤效果最强. 在各组与GEM单药组进行比较时, 除了与第3天GEM-PBCA-NP组比较, 差异无统计学意义(P>0.05), 其他两两比较差异均具有统计学意义(P<0.05).
| 分组 | 治疗前 | 治疗后 | |||
| 3 d | 6 d | 9 d | 12 d | ||
| 组1 | 57.27±1.57 | 43.30±1.61a | 34.24±2.63a | 23.21±3.75a | 13.73±1.19a |
| 组2 | 54.45±3.24 | 48.44±1.81a | 39.84±0.47a | 31.27±1.35a | 23.15±1.78a |
| 组3 | 54.45±2.86 | 48.60±0.86a | 42.07±1.75a | 37.25±2.30a | 29.94±1.14a |
| 组4 | 54.45±3.10 | 64.02±3.21 | 73.63±1.59 | 81.62±1.78 | 92.80±3.11 |
| 组5 | 54.86±1.19 | 65.22±3.35 | 73.24±2.04 | 82.07±2.36 | 92.91±3.79 |
荷瘤裸鼠治疗12 d停药后处死剥离瘤体, 对瘤体进行称质量并利用公式计算抑瘤率(表2). EGFR-GEM-PBCA-NP组(24.53 mg±3.72 mg)、GEM-PBCA-NP组(35.82 mg±5.44 mg)、GEM组(49.89 mg±6.11 mg)瘤质量与对照组比较差异有统计学意义(P<0.05). EGFR-GEM-PBCA-NP、GEM-PBCA-NP、GEM组两两比较差异均有统计学意义(P<0.05).
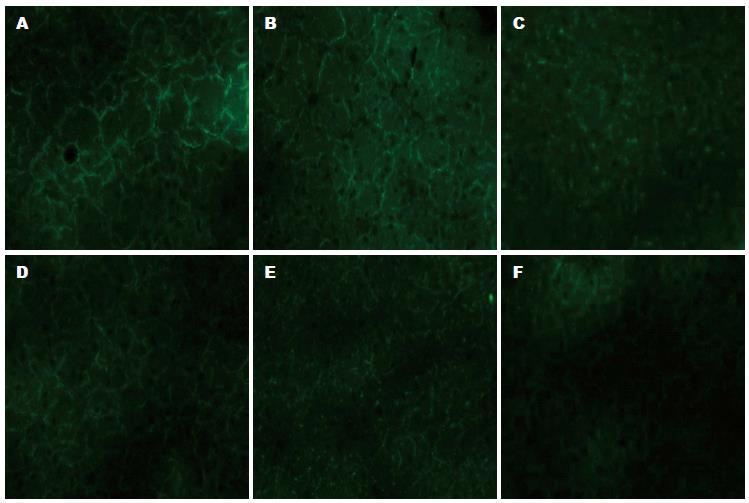
实验组小鼠尾静脉注射EGFR-Cy3-PBCA-NP, 对照组注射Cy3-PBCA-NP, 分别于1、5、12 h将小鼠肿瘤剥离制作冰冻切片, 在荧光显微镜下观察并采集图像(图2). 实验组(EGFR-Cy3-PBCA-NP)荧光强度于1、5、12 h均强于对照组(Cy3-PBCA-NP). 且实验组于5 h时荧光强度强于1、12 h.
PBCA-NP作为药物载体不但对药物有靶向传输功能还能起到药物缓释作用, 从而有效克服癌症患者化疗药物应用引起的相关问题, 如全身性毒性、生物利用度差以及药物代谢途径异常等[21-23]. 在本研究中, 为了能延长GEM在体内的作用时间和实现对实体瘤治疗靶向性, 我们通过乳化聚合法制备了包被GEM的PBCA纳米粒, 另外为了防止载药纳米粒被RES巨噬细胞吞噬, 我们将纳米粒子粒径限制为100 nm以下, 结合我们前期的预实验研究发现48.9 nm±3.05 nm PBCA-NP在胰腺组织中分布明显, 且优于粒径为20、100、150、200 nm左右的纳米粒子. 因此此次试验我们制作了48.9 nm±3.05 nm GEM-PBCA-NP和53.6 nm±2.24 nm的EGFR-GEM-PBCA-NP实现纳米粒子在体内重新分布, 从而增加肿瘤部位聚集可能. 结果显示制备的纳米粒子分布均匀且稳定性较好, 基本符合进一步研究需要. 前期国外相关研究[20,24]已证明EGFR在胰腺癌中呈现过表达, 并且将其标记于纳米粒子表面作为药物、基因的靶向运输标志物, 证明了EGFR具有明显的靶向识别作用[25-27]. 因此设想将其标记于PBCA-NP表面即能发挥PBCA的优势又能增强其对肿瘤的靶向性. 将为未来医学领域胰腺癌的临床治疗产生巨大影响.
按照分组将制备的试剂分别按照组别注射入小鼠体内, 定期观察并测定瘤体的长、短径, 并计算出各时段的肿瘤体积. 通过实验结果可知用药后3 d起GEM、GEM-PBCA-NP、EGFR-GEM-PBCA-NP 3组与对照组(NS组)比较均具有明显的肿瘤抑制作用, 其中EGFR-GEM-PBCA-NP组的肿瘤抑制能力强于GEM组、GEM-PBCA-NP组. PBCA-NP组与NS组比较差异无统计学意义, 说明PBCA-NP无肿瘤抑制作用且不干扰实验结果. 于15 d后处死小鼠称取瘤质量、计算肿瘤抑制率, 结果与肿瘤体积变化得出相同结论. 综合不同组别荷瘤小鼠瘤体体积及质量变化, 可以发现GEM经过PBCA包载后抑瘤效果强于未经处理的单药组, 这体现出PBCA-NP缓释药物的优势, 从而延长药物在体内的循环时间发挥更好的抗肿瘤效应. 另外由于PBCA-NP表面易于修饰, 将抗EGFR单抗偶联于PBCA-NP表面, 利用抗EGFR单抗与胰腺癌表面EGFR特异性识别的特性发挥GEM靶向治疗的作用. EGFR-GEM-PBCA-NP组肿瘤体积大小及抑瘤率明显强于其他组的实验结果给予以上理论有力的证明. 为了直观上观察抗EGFR单抗对于胰腺癌细胞的靶向性, 将其标记于具有荧光显像功能的Cy3-PBCA-NP表面, 观察其在肿瘤部位的聚集情况, 实验结果从直观上就抗EGFR单抗的胰腺癌细胞靶向性给予肯定, 进一步证明了抗EGFR单抗作为胰腺癌靶向治疗配体的可行性.
本实验仍有不足, 在纳米粒径选择上还有很大空间, 如在<100 nm的粒径范围内通过调控制备条件、原料剂量及稳定剂的类型可细化多个粒径, 通过动物实验对比筛选出胰腺癌靶向治疗的最佳粒径. 另外在纳米粒子表面修饰物的选择上还有很大研究空间, 如其他一些胰腺癌细胞靶向识别因子HER2、CKAAKN肽、CA19-9等[28-30]. 因此可以就不同靶向因子靶向性强弱作为研究对象, 从中筛选出最佳靶向配体, 从而实现最大限度的胰腺癌靶向治疗. 综合以上不足, 进一步完善实验方案, 将是我们未来的研究重点.
聚氰基丙烯酸正丁酯(polybutyl-cyanoacrylate, PBCA)是目前研究最为广泛和深入的纳米材料之一. 已有研究利用聚氰基丙烯酸正丁酯毫微粒(polybutylcyanoacrylate nanoparticles, PBCA-NP)为载体运载5-氟尿嘧啶、吉西他滨、顺铂等抗肿瘤药物应用于各部位肿瘤治疗, 其中包括胰腺癌. 然而纳米粒子本身没有与肿瘤细胞特异性结合的靶向性特点, 单纯的纳米粒子难以在肿瘤细胞内集聚, 将表皮生长因子受体(epidermal growth factor receptor, EGFR)偶联于纳米粒子表面可起到肿瘤靶向治疗作用.
肖恩华, 教授, 中南大学湘雅二医院放射教研室; 杜奕奇, 副教授, 中国人民解放军第二军医大学长海医院
通过特殊工艺EGFR可与纳米粒子结合形成螯合剂起到靶向导向作用, 另外严格限制纳米粒子粒径大小可有效逃避网状内皮系统(reticuloe endothelin system, RES)吞噬功能, 使载药纳米粒子最大限度发挥治疗作用.
钱亦淳等观察偶联西妥昔单抗(C225)的金纳米颗粒(AuNPs)对肺腺癌A549细胞株的作用, 研究其对细胞功能以及相关蛋白的影响并探讨其分子机制. 结果发现C225-AuNPs能够显著抑制肺腺癌细胞增殖、迁移, 促进凋亡.
本研究独创性的制备了表面偶联抗EGFR单抗的载药PBCA-NP, 并将纳米粒子大小限定于100 nm以下, 将抗EGFR单抗与胰腺癌细胞的靶向识别作用与PBCA运载功能相结合, 为胰腺癌靶向性化疗研究方面提供了新的思路.
本研究方法中为了直观上观察抗EGFR单抗对于胰腺癌细胞的靶向性, 将其标记于Cy3-PBCA-NP表面, 在荧光显微镜下观察其在肿瘤部位的聚集情况, 从直观上就抗EGFR单抗的胰腺癌细胞靶向性给予肯定. 同时结合给药后瘤体体积与质量变化等定量方法, 从定性及定量两方面对靶向纳米粒子对胰腺癌的治疗作用进行综合分析.
网状内皮系统(RES): 人体内各处凡是具有吞噬能力的细胞, 如结缔组织中的巨噬细胞、血窦和淋巴窦中的网状细胞及内皮细胞等, 都归纳成为一个系统, 并认为他们都是共同来源于网状细胞;
表皮生长因子受体(EGFR): 本身具有酪氨酶激酶活性, 一旦与表皮生长因子(EGF)组合可启动细胞核内的有关基因, 从而促进细胞分裂增殖. 胰腺癌、胃癌、乳腺癌、膀胱癌和头颈部鳞癌的EGFR表达增高.
本文对抗EGFR单抗偶联吉西他滨聚氰基丙烯酸正丁酯纳米粒对胰腺癌靶向治疗开展了实验研究, 总体设计有创新性, 研究结果对于设计新型胰腺癌抗肿瘤药物提供了新的思路, 研究设计较好.
编辑: 韦元涛 电编:闫晋利
| 1. | Cohen SJ, Pinover WH, Watson JC, Meropol NJ. Pancreatic cancer. Curr Treat Options Oncol. 2000;1:375-386. [PubMed] [DOI] |
| 2. | Chao YJ, Sy ED, Hsu HP, Shan YS. Predictors for resectability and survival in locally advanced pancreatic cancer after gemcitabine-based neoadjuvant therapy. BMC Surg. 2014;14:72. [PubMed] [DOI] |
| 3. | Meoni G, Cecere FL, Lucherini E, Di Costanzo F. Medical treatment of advanced non-small cell lung cancer in elderly patients: a review of the role of chemotherapy and targeted agents. J Geriatr Oncol. 2013;4:282-290. [PubMed] [DOI] |
| 4. | de Sousa Cavalcante L, Monteiro G. Gemcitabine: metabolism and molecular mechanisms of action, sensitivity and chemoresistance in pancreatic cancer. Eur J Pharmacol. 2014;741:8-16. [PubMed] [DOI] |
| 5. | Watanabe M, Hara F, Kiyoto S, Takahashi M, Takabatake D, Takashima S, Aogi K, Ohsumi S. [Clinical experience with gemcitabine treatment for metastatic breast cancer]. Gan To Kagaku Ryoho. 2013;40:1355-1359. [PubMed] |
| 6. | Le HK, Graham L, Cha E, Morales JK, Manjili MH, Bear HD. Gemcitabine directly inhibits myeloid derived suppressor cells in BALB/c mice bearing 4T1 mammary carcinoma and augments expansion of T cells from tumor-bearing mice. Int Immunopharmacol. 2009;9:900-909. [PubMed] [DOI] |
| 7. | Green MR. Gemcitabine safety overview. Semin Oncol. 1996;23:32-35. [PubMed] |
| 8. | Wang EC, Wang AZ. Nanoparticles and their applications in cell and molecular biology. Integr Biol (Camb). 2014;6:9-26. [PubMed] [DOI] |
| 9. | Liboiron BD, Mayer LD. Nanoscale particulate systems for multidrug delivery: towards improved combination chemotherapy. Ther Deliv. 2014;5:149-171. [PubMed] [DOI] |
| 10. | Ahmad J, Wahab R, Siddiqui MA, Musarrat J, Al-Khedhairy AA. Zinc oxide quantum dots: a potential candidate to detain liver cancer cells. Bioprocess Biosyst Eng. 2015;38:155-163. [PubMed] |
| 11. | Orel V, Shevchenko A, Romanov A, Tselepi M, Mitrelias T, Barnes CH, Burlaka A, Lukin S, Shchepotin I. Magnetic properties and antitumor effect of nanocomplexes of iron oxide and doxorubicin. Nanomedicine. 2015;11:47-55. [PubMed] [DOI] |
| 12. | Rippel RA, Seifalian AM. Gold revolution--gold nanoparticles for modern medicine and surgery. J Nanosci Nanotechnol. 2011;11:3740-3748. [PubMed] [DOI] |
| 13. | Devulapally R, Paulmurugan R. Polymer nanoparticles for drug and small silencing RNA delivery to treat cancers of different phenotypes. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 2014;6:40-60. [PubMed] [DOI] |
| 14. | Reukov V, Maximov V, Vertegel A. Proteins conjugated to poly(butyl cyanoacrylate) nanoparticles as potential neuroprotective agents. Biotechnol Bioeng. 2011;108:243-252. [PubMed] [DOI] |
| 15. | Bernstein LR, Tanner T, Godfrey C, Noll B. Chemistry and pharmacokinetics of gallium maltolate, a compound with high oral gallium bioavailability. Met Based Drugs. 2000;7:33-47. [PubMed] [DOI] |
| 16. | Xu ZR, Wang WF, Liang XF, Liu ZH, Liu Y, Lin L, Zhu X. Protective Effects of Poly (butyl) Cyanoacrylate Nanoparticles Containing Vasoactive Intestinal Peptide Against 6-Hydroxydopamine-Induced Neurotoxicity In Vitro. J Mol Neurosci. 2014; Oct 19. [Epub ahead of print]. [PubMed] [DOI] |
| 17. | Jutten B, Rouschop KM. EGFR signaling and autophagy dependence for growth, survival, and therapy resistance. Cell Cycle. 2014;13:42-51. [PubMed] [DOI] |
| 18. | Ayuso-Sacido A, Moliterno JA, Kratovac S, Kapoor GS, O'Rourke DM, Holland EC, García-Verdugo JM, Roy NS, Boockvar JA. Activated EGFR signaling increases proliferation, survival, and migration and blocks neuronal differentiation in post-natal neural stem cells. J Neurooncol. 2010;97:323-337. [PubMed] [DOI] |
| 19. | Zhou C, Qiu L, Sun Y, Healey S, Wanebo H, Kouttab N, Di W, Yan B, Wan Y. Inhibition of EGFR/PI3K/AKT cell survival pathway promotes TSA's effect on cell death and migration in human ovarian cancer cells. Int J Oncol. 2006;29:269-278. [PubMed] [DOI] |
| 20. | Harsha HC, Jimeno A, Molina H, Mihalas AB, Goggins MG, Hruban RH, Schulick RD, Kamath U, Maitra A, Hidalgo M. Activated epidermal growth factor receptor as a novel target in pancreatic cancer therapy. J Proteome Res. 2008;7:4651-4658. [PubMed] [DOI] |
| 21. | Kolter M, Ott M, Hauer C, Reimold I, Fricker G. Nanotoxicity of poly(n-butylcyano-acrylate) nanoparticles at the blood-brain barrier, in human whole blood and in vivo. J Control Release. 2015;197:165-179. [PubMed] [DOI] |
| 22. | Jin X, Huang A, Ping Q, Cao F, Su Z. Box-Behnken optimization design and enhanced oral bioavailability of thymopentin-loaded poly (butyl cyanoacrylate) nanoparticles. Pharmazie. 2011;66:339-347. [PubMed] |
| 23. | Couvreur P, Kante B, Roland M, Speiser P. Adsorption of antineoplastic drugs to polyalkylcyanoacrylate nanoparticles and their release in calf serum. J Pharm Sci. 1979;68:1521-1524. [PubMed] [DOI] |
| 24. | Valsecchi ME, McDonald M, Brody JR, Hyslop T, Freydin B, Yeo CJ, Solomides C, Peiper SC, Witkiewicz AK. Epidermal growth factor receptor and insulinlike growth factor 1 receptor expression predict poor survival in pancreatic ductal adenocarcinoma. Cancer. 2012;118:3484-3493. [PubMed] [DOI] |
| 25. | Xu J, Singh A, Amiji MM. Redox-responsive targeted gelatin nanoparticles for delivery of combination wt-p53 expressing plasmid DNA and gemcitabine in the treatment of pancreatic cancer. BMC Cancer. 2014;14:75. [PubMed] [DOI] |
| 26. | Wang Y, Zhou J, Qiu L, Wang X, Chen L, Liu T, Di W. Cisplatin-alginate conjugate liposomes for targeted delivery to EGFR-positive ovarian cancer cells. Biomaterials. 2014;35:4297-4309. [PubMed] [DOI] |
| 27. | Gao J, Xia Y, Chen H, Yu Y, Song J, Li W, Qian W, Wang H, Dai J, Guo Y. Polymer-lipid hybrid nanoparticles conjugated with anti-EGF receptor antibody for targeted drug delivery to hepatocellular carcinoma. Nanomedicine (Lond). 2014;9:279-293. [PubMed] [DOI] |
| 28. | Arora S, Swaminathan SK, Kirtane A, Srivastava SK, Bhardwaj A, Singh S, Panyam J, Singh AP. Synthesis, characterization, and evaluation of poly (D,L-lactide-co-glycolide)-based nanoformulation of miRNA-150: potential implications for pancreatic cancer therapy. Int J Nanomedicine. 2014;9:2933-2942. [PubMed] |
| 29. | Valetti S, Maione F, Mura S, Stella B, Desmaële D, Noiray M, Vergnaud J, Vauthier C, Cattel L, Giraudo E. Peptide-functionalized nanoparticles for selective targeting of pancreatic tumor. J Control Release. 2014;192:29-39. [PubMed] |
| 30. | Girgis MD, Federman N, Rochefort MM, McCabe KE, Wu AM, Nagy JO, Denny C, Tomlinson JS. An engineered anti-CA19-9 cys-diabody for positron emission tomography imaging of pancreatic cancer and targeting of polymerized liposomal nanoparticles. J Surg Res. 2013;185:45-55. [PubMed] [DOI] |