修回日期: 2015-03-10
接受日期: 2015-03-18
在线出版日期: 2015-04-28
目的: 分析大鼠肝纤维化发展成为肝癌过程中肝组织差异表达的蛋白, 以寻找其发展过程中的关键蛋白.
方法: 以二乙基亚硝胺(diethylinitrosamine, DEN)建立大鼠肝纤维化-肝癌模型, 采用同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation, iTRAQ)技术结合2D-LC-MS/MS(two dimensional liquid chromatography-tandem mass spectrometry)定量蛋白质组学技术, 分析和鉴定建模过程中的第4、10、12、18周肝组织蛋白质的差异表达, 经生物信息学分析差异表达的蛋白质功能.
结果: 质谱分析共鉴定到530种蛋白质. 4个时间点鉴定到的差异蛋白质数量分别为128、113、106、127个, 均重复鉴定到的差异蛋白为49个, 其中上调蛋白37个, 下调蛋白12个. 通过对这些差异蛋白进行功能分析, 发现他们参与翻译后修饰、转录、重组和信号传导等过程.
结论: iTRAQ结合LC-ESI-MS/MS定量蛋白质组学技术能整体、动态分析的大鼠肝纤维化演变肝癌过程中的蛋白质表达变化, 其中鉴定到过氧化物还原酶1(peroxiredoxin-1, Prdx1)、过氧化物还原酶2(peroxiredoxin-2, Prdx2)、硫代硫酸硫基转移酶(thiosulfate sulfurtransferase, Tst)、真核翻译起始因子3b(eukaryotic translation initiation factor 3 subunit b, eIF3b)、α2-HS-糖蛋白(alpha-2-HS-glycoprotein, Ahsg)和超氧化物歧化酶1(superoxide dismutase 1, SOD1)蛋白可能是肝纤维化发展为肝癌过程中的关键蛋白, 值得进一步深入探讨研究.
核心提示: 本文利用同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation, iTRAQ)技术筛选肝纤维化发展为肝癌过程中的差异蛋白, 分析得到的6种关键蛋白对下一步寻找肝癌早期诊断指标奠定基础.
引文著录: 付娆, 张学荣, 廖明, 付道莹. 以iTRAQ技术分析大鼠肝纤维化发展成肝癌过程中肝组织差异表达的蛋白质. 世界华人消化杂志 2015; 23(12): 1873-1882
Revised: March 10, 2015
Accepted: March 18, 2015
Published online: April 28, 2015
AIM: To identify differentially expressed proteins in rat hepatocarcinogenesis.
METHODS: Sprague-Dawley rats were randomly divided into a diethylinitrosamine (DEN) group and a normal control group. The DEN group was administrated 0.01% DEN solution in water for 18 wk, and the control group was given vehicle. The animals were sacrificed at the end of the 4th, 10th, 12th, or 18th week. Liver tissue proteins were quantified and identified using the isobaric tags for relative an absolute quantitation (iTRAQ) technology with two dimensional liquid chromatography-tandem mass spectrometry (2DLC-MS/MS). The functions of differentially expressed proteins were analyzed by bioinformatics.
RESULTS: A total of 530 proteins were identified by MS, and the numbers of differentially expressed proteins at the four time points were 128, 113, 106 and 127, respectively. Forty-nine proteins were identified simultaneously at two or more time points, of which 37 were up-regulated and 12 down-regulated. Bioinformatics analysis indicated that differentially expressed proteins are associated with post-translational modification, transcription, recombination and signal transduction pathways.
CONCLUSION: The protein changes in the process of rat hepatocarcinogenesis can be observed dynamically by iTRAQ combined with LC-ESI-MS/MS. Six proteins (peroxiredoxin-1, peroxiredoxin-2, thiosulfate sulfurtransferase, eukaryotic translation initiation factor 3 subunit b, alpha-2-HS-glycoprotein, and superoxide dismutase 1) are associated closely with hepatic fibrosis or hepatic carcinoma, and they may play critical roles in hepatocarcinogenesis.
- Citation: Fu R, Zhang XR, Liao M, Fu DY. Proteomic identification of differentially expressed proteins in rat hepatocarcinogenesis using iTRAQ technology. Shijie Huaren Xiaohua Zazhi 2015; 23(12): 1873-1882
- URL: https://www.wjgnet.com/1009-3079/full/v23/i12/1873.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i12.1873
肝纤维化是肝硬化、肝癌乃至肝功能衰竭的共同病理基础和必经阶段. 近年来, 研究者对肝纤维化与肝癌的关系进行了尝试性研究, 在研究肝纤维化发展成肝癌过程的相关因子中, 有研究[1-4]发现与肝纤维化密切相关的Toll样受体4(Toll-like receptor-4)、髓样分化因子88(myeloid differentiation factor 88)和核因子κB有促进肝癌作用. 另外, Matsuzaki等[5]报道肝纤维化因子转化生长因子(transforming growth factor, TGF)-βl在肝癌的进程中, 能促进肝癌的发生, 可通过上调E-钙黏蛋白(E-cadherin), 阻断TGF-βl受体激肽抑制, 阻止肝癌细胞的移行和侵袭[6-8].
尽管肝纤维化是慢性肝病发展成肝癌的主要中心环节. 但是, 迄今肝纤维化促肝癌的发生机制仍不清, 临床上更是缺乏肝纤维化转化成肝癌的预警检测指标. 而一直以来, 动物模型是肿瘤基础研究中的重要材料, 更是筛选肿瘤多阶段演进过程中的关键因子时不可或缺的手段. 我们曾经利用二乙基亚硝胺(diethylinitrosamine, DEN)建立了大鼠肝纤维化-肝癌模型, 并动态观察大鼠肝纤维化-肝癌发生过程中的病理形态特点. HE染色显示了肝脏损伤、坏死-肝纤维化-肝癌的发展过程, 该动物模型可动态观察肝癌发生发展进程[9].
同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation, iTRAQ)技术能精确定性和定量, 且具有极高灵敏度, 非常适合于高通量的筛选和鉴定组织中蛋白质表达水平的差异[10,11]. 因此, 为从整体、动态、网络的水平上对肝纤维化发展成肝癌过程中涉及的关键蛋白质进行研究, 本项目以大鼠肝纤维化-肝癌模型, 通过iTRAQ技术分析在造模过程中不同时间点大鼠肝组织中蛋白质的表达差异, 探寻肝纤维化发展成为肝癌的关键蛋白质.
♂, SD大鼠, 体质量180-220 g, 由广西医科大学实验动物中心提供, 合格证号: SCXK桂(2013-0003). 哺乳动物组织蛋白裂解液(Thermo); Protease Inhibitor Cocktail(Amresco); iTRAQ Reagents-8plex Chemistry试剂盒、TEAB(Applied Biosystems公司); PolySULFOETHYL A色谱柱(规格100 mm×2.1 mm, Polylc公司); MAGIC C18AQ液相色谱柱(规格100 μm×150 mm, Michrom公司); 考马斯亮蓝试剂(Thermo公司); 美国BIO-RAD电泳仪; AB Sciex TOF5800质谱仪(Applied Biosystems公司).
1.2.1 大鼠肝纤维化-肝癌模型的建立及分组: SD大鼠80只, 采用分笼饲养, 标准饲料喂养, 定期更换垫料, 自由喂养1 wk后, 从第2周开始, 采用完全随机分实验组(40只)和对照组(40只), 实验组饮用蒸馏水配制成的0.01%DEN(Sigma公司产品, 其纯度为99.9%)溶液, 自由饮用8 wk, 停药2 wk, 此间断期, 改为普通喂养, 而后再继续给药喂养5 wk停药, 普通喂养直至第18周; 对照组, 常规自由饮水. 模型建立参照本研究以前的方法[9], 在诱癌第4、10、12周分别处死实验组大鼠6只, 处死对照组大鼠6只, 第18周处死全部剩余大鼠, 处死之前均给予3.5%水合氯醛(用0.9%生理盐水配制)10 mL/kg腹腔注射麻醉, 待麻醉成功后迅速取肝脏, -80 ℃保存备用.
1.2.2 肝蛋白质提取: 取造模各时间点内的大鼠肝组织1 g剪碎后合并, 加入10 mL蛋白裂解液, 置于玻璃匀浆管中研磨均匀后超声破碎30 s, 再以20000 g转速于4 ℃离心30 min, 取上清液5 mL与-20 ℃预冷丙酮以1:5混合均匀, 于-20 ℃冰箱静置2 h后, 以5000 g转速离心5 min, 弃上清液, 用iTRAQ试剂盒中自带的溶解液dissolution buffer(40 μL)和1%SDS(2 μL)充分混悬溶解蛋白沉淀, 再以25000 g转速于4 ℃离心20 min, 取上清, 采用Bradford方法测定蛋白质含量, 并进行SDS-PAGE电泳检测蛋白质的提取质量.
1.2.3 蛋白质酶解和iTRAQ标记: 按上述定量结果, 取蛋白100 μg, 分别置于5个EP管中, 每管加入还原剂2 μL, 混匀, 60 ℃反应1 h; 加入半胱氨酸封闭试剂1 μL, 室温处理10 min. 按酶:蛋白 = 1:20的比例分两次加入Trypsin, 第1次加入后于37 ℃酶解4 h, 再次加入后于37 ℃酶解12 h. 真空冷冻干燥肽段后, 0.5 mol/L TEAB复溶肽段. 根据iTRAQ标记试剂盒说明进行肽段标记, iTRAQ试剂113、114、115、116分别标记造模第4、10、12、18周的肝组织蛋白质, 117标记对照组肝组织蛋白质. 合并各管标记好的样品, 经标记后的样品用SymmetryC18柱进行脱盐处理后, 真空冷冻干燥, 置于4 ℃备用.
1.2.4 肽段的液相分离: 第一维强阳离子柱分离: 缓冲液A液含10 mmol/L KH2PO4和25%ACN, pH 3; 缓冲液B液含10 mmol/L KH2PO4、500 mmol/L KCl和25%ACN, pH 3. 用200 μL缓冲液A液复溶标记后已抽干的混合肽段. 分两次梯度洗脱, 每次进样100 μL, 设紫外检测波长为214 nm/280 nm, 流速为200 μL/min. 线性梯度洗脱程序为: 15-65 min, 0%-80% B液; 65-70 min, 80%-100% B液. 根据洗脱峰形和时间, 最终得到20个馏分, 将各馏分分别用SymmetryC18柱进行脱盐处理, 真空冷冻干燥备用.
1.2.5 蛋白质的液相色谱-电喷雾电离串联质谱法(liquid chromatography electrospray ionisation tandem mass spectrometry, LC-ESI-MS/MS)分析: 第二维反相液相液质联用(reversed-phase liquid chromatography-mass spectrometry, RPLC-MS), 流动相A(水:乙腈:甲酸 = 98:2:0.1)流动相B液(水:乙腈:甲酸 = 2:98:0.1), 每次进样量为8.8 μL, RPLC柱线性梯度洗脱程序为: 0-10 min, 进样; 10-12 min, 5% B液; 12-16 min, 5%-13% B液; 16-71 min, 13%-30% B液; 71-85 min, 30%-40% B液; 85-90 min, 40%-80% B液; 90-95 min, 80% B液; 5 min恢复柱料, 100 min结束. 多肽的串联质谱鉴定和相对定量分析采用5800 MALDITOF/TOF质谱分析仪. 具体操作参数: 一级质谱(MS)激光激发1250次, 在阳离子模式下用反射模式进行检测, 随后选择信噪比>50的母离子做二级质谱(MS/MS)分析, 每个样品点上最多选择25个母离子. 二级MS/MS激光激发2500次, 碰撞能量为2 kV, CID碰撞小室内的氮气压力维持在2.0×10-4 Pa.
1.2.6 蛋白质鉴定和定量: 质谱分析数据采用ProteinPilot 3.0在Uniprot数据库中进行检索鉴定蛋白, 报告置信度在95%以上的蛋白质同时用m/z 113、114、115、116和117报告离子的峰面积积分进行相对定量分析, 以m/z 117为对照, 按113:117、114:117、115:117、116:117比值, 选择P≤0.05的结果进行报告. 对有一个以上高置信度(不低于99%)唯一多肽匹配的蛋白不再进行人工确认, 对不含高置信度(不低于99%)唯一多肽匹配的蛋白, 用手工方法对MS/MS图谱碎片离子进行检查确认. 参考文献[12-14]和统计学意义, 当差异倍数达到1.2倍以上或低于0.7倍, 且经统计检验其P值<0.05时, 视为差异表达蛋白质.
统计学处理 采用Uniprot数据库中的注释信息分析iTRAQ筛选出来的肝癌组织差异表达蛋白, 通过GO分析数据库(http://www.geneontology.org/)进行GO分析, 用Reactome数据库中的生物代谢途径数据分析肝组织差异蛋白涉及的生物代谢途径, 从生物学进程(biological process, BP)和分子功能(molecular function, MF)这两个方面进行显著性分析. STRING9.0数据库构建肝癌组织差异表达蛋白相互作用网络图. 实验数据的结果用mean±SE进行表示, 组间比较采用单因素方差分析, 数据处理使用SPSS16.0软件, 认为P<0.05时差异有统计学意义.
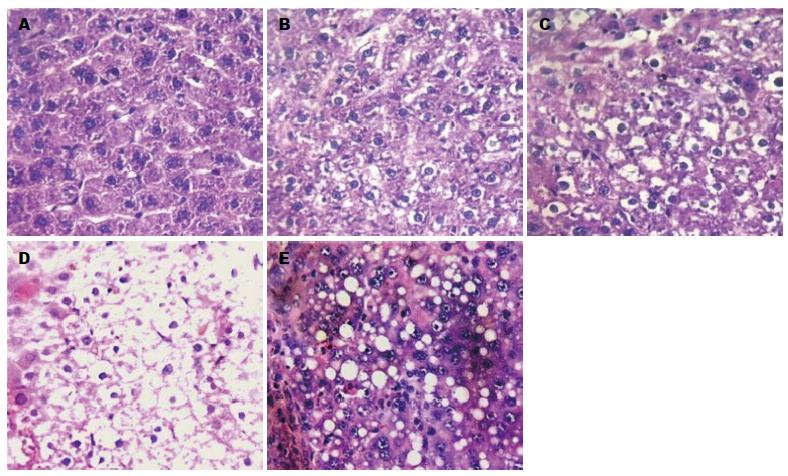
在造模过程中, 对照组大鼠无自然死亡, 肝脏未见病理改变; 实验组共有13只大鼠死亡, 死亡率为32.5%(13/40), 其中在12-15周死亡9只, 死亡原因疑为肺部炎症, 肝硬化等, 在15-18周死亡4只, 经解剖发现腹腔大量出血. 至实验结束时, 剩余的9只大鼠全部成癌. 病理学观察结果: 第4周: 肝损伤肝炎期, 肝细胞变性肿胀并不同程度的脂肪变性, 小叶内存在点状坏死及炎性细胞浸润; 第10周: 肝纤维化, 肝细胞严重脂肪性、灶性坏死, 门管区出现纤维组织增生; 第12周: 肝纤维-肝硬化期, 肝纤维组织增生, 肝缘变钝, 质地变硬; 第18周: 肝癌期, 肝细胞呈多形性, 异型性明显, 胞核增大, 胞质少, 可见多畸形的单核、多核瘤巨细胞和核分裂相(图1).
iTRAQ标记结合LC-ESI-MS/MS串联质谱鉴定到530种肝组织蛋白. 设定蛋白丰度差异达到>1.2倍(上调)或<0.7倍(下调), 且经统计检验其P<0.05的为差异蛋白, 与对照组相比, 模型组4个时间点分别鉴定到的差异蛋白质数量分别为128、113、106、127个, 其中在4个时间点均显著表达差异的蛋白49个, 上调表达的蛋白37个, 下调蛋白12个. 重复均鉴定到的上调和下调的蛋白分别如表1, 2.
| Accession | Protein Description | Ratio | |||
| 113:117 | 114:117 | 115:117 | 116:117 | ||
| tr|G3V786 | Protein Akr1b8 | 2.773 | 4.983 | 4.739 | 3.730 |
| sp|P24329 | Thiosulfate sulfurtransferase | 1.584 | 2.554 | 1.538 | 3.647 |
| sp|P07335 | Creatine kinase B-type | 2.33 | 2.835 | 1.907 | 3.435 |
| sp|B1H267 | Sorting nexin-5 | 3.564 | 4.846 | 3.727 | 3.193 |
| sp|P38983 | 40S ribosomal protein SA | 2.569 | 2.521 | 1.409 | 3.135 |
| tr|Q6P7Q6 | Galectin | 1.842 | 1.503 | 1.642 | 2.819 |
| sp|Q4G061 | Eukaryotic translation initiation factor | 2.328 | 4.656 | 2.689 | 2.813 |
| tr|Q6I8Q6 | Histone H2A | 2.609 | 1.336 | 1.343 | 2.784 |
| sp|Q5FVQ4 | Malectin | 1.822 | 1.503 | 1.642 | 2.819 |
| sp|Q4KM35 | Proteasome subunit beta type-10 | 1.975 | 2.163 | 1.532 | 2.437 |
| tr|D4AAV1 | Protein Amdhd1 | 2.337 | 2.217 | 1.896 | 2.423 |
| sp|P45479 | Palmitoyl-protein thioesterase 1 | 2.649 | 2.383 | 1.288 | 2.419 |
| sp|P97584 | Prostaglandin reductase 1 | 1.691 | 2.433 | 2.593 | 2.341 |
| sp|O35796 | Complement component 1 Q | 1.222 | 1.334 | 1.274 | 2.315 |
| sp|B0BN18 | Prefoldin subunit 2 | 2.569 | 1.296 | 2.172 | 2.043 |
| sp|P80067 | Dipeptidyl peptidase 1 | 1.908 | 1.423 | 1.614 | 2.009 |
| tr|Q6AY21 | GTPase activating protein (SH3 domain) binding protein 2 | 2.064 | 2.519 | 1.280 | 1.934 |
| tr|F1LM19 | Alpha-2-HS-glycoprotein | 1.963 | 1.283 | 1.274 | 1.903 |
| sp|Q920L2 | Succinate dehydrogenase [ubiquinone] flavoprotein subunit | 1.571 | 1.443 | 1.594 | 1.722 |
| sp|P35704 | Peroxiredoxin-2 | 1.395 | 1.561 | 1.679 | 1.701 |
| sp|Q5M827 | Pirin | 2.095 | 2.816 | 2.061 | 1.701 |
| sp|Q63716 | Peroxiredoxin-1 | 1.606 | 1.827 | 1.762 | 1.689 |
| sp|Q62812 | Myosin-9 | 1.252 | 1.222 | 1.894 | 1.681 |
| sp|Q10758 | Keratin, type II cytoskeletal 8 | 1.394 | 1.339 | 1.334 | 1.646 |
| tr|G3V9E3 | Caldesmon 1 | 2.335 | 1.589 | 1.630 | 1.636 |
| sp|Q9ER34 | Aconitate hydratase | 1.351 | 1.365 | 1.369 | 1.565 |
| sp|P32755 | 4-hydroxyphenylpyruvate dioxygenase | 1.26 | 1.482 | 1.205 | 1.527 |
| sp|Q8CFN2 | Cell division control protein 42 homolog | 1.483 | 1.570 | 1.329 | 1.504 |
| tr|M0RBJ7 | Complement C3 | 1.292 | 1.268 | 1.789 | 1.472 |
| sp|Q99MC0 | Protein phosphatase 1 regulatory subunit 14A | 1.775 | 1.653 | 1.945 | 1.467 |
| sp|Q9Z0U5 | Aldehyde oxidase 1 | 1.605 | 1.859 | 2.322 | 1.399 |
| tr|F1LP60 | Moesin | 1.378 | 1.201 | 1.281 | 1.383 |
| sp|P09811 | Glycogen phosphorylase | 2.818 | 4.695 | 1.802 | 1.322 |
| sp|P17220 | Proteasome subunit alpha type-2 | 1.521 | 1.557 | 1.332 | 1.282 |
| sp|P28064 | Proteasome subunit beta type-8 | 1.256 | 1.381 | 1.399 | 1.259 |
| sp|P46413 | Glutathione synthetase | 1.253 | 1.306 | 1.224 | 1.214 |
| tr|F1LNY0 | Uncharacterized protein | 1.316 | 1.376 | 1.439 | 1.194 |
| Accession | Protein Description | Ratio | |||
| 113:117 | 114:117 | 115:117 | 116:117 | ||
| sp|P02761 | Major urinary protein | 0.213 | 0.338 | 0.373 | 0.208 |
| tr|G3V697 | Clock homolog | 0.180 | 0.490 | 0.471 | 0.667 |
| sp|O09171 | Betaine--homocysteine S-methyltransferase 1 | 0.644 | 0.446 | 0.508 | 0.337 |
| sp|P04762 | Catalase | 0.577 | 0.547 | 0.519 | 0.576 |
| tr|M0RDH0 | Glycine N-methyltransferase | 0.546 | 0.393 | 0.555 | 0.510 |
| sp|Q8CHM7 | 2-hydroxyacyl-CoA lyase | 0.652 | 0.579 | 0.590 | 0.581 |
| sp|Q5M876 | N-acyl-aromatic-L-amino acid amidohydrolase | 0.663 | 0.599 | 0.593 | 0.613 |
| sp|P04904 | Glutathione S-transferase | 0.481 | 0.429 | 0.649 | 0.499 |
| sp|P52759 | Ribonuclease UK114 | 0.522 | 0.656 | 0.396 | 0.546 |
| tr|D3ZIC2 | Protein Uroc1 | 0.450 | 0.395 | 0.679 | 0.245 |
| sp|P07632 | Superoxide dismutase | 0.697 | 0.648 | 0.769 | 0.498 |
| sp|Q4QQW3 | Hydroxyacid-oxoacid transhydrogenase | 0.646 | 0.396 | 0.772 | 0.425 |
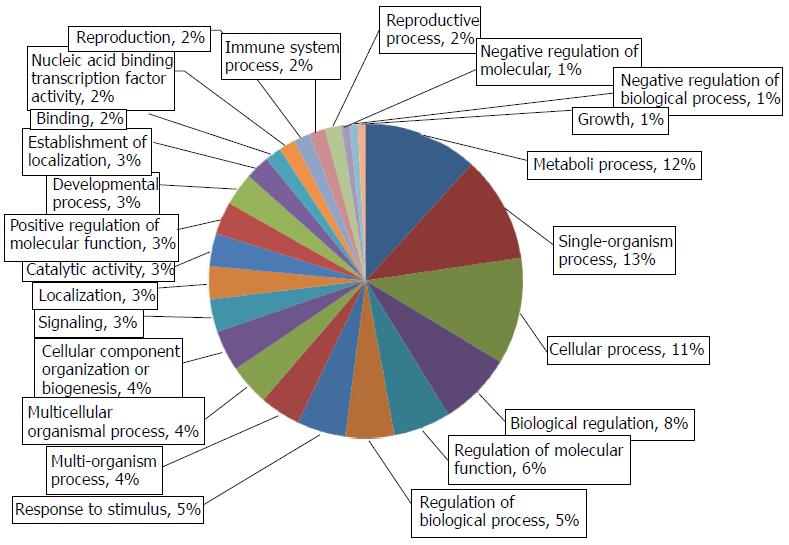
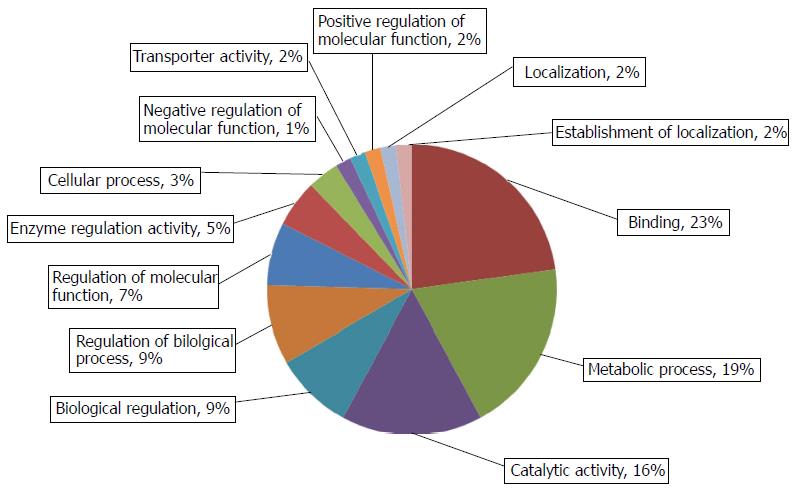
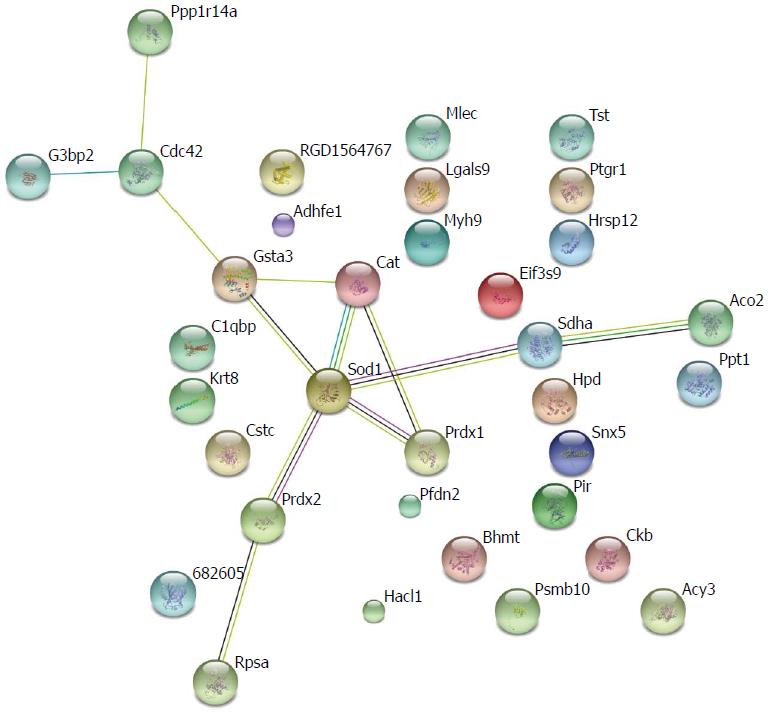
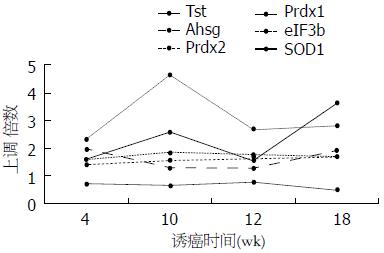
对差异表达蛋白进行GO分析, 研究这些蛋白的功能. BP分析发现, 差异表达蛋白大多参与信号传导、代谢合成和外界刺激压力反应(图2). MF分析揭示, 这些蛋白大多具有结合核苷酸或受体、参与水解代谢反应、转录活性等功能(图3). 运用STRING 9.0检索差异蛋白相互作用(图4). 其中, 相互作用关键节点蛋白过氧化物还原酶1(peroxiredoxin-1, Prdx1)蛋白、过氧化物还原酶2(peroxiredoxin-2, Prdx2)蛋白、超氧化物歧化酶1(superoxide dismutase 1, SOD1)蛋白、真核翻译起始因子3b(eukaryotic translation initiation factor 3 subunit b, eIF3b)蛋白、α2-HS-糖蛋白(alpha-2-HS-glycoprotein, Ahsg)蛋白和硫代硫酸硫基转移酶(thiosulfate sulfurtransferase, Tst)蛋白在肝癌发生过程中的含量变化如图5, Prdx1蛋白在第10周表达量达到最高, 之后的第12周、第18周表达量逐渐递减; Prdx2蛋白随着诱癌时间加长, 其表达量逐渐增高, 第18周表达量最高, 较对照组增加了1.7倍. Tst蛋白表达量趋势为: 逐步增高后降低再增高, 在第10周表达量达到最大. eIF3b蛋白表达量尤为显著, 第4周蛋白量高于正常组2.3倍, 第10周再次成倍增长达到最高峰, 之后有所降低. Ahsg蛋白表达量在第4、18周时相近且较高, 第10、12周表达量降低. SOD1蛋白量在4-10周表达量开始逐渐降低, 在第12周表达量有少许增加, 第18周表达量降到最低, 不足正常组表达量的一半.
肝纤维化是慢性肝病发展成为肝硬化、肝癌的主要中心环节. 但是, 目前肝纤维化促肝癌的发生机制仍不清楚, 临床上更是缺乏肝纤维化转化成肝癌的预警检测指标, 因此, 寻找肝纤维化演化成肝癌过程中的关键蛋白, 用于肝癌的早期发现、早期诊断和早期治疗, 以及用于癌变机制研究和药物靶标设计有着重要的意义.
在前期的研究中, 我们发现在肝纤维化-肝癌模型大鼠中第4、10、12、18周时间点为肝纤维化发展为肝癌进程的关键时间点[9]. 本研究采用iTRAQ技术分析这4个时间点大鼠肝组织中蛋白质表达的差异, 旨在研究肝纤维化发展为肝癌过程中的关键蛋白. 经生物信息学分析发现, 关键蛋白Prdx1蛋白、Prdx2蛋白和SOD1蛋白在相互作用网图中处于功能网络交叉点, 而eIF3b蛋白、Ahsg蛋白和Tst蛋白参与了肿瘤疾病的恶性表达及肝脏衰竭过程[15,16], 以上蛋白可能在肝纤维化转变为肝癌过程中扮演重要角色.
Prdx1属于抗氧化蛋白超家族, 王永[17]在临床研究肝癌中发现: Prdx1蛋白在肝癌组织中的阳性表达率为57.7%, 在正常肝组织的阳性率为33.3%, 两者差异有统计学意义, 与肿瘤肝内转移灶分化程度有关. 在肝癌细胞实验中发现, Prdx1基因沉默后, 肝癌细胞形态发生变化且生长缓慢, 对肝癌的发展有抑制作用[18]. Prdx1高表达可以增强TGF-β1诱导的上皮细胞间质转化和细胞迁移[19]. 有研究[20]指出二萜类化合物腺花素作用于靶蛋白Prdx1杀死肝癌细胞, 说明Prdx1的表达与肝癌的发生和发展密切相关. 本实验中Prdx1蛋白在建模期4个时间点的表达量显著高于正常组, 在第10周最高, 随后小幅度波动, 其动态变化可能与肝组织受到DEN的损伤后正常小叶被破坏有关, 使得肝纤维化-肝癌的重要蛋白Prdx1的表达持续上升, 并在肝癌形成初期维持较高的表达水平.
Prdx2与Prdx1同属于抗氧化蛋白超家族. 有研究[21,22]表明: 在乳腺癌、间皮瘤、头颈部肿瘤中Prdx2表达水平增加. 下调Prdx2的表达可以增加头颈部肿瘤细胞和胃癌细胞对顺铂的敏感性[23,24], 还可以增强TNF-α和TNF相关凋亡诱导配体(TNF-related apoptosis-inducing ligand)诱导的细胞凋亡, 抑制肿瘤发生. Prdx2通过调控TGF-β1参与细胞凋亡、分化、增殖, 在本实验中, 与对照组相比, Prdx2在第4周表达量加倍可能是由于在DEN诱导下肝组织结缔组织异常增生引起的, 在第4、10、12、18周其表达量逐级递增可能是由肝纤维化进入肝癌过程中炎症反应的加剧引起的.
Tst在肝脏生物转化中起着不可或缺的作用. 结合反应是肝脏生物化学作用中最重要的生物转化方式, 而硫酸结合反应是其中之一, 其催化剂为Tst. 此外, 有学者在研究PLP(phellinus linteus polysaccharide)抑制肝纤维化蛋白组学分析中表明, Tst在药物治疗组中的表达含量较肝纤维化组明显降低[25]. 本实验中Tst的表达量在第10周达到一个小高峰提示肝脏发生重度肝纤维化, 出现多量的肝细胞增生性病变, 第12周表达量降低可能是由于肝纤维化向癌变过度期间肝损伤的加剧短暂阻碍了其表达, 在第18周其表达量达到最大值说明: 肝癌的形成导致肝脏转化功能的病态活跃从而使得Tst表达量大幅度增高.
eIF3b是eIF3家族成员之一. Zhang等[26]在分析过表达eIF3亚基中发现5种亚基(即eIF3a、eIF3b、eIF3c、eIF3h和eIF3i)过表达时蛋白合成速度增加, 非锚定性生长能力增加, 其凋亡和其他恶性表型增强. 过表达的3a、3b或3c子单元导致整个eIF3活性增加[27]. 本实验结果显示eIF3b作为翻译起始因子对肝组织的病变过程较敏感, 在建模初期第4-10周其表达量增高极为明显, 并在第10周表达量骤增提示肝组织在DEN影响下发生大量异常蛋白的合成, 第12, 18周表达量有所降低但是仍然高于对照组, 可能是由于肝细胞在肝纤维化-肝癌向肝癌发展期间纤维组织增生、假小叶形成, 异型性增多阻碍了其表达.
Ahsg是由肝脏分泌的一种糖蛋白, 近几年对Ahsg的研究兴趣集中在他的抗炎作用, 这一作用可能与肝衰竭的发生机制有关[28]. 张玉玲等[29]在对血清蛋白组学分析时提出Ahsg可作为肝脏疾病的标志物. 本研究分析了Ahsg在肝纤维化-肝癌模型中的表达量动态变化, 在肝组织受DEN化学损伤时(即第4周)Ahsg表达急速上升, 可能是由于大鼠肌体对外来损伤的一种快速反应所致; 在大鼠肝脏纤维化向肝癌发展时期(肝纤维化-肝癌模型的第10-12周), Ahsg的表达趋于平稳(但仍然高于对照组), 提示大鼠肝脏已成纤维性, 对损伤有一定的耐受性; 在肝组织完全癌变期(第18周)Ahsg的表达再次升高, 说明在DEN持续干扰下, 大鼠肝脏深度受损并癌变, 可能作为关键蛋白的Ahsg蛋白表达继续上调.
SOD1广泛存在于生物体内, 是清除细胞内O2-的关键酶, 将O2-歧化生成H2O2, 后者在过氧化氢酶的作用下分解为H2O和O2而彻底解毒, 两者在解毒过程中相辅相成, 共同作用. 韦薇[30]在研究树鼩诱发性肝细胞癌(hepatocellular carcinoma, HCC)差异表达基因中发现SOD1在树鼩HCC、癌旁及癌前肝组织中均可检测到, 但表达量不同, HCC中SOD1蛋白表达的综合得分明显低于癌旁及癌前肝组织, 与本实验结果基本相符. 本实验中SOD1的表达量在第4-10周逐渐降低且低于正常组, 是由于肝组织损伤及纤维化的扩大导致有氧能力降低, 生成SOD1的能力减弱, 在肝纤维化向肝癌过渡期(即第12周)其表达量小幅度增加可能是由于纤维化细胞转变为癌细胞过程中细胞进行快速分化导致有氧氧化能力非正常态增强, 第18周SOD1表达量骤减(不足正常表达量的一半)表明肝组织完全癌变, 其正常功能丧失.
总之, 本文通过对肝组织蛋白组学数据进行分析, 筛选得到的Prdx1、Prdx2、Tst、eIF3b、Ahsg和SOD1可能为肝纤维化发展成肝癌过程中的关键蛋白, 但这些蛋白在肝癌发生、发展中的作用机制还尚未清楚, 下一步工作将对这些蛋白进行深入研究, 分析他们之间的相互关系和调控网络, 为进一步研究肝癌的发生机制提供理论依据.
尽管肝纤维化是慢性肝病发展成肝癌的主要中心环节, 但是, 迄今肝纤维化促肝癌的发生机制仍不清楚, 临床上更是缺乏肝纤维化转化为肝癌的预警指标. 二乙基亚硝胺制备大鼠肝纤维化-肝癌模型已是较成熟技术, 可利用此模型进行实验研究.
程英升, 教授, 上海交通大学附属第六人民医院放射科; 董蕾, 教授, 博士生导师, 西安交通大学第二附属医院消化内科; 吴江锋, 教授, 三峡大学医学院形态学部
分析大鼠肝纤维化发展成肝癌过程中差异表达的蛋白, 为寻找肝癌早期诊断指标提供研究基础.
Price和Perkins等的研究发现沉默过氧化物还原酶1基因对肝癌的发展有抑制作用; Wang等发现硫代硫酸硫基转移酶蛋白在药物治疗组中的表达含量较肝纤维化组明显降低.
本文通过动物模型动态观察肝癌发生发展进程, 探寻肝纤维化发展为肝癌的关键蛋白.
分析肝纤维化发展为肝癌过程中的差异表达蛋白, 为获得肝脏疾病之间的内在关联提供实验参考依据.
iTRAQ技术: 利用多种胺活性试剂对蛋白质水解的肽段进行标记, 再结合串联质谱对肽段进行标记精确的鉴别和定量.
本文选题新颖, 技术方法可行, 结果具有一定的学术价值和科学性, 对肝纤维化发展为肝癌的临床研究具有一定参考价值.
编辑: 韦元涛 电编:闫晋利
| 1. | Seki E, De Minicis S, Osterreicher CH, Kluwe J, Osawa Y, Brenner DA, Schwabe RF. TLR4 enhances TGF-beta signaling and hepatic fibrosis. Nat Med. 2007;13:1324-1332. [PubMed] [DOI] |
| 2. | Luedde T, Trautwein C. A molecular link between inflammation and fibrogenesis: the bacterial microflora influences hepatic fibrosis via toll-like receptor 4-dependent modification of transforming growth factor-beta signaling in hepatic stellate cells. Hepatology. 2008;47:1089-1091. [PubMed] [DOI] |
| 3. | Naugler WE, Sakurai T, Kim S, Maeda S, Kim K, Elsharkawy AM, Karin M. Gender disparity in liver cancer due to sex differences in MyD88-dependent IL-6 production. Science. 2007;317:121-124. [PubMed] [DOI] |
| 4. | Machida K, Tsukamoto H, Mkrtchyan H, Duan L, Dynnyk A, Liu HM, Asahina K, Govindarajan S, Ray R, Ou JH. Toll-like receptor 4 mediates synergism between alcohol and HCV in hepatic oncogenesis involving stem cell marker Nanog. Proc Natl Acad Sci U S A. 2009;106:1548-1553. [PubMed] [DOI] |
| 5. | Matsuzaki K, Murata M, Yoshida K, Sekimoto G, Uemura Y, Sakaida N, Kaibori M, Kamiyama Y, Nishizawa M, Fujisawa J. Chronic inflammation associated with hepatitis C virus infection perturbs hepatic transforming growth factor beta signaling, promoting cirrhosis and hepatocellular carcinoma. Hepatology. 2007;46:48-57. [PubMed] [DOI] |
| 6. | Fransvea E, Angelotti U, Antonaci S, Giannelli G. Blocking transforming growth factor-beta up-regulates E-cadherin and reduces migration and invasion of hepatocellular carcinoma cells. Hepatology. 2008;47:1557-1566. [PubMed] [DOI] |
| 7. | Coulouarn C, Factor VM, Thorgeirsson SS. Transforming growth factor-beta gene expression signature in mouse hepatocytes predicts clinical outcome in human cancer. Hepatology. 2008;47:2059-2067. [PubMed] [DOI] |
| 8. | Friedman SL. Mechanisms of hepatic fibrogenesis. Gastroenterology. 2008;134:1655-1669. [PubMed] [DOI] |
| 11. | Orvisky E, Drake SK, Martin BM, Abdel-Hamid M, Ressom HW, Varghese RS, An Y, Saha D, Hortin GL, Loffredo CA. Enrichment of low molecular weight fraction of serum for MS analysis of peptides associated with hepatocellular carcinoma. Proteomics. 2006;6:2895-2902. [PubMed] [DOI] |
| 12. | Zhang L, Selão TT, Pisareva T, Qian J, Sze SK, Carlberg I, Norling B. Deletion of Synechocystis sp. PCC 6803 leader peptidase LepB1 affects photosynthetic complexes and respiration. Mol Cell Proteomics. 2013;12:1192-1203. [PubMed] [DOI] |
| 13. | Ahn JM, Sung HJ, Yoon YH, Kim BG, Yang WS, Lee C, Park HM, Kim BJ, Kim BG, Lee SY. Integrated glycoproteomics demonstrates fucosylated serum paraoxonase 1 alterations in small cell lung cancer. Mol Cell Proteomics. 2014;13:30-48. [PubMed] [DOI] |
| 14. | Zhang P, Li C, Zhang P, Jin C, Pan D, Bao Y. iTRAQ-based proteomics reveals novel members involved in pathogen challenge in sea cucumber Apostichopus japonicus. PLoS One. 2014;9:e100492. [PubMed] [DOI] |
| 15. | Wang Z, Chen J, Sun J, Cui Z, Wu H. RNA interference-mediated silencing of eukaryotic translation initiation factor 3, subunit B (EIF3B) gene expression inhibits proliferation of colon cancer cells. World J Surg Oncol. 2012;10:119. [PubMed] [DOI] |
| 16. | Ucar F, Sezer S, Ginis Z, Ozturk G, Albayrak A, Basar O, Ekiz F, Coban S, Yuksel O, Armutcu F. APRI, the FIB-4 score, and Forn's index have noninvasive diagnostic value for liver fibrosis in patients with chronic hepatitis B. Eur J Gastroenterol Hepatol. 2013;25:1076-1081. [PubMed] [DOI] |
| 17. | 王 永. ILK及prdx1在肝癌中的表达与意义. 长沙: 中南大学湘雅医学院 2013; . |
| 18. | Price TR, Perkins SM, Sandrasegaran K, Henderson MA, Maluccio MA, Zook JE, Tector AJ, Vianna RM, Johnstone PA, Cardenes HR. Evaluation of response after stereotactic body radiotherapy for hepatocellular carcinoma. Cancer. 2012;118:3191-3198. [PubMed] [DOI] |
| 19. | Ha B, Kim EK, Kim JH, Lee HN, Lee KO, Lee SY, Jang HH. Human peroxiredoxin 1 modulates TGF-β1-induced epithelial-mesenchymal transition through its peroxidase activity. Biochem Biophys Res Commun. 2012;421:33-37. [PubMed] [DOI] |
| 20. | Hou JK, Huang Y, He W, Yan ZW, Fan L, Liu MH, Xiao WL, Sun HD, Chen GQ. Adenanthin targets peroxiredoxin I/II to kill hepatocellular carcinoma cells. Cell Death Dis. 2014;5:e1400. [PubMed] [DOI] |
| 21. | Kinnula VL, Lehtonen S, Sormunen R, Kaarteenaho-Wiik R, Kang SW, Rhee SG, Soini Y. Overexpression of peroxiredoxins I, II, III, V, and VI in malignant mesothelioma. J Pathol. 2002;196:316-323. [PubMed] [DOI] |
| 22. | Karihtala P, Mäntyniemi A, Kang SW, Kinnula VL, Soini Y. Peroxiredoxins in breast carcinoma. Clin Cancer Res. 2003;9:3418-3424. [PubMed] |
| 23. | Park SH, Chung YM, Lee YS, Kim HJ, Kim JS, Chae HZ, Yoo YD. Antisense of human peroxiredoxin II enhances radiation-induced cell death. Clin Cancer Res. 2000;6:4915-4920. [PubMed] |
| 24. | Yo YD, Chung YM, Park JK, Ahn CM, Kim SK, Kim HJ. Synergistic effect of peroxiredoxin II antisense on cisplatin-induced cell death. Exp Mol Med. 2002;34:273-277. [PubMed] [DOI] |
| 25. | Wang H, Wu G, Park HJ, Jiang PP, Sit WH, van Griensven LJ, Wan JM. Protective effect of Phellinus linteus polysaccharide extracts against thioacetamide-induced liver fibrosis in rats: a proteomics analysis. Chin Med. 2012;7:23. [PubMed] [DOI] |
| 26. | Zhang L, Pan X, Hershey JW. Individual overexpression of five subunits of human translation initiation factor eIF3 promotes malignant transformation of immortal fibroblast cells. J Biol Chem. 2007;282:5790-5800. [PubMed] [DOI] |
| 27. | Moser K, White FM. Phosphoproteomic analysis of rat liver by high capacity IMAC and LC-MS/MS. J Proteome Res. 2006;5:98-104. [PubMed] [DOI] |
| 28. | Dai XH, Zhang P, Xiao MF, Zhou RR, Zhang BX, Hu GS, Huang ZB, Fan XG. Protective role of α2HS-glycoprotein in HBV-associated liver failure. Int J Mol Sci. 2011;12:3846-3856. [PubMed] [DOI] |
| 30. | 韦 薇. 肝癌发生过程中差异表达基因的研究. 南宁: 广西医科大学 2004; . |