修回日期: 2015-02-11
接受日期: 2015-02-13
在线出版日期: 2015-04-18
目的: 研究ChemoCentryx趋化因子受体(ChemoCentryx chemokine receptor, CCXCKR)、血管内皮生长因子(vascular endothelial growth factor, VEGF)A和C在直肠癌组织、癌旁组织、正常直肠组织中的表达, 探讨其与淋巴结转移的关系.
方法: 应用免疫组织化学SP法检测50例手术切除的直肠癌组织、癌旁组织和11例正常直肠组织中CCXCKR、VEGF-A、VEGF-C的表达情况. 将50例直肠癌患者根据有无淋巴结转移分为: 淋巴结转移组(19例)与无淋巴结转移组, 并采用免疫组织化学方法分别检测CCXCKR、VEGF-A及VEGF-C在有无淋巴结转移的直肠癌组织中的表达情况, 以探讨CCXCKR、VEGF-A及VEGF-C与淋巴结转移的关系.
结果: CCXCKR在正常直肠组织、癌旁组织中表达明显高于直肠癌组织(P<0.01), 在淋巴结转移组CCXCKR的表达明显低于淋巴结未转移组(P<0.01). 而直肠癌组织、癌旁组织中VEGF-A和VEGF-C表达阳性率明显高于正常直肠组织(P<0.01), 其中在淋巴结转移组两者的表达明显高于淋巴结未转移组(P<0.05). VEGF-A和VEGF-C在直肠癌组织中的表达呈正相关(r = 0.703, P<0.0l), 而CCXCKR与VEGF-A及VEGF-C在直肠癌组织中的表达均分别呈负相关(r = -0.360, P<0.05、r = -0.326, P<0.05).
结论: 直肠癌中CCXCKR低表达、VEGF-A与VEGF-C高表达与直肠癌淋巴结转移密切相关, CCXCKR可能对直肠癌的发生和转移有抑制作用, CCXCKR、VEGF-A与VEGF-C联合检测, 对直肠癌预后的判断具有实际意义.
核心提示: ChemoCentryx趋化因子受体(ChemoCentryx chemokine receptor, CCXCKR)对于肿瘤的发生和转移起到抑制作用, 而血管内皮生长因子(vascular endothelial growth factor, VEGF)-A、C两者的协同作用具有强烈的诱导淋巴管新生的能力, 增加了淋巴转移的风险. 因此, VEGF-A、C, CCXCKR可作为预测直肠癌淋巴转移的重要指标, 并有望成为直肠癌转移分子治疗的新靶点.
引文著录: 罗建, 于丽君, 孔露, 李东宁, 王昶, 李骢, 梁品. CCXCKR、VEGF-A及VEGF-C在人直肠癌中的表达及其与转移的关系. 世界华人消化杂志 2015; 23(11): 1745-1754
Revised: February 11, 2015
Accepted: February 13, 2015
Published online: April 18, 2015
AIM: To detect the expressions of ChemoCentryx chemokine receptor (CCXCKR), vascular endothelial growth factor (VEGF)-A and -C in rectal carcinoma, and to analyze their relationship with lymph node metastasis.
METHODS: The immunohistochemical SP method was used to examine the expression of CCXCKR, VEGF-A and -C in 50 rectal carcinoma tissues, 50 para-cancerous tissues, and 11 normal rectal tissues. The 50 rectal carcinoma patients were divided into two groups: patients (n = 19) with lymph node metastasis and those without (n = 31). The correlation between the expression of CCXCKR, VEGF-A and C and lymph node metastasis was analyzed.
RESULTS: The expression of CCXCKR in both normal rectal tissues and para-cancerous tissues were significantly higher than that in rectal carcinoma tissues (P < 0.01). The expression of CCXCKR in the rectal carcinoma group with lymph node metastasis was significantly lower than that without lymph node metastasis (P < 0.01). Positive expression rates of VEGF-A and -C in rectal carcinoma tissues and para-cancerous tissues were significantly higher than those in normal rectal tissues (P < 0.01), and the expression of VEGF-A and -C in the rectal carcinoma group with lymph node metastasis was significantly higher than that without lymph node metastasis (P < 0.05). There was a positive correlation between expression of VEGF-A and -C, and a significantly negative correlation between CCXCKR and VEGF-A or C (r = -0.360, P < 0.05; r = -0.326, P < 0.05).
CONCLUSION: Low expression of CCXCKR and high expression of VEGF-A and VEGF-C in rectal carcinoma are closely related to lymph node metastasis. CCXCKR probably can inhibit the occurrence and metastasis of rectal carcinoma. Combined detection of CCXCKR, VEGF-A and VEGF-C should be a useful prognostic indicator for rectal carcinoma patients.
- Citation: Luo J, Yu LJ, Kong L, Li DN, Wang C, Li C, Liang P. Expression of CCXCKR, VEGF-A and VEGF-C in rectal carcinoma and their relationship with lymph node metastasis. Shijie Huaren Xiaohua Zazhi 2015; 23(11): 1745-1754
- URL: https://www.wjgnet.com/1009-3079/full/v23/i11/1745.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i11.1745
大肠癌是常见的消化系恶性肿瘤之一, 包括直肠癌和结肠癌, 转移是影响大肠癌预后的主要因素[1,2]. 然而, 目前尚缺乏有效方法对大肠癌术后可能发生肿瘤转移的潜能进行预测和早期诊断. 趋化因子及其受体是一类调节白细胞迁移的分泌性小分子[3]. 目前认为其不仅存在广泛, 而且参与多种人类恶性肿瘤的发生发展, 大量实验证实趋化因子及其受体网络还能够影响着淋巴细胞的迁移, 以及肿瘤细胞在淋巴道的转移[4-6]. 在趋化因子体系中, 存在着一类特殊类型的受体, 他们能识别和结合配体, 但并不引起任何信号转导, 即具有捕获趋化因子使其信号湮灭的能力, 被称之为趋化因子诱饵受体[7,8]. ChemoCentryx趋化因子受体(ChemoCentryx chemokine receptor, CCXCKR)是新被人们发现的诱饵受体[9]. CCXCKR有可能通过湮灭趋化因子的信号, 导致某些趋化因子与其受体结合受阻, 从而使他们失去了利于肿瘤细胞在淋巴道转移的作用. 血管内皮生长因子(vascular endothelial growth factor, VEGF)是目前公认的刺激肿瘤血管生长的最主要因子, 在恶性肿瘤的发生、发展过程中起重要作用[10,11]. VEGF-A和VEFG-C作为VEGF的家族成员中的一员, 在多种肿瘤中都有不同表达, 他们能与血管内皮细胞上的受体结合, 直接促进肿瘤内血管的新生, 并能促使肿瘤细胞基底膜水解, 最终导致肿瘤的生长、侵袭和转移[12,13]. 本研究应用免疫组织化SP法检测人正常直肠组织、癌旁组织、癌组织中CCXCKR、VEGF-A和VEGF-C的表达, 旨在探讨其表达与直肠癌淋巴结转移之间的关系, 同时为研究直肠癌组织CCXCKR、VEGF-A和VEGF-C的表达与转移潜能的相关性提供形态学依据.
收集大连医科大学附属第一医院病理科2012-05-01/2012-10-31手术切除的直肠癌存档蜡块50例、正常直肠组织蜡块11例, 其中每例直肠癌蜡块均包含取自于癌中央区(即癌内)及癌组织和周围正常组织交界区(即癌旁)的组织, 术前未接受过化疗. 根据病理学结果将其分为淋巴结转移组和无淋巴结转移组. 男性27例、女性23例, 28-89岁, 病例均有完整的标本背景资料, 包括年龄、性别、肿瘤的大小、病理学检查结果等. CCXCKR多克隆抗体购自Abcam公司, 工作浓度(1:150); VEGF-A多克隆抗体购自Bioworld公司, 工作浓度(1:120); VEGF-C多克隆抗体购自Abgent公司, 工作浓度(1:30), 上述抗体均用PBS稀释. 免疫组织化学试剂盒和DAB试剂盒购自北京中杉金桥生物技术有限公司.
1.2.1 免疫组织化学染色: 采用辣根过氧化酶标记的SP法. 以PBS代替CCXCKR、VEGF-A及VEGF-C抗体做为阴性对照. 染色采用DAB方法.
1.2.2 结果判定: VEGF-A、VEGF-C及CCXCKR蛋白阳性染色均为组织染色呈棕黄色或棕褐色颗粒, 主要存在于细胞膜或细胞质, 偶见于胞核. 染色结果采用双评分半定量法进行评分: 选择染色良好区域, 随机计数5个高倍视野(10×40), 从阳性细胞百分率和染色强度两个方面评分. (1)阳性细胞百分率<10%为0分, 10%-49%为1分, 50%-74%为2分, ≥75%为3分; (2)阳性细胞的染色强度定为: 无着色为0分, 轻度着色为1分, 中度着色为2分, 重度着色或胞浆中出现深棕色斑块为3分. 根据两项得分之和为染色结果, <2分为阴性; ≥2分为阳性, 其中2分为弱阳性(+), 3-4分为中等阳性(++), 5-6分为强阳性(+++).
统计学处理 数据采用SPSS11.5统计软件分析, 组间比较采用χ2检验, 等级数据使用Spearman等级相关. 以P<0.05为差异有统计学意义.
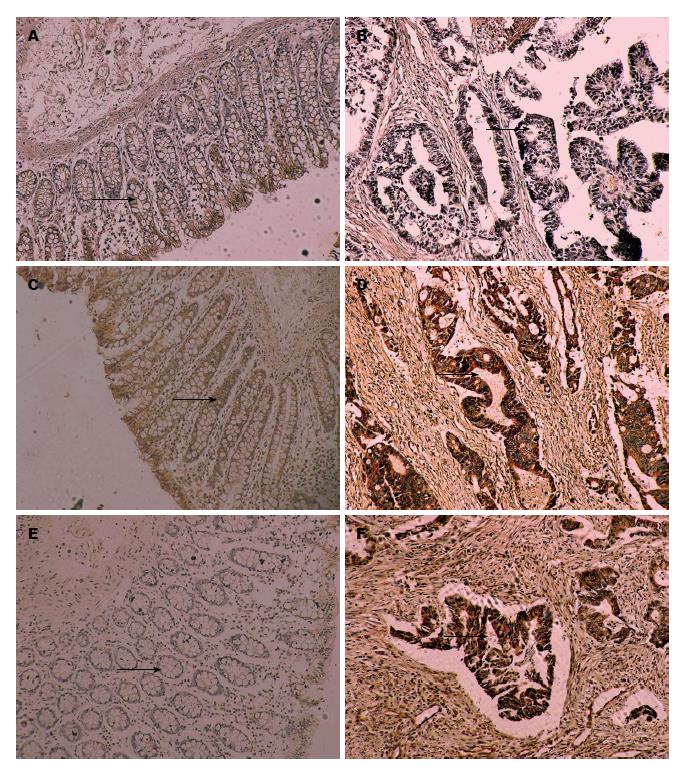
CCXCKR蛋白表达阳性着色呈弥漫性或散在分布的棕黄色颗粒, 主要定位于细胞浆内. CCXCKR在11例正常直肠组织中阳性表达的(+-+++)有11例, 阳性表达率为100%. 在50例癌旁组织中阳性表达(+-+++)有40例, 阳性表达率为80%. 在50例直肠癌组织中阳性表达的(+-+++)仅有21例, 阳性表达率为42%. 说明在直肠癌组织中CCXCKR蛋白呈低表达, 阳性率与正常直肠组织和癌旁组织相比差异有显著统计学意义(P<0.01), 而癌旁组与正常直肠组差异无统计学意义(P>0.05)(表1, 图1A, B).
| 分组 | n | CCXCKR的表达 | 总阳性率(%) | |||
| - | + | ++ | +++ | |||
| 直肠癌组织 | 50 | 29 | 11 | 6 | 4 | 42 |
| 癌旁组织 | 50 | 10 | 19 | 15 | 6 | 80 |
| 正常直肠组织 | 11 | 0 | 3 | 5 | 3 | 100 |
VEGF-A蛋白阳性着色为棕黄色或棕褐色, 主要位于细胞浆内. VEGF-A在50例直肠癌组织中阳性表达的(+-+++)有41例, 阳性表达率为82%. 在50例癌旁组织中阳性表达(+-+++)有37例, 阳性表达率为74%. 在11例正常直肠组织中仅有1例呈弱阳性表达, 其余均为阴性表达. 说明在直肠癌组织及癌旁组织中VEGF-A蛋白呈高表达, 阳性率与正常直肠组织相比差异有显著统计学意义(P<0.01), 癌旁组与直肠癌组差异无统计学意义(P>0.05)(表2, 图1C, D).
| 分组 | n | VEGF-A的表达 | 总阳性率(%) | |||
| - | + | ++ | +++ | |||
| 直肠癌组织 | 50 | 9 | 5 | 24 | 12 | 82.0 |
| 癌旁组织 | 50 | 13 | 6 | 22 | 9 | 74.0 |
| 正常直肠组织 | 11 | 10 | 1 | 0 | 0 | 9.1 |
VEGF-C蛋白表达阳性着色呈弥漫性或散在分布的棕黄色颗粒, 主要定位于细胞浆内. VEGF-C在50例直肠癌组织中阳性表达的(+-+++)有42例, 阳性表达率为84%. 在50例癌旁组织中阳性表达(+-+++)有39例, 阳性表达率为78%. 在11例正常直肠组织中无阳性表达. 说明在直肠癌组织及癌旁组织中VEGF-C蛋白呈高表达, 阳性率与正常直肠组织相比差异有显著统计学意义(P<0.01), 癌旁组与直肠癌组差异无统计学意义(P>0.05)(表3, 图1E, F).
| 分组 | n | VEGF-C的表达 | 总阳性率(%) | |||
| - | + | ++ | +++ | |||
| 直肠癌组织 | 50 | 8 | 9 | 21 | 12 | 84 |
| 癌旁组织 | 50 | 11 | 9 | 20 | 10 | 78 |
| 正常直肠组织 | 11 | 11 | 0 | 0 | 0 | 0 |
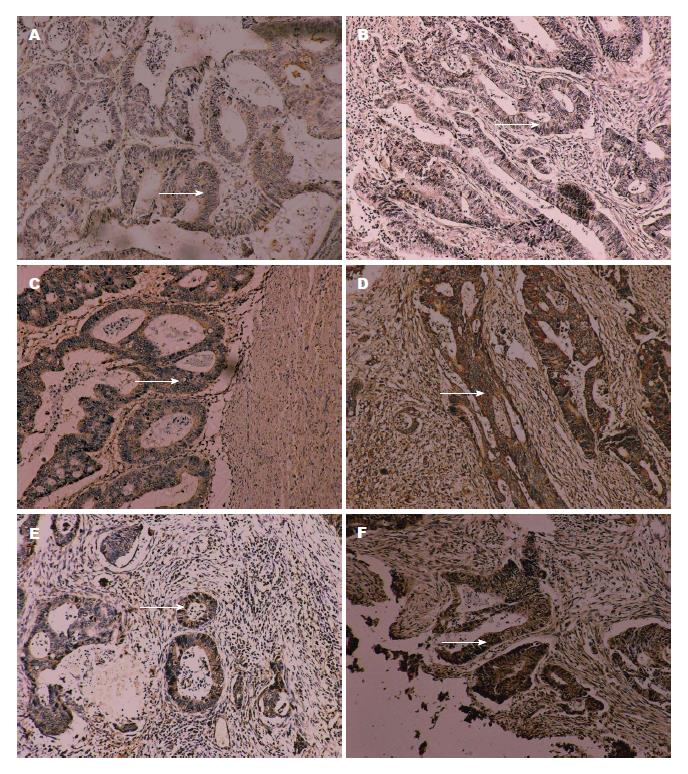
19例淋巴结转移标本中CCKCKR表达阳性的有2例(阳性率10.5%), 在无淋巴结转移的31例标本中有19例为阳性表达(阳性率61.3%). 两组比较差异均有统计学意义(P<0.01)(表4, 图2).
| 分组 | n | CCXCKR表达 | |
| 阴性 | 阳性 | ||
| 癌组织 | 50 | 29(58.0) | 21(42.0) |
| 有淋巴结转移 | 19 | 17(89.5) | 2(10.5) |
| 无淋巴结转移 | 31 | 12(38.7) | 19(61.3) |
19例淋巴结转移标本中VEGF-A、VEGF-C的表达均为阳性(100%), 而在无淋巴结转移的31例标本中则分别有22例(70.1%)、23例(74.2%)为阳性表达. 淋巴结转移组与无转移组比较, VEGF-A、VEGF-C蛋白表达差异均有统计学意义(P<0.05)(表5, 图2).
| 分组 | n | VEGF-A表达 | VEGF-C表达 | ||
| 阴性 | 阳性 | 阴性 | 阳性 | ||
| 癌组织n(%) | 50 | 9(18) | 41(82) | 8(16) | 42(84) |
| 有淋巴结转移 | 19 | 0 | 19 | 0 | 19 |
| 无淋巴结转移 | 31 | 9 | 22 | 8 | 23 |
50例直肠癌组织中, VEGF-A表达阳性的41例直肠癌组织中有40例VEGF-C表达阳性, 1例表达阴性, 而在42例VEGF-C表达阳性的直肠癌组织中有40例VEGF-A表达阳性, 2例表达阴性. 经Spearman等级相关分析显示直肠癌组织中VEGF-A与VEGF-C的蛋白表达呈明显的正相关(r = 0.703, P<0.01)(表6).
| VEGF-A | VEGF-C | 合计 | |||
| - | + | ++ | +++ | ||
| - | 7 | 1 | 1 | 0 | 9 |
| + | 1 | 4 | 0 | 0 | 5 |
| ++ | 0 | 2 | 17 | 5 | 24 |
| +++ | 0 | 2 | 3 | 7 | 12 |
| 合计 | 8 | 9 | 21 | 12 | 50 |
50例直肠癌组织中, CCXCKR表达阳性的21例直肠癌组织中有13例VEGF-A表达阳性, 8例表达阴性, 而在41例VEGF-A表达阳性的直肠癌组织中有13例CCXCKR表达阳性, 28例表达阴性. 经Spearman等级相关分析显示直肠癌组织中CCXCKR与VEGF-A的蛋白表达呈明显的负相关性(r = -0.360, P<0.05)(表7).
| CCXCKR | VEGF-A | 合计 | |||
| - | + | ++ | +++ | ||
| - | 1 | 3 | 19 | 6 | 29 |
| + | 2 | 0 | 3 | 6 | 11 |
| ++ | 2 | 2 | 2 | 0 | 6 |
| +++ | 4 | 0 | 0 | 0 | 4 |
| 合计 | 9 | 5 | 24 | 12 | 50 |
50例直肠癌组织中, CCXCKR表达阳性的21例直肠癌组织中有13例VEGF-C表达阳性, 8例表达阴性, 而在42例VEGF-C表达阳性的直肠癌组织中有13例CCXCKR表达阳性, 29例表达阴性. 经Spearman等级相关分析显示直肠癌组织中CCXCKR与VEGF-C的蛋白表达呈明显的负相关性(r = -0.326, P<0.05)(表8).
| CCXCKR | VEGF-C | 合计 | |||
| - | + | ++ | +++ | ||
| - | 0 | 7 | 16 | 6 | 29 |
| + | 2 | 0 | 3 | 6 | 11 |
| ++ | 3 | 2 | 1 | 0 | 6 |
| +++ | 3 | 0 | 1 | 0 | 4 |
| 合计 | 8 | 9 | 21 | 12 | 50 |
近年来, 随着生活水平的提高及膳食结构的改变, 大肠癌的发病呈上升趋势, 严重影响患者的生活质量[14], 其致死率之高的最关键因素是其极强的侵袭性和转移力[15], 迄今为止, 其转移的具体机制仍然没有被完全阐明. 特别是有关直肠癌的研究, 更是鲜有专门的报道. 趋化因子受体和相应的趋化因子配基已被证明在恶性肿瘤转移中发挥重要作用[16-18]. 趋化因子是一类单链小分子的蛋白质超家族, 参与免疫、造血、器官发育、炎症、艾滋病、肿瘤等生理病理过程. 趋化因子受体是7次跨膜G蛋白偶联受体家族成员, 可识别和结合特定的趋化因子, 从而促进肿瘤的发生、发展及转移[19-21]. 趋化因子结合蛋白也被称作"非典型"趋化因子受体或者诱饵受体, 是一类趋化因子受体亚家族. 趋化因子诱饵受体虽然也有经典的7次跨膜结构, 但缺乏胞内具有信号转导作用的区段, 故只能结合配基而无信号转导作用. 从而有效地内化同源趋化因子配基并使其降解[22-24].
CCXCKR是继DARC和D6之后被发现的第3个"非典型"趋化因子受体结合蛋白. CCXCKR作为诱饵受体家族的一员, 可结合并清除他所能识别的配基, 因此我们推测CCXCKR通过湮灭有促进肿瘤细胞转移功能的趋化因子, 减少或阻断这些趋化因子与其受体的结合, 进而抑制肿瘤淋巴管的增生及肿瘤细胞经淋巴道转移. Gosling等[25]已经证实CCXCKR基因在人类造血细胞和器官上有表达, 同时在一些非造血器官也有表达. 有学者在人肺结节病[26]中发现, 患病组和对照组的所有支气管肺泡细胞样本都检测到CCXCKR mRNA的表达, 并且患病组的CCXCKR的转录显著上调. 我们的研究发现在正常直肠组织、癌旁组织及直肠癌组织中均有CCXCKR表达, 但与正常组织及癌旁组织相比, 其在直肠癌组织阳性率明显降低. 同时, 我们还发现伴有淋巴结转移的直肠癌组织CCXCKR表达明显低于没有淋巴结转移的直肠癌组织, 两组相比差异有统计学意义(P<0.01). 提示CCXCKR的表达在直肠癌的发生、发展中具有重要的作用. 其与相应趋化因子结合后可减弱这些趋化因子与功能性受体结合的比例, 从而不同程度的阻断了肿瘤的生长和转移.
肿瘤的生长需要血管提供氧和营养物质. 如果没有新生血管生成, 肿瘤组织最终的结果不是坏死就是维持在体积很小的静息状态[27]. VEFG被公认为是众多促血管内皮增生细胞因子中作用最强, 同时也是最重要、最为关键的始动因子[28]. VEGF家族目前发现的有VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E, 胎盘生长因子及其受体VEGFR-1、VEGFR-2、VEGFR-3等. 其中VEGF-A主要作用是剌激血管内皮生长; 而VEGF-C则主要介导淋巴管生成, 与淋巴结转移关系密切. VEGF-A引起内皮细胞的增殖、迁移、诱导血管生成从而促进肿瘤的生长和转移[29,30]. VEGF-C作为最早被发现的淋巴管生长因子, 因其能结合VEGFR-2和VEGFR-3, 故VEGF-C同时具有促血管生成和淋巴管生成的作用[31,32]. VEGFR-2主要表达在血管内皮细胞, 当VEGF-C与之结合后能诱导血管生成, 而VEGFR-3则主要分布在血管以及淋巴管系统的内皮细胞内, 在成人的组织中, VEGFR-3主要分布于血管淋巴系统. 故VEGF-C较之于VEGF家族的其他成员, 其功能主要为促进淋巴管生成, 并和肿瘤细胞通过淋巴道转移密切相关. 本实验证实, VEGF-A和VEGF-C在直肠癌癌组织中及瘤旁组织中均有明显表达, 与正常直肠组织相比差异有统计学意义. 表明VEGF-A和VEGF-C在正常直肠组织中基本处于失活状态, 但在癌变的情况下, 肿瘤细胞通过自分泌环或旁分泌而发挥血管及淋巴管生成的作用. VEGF-A的增高与VEGF-C显著相关. 两者有可能共同促进直肠癌的侵袭和转移. 同时, 与没有淋巴结转移的直肠癌组织相比, VEGF-A和VEGF-C在淋巴结转移组均有较高的表达, 其差异具有统计学意义(P<0.01). 这也与上述结论相吻合. 同时, 我们还注意到CCXCKR的表达与VEGF-A与VEGF-C均呈明显的负相关, 因此, 我们猜测上述因子可能共同参与了直肠癌的转移.
总之, CCXCKR对于肿瘤的发生和转移起到抑制作用, 而VEGF-A、C两者的协同作用有强烈的诱导淋巴管新生的能力, 增加了淋巴转移的风险. 因此, VEGF-A、C, CCXCKR可作为预测直肠癌淋巴转移的重要指标, 并有望成为直肠癌转移分子治疗的新靶点. 联合检测上述指标, 对直肠癌预后的判断更具有实际意义.
直肠癌是常见的消化系恶性肿瘤之一, 本研究应用免疫组织化学SP法检测人正常直肠组织、癌旁组织、癌组织中ChemoCentryx趋化因子受体(ChemoCentryx chemokine receptor, CCXCKR)、血管内皮生长因子(vascular endothelial growth factor, VEGF)-A和VEGF-C的表达, 旨在探讨其表达与直肠癌淋巴结转移之间的关系, 为直肠癌的早期诊断和肿瘤转移潜能的预测提供形态学依据.
李革, 副教授, 延边大学附属医院
近年来, 大肠癌的发病呈上升趋势, 其致死率之高的最关键因素是其极强的侵袭性和转移力, 迄今为止, 其转移的具体机制仍然没有被完全阐明. 特别是有关直肠癌的研究, 更是鲜有专门的报道.
Gosling等已经证实CCXCKR基因在人类造血细胞和器官上有表达, 同时一些非造血器官也有表达. 国内有学者在mRNA和蛋白质水平上首次证实多种人乳腺癌细胞系可表达CCXCKR, 但具有高转移特性的乳腺癌细胞系的CCXCKR的表达降低. 同时, 观察到在乳腺癌患者中CCXCKR高表达者腋窝淋巴结转移少, 患者存活期长.
本研究在人正常直肠组织、癌旁组织、癌组织中分别进行CCXCKR、VEGF-A和VEGF-C的检测. 并探讨其表达与淋巴结转移的关系. 明确CCXCKR、VEGF-A和VEGF-C是否参与了大肠癌的淋巴道转移. 进一步揭开其转移机制, 寻找抑制肿瘤转移新的治疗靶点.
当今治疗直肠癌的最大挑战仍然是如何防治肿瘤的转移扩散, 其中淋巴转移是一个重要途径. 我们探讨CCXCKR、VEGF-A和VEGF-C是否参与及如何影响肿瘤细胞在淋巴道的转移, 为进一步研究抗肿瘤新药提供实验基础及理论依据.
趋化因子结合蛋白: 也被称作"非典型"趋化因子受体或者诱饵受体, 是一类趋化因子受体亚家族. 趋化因子诱饵受体虽然也有经典的7次跨膜结构, 但缺乏胞内具有信号转导作用的区段, 故只能结合配基而无信号转导作用. 从而有效地内化同源趋化因子配基并使其降解.
本文主要研究了CCXCKR、VEGF-A和C在直肠癌组织、癌旁组织、正常直肠组织中的表达, 并探讨其与淋巴结转移的关系, 得出一些好的结论, 为直肠癌的治疗及预后的估计打下一定的基础. 论文撰写好, 结论可靠, 有一定的科学价值.
编辑: 韦元涛 电编: 都珍珍
| 1. | Papageorgis P, Cheng K, Ozturk S, Gong Y, Lambert AW, Abdolmaleky HM, Zhou JR, Thiagalingam S. Smad4 inactivation promotes malignancy and drug resistance of colon cancer. Cancer Res. 2011;71:998-1008. [PubMed] [DOI] |
| 2. | Jin K, Lan H, Xie B, He K, Xu Z, Li G, Han N, Teng L, Cao F. Antitumor effects of FP3 in combination with capecitabine on PDTT xenograft models of primary colon carcinoma and related lymphatic and hepatic metastases. Cancer Biol Ther. 2012;13:737-744. [PubMed] [DOI] |
| 3. | Zlotnik A, Yoshie O. The chemokine superfamily revisited. Immunity. 2012;36:705-716. [PubMed] [DOI] |
| 4. | Hinton CV, Avraham S, Avraham HK. Role of the CXCR4/CXCL12 signaling axis in breast cancer metastasis to the brain. Clin Exp Metastasis. 2010;27:97-105. [PubMed] [DOI] |
| 5. | Mo W, Chen J, Patel A, Zhang L, Chau V, Li Y, Cho W, Lim K, Xu J, Lazar AJ. CXCR4/CXCL12 mediate autocrine cell- cycle progression in NF1-associated malignant peripheral nerve sheath tumors. Cell. 2013;152:1077-1090. [PubMed] [DOI] |
| 6. | Coussens LM, Zitvogel L, Palucka AK. Neutralizing tumor-promoting chronic inflammation: a magic bullet? Science. 2013;339:286-291. [PubMed] [DOI] |
| 7. | Graham GJ, Locati M, Mantovani A, Rot A, Thelen M. The biochemistry and biology of the atypical chemokine receptors. Immunol Lett. 2012;145:30-38. [PubMed] [DOI] |
| 8. | Cancellieri C, Vacchini A, Locati M, Bonecchi R, Borroni EM. Atypical chemokine receptors: from silence to sound. Biochem Soc Trans. 2013;41:231-236. [PubMed] [DOI] |
| 9. | Feng LY, Ou ZL, Wu FY, Shen ZZ, Shao ZM. Involvement of a novel chemokine decoy receptor CCX-CKR in breast cancer growth, metastasis and patient survival. Clin Cancer Res. 2009;15:2962-2970. [PubMed] [DOI] |
| 10. | Jin K, Lan H, Cao F, Han N, Xu Z, Li G, He K, Teng L. Differential response to EGFR- and VEGF-targeted therapies in patient-derived tumor tissue xenograft models of colon carcinoma and related metastases. Int J Oncol. 2012;41:583-588. [PubMed] [DOI] |
| 11. | 孔 令建, 赵 晶, 曲 波, 樊 微微, 高 善玲. Survivin、COX-2及VEGF在大肠癌中的表达及与肿瘤微血管密度的关系. 世界华人消化杂志. 2009;17:2048-2053. [DOI] |
| 12. | Yeh CY, Chiang JM, Hsieh PS, Tsai WS, Tang R, Changchien CR, Chen JS, Wang JY, Wu RC, Hung HY. Immunohistochemical study of vascular endothelial growth factor (VEGF) and matrilysin (MMP-7) in T1 adenocarcinoma of the colon and rectum to predict lymph node metastases or distant metastases. Hepatogastroenterology. 2011;58:1943-1946. [PubMed] [DOI] |
| 13. | Li Q, Wang D, Li J, Chen P. Clinicopathological and prognostic significance of HER-2/neu and VEGF expression in colon carcinomas. BMC Cancer. 2011;11:277. [PubMed] [DOI] |
| 14. | Osti MF, Agolli L, Bracci S, Masoni L, Valeriani M, Falco T, De Sanctis V, Maurizi Enrici R. Neoadjuvant chemoradiation with concomitant boost radiotherapy associated to capecitabine in rectal cancer patients. Int J Colorectal Dis. 2014;29:835-842. [PubMed] [DOI] |
| 16. | Gil M, Seshadri M, Komorowski MP, Abrams SI, Kozbor D. Targeting CXCL12/CXCR4 signaling with oncolytic virotherapy disrupts tumor vasculature and inhibits breast cancer metastases. Proc Natl Acad Sci USA. 2013;110:E1291-E1300. [PubMed] [DOI] |
| 17. | Chen HW, Du CW, Wei XL, Khoo US, Zhang GJ. Cytoplasmic CXCR4 high-expression exhibits distinct poor clinicopathological characteristics and predicts poor prognosis in triple-negative breast cancer. Curr Mol Med. 2013;13:410-416. [PubMed] [DOI] |
| 18. | Chen J, Yao Y, Gong C, Yu F, Su S, Chen J, Liu B, Deng H, Wang F, Lin L. CCL18 from tumor-associated macrophages promotes breast cancer metastasis via PITPNM3. Cancer Cell. 2011;19:541-555. [PubMed] [DOI] |
| 19. | Steiner JL, Murphy EA. Importance of chemokine (CC-motif) ligand 2 in breast cancer. Int J Biol Markers. 2012;27:e179-e185. [PubMed] [DOI] |
| 20. | Facciabene A, Peng X, Hagemann IS, Balint K, Barchetti A, Wang LP, Gimotty PA, Gilks CB, Lal P, Zhang L. Tumour hypoxia promotes tolerance and angiogenesis via CCL28 and T(reg) cells. Nature. 2011;475:226-230. [PubMed] [DOI] |
| 21. | Gu XL, Ou ZL, Lin FJ, Yang XL, Luo JM, Shen ZZ, Shao ZM. Expression of CXCL14 and its anticancer role in breast cancer. Breast Cancer Res Treat. 2012;135:725-735. [PubMed] [DOI] |
| 22. | Hou T, Liang D, Xu L, Huang X, Huang Y, Zhang Y. Atypical chemokine receptors predict lymph node metastasis and prognosis in patients with cervical squamous cell cancer. Gynecol Oncol. 2013;130:181-187. [PubMed] [DOI] |
| 23. | Zhu Z, Sun Z, Wang Z, Guo P, Zheng X, Xu H. Prognostic impact of atypical chemokine receptor expression in patients with gastric cancer. J Surg Res. 2013;183:177-183. [PubMed] [DOI] |
| 24. | Zeng XH, Ou ZL, Yu KD, Feng LY, Yin WJ, Li J, Shen ZZ, Shao ZM. Coexpression of atypical chemokine binders (ACBs) in breast cancer predicts better outcomes. Breast Cancer Res Treat. 2011;125:715-727. [PubMed] [DOI] |
| 25. | Gosling J, Dairaghi DJ, Wang Y, Hanley M, Talbot D, Miao Z, Schall TJ. Cutting edge: identification of a novel chemokine receptor that binds dendritic cell- and T cell-active chemokines including ELC, SLC, and TECK. J Immunol. 2000;164:2851-2856. [PubMed] [DOI] |
| 26. | Kriegova E, Tsyrulnyk A, Arakelyan A, Mrazek F, Ordeltova M, Petzmann S, Zatloukal J, Kolek V, du Bois RM, Popper H. Expression of CCX CKR in pulmonary sarcoidosis. Inflamm Res. 2006;55:441-445. [PubMed] [DOI] |
| 27. | Tugues S, Koch S, Gualandi L, Li X, Claesson-Welsh L. Vascular endothelial growth factors and receptors: anti-angiogenic therapy in the treatment of cancer. Mol Aspects Med. 2011;32:88-111. [PubMed] [DOI] |
| 28. | Wang R, Zhao N, Li S, Fang JH, Chen MX, Yang J, Jia WH, Yuan Y, Zhuang SM. MicroRNA-195 suppresses angiogenesis and metastasis of hepatocellular carcinoma by inhibiting the expression of VEGF, VAV2, and CDC42. Hepatology. 2013;58:642-653. [PubMed] [DOI] |
| 29. | Mao D, Zhang Y, Lu H, Zhang H. Molecular basis underlying inhibition of metastasis of gastric cancer by anti-VEGFa treatment. Tumour Biol. 2014;35:8217-8223. [PubMed] [DOI] |
| 30. | Geng L, Chaudhuri A, Talmon G, Wisecarver JL, Wang J. TGF-Beta suppresses VEGFA-mediated angiogenesis in colon cancer metastasis. PLoS One. 2013;8:e59918. [PubMed] [DOI] |
| 31. | Issa A, Le TX, Shoushtari AN, Shields JD, Swartz MA. Vascular endothelial growth factor-C and C-C chemokine receptor 7 in tumor cell-lymphatic cross-talk promote invasive phenotype. Cancer Res. 2009;69:349-357. [PubMed] [DOI] |