修回日期: 2015-02-12
接受日期: 2015-03-06
在线出版日期: 2015-04-18
目的: 探讨Th9细胞在乙型肝炎肝硬化患者中的表型和作用, 以及巨噬细胞炎症蛋白-3a(macrophage inflammatory protein 3a, MIP-3a)/CCL20与CC类趋化因子受体6(CC chemokine receptor 6, CCR6)趋化轴对Th9细胞可能影响.
方法: 收集18例乙型肝炎肝硬化患者和6例健康捐献者的外周血和肝组织. 流式细胞术检测外周血中Th9细胞的表达和表型, ELISA检测血清白介素-9(interleukin-9, IL-9)和CCL20的水平, 肝组织石蜡切片免疫组织化学检测趋化因子CCL20和其受体CCR6的表达.
结果: 与健康对照组相比, 乙型肝炎肝硬化组Th9细胞的频率和血清IL-9水平显著升高. 患者Th9细胞和IL-9的水平与肝纤维化的严重性相关. Th9细胞高表达CCR4和CCR6趋化因子受体. 免疫组织化学结果显示乙型肝炎肝硬化组肝细胞和星状细胞等高表达CCL20和CCR6.
结论: Th9细胞可能参与乙型肝炎肝硬化的发生发展, CCL20/CCR6趋化轴可能在Th9细胞趋向肝组织过程中发挥作用.
核心提示: Th9细胞是一种新型的辅助T细胞亚群, 他及其效应分子白介素-9(interleukin-9)参与多种疾病的病理生理过程, 但是是否参与乙型肝炎肝硬化的发生发展尚未有报道; Th9细胞相关趋化因子家族及其受体尚未明确, Th9细胞到达肝脏的迁移募集机制有待进一步解答.
引文著录: 王家旭, 郭晓云, 姜海行, 罗薇, 陈梅, 卢东红, 岑瑜. Th9细胞在乙型肝炎肝硬化患者中的表达及意义. 世界华人消化杂志 2015; 23(11): 1736-1744
Revised: February 12, 2015
Accepted: March 6, 2015
Published online: April 18, 2015
AIM: To investigate the phenotype and function of circulatory T-helper 9 (Th9) cells in patients with hepatitis B associated liver cirrhosis, as well as the impact of the macrophage inflammatory protein 3a (MIP-3a, CCL20)/CCR6 axis on Th9 cell expression.
METHODS: Peripheral blood and liver tissue samples were collected from 18 patients with hepatitis B associated cirrhosis and 6 healthy donors. Expression and phenotype of Th9 cells in the peripheral blood were tested by flow cytometry. Serum interleukin-9 (IL-9) and CCL20 levels were tested by enzyme-linked immunosorbent assay (ELISA). Immunohistochemical staining was used to detect the expression of CCR6 and CCL20 proteins in liver tissues.
RESULTS: Compared with normal controls, the frequency of Th9 cells in the hepatitis B-associated cirrhosis group and serum level of IL-9 significantly increased. The levels of Th9 cells and IL-9 were associated with severity of liver cirrhosis. In addition, expression of CCR4 and CCR6 chemokine receptors in Th9 cells was significantly increased. Immunohistochemistry showed that the expression of CCL20 and CCR6 proteins was significantly increased in the hepatitis B associated cirrhosis group.
CONCLUSION: Th9 cells may be involved in the development and progression of hepatitis B associated liver cirrhosis, and the CCL20/CCR6 axis may play a role in Th9 cell infiltration in liver tissue.
- Citation: Wang JX, Guo XY, Jiang HX, Luo W, Chen M, Lu DH, Cen Y. Circulatory Th9 cells in patients with hepatitis B associated liver cirrhosis. Shijie Huaren Xiaohua Zazhi 2015; 23(11): 1736-1744
- URL: https://www.wjgnet.com/1009-3079/full/v23/i11/1736.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i11.1736
Th9细胞是最新被定义的CD4+ T细胞之一, 以强烈分泌白介素-9(interleukin-9, IL-9)被鉴定, 是独立于Th1、Th2和Th17以外的一群独特的Th细胞亚群. 在TGF-β和IL-4的作用下, 由初始CD4+ T细胞分化而来[1,2]. 信号转导和转录激活因子6(signal transducer and activator of transcription 6, STAT6), 转录因子PU.1[spleen focus forming virus (SFFV) proviral integration oncogene, spi-l或PU.1][3,4], 干扰素调节因子4[5](interferon response factor 4, IRF4)和GATA结合蛋白3(GATA-binding protein 3, GATA3)[6]被认为是Th9细胞不可或缺的核心转录因子. IL-25、IL-21和Ⅰ型干扰素均参与了Th9细胞的分化调节[7]. Th9细胞的功能是多元的, 有报道称他们参与不同形式的炎症、肿瘤和自身免疫性疾病等[8-11].
慢性乙型肝炎临床病程是高度可变的, 从无症状携带者状态发展肝硬化, 肝功能失代偿或者肝细胞癌(hepatocellular carcinoma, HCC). 肝纤维化和肝硬化的发生, 是慢性肝脏炎症或损伤发展, 细胞外基质(extracellular matrixc, ECM)的过度积累的结果[12]. ECM主要来源于活化的肝星状细胞(hepatocyte stellate cell, HSC), 而表达α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)是HSC活化的标志. 已有报道Th17细胞[13,14]、Th22细胞[15]在肝硬化发挥有重要作用. 但是目前尚未有Th9细胞在乙型肝炎肝硬化研究中的报道. 本研究旨在探索乙型肝炎肝硬化患者中Th9细胞的表达、表型和募集.
收集新诊断的18例乙型肝炎肝硬化患者和6例健康志愿者的外周血标本. 同时收集18例肝硬化患者新鲜的肝组织标本和6例正常肝组织. 所有的患者来自广西医科大学第一附属医院2013-12/2014-06住院行肝移植术或者肝硬化组织活检的患者, 正常肝组织来自正常供肝标本. 采集肝组织前1 d清晨空腹抽取外周静脉血5 mL, 取下肝组织后立即放入液氮中保存. 这项研究经广西医科大学伦理委员会批准并得到每个参与者的书面知情同意. 所有患者肝硬化的诊断标准符合美国国家病毒性肝炎预治程序. 而且入选的患者前6 mo内没有采取抗病毒治疗或免疫抑制药物. 乙型肝炎肝硬化患者并发丙型肝病毒、戊型肝炎病毒或人类免疫缺陷病毒感染、自身免疫性肝病、酒精性肝病和其他类型的慢性炎性疾病被排除. 另收集健康对照者, 均无肝炎病史, 乙型肝炎病毒(hepatitis B virus, HBV)血清学标志物均阴性, 肝功能各项指标正常. 入选样本的特点如表1. CD4-APC、IL-9-AF647、IL-22-PE、CCR4-PerCP-Cy5.5、CCR6-PerCP-Cy5.5抗体及同型对照抗体、固定破膜剂、莫能霉素、溶血素购自美国BD公司, 佛波醇乙酯(PMA)、离子霉素购自美国Sigma公司. IL-9 ELISA试剂盒购自苏州卡尔文生物科技有限公司; CCL20 ELISA试剂盒购自美国RD公司. CCR6(多克隆兔抗人, Origene, 美国), CCL20(多克隆兔抗人, 博奥森, 北京). α-SMA一抗购自Sigma-Aldrich公司; 免疫组织化学试剂盒购自北京中杉生物技术有限公司.
| 类别 | 正常对照组 | 乙型肝炎肝硬化组 |
| n | 6 | 18 |
| 年龄(岁) | 26(25-27) | 43(31-61) |
| 性别(男/女) | 3/3 | 11/7 |
| ALT(IU/L) | 正常 | 58.60±43.51 |
| AST(IU/L) | 正常 | 82.00±53.19 |
| 总胆红素(μmol/L) | 正常 | 75.06±97.57 |
| 凝血酶原时间(s) | 18.11±7.67 | |
| 白蛋白(g/L) | 28.60±6.10 | |
| HBV DNA(copies/mL) | ||
| 1×103-1×105 | 0 | 12 |
| >1×105 | 0 | 6 |
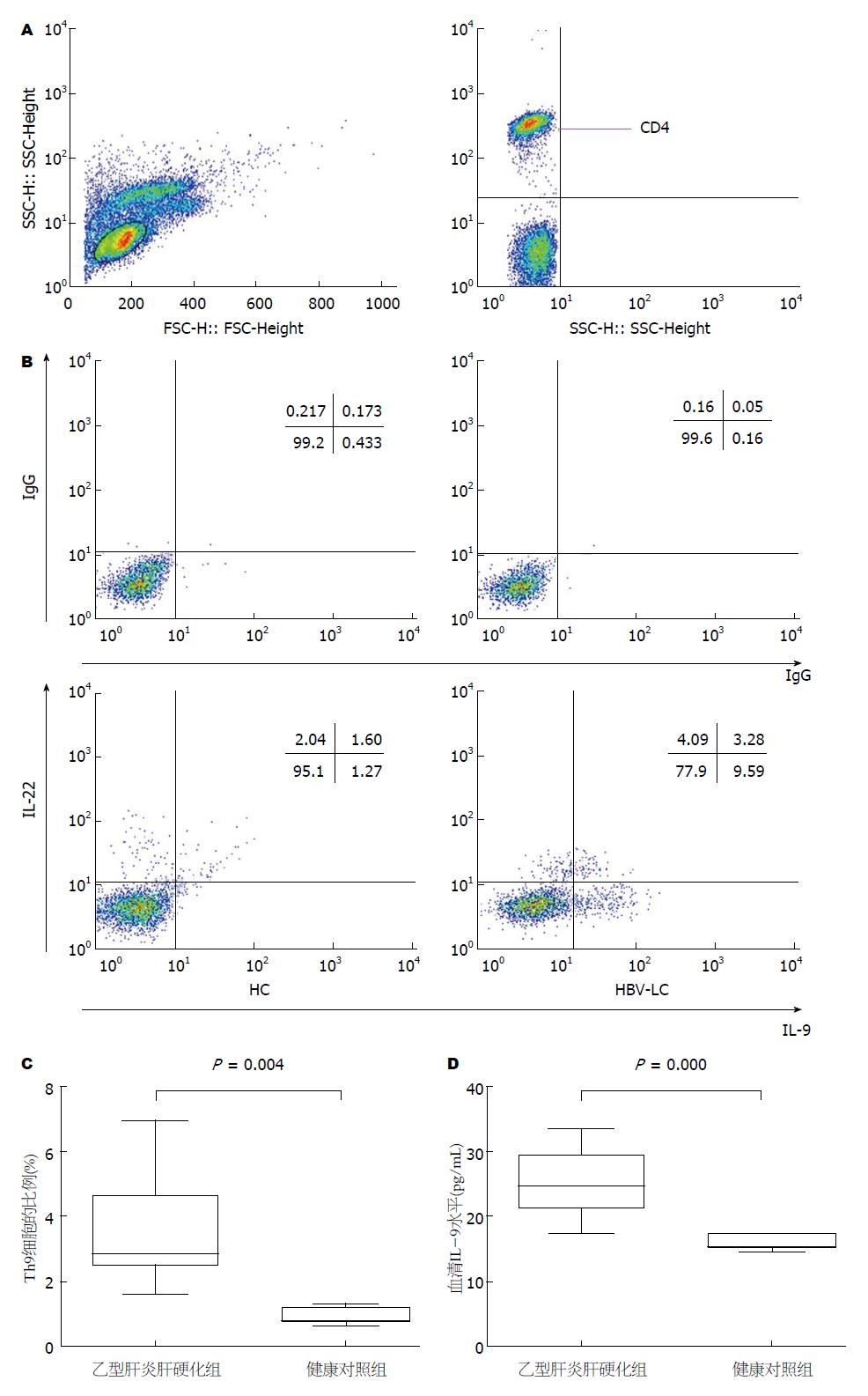
1.2.1 流式细胞术检测外周血Th9细胞的表型和频率: 用肝素抗凝真空采血管采集静脉血3 mL 取500 μL全血, 加入PMA(50 ng/mL)、离子霉素(1 μg/mL)、莫能霉素(0.7 μg/mL), 放入含50 mL/L CO2培养箱孵育5 h. 然后加入CD4-APC、CCR6-PerCP-Cy5.5抗体5 μL, 室温避光孵育25 min. 加入1×溶血素, 混匀, 室温避光孵育10 min. 300 g离心5 min, 弃上清液, 加入250 μL破膜剂充分混匀, 室温避光孵育25 min, 500 g离心5 min, 弃上清液, 将其分两管, 实验管加入IL-9-AF488抗体、IL-22-PE抗体, 对照管加入同型对照抗体, 室温避光孵育30 min后, 用1%多聚甲醛300 μL固定, 24 h上机检测. 所有制备好的样本均用流式细胞仪进行检测, 采用FlowJo7.6.1软件进行分析. CD4+IL9+IL-22-定义为Th9细胞.
1.2.2 ELISA检测血浆IL-9水平: 将前述剩余的血离心取血浆, 并保存于-80 ℃冰箱. 血浆IL-9和CCL20的表达水平通过ELISA来检测, 严格按照说明书进行.
1.2.3 免疫组织化学染色检测肝脏组织中α-SMA、CCR6和CCL20的表达: 肝组织石蜡包埋标本3 μm厚连续切片, 采用SP法, 切片、脱蜡、水化、抗原修复、一抗、二抗温育、二氨基联苯胺显色、苏木精复染、脱水、透明、封片后于显微镜下观察. 以PBS代替第一抗体作为空白对照. CCR6表达在细胞膜和CCL20表达在细胞质和细胞间隙, 棕褐色或棕黄色反应产物代表抗原的定位, 背景呈紫蓝色. 每个标本由两名独立观察员计算5个不同高倍视野(×400), 使用Image proplus 6.0图像分析系统半定量测定α-SMA、CCR6和CCL20的表达, 计算平均光密度值(integrated optical density, IOD), 同一标本3张切片测量值取均值.
统计学处理 采用SPSS16.0对数据进行分析, 结果图用GraphPad Prism 5.0软件以mean±SD的形式输出. 两组比较采用非配对t检验, 不服从正态分布时用秩和检验, 方差不齐时用t'检验, 3组之间的比较采用单因素方差分析, 相关性分析根据数据类型进行Pearson或者Spearman相关性分析. P<0.05为差异有统计学意义.
我们首先检测了外周血中Th9细胞的频率和血清IL-9水平, 流式细胞检测如图1A, CD4+IL9+IL-22-定义为Th9细胞. 此外还存在IL-9和IL-22双阳性的CD4+ T细胞. 结果显示与健康对照组相比, 乙型肝炎肝硬化组外周血Th9细胞的频率和血清IL-9水平显著升高(分别为: 3.55%±1.69% vs 0.97%±0.24%, P<0.05; 25.55 pg/mL±4.62 pg/mL vs 16.18 pg/mL±1.32 pg/mL, P<0.05).
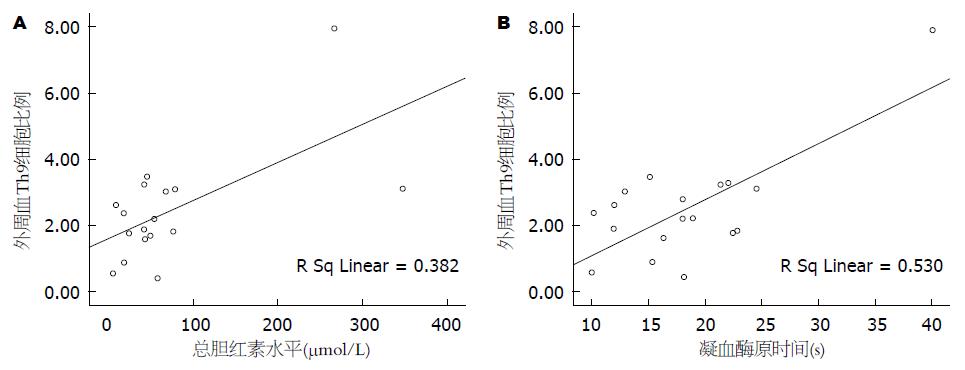
相关分析表明, Th9细胞比例与肝硬化组患者的年龄、性别、谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)、白蛋白、HBV-DNA无相关性; 与凝血酶原时间和总胆红素水平呈正相关性(图2), 凝血酶原时间越长, 总胆红素水平越高, 外周血Th9细胞比例越高. 血清IL-9的水平与肝硬化组患者的年龄、性别、ALT、AST、白蛋白、HBV DNA、凝血酶原时间、总胆红素水平无相关性(表2).
| 类别 | Th9细胞 | IL-9水平 | ||
| r值 | P值 | r值 | P值 | |
| 年龄 | 0.485 | 0.570 | 0.413 | 0.671 |
| 性别 | 0.317 | 0.631 | 0.297 | 0.530 |
| ALT | -0.144 | 0.609 | -0.272 | 0.290 |
| AST | -0.110 | 0.968 | -0.215 | 0.408 |
| 总胆红素 | 0.617 | 0.014 | -0.060 | 0.819 |
| 凝血酶原时间 | 0.725 | 0.002 | -0.155 | 0.552 |
| 白蛋白 | -0.363 | 0.337 | 0.072 | 0.885 |
| HBV DNA | -0.130 | 0.644 | -0.204 | 0.432 |
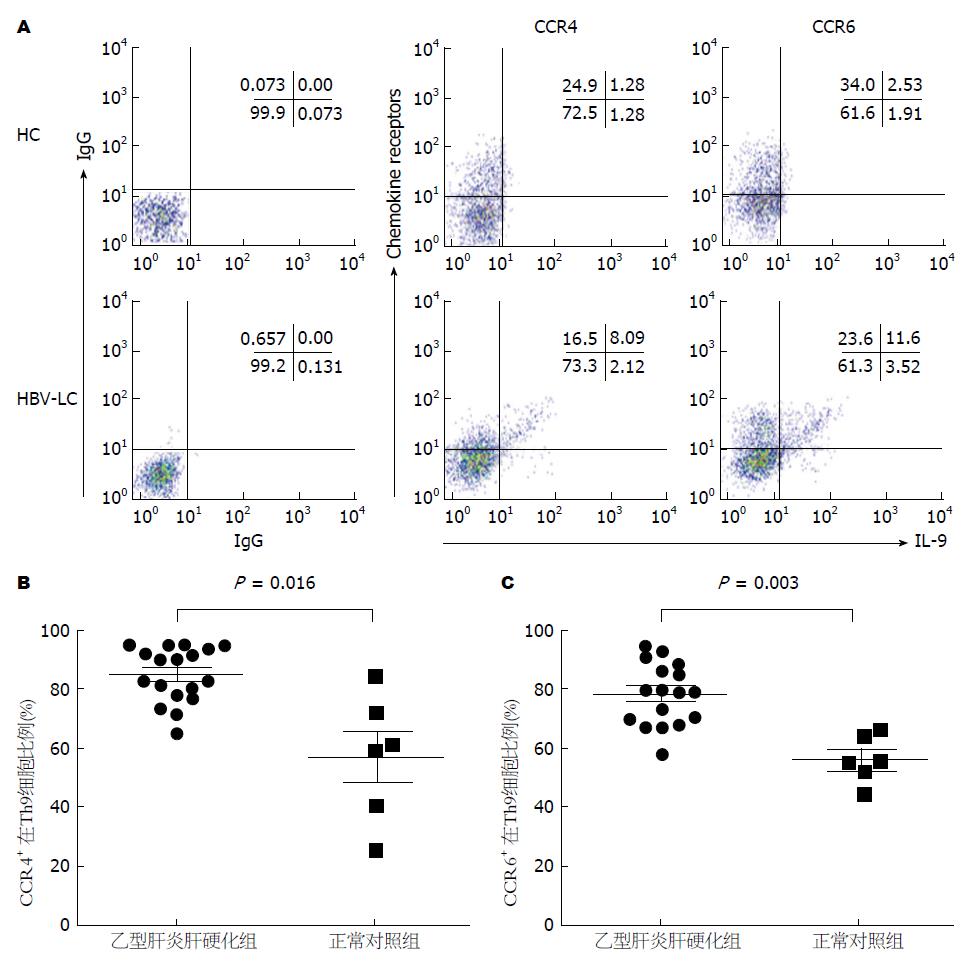
为了进一步了解Th9细胞的表型特点, 我们运用流式细胞术对趋化因子受体CCR4, CCR6进行了检测. 流式结果显示Th9细胞表达高水平的CCR4和CCR6受体, 而且与健康对照组相比, 乙型肝炎肝硬化组CCR4+ Th9细胞, CCR6+ Th9细胞的比例显著升高(分别是85.8%±12.5% vs 56.4%±2.36%, P<0.05; 78.1%±10.6% vs 56.4%±9.04%, P<0.05, 差异有统计学意义)(图3).
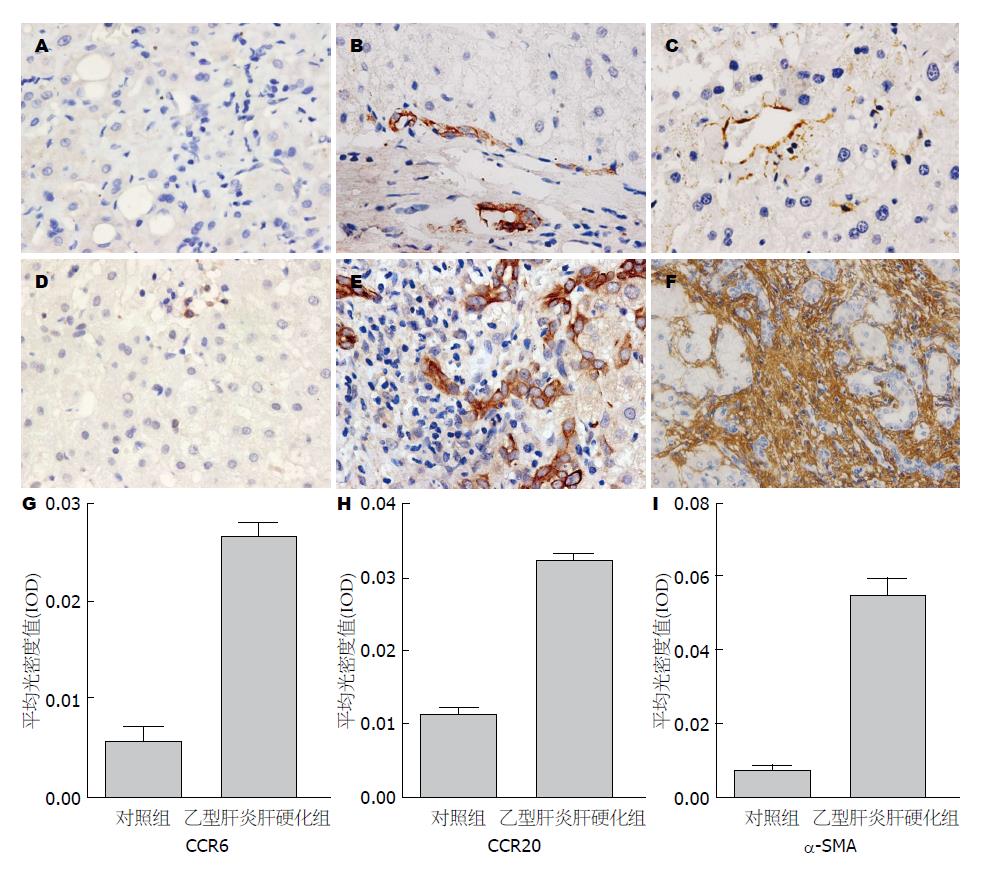
为了了解CCR6和CCL20是否影响Th9细胞的募集, 我们用ELISA检测了血清CCL20的水平和免疫组织化学检测了肝组织中CCR6和CCL20的表达. 结果显示乙型肝炎肝硬化组血清CCL20的水平比正常对照组显著升高(224.77 pg/mL±33.73 pg/mL vs 34.58 pg/mL±3.72 pg/mL, P<0.05). 免疫组织化学的结果显示CCR6表达在汇管区中浸润的淋巴细胞的细胞膜, CCL20表达在汇管区树突状细胞、肝星状细胞、成纤维细胞、血管内皮细胞和胆管上皮细胞的细胞膜和细胞质(图4). 与健康对照相比, 乙型肝炎肝硬化组CCR6和CCL20表达均显著增高(0.027±0.021 vs 0.006±0.001, 0.033±0.011 vs 0.017±0.006, 均P<0.05). 此外在门静脉、汇管区及纤维间隔区域内可见有α-SMA大量表达(图4), 且随纤维化程度加重而增加, 与对照组相比, 肝硬化组α-SMA表达明显增加(0.054±0.018 vs 0.007±0.001, P<0.05). 相关分析显示肝组织中α-SMA和CCR6、CCL20表达呈正相关(r = 0.492、0.516, 均P<0.05).
IL-9最先被描述为一个Th2型细胞因子, 他的很多的作用类似于IL-4[16]. IL-4和TGFβ可以促进Th0和Th2细胞可以分化为Th9细胞. IL-9主要由Th9细胞分泌. IL-9对CD4+ T细胞亚群发挥多效性作用, 影响效应细胞的分化及功能[17,18]. IL-9参与调节炎症的进展和肿瘤免疫[19]. 如Ouyang等[20]开展了有关Th9细胞和IL-9在系统性红斑狼疮(systemic lupus erythematosus, SLE)进展的研究, 他们发现外周血CD4+IL-9+ T细胞比例和血清IL-9 mRNA水平在SLE患者明显升高. 此外, 血清IL-9水平和CD4+IL-9+ T细胞的百分比与SLE疾病活动指数(systemic lupus erythematosus disease activity index, SLEDAI)显著相关. 因此, 他们认为, IL-9可能参与SLE的发病机制. 然而在乙型肝炎肝硬化中尚没有Th9作用的报道. 本研究发现与健康对照组相比, 乙型肝炎肝硬化患者外周血Th9细胞比例和血清IL-9水平显著增高, 同时我们研究发现Th9细胞比例和血清IL-9水平与肝硬化组患者的年龄、性别、ALT、AST、白蛋白、HBV-DNA、凝血酶原时间和总胆红素水平无相关性. 这些可能与肝硬化状态下炎症细胞浸润减少有关. 且多项研究已经表明, ALT水平和肝纤维化之间没有明显的联系[21-24], 因此ALT、AST不能完全反映肝纤维化的严重程度. Shao等[25]在HBV DNA>10×105拷贝/mL的慢性乙型肝炎患者研究中发现血清HBV DNA水平与肝脏组织学分级或者肝脏疾病的阶段无明显相关. 这可能是在免疫清除期时, 血清HBV DNA水平与肝纤维化无明显关联, 尽管组织学明显异常[26]. 此外, 这也可能与我们的标本量过少, 实验结果易出现统计偏差有关. 而凝血酶原时间、白蛋白和总胆红素水平作为Child-Pugh评分的依据, 是肝纤维化或者肝硬化的预测因子[17], 我们的结果显示乙型肝炎肝硬化患者外周血Th9细胞比例和血清IL-9水平显著增高; Th9细胞比例与凝血酶原时间和总胆红素水平呈正相关性, 凝血酶原时间越长, 总胆红素水平越高, 外周血Th9细胞比例越高. 这提示Th9细胞和IL-9可能参与了乙型肝炎肝硬化的发生发展过程, 但是具体发挥什么作用, 是促进肝硬化形成还是抑制肝硬化形成尚不明确, 需要进一步的研究予以证实.
Th细胞向炎症部位的迁移是其执行效应功能所必需的. 趋化因子家族及其受体, 是一类具有趋化、募集、迁移细胞功能的小分子蛋白, 参与体内许多重要的生理和病理效应. 最近Kara等[27]在过敏性和自身免疫性疾病中, 研究了调节Th9细胞迁移到炎症区域的趋化因子受体轴, 发现大多数Th9细胞表达CCR3、CCR6和CXCR3, 这些受体的表达有助于解释Th9细胞募集到不同的炎症部位. 在过敏性炎症, Th9细胞通过CCR3和CCR6, 但不是CXCR3, 迁移到腹腔, 而在实验性自身免疫性脑脊髓炎(experimental allergic encephalomyelitis, EAE), Th9细胞迁移到中枢神经系统涉及CXCR3和CCR6, 但没有CCR3. 表明Th9细胞比其他Th细胞亚群表达更广泛的功能性趋化因子受体. Ye等[28]在结核性胸腔积液(tuberculous pleurisy effusion, TPE)的研究结果显示TPE来源的胸膜间皮细胞(pleural mesothelial cells, PMCs)几乎全部表达CCL20, Th9细胞高表达CCL20的配体CCR6. 体外趋化实验证实TPE和PMCs培养上清具有诱导Th9迁移的能力, 以中和抗体阻断CCL20则显著地削弱这种趋化效应. 因此, 结核感染环境中PMCs所分泌的CCL20可能参与Th9细胞的胸膜腔浸润过程.
然而在本研究中, 我们通过流式细胞术检测了Th9细胞的表型, 研究结果显示Th9细胞高表达趋化因子受体CCR4、CCR6. 出现Th9细胞表型的差异可能是Th9细胞不表达特有的趋化因子的受体, 而是与其他已知的Th细胞亚群共享趋化因子受体. 这些提示Th9细胞在乙型肝炎肝硬化的肝脏微环境中可能拥有他自身的T细胞标记和趋化因子受体表达谱. 此外, 我们的研究发现与健康对照组相比, 乙型肝炎肝硬化组的血清CCL20的水平显著高和肝组织中α-SMA、CCR6、CCL20相关蛋白高表达, 并且还CCR6、CCL20与α-SMA的表达呈正相关. α-SMA是HSC活化的标志, HSC活化又是肝纤维化发生发展中的主要步骤[29]. 因此这些提示CCR6/CCL20趋化轴可能参与乙型肝炎肝纤维化的发生. 与这相类似的, Hammerich等[30]发现CCL20与CCR6与慢性肝损伤的研究有关; Affò等[31]在酒精性肝硬化的研究中证明CCL20与CCR6结合介导酒精性的肝炎和肝纤维化. 然而Th9细胞是否通过CCR6/CCL20趋化轴迁移到肝内炎症部位发挥作用, 需要通过趋化因子受体敲除模型系统等进一步试验.
本研究中存在一些局限性: 由于除了TH9细胞外, 许多类型的CD4+ T细胞如Th2, Th17和Treg细胞能够分泌IL-9, 因此流式细胞术检测中干扰素-γ, IL-4, IL-17和Foxp3负染色可能有利于获得更多更纯的Th9细胞; 由于样本量过小易出现统计偏差, 我们需要进行一个更大规模的标本的研究, 才有助于明确Th9细胞在乙型肝炎肝纤维化中的作用.
总之, 我们的研究首次证明了Th9细胞和IL-9在乙型肝炎肝硬化患者中表达上调, 提示了Th9细胞和IL-9与乙型肝炎肝硬化的发生发展有关, 同时提示CCR6/CCL20趋化轴可能参与Th9细胞在肝脏的募集.
Th9细胞是新近发现的一类独立的CD4+ T淋巴细胞亚群, 以高水平分泌白介-9(interleukin-9, IL-9)为特点. Th9细胞及其效应分子IL-9的功能是多元的, 报道称他们参与不同形式的炎症、肿瘤和自身免疫性疾病等. 趋化因子家族及其受体具有募集、迁移肿瘤细胞功能, 他们在生物、基因抗肿瘤疗效方面显示出巨大的潜力.
李涛, 副主任医师, 北京大学人民医院肝胆外科
对Th9细胞、趋化因子家族及其受体的研究是近年来医学研究的热点, Th9细胞的发现极大推进了我们对CD4+ T细胞在疾病中作用的了解. CCR6/CCL20趋化轴的研究有助于进一步研究Th9细胞作用机制和迁移募集, 但Th9细胞与CCR6/CCL20趋化轴的关系、在疾病中如何相互作用还有待进一步深入研究.
近年来, Th9细胞在炎症、肿瘤等疾病中的作用引起了极大的关注. 但有关Th9细胞相关趋化因子及其受体的研究与报道很稀少, 尤其Th9细胞在肝脏生理、病理活动中所发挥作用以及Th9细胞趋化募集、分化调控等尚未有报道, 其具体作用机制亟待进一步的研究.
首次证明了Th9细胞和IL-9在乙型肝炎肝硬化患者中表达上调, 提示了Th9细胞和IL-9与乙型肝炎肝硬化的发生发展有关; 同时发现Th9细胞高表达CCR4和CCR6, 提示CCR6/CCL20趋化轴可能参与Th9细胞在肝脏的募集.
本文研究Th9细胞和IL-9在乙型肝炎肝硬化患者中的关系, 提示了Th9细胞和IL-9与乙型肝炎肝硬化的发生发展有关, 同时提示CCR6/CCL20趋化轴可能参与Th9细胞在肝脏的募集. 有助于完善对Th9细胞的认识, 为进一步研究Th9细胞在疾病中的趋化迁移及作用机制提供一些方向, 后续研发相应针对Th9细胞作用的生物制剂做铺垫.
CCL/CCR生物轴: 每个趋化因子在机体发挥其作用的前提是必须与相应的受体结合, 一种趋化因子可以与不同的受体结合, 一种受体也可以与不同的因子结合.
该论文探讨了Th9细胞在乙型肝炎肝硬化患者中的表达及意义. 研究具有一定的创新性和实用价值, 研究设计合理, 具有一定的学术价值.
编辑: 郭鹏 电编: 都珍珍
| 1. | Dardalhon V, Awasthi A, Kwon H, Galileos G, Gao W, Sobel RA, Mitsdoerffer M, Strom TB, Elyaman W, Ho IC. IL-4 inhibits TGF-beta-induced Foxp3+ T cells and, together with TGF-beta, generates IL-9+ IL-10+ Foxp3(-) effector T cells. Nat Immunol. 2008;9:1347-1355. [PubMed] [DOI] |
| 2. | Veldhoen M, Uyttenhove C, van Snick J, Helmby H, Westendorf A, Buer J, Martin B, Wilhelm C, Stockinger B. Transforming growth factor-beta 'reprograms' the differentiation of T helper 2 cells and promotes an interleukin 9-producing subset. Nat Immunol. 2008;9:1341-1346. [PubMed] [DOI] |
| 3. | Chang HC, Sehra S, Goswami R, Yao W, Yu Q, Stritesky GL, Jabeen R, McKinley C, Ahyi AN, Han L. The transcription factor PU.1 is required for the development of IL-9-producing T cells and allergic inflammation. Nat Immunol. 2010;11:527-534. [PubMed] [DOI] |
| 4. | Gerlach K, Hwang Y, Nikolaev A, Atreya R, Dornhoff H, Steiner S, Lehr HA, Wirtz S, Vieth M, Waisman A. Corrigendum: TH9 cells that express the transcription factor PU.1 drive T cell-mediated colitis via IL-9 receptor signaling in intestinal epithelial cells. Nat Immunol. 2015;16:214. [PubMed] [DOI] |
| 5. | Staudt V, Bothur E, Klein M, Lingnau K, Reuter S, Grebe N, Gerlitzki B, Hoffmann M, Ulges A, Taube C. Interferon-regulatory factor 4 is essential for the developmental program of T helper 9 cells. Immunity. 2010;33:192-202. [PubMed] [DOI] |
| 6. | Pang N, Zhang F, Ma X, Zhang Z, Zhao H, Xin Y, Wang S, Zhu Y, Wen H, Ding J. Th9/IL-9 profile in human echinococcosis: their involvement in immune response during infection by Echinococcus granulosus. Mediators Inflamm. 2014;2014:781649. [PubMed] [DOI] |
| 7. | Wong MT, Ye JJ, Alonso MN, Landrigan A, Cheung RK, Engleman E, Utz PJ. Regulation of human Th9 differentiation by type I interferons and IL-21. Immunol Cell Biol. 2010;88:624-631. [PubMed] [DOI] |
| 8. | Jia L, Wu C. Differentiation, regulation and function of Th9 cells. Adv Exp Med Biol. 2014;841:181-207. [PubMed] [DOI] |
| 9. | Végran F, Apetoh L, Ghiringhelli F. Th9 cells: a novel CD4 T-cell subset in the immune war against cancer. Cancer Res. 2015;75:475-479. [PubMed] [DOI] |
| 10. | Pan HF, Leng RX, Li XP, Zheng SG, Ye DQ. Targeting T-helper 9 cells and interleukin-9 in autoimmune diseases. Cytokine Growth Factor Rev. 2013;24:515-522. [PubMed] |
| 11. | Lu Y, Hong S, Li H, Park J, Hong B, Wang L, Zheng Y, Liu Z, Xu J, He J. Th9 cells promote antitumor immune responses in vivo. J Clin Invest. 2012;122:4160-4171. [PubMed] [DOI] |
| 13. | Zhao J, Zhang Z, Luan Y, Zou Z, Sun Y, Li Y, Jin L, Zhou C, Fu J, Gao B. Pathological functions of interleukin-22 in chronic liver inflammation and fibrosis with hepatitis B virus infection by promoting T helper 17 cell recruitment. Hepatology. 2014;59:1331-1342. [PubMed] [DOI] |
| 14. | Shi M, Wei J, Dong J, Meng W, Ma J, Wang T, Wang N, Wang Y. Function of interleukin-17 and -35 in the blood of patients with hepatitis B-related liver cirrhosis. Mol Med Rep. 2015;11:121-126. [PubMed] [DOI] |
| 15. | Kong X, Feng D, Wang H, Hong F, Bertola A, Wang FS, Gao B. Interleukin-22 induces hepatic stellate cell senescence and restricts liver fibrosis in mice. Hepatology. 2012;56:1150-1159. [PubMed] [DOI] |
| 16. | Schmitt E, Klein M, Bopp T. Th9 cells, new players in adaptive immunity. Trends Immunol. 2014;35:61-68. [PubMed] [DOI] |
| 17. | Li H, Rostami A. IL-9: basic biology, signaling pathways in CD4+ T cells and implications for autoimmunity. J Neuroimmune Pharmacol. 2010;5:198-209. [PubMed] [DOI] |
| 18. | Purwar R, Schlapbach C, Xiao S, Kang HS, Elyaman W, Jiang X, Jetten AM, Khoury SJ, Fuhlbrigge RC, Kuchroo VK. Robust tumor immunity to melanoma mediated by interleukin-9-producing T cells. Nat Med. 2012;18:1248-1253. [PubMed] [DOI] |
| 19. | Lu Y, Yi Q. Utilizing TH9 cells as a novel therapeutic strategy for malignancies. Oncoimmunology. 2013;2:e23084. [PubMed] [DOI] |
| 20. | Ouyang H, Shi Y, Liu Z, Feng S, Li L, Su N, Lu Y, Kong S. Increased interleukin9 and CD4+IL-9+ T cells in patients with systemic lupus erythematosus. Mol Med Rep. 2013;7:1031-1037. [PubMed] [DOI] |
| 21. | Kumar M, Sarin SK, Hissar S, Pande C, Sakhuja P, Sharma BC, Chauhan R, Bose S. Virologic and histologic features of chronic hepatitis B virus-infected asymptomatic patients with persistently normal ALT. Gastroenterology. 2008;134:1376-1384. [PubMed] [DOI] |
| 22. | Mohamadnejad M, Montazeri G, Fazlollahi A, Zamani F, Nasiri J, Nobakht H, Forouzanfar MH, Abedian S, Tavangar SM, Mohamadkhani A. Noninvasive markers of liver fibrosis and inflammation in chronic hepatitis B-virus related liver disease. Am J Gastroenterol. 2006;101:2537-2545. [PubMed] [DOI] |
| 23. | Hui AY, Chan HL, Wong VW, Liew CT, Chim AM, Chan FK, Sung JJ. Identification of chronic hepatitis B patients without significant liver fibrosis by a simple noninvasive predictive model. Am J Gastroenterol. 2005;100:616-623. [PubMed] [DOI] |
| 24. | Seto WK, Lai CL, Ip PP, Fung J, Wong DK, Yuen JC, Hung IF, Yuen MF. A large population histology study showing the lack of association between ALT elevation and significant fibrosis in chronic hepatitis B. PLoS One. 2012;7:e32622. [PubMed] [DOI] |
| 25. | Shao J, Wei L, Wang H, Sun Y, Zhang LF, Li J, Dong JQ. Relationship between hepatitis B virus DNA levels and liver histology in patients with chronic hepatitis B. World J Gastroenterol. 2007;13:2104-2107. [PubMed] |
| 26. | Yuen MF, Ng IO, Fan ST, Yuan HJ, Wong DK, Yuen JC, Sum SS, Chan AO, Lai CL. Significance of HBV DNA levels in liver histology of HBeAg and Anti-HBe positive patients with chronic hepatitis B. Am J Gastroenterol. 2004;99:2032-2037. [PubMed] [DOI] |
| 27. | Kara EE, Comerford I, Bastow CR, Fenix KA, Litchfield W, Handel TM, McColl SR. Distinct chemokine receptor axes regulate Th9 cell trafficking to allergic and autoimmune inflammatory sites. J Immunol. 2013;191:1110-1117. [PubMed] [DOI] |
| 28. | Ye ZJ, Yuan ML, Zhou Q, Du RH, Yang WB, Xiong XZ, Zhang JC, Wu C, Qin SM, Shi HZ. Differentiation and recruitment of Th9 cells stimulated by pleural mesothelial cells in human Mycobacterium tuberculosis infection. PLoS One. 2012;7:e31710. [PubMed] [DOI] |
| 29. | Urtasun R, Nieto N. [Hepatic stellate cells and oxidative stress]. Rev Esp Enferm Dig. 2007;99:223-230. [PubMed] |
| 30. | Hammerich L, Bangen JM, Govaere O, Zimmermann HW, Gassler N, Huss S, Liedtke C, Prinz I, Lira SA, Luedde T. Chemokine receptor CCR6-dependent accumulation of γδ T cells in injured liver restricts hepatic inflammation and fibrosis. Hepatology. 2014;59:630-642. [PubMed] [DOI] |