修回日期: 2015-01-29
接受日期: 2015-02-09
在线出版日期: 2015-04-08
目的: 探讨重组人前梯度同源蛋白2(anterior gradient homolog 2, AGR2)的表达对肝癌细胞增殖能力的影响及其可能的作用机制.
方法: 通过实时荧光定量PCR、Western blot、免疫组织化学检测40例肝癌患者癌组织和对应癌旁组织中AGR2基因、干扰素诱导跨膜蛋白3(interferon-induced transmembrane protein 3, IFITM3)的表达情况, 构建AGR2的过表达质粒pcDNA3.1-AGR2, 并将其转染至肝癌细胞中, 运用实时荧光定量PCR和蛋白质印迹法分别检测AGR2 mRNA和蛋白的表达, CCK-8(cell counting kit 8)法检测细胞的增殖能力, 利用流式细胞技术检测细胞凋亡, 蛋白质印迹法检测IFITM3的表达.
结果: 在原发性肝癌组织中AGR2、IFITM3呈现高表达; 成功构建AGR2的过表达质粒pcDNA3.1-AGR2, 成功构建稳定高表达AGR2的肝癌HepG2细胞. pcDNA3.1-AGR2转染组HepG2细胞中AGR2 mRNA和蛋白的表达水平明显高于阴性对照组和空白对照组. 与阴性对照组比较, pcDNA3.1-AGR2转染组HepG2细胞的体外增殖能力和克隆形成能力明显升高, IFITM3蛋白的表达水平也随之升高.
结论: 上调AGR2可以增加IFITM3的表达, 促进肝癌细胞的增殖.
核心提示: 重组人前梯度同源蛋白2(anterior gradient homolog 2, AGR2)基因在人多个腺体的肿瘤组织中呈过表达, 与肿瘤细胞的生长、存活和转移相关; 在肝癌中AGR2调控干扰素诱导跨膜蛋白3(interferon-induced transmembrane protein 3, IFITM3)的表达促进肝癌细胞的增殖的研究未见报道. 本研究在组织和细胞水平探讨AGR2调控IFITM3的表达对肝癌细胞增殖的影响.
引文著录: 冯潜, 周勇, 石世代, 李恩亮, 吴荣寿, 李科浩, 邬林泉. AGR2调控IFITM3的表达促进肝癌细胞的增殖. 世界华人消化杂志 2015; 23(10): 1585-1591
Revised: January 29, 2015
Accepted: February 9, 2015
Published online: April 8, 2015
AIM: To investigate the effect of anterior gradient homolog 2 (AGR2) expression on the proliferation of hepatocellular carcinoma cells, and to explore the possible mechanism.
METHODS: The expression of AGR2 and interferon-induced transmembrane protein 3 (IFITM3) in hepatocellular carcinoma and adjacent tissues was detected by fluorescence quantitative PCR and Western blot. The expression of AGR2 mRNA and protein was examined by real-time fluorescence quantitative PCR and Western blot after transfection with pcDNA3.1-AGR2. The cellular growth ability was examined by CCK-8 assay, and the colony formation ability was detected by colony formation assay. Flow cytometry assay was used to determine the apoptosis index. The expression level of IFITM3 protein was examined by Western blot.
RESULTS: AGR2 and IFITM3 mRNA and protein expression in hepatocellular carcinoma tissues was significantly higher than that in the corresponding adjacent tissues. The pcDNA3.1-AGR2 was successfully constructed, and HepG2 cells with stable expression of AGR2 were established. The expression levels of AGR2 mRNA and protein in HepG2 cells after transfection with pcDNA3.1-AGR2 were higher than those in the negative control cells, and the cellular growth ability of HepG2 cells after transfection with pcDNA3.1-AGR2 was significantly increased. IFITM3 protein expression was also increased after transfection with pcDNA3.1-AGR2.
CONCLUSION: Raised AGR2 expression can increase the expression of IFITM3 and promote the proliferation of hepatocellular cells.
- Citation: Feng Q, Zhou Y, Shi SD, Li EL, Wu RS, Li KH, Wu LQ. AGR2 regulates IFITM3 expression to promote hepatocellular carcinoma cell proliferation. Shijie Huaren Xiaohua Zazhi 2015; 23(10): 1585-1591
- URL: https://www.wjgnet.com/1009-3079/full/v23/i10/1585.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i10.1585
原发性肝细胞性肝癌(primary hepatocellular carcinoma, PHC)简称肝癌, 是严重威胁人类生命的恶性肿瘤之一[1,2]. 其发病率和死亡率呈逐年上升趋势, 我国是肝癌的高发地区, 发病率和死亡率均占癌症中的第2位. 重组人前梯度同源蛋白2(anterior gradient homolog 2, AGR2)是一种分泌蛋白, 是人类早期阶段前后位分化的相关蛋白, 在人乳腺、结肠、肺、前列腺、胰腺等腺体的肿瘤组织中, AGR2基因呈过表达, 提示与肿瘤细胞的生长、存活和转移相关[3-6]. 研究证实人类干扰素诱导跨膜蛋白(interferon-induced transmembrane protein, IFITM)基因家族在免疫细胞信号传导、细胞黏附、癌症及干细胞迁移等过程中起重要作用[7,8]. IFITM3基因属于IFITM基因家族中的一员, 研究[9-11]报道IFITM3基因编码蛋白参与调节原始生殖细胞的迁移、内胚层定位及丙型肝炎病毒(hepatitis C virus, HCV)感染, 介导调节白细胞、内皮细胞的黏附和凋亡等生物学过程. 本研究运用实时荧光定量PCR、Western blot、免疫组织化学方法, 检测AGR2基因和IFITM3基因在肝癌组织中的表达情况, 探讨其在肝癌细胞中AGR2基因调控IFITM3基因的表达对肝癌细胞增殖的影响.
2013-09/2014-09收集南昌大学第二附属医院40例肝癌及对应癌旁组织标本, 所有标本均经病理学检查确诊, 年龄45-78岁. 所有患者手术切除肿瘤前均未接受放化疗. 其中男26例, 女14例, 标本收集后立即液氮保存. 全部标本的采集均由患者本人知情同意并通过南昌大学第二附属医院伦理委员会审核通过. 肝癌细胞购自中国科学院细胞库; DMEM培养液和胎牛血清(Gibco), G418(索莱宝), TRIzol试剂、PrimeScriptTM RT reagent Kit with gDNA Eraser及SYBR® Premix Ex TaqTM试剂盒购自宝生物工程有限公司; RIPA裂解液(普利莱); 兔抗人AGR2和IFITM3多克隆抗体以及鼠抗人Tubulin单克隆抗体(Proteintech); 辣根过氧化物酶标记的山羊抗兔或抗鼠IgG(二抗)(北京中杉金桥); 脂质体Lipfectamine 2000(Invitrogen); 总蛋白提取试剂盒(普利莱); 化学发光检测试剂(北京天根). PCR引物序列由上海生工公司合成, AGR2引物序列: 上游: 5'-CTGGCCAGAGATACCACAGTC-3', 下游: 5'-AGTTGGTCACCCCAACCTC-3'.
1.2.1 实时荧光定量PCR检测原发性肝癌组织中AGR2、IFITM3 mRNA的表达: 采用TRIzol试剂提取肿瘤组织及对照癌旁组织中总RNA, -80 ℃保存, 将TRIzol法获得的RNA进行逆转录成cDNA, 反应体系: 16 ℃ 30 min, 42 ℃ 30 min, 85 ℃ 5 min. 用20 μL反应体系: SYBR 10 μL、上下游引物各1 μL、cDNA 6 μL及H2O 2 μL, 反应条件: 95 ℃ 10 min, 95 ℃ 15 s, 59 ℃ 60 s, 40个循环. 根据获得的Ct值按统计学分析AGR2、IFITM3在原发性肝癌和对应癌旁组织中的表达情况.
1.2.2 免疫组织化学和Western blot检测原发性肝癌组织中AGR2、IFITM3蛋白的表达: 将收集的原发性肝癌患者的癌组织和癌旁组织制成石蜡切片后置于67 ℃烘箱中, 烘片2 h, 用pH 7.4的PBS冲洗3次, 取一定量柠檬酸盐缓冲液(pH 6.0), 加热至沸腾, 将脱蜡水化后的组织切片置于耐高温塑料切片架上, 取出玻片, 先用蒸馏水冲洗2次, 每张切片加1滴相应的抗体, 孵育2 h后加1滴聚合物增强剂, 孵育20-30 min. 加入1滴酶标抗鼠/兔聚合物, 孵育30 min. 再加入1滴新鲜配制的DAB液, 后放入显微镜下观察5 min. 用自来水冲洗后蓝化, 切片经过梯度酒精脱水干燥, 二甲苯透明, 中性树胶封固, 晾干后观察.
采用RIPA裂解液分别提取癌组织及癌旁组织总蛋白, 按照BCA法进行总蛋白定量, 凝胶电泳后将蛋白转移至PVDF膜. 5%脱脂牛奶封闭后, 加入稀释的AGR2抗体、Tubulin抗体4 ℃孵育过夜, TBST洗涤后加入HRP标记山羊抗兔二抗室温孵育1 h, TBST洗涤后, 显影.
1.2.3 细胞培养及转染: 将HepG2接种于DMEM培养基(含10%胎牛血清), 37 ℃、50 mL/L CO2条件下培养. 待细胞数量达到70%-90%, 严格遵照新型脂质体LipofectamineTM 2000转染试剂说明, 用不含10%胎牛血清的DMEM培养液来进行转染, 在转染4-6 h后, 更换至含有10%胎牛血清的培养液中继续培养24-36 h.
1.2.4 MTT实验检测HepG2细胞增殖情况: 收集HepG2细胞, 将各组细胞悬液在离心管内反复充分打匀, 接种于96孔培养板(6 × 103/孔), 24 h后换液. 每组设有3个复孔. 每孔加入MTT试剂20 μL, 在37 ℃、50 mL/L CO2条件下继续孵育4 h. 测定各孔吸光度(A)值(波长490 nm). 每组重复3次. 按公式计算细胞的生长抑制率(%): 细胞生长抑制率 = (实验组平均A490-对照组平均A490)/对照组平均A490 × 100%, 上述操作重复3次.
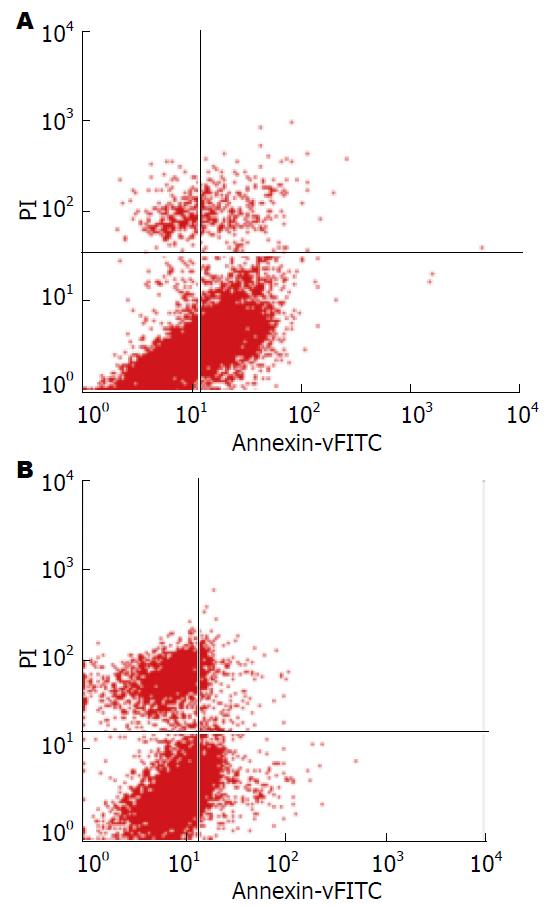
1.2.5 流式细胞术分析HepG2细胞的凋亡: 将细胞接种于6孔板中, 转染过表达AGR2质粒, 经48 h后收集细胞并制备为单细胞悬液, 采用PBS漂洗2次, 离心、弃上清, 最后运用Annexin V-FITC早期凋亡试剂盒和流式细胞仪检测各组细胞的早期凋亡情况. 上述操作重复3次.
统计学处理 采用SPSS19.0统计软件, 计量资料以mean±SD表示, 肝癌及对应癌旁组织采用配对样本t检验, 其他两组间均数的比较采用两独立样本t检验, P<0.05为差异有统计学意义.
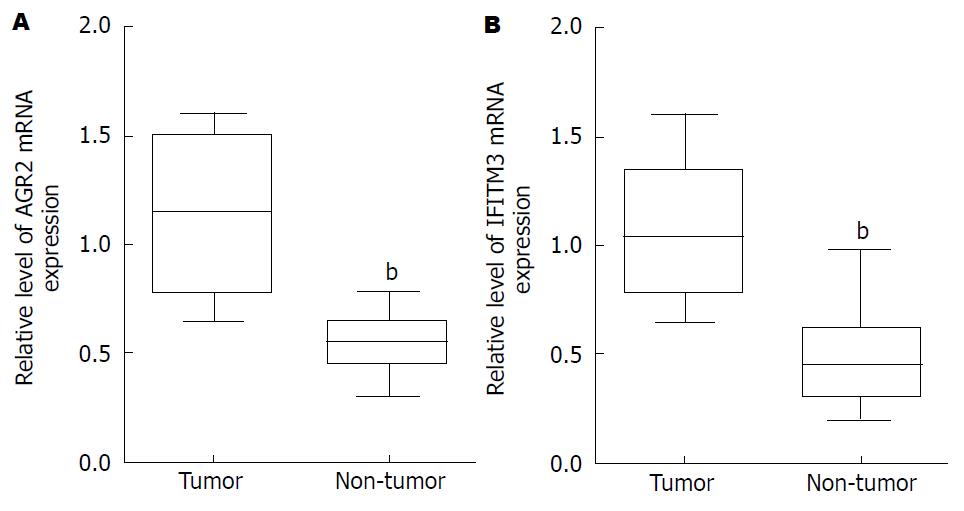
实时荧光定量PCR检测40例肝癌患者癌和癌旁组织中AGR2、IFITM3的表达情况, 结果发现: 肝癌组织AGR2、IFITM3 mRNA的表达明显高于相对应的正常癌旁组织, 结果差异有统计学意义(P<0.05)(图1).
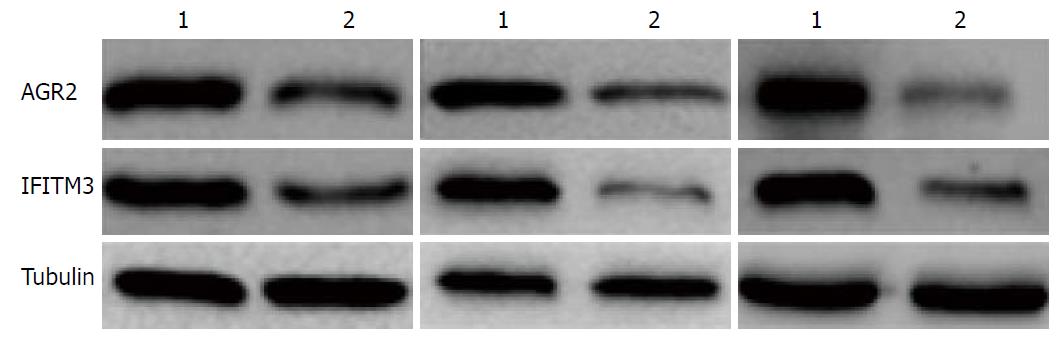
Western blot检测40例肝癌患者癌和癌旁组织中AGR2、IFITM3蛋白的表达情况, 结果发现: 肝癌组织AGR2、IFITM3蛋白的表达也同样明显高于相对应的正常癌旁组织, 结果差异有统计学意义(P<0.05)(图2).
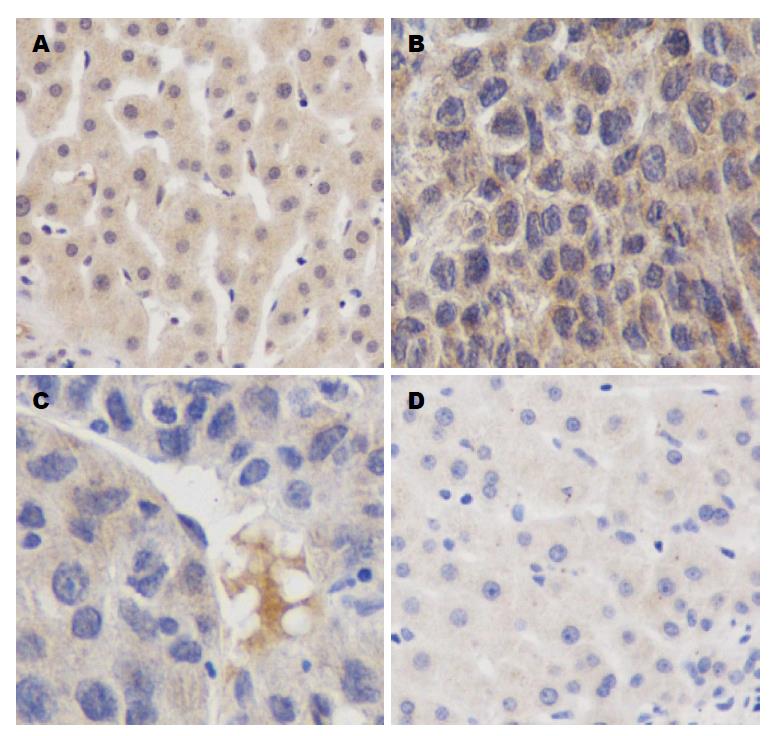
免疫组织化学染色法检测AGR2、IFITM3表达如图3.
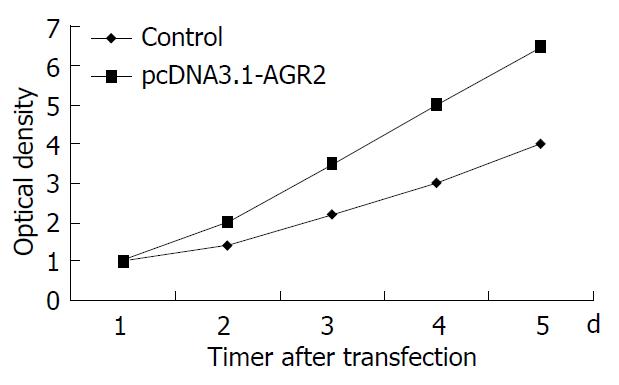
MTT检查结果发现: HepG2细胞转染pcDNA3.1-AGR2后的细胞生长较对照组均明显增加(P<0.05)(图4).
流式细胞仪检测的细胞凋亡结果显示: HepG2细胞在转染pcDNA3.1-AGR2后, 凋亡指数下降(P<0.05)(图5).
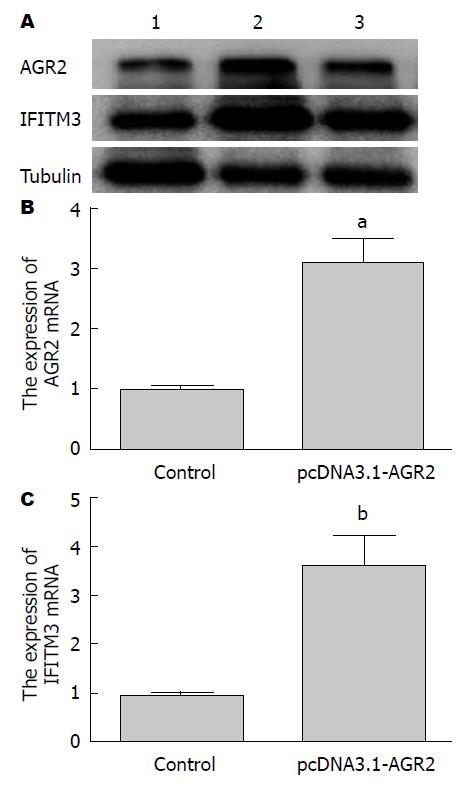
实时荧光定量PCR结果发现HepG2细胞转染pcDNA3.1-AGR2后AGR2 mRNA的表达比对照组明显升高, 同时Western blot结果同样发现pcDNA3.1-AGR2组AGR2蛋白的表达比对照组增加(图6).
人AGR2基因定位于染色体7p21.3, 包含两个转录产物, 全长分别为0.9 Kb和1.7 Kb, 是一种来源于非洲爪蛙黏液腺基因xAG2(xenopus laevis anterior gradient-2)的人型同源基因[12,13]. AGR2蛋白在ER应激、 杯状细胞末端、炎症、肢再生等生物系统中都发挥了作用, 特别是在肿瘤的生长、转移、浸润、耐药性等方面有着关键的作用[14-17], 近年来, 对于AGR2基因的功能和其在信号传导过程中所发挥的作用的研究, 以及与其他信号通路和因子之间的相互联系都成为目前肿瘤研究领域一个重要的热点[18-21].
目前国内外对于IFITM3基因在肿瘤发生发展中的作用报道较少. IFITM3基因编码蛋白分子量约14 kDa, 由133个氨基酸构成[22-24]. 近年来, IFITM3基因在恶性肿瘤中的作用愈来愈受到研究者们的重视. 有研究[25-29]发现IFITM3基因在结肠癌组织中表达高于对应的癌旁正常组织, 尤其是在转移性淋巴结中的表达更明显; 并且IFITM3基因的高表达与结肠癌患者的临床分期、淋巴结转移、远处转移及不良预后显著相关; 降低IFITM3基因的表达可以明显地抑制结肠癌细胞的侵袭和迁移能力. 另外, 还有研究[30,31]证实降低IFITM3基因的表达可以明显抑制乳腺癌细胞的增殖.
本研究通过运用实时荧光定量PCR、Western blot及免疫组织化学方法检测肝癌及对应癌旁组织中AGR2基因和IFITM3基因蛋白及mRNA的表达情况. Western blot结果显示AGR2、IFITM3蛋白在肝癌组织中的表达明显高于癌旁正常组织, 差异具有统计学意义, 提示AGR2、IFITM3高表达与肝癌的发生、发展有关. 本研究结果还发现过表达AGR2后肝癌细胞的增殖能力明显增加. 提示AGR2高表达可能通过增加IFITM3的表达增加肝癌细胞的增殖能力. 我们可推测AGR2基因异常表达可能会促进IFITM3的表达增加肝癌细胞的增殖能力, 可以把AGR2基因作为肝癌的一种潜在肿瘤标志物来继续深入研究.
随着诊断治疗水平的提高, 原发性肝癌治疗后的生存率得到提高, 但是效果仍然十分有限, 关键在于对肝癌细胞的增殖及复发转移的分子机制不完全清楚, 对其分子调控网络知之较少, 因此肝癌细胞的增殖及复发转移的分子机制的研究是目前医学界亟待解决的重大问题.
王蒙, 副教授, 中国人民解放军第二军医大学附属东方肝胆外科医院肝外综合治疗一科
重组人前梯度同源蛋白2(anterior gradient homolog 2, AGR2)是人类早期阶段前后位分化的相关蛋白, 在人多个腺体的肿瘤组织中过表达, AGR2基因的功能和其在信号传导过程中所发挥的作用的研究, 以及与其他信号通路和因子之间的相互联系是肿瘤研究领域一个重要的热点.
根据研究推测AGR2基因异常表达可能会促进干扰素诱导跨膜蛋白3(interferon-induced transme-mbrane protein 3)的表达增加肝癌细胞的增殖能力, 可以把AGR2基因作为肝癌的一种潜在肿瘤标志物来继续深入研究.
本文构思合理, 有继续发展的空间.
编辑: 韦元涛 电编:闫晋利
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Gory I, Fink M, Bell S, Gow P, Nicoll A, Knight V, Dev A, Rode A, Bailey M, Cheung W. Radiofrequency ablation versus resection for the treatment of early stage hepatocellular carcinoma: a multicenter Australian study. Scand J Gastroenterol. 2015;50:567-576. [PubMed] [DOI] |
| 4. | Bergström JH, Berg KA, Rodríguez-Piñeiro AM, Stecher B, Johansson ME, Hansson GC. AGR2, an endoplasmic reticulum protein, is secreted into the gastrointestinal mucus. PLoS One. 2014;9:e104186. [PubMed] [DOI] |
| 5. | Tsuji T, Satoyoshi R, Aiba N, Kubo T, Yanagihara K, Maeda D, Goto A, Ishikawa K, Yashiro M, Tanaka M. Agr2 mediates paracrine effects on stromal fibroblasts that promote invasion by gastric signet-ring carcinoma cells. Cancer Res. 2015;75:356-366. [PubMed] [DOI] |
| 6. | Mizuuchi Y, Aishima S, Ohuchida K, Shindo K, Fujino M, Hattori M, Miyazaki T, Mizumoto K, Tanaka M, Oda Y. Anterior gradient 2 downregulation in a subset of pancreatic ductal adenocarcinoma is a prognostic factor indicative of epithelial-mesenchymal transition. Lab Invest. 2015;95:193-206. [PubMed] [DOI] |
| 7. | Chutiwitoonchai N, Hiyoshi M, Hiyoshi-Yoshidomi Y, Hashimoto M, Tokunaga K, Suzu S. Characteristics of IFITM, the newly identified IFN-inducible anti-HIV-1 family proteins. Microbes Infect. 2013;15:280-290. [PubMed] [DOI] |
| 8. | Diamond MS, Farzan M. The broad-spectrum antiviral functions of IFIT and IFITM proteins. Nat Rev Immunol. 2013;13:46-57. [PubMed] [DOI] |
| 9. | Shen C, Wu XR, Jiao WW, Sun L, Feng WX, Xiao J, Miao Q, Liu F, Yin QQ, Zhang CG. A functional promoter polymorphism of IFITM3 is associated with susceptibility to pediatric tuberculosis in Han Chinese population. PLoS One. 2013;8:e67816. [PubMed] [DOI] |
| 10. | Bailey CC, Zhong G, Huang IC, Farzan M. IFITM-Family Proteins: The Cell's First Line of Antiviral Defense. Annu Rev Virol. 2014;1:261-283. [PubMed] [DOI] |
| 11. | Wakim LM, Gupta N, Mintern JD, Villadangos JA. Enhanced survival of lung tissue-resident memory CD8⁺ T cells during infection with influenza virus due to selective expression of IFITM3. Nat Immunol. 2013;14:238-245. [PubMed] [DOI] |
| 12. | Wright TM, Wardell SE, Jasper JS, Stice JP, Safi R, Nelson ER, McDonnell DP. Delineation of a FOXA1/ERα/AGR2 regulatory loop that is dysregulated in endocrine therapy-resistant breast cancer. Mol Cancer Res. 2014;12:1829-1839. [PubMed] [DOI] |
| 13. | Liu D, Rudland PS, Sibson DR, Platt-Higgins A, Barraclough R. Human homologue of cement gland protein, a novel metastasis inducer associated with breast carcinomas. Cancer Res. 2005;65:3796-3805. [PubMed] [DOI] |
| 14. | Li Y, Lu J, Peng Z, Tan G, Liu N, Huang D, Zhang Z, Duan C, Tang X, Tang F. N,N'-dinitrosopiperazine-mediated AGR2 is involved in metastasis of nasopharyngeal carcinoma. PLoS One. 2014;9:e92081. [PubMed] [DOI] |
| 15. | Niederreiter L, Kaser A. Endoplasmic reticulum stress and inflammatory bowel disease. Acta Gastroenterol Belg. 2011;74:330-333. [PubMed] |
| 16. | Di Maro G, Salerno P, Unger K, Orlandella FM, Monaco M, Chiappetta G, Thomas G, Oczko-Wojciechowska M, Masullo M, Jarzab B. Anterior gradient protein 2 promotes survival, migration and invasion of papillary thyroid carcinoma cells. Mol Cancer. 2014;13:160. [PubMed] [DOI] |
| 17. | Pizzi M, Fassan M, Realdon S, Balistreri M, Battaglia G, Giacometti C, Zaninotto G, Zagonel V, De Boni M, Rugge M. Anterior gradient 2 profiling in Barrett columnar epithelia and adenocarcinoma. Hum Pathol. 2012;43:1839-1844. [PubMed] [DOI] |
| 18. | Huang J, Wang L, Jiang M, Chen Q, Jiang Z, Feng H. AGR2-mediated lung adenocarcinoma metastasis novel mechanism network through repression with interferon coupling cytoskeleton to steroid metabolism-dependent humoral immune response. Cell Immunol. 2014;290:102-106. [PubMed] [DOI] |
| 19. | Salmans ML, Zhao F, Andersen B. The estrogen-regulated anterior gradient 2 (AGR2) protein in breast cancer: a potential drug target and biomarker. Breast Cancer Res. 2013;15:204. [PubMed] [DOI] |
| 20. | Sung HY, Choi EN, Lyu D, Park AK, Ju W, Ahn JH. Aberrant hypomethylation-mediated AGR2 overexpression induces an aggressive phenotype in ovarian cancer cells. Oncol Rep. 2014;32:815-820. [PubMed] [DOI] |
| 21. | Riener MO, Thiesler T, Hellerbrand C, Amann T, Cathomas G, Fritzsche FR, Dahl E, Bahra M, Weichert W, Terracciano L. Loss of anterior gradient-2 expression is an independent prognostic factor in colorectal carcinomas. Eur J Cancer. 2014;50:1722-1730. [PubMed] [DOI] |
| 22. | Andreu P, Colnot S, Godard C, Laurent-Puig P, Lamarque D, Kahn A, Perret C, Romagnolo B. Identification of the IFITM family as a new molecular marker in human colorectal tumors. Cancer Res. 2006;66:1949-1955. [PubMed] [DOI] |
| 23. | Li D, Peng Z, Tang H, Wei P, Kong X, Yan D, Huang F, Li Q, Le X, Li Q. KLF4-mediated negative regulation of IFITM3 expression plays a critical role in colon cancer pathogenesis. Clin Cancer Res. 2011;17:3558-3568. [PubMed] [DOI] |
| 24. | Xue WW, Wang HN, Wang ZM, Qiu MX, Che J, Deng FJ, Liu JD. Cloning and characterization of ifitm1 and ifitm3 expression during early zebrafish development. Zygote. 2016;24:149-158. [PubMed] [DOI] |
| 25. | Chesarino NM, McMichael TM, Yount JS. Regulation of the trafficking and antiviral activity of IFITM3 by post-translational modifications. Future Microbiol. 2014;9:1151-1163. [PubMed] [DOI] |
| 26. | Williams DE, Wu WL, Grotefend CR, Radic V, Chung C, Chung YH, Farzan M, Huang IC. IFITM3 polymorphism rs12252-C restricts influenza A viruses. PLoS One. 2014;9:e110096. [PubMed] [DOI] |
| 27. | Hu J, Wang S, Zhao Y, Guo Q, Zhang D, Chen J, Li J, Fei Q, Sun Y. Mechanism and biological significance of the overexpression of IFITM3 in gastric cancer. Oncol Rep. 2014;32:2648-2656. [PubMed] [DOI] |
| 28. | Yu M, Qi W, Huang Z, Zhang K, Ye J, Liu R, Wang H, Ma Y, Liao M, Ning Z. Expression profile and histological distribution of IFITM1 and IFITM3 during H9N2 avian influenza virus infection in BALB/c mice. Med Microbiol Immunol. 2015;204:505-514. [PubMed] [DOI] |
| 29. | Zhu X, He Z, Yuan J, Wen W, Huang X, Hu Y, Lin C, Pan J, Li R, Deng H. IFITM3-containing exosome as a novel mediator for anti-viral response in dengue virus infection. Cell Microbiol. 2015;17:105-118. [PubMed] [DOI] |
| 30. | Fan J, Peng Z, Zhou C, Qiu G, Tang H, Sun Y, Wang X, Li Q, Le X, Xie K. Gene-expression profiling in Chinese patients with colon cancer by coupling experimental and bioinformatic genomewide gene-expression analyses: identification and validation of IFITM3 as a biomarker of early colon carcinogenesis. Cancer. 2008;113:266-275. [PubMed] [DOI] |