修回日期: 2015-01-30
接受日期: 2015-02-09
在线出版日期: 2015-04-08
目的: 探讨NADPH氧化酶Nox1和Duox2在小鼠肠炎发病中的表达及意义.
方法: 将6-8周龄的C57BL/6小鼠随机分为正常组、1.5%葡聚糖硫酸钠(dextran sulphate sodium, DSS)组和3.0%DSS组, 每组10只, 正常组正常饮水, 1.5%和3.0%DSS组分别自由饮用含有1.5%或者3.0%DSS的饮水, 共6 d建立小鼠急性肠炎模型. 通过疾病活动指数(disease activity index, DAI)评分、结肠长度测定和HE染色等方法评估肠道炎症程度. 利用生化方法检测血清丙二醛(malondialdehyde, MDA)含量以及结肠组织中氧化型谷胱甘肽/还原型谷胱甘肽(oxidized glutathione/glutathione, GSSG/GSH)比率等氧化应激指标, 以评估机体氧化应激程度. 采用免疫组织化学方法和实时定量PCR技术分别检测小鼠结肠组织中NADPH氧化酶Nox1和Duox2蛋白及mRNA表达情况.
结果: 正常组小鼠无肠炎, 1.5%DSS组、3.0%DSS组小鼠分别呈轻度和重度肠炎. 氧化应激指标(MDA、GSSG/GSH)在1.5%DSS组升高, 而3.0%DSS组进一步升高(均P<0.05). NADPH氧化酶Nox1与Duox2蛋白和mRNA在不同炎症程度时表达不同: Nox1蛋白和mRNA在正常组呈高表达, 在1.5%DSS组表达下调(P<0.05), 在3.0%DSS组进一步下调(P<0.05); Duox2蛋白和mRNA在1.5%DSS组表达较正常组明显上调(P<0.05), 而在3.0%DSS组表达下调至正常水平.
结论: Nox1主要在维持肠道正常生理功能中发挥作用, 而Duox2除了维持正常生理功能外, 可能还积极地参与肠炎发病过程.
核心提示: 在本实验中, 应用小鼠肠炎模型的方法发现NADPH氧化酶Nox1和Duox2产生的活性氧并不是机体氧化应激的主要贡献者. Nox1主要是在维持结肠组织正常生理功能中发挥重要作用, 而Duox2除了参与维持正常生理功能外, 可能还通过氧化应激途径在肠道黏膜炎症过程中发挥作用.
引文著录: 杨茉莉, 李宏谦, 李小珍, 姜雅琳, 陈梦露, 高强. NADPH氧化酶Nox1和Duox2在小鼠肠炎中的表达和意义. 世界华人消化杂志 2015; 23(10): 1560-1567
Revised: January 30, 2015
Accepted: February 9, 2015
Published online: April 8, 2015
AIM: To investigate the significance of expression of NADPH oxidases Nox1 and Duox2 in the pathogenesis of mouse colitis.
METHODS: Six-to-eight-week-old C57BL/6 mice were randomly divided into a control group, a 1.5% dextran sulfate sodium (DSS) group and a 3% DSS group (n = 10 for each group). Colitis was induced in mice by giving 1.5% DSS or 3% DSS in drinking water for 6 d, and mice in the control group was given drinking water only. Disease activity index (DAI), colon length and inflammatory score of the colon were observed. Oxidative stress indicators, malondialdehyde (MDA) in serum and oxidized glutathione/glutathione (GSSG/GSH) ratio in colon tissue, were measured by biochemical methods. The protein and mRNA expression of Nox1 and Duox2 in colon tissue of mice was evaluated by immunohistochemistry and quantitative real-time PCR, respectively.
RESULTS: There was no colitis in the control group, while mild and severe enteritis was found in mice in the 1.5% DSS group and 3.0% DSS group, respectively. Oxidative stress (MDA and GSSG/GSH) was enhanced along with the increased concentration of DSS (P < 0.05 for both). The expression of Nox1 and Duox2 protein and mRNA was different with the severity of inflammation: Nox1 protein and mRNA was highly expressed in normal colon epithelial cells, but down-regulated in the 1.5% DSS group (P < 0.05), and further reduced in the 3% DSS group (P < 0.05); Duox2 protein and mRNA expression was increased (P < 0.05) in mice in the 1.5% DSS group compared to the control group, but returned to the control level in the 3% DSS group.
CONCLUSION: Nox1 is mainly involved in the functional and structural maintenance of normal colonic epithelium, while Duox2 may actively participate in the inflammatory pathogenesis besides the physiological process of the colon.
- Citation: Yang ML, Li HQ, Li XZ, Jiang YL, Chen ML, Gao Q. Significance of NADPH oxidases Nox1 and Duox2 expression in mouse colitis. Shijie Huaren Xiaohua Zazhi 2015; 23(10): 1560-1567
- URL: https://www.wjgnet.com/1009-3079/full/v23/i10/1560.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i10.1560
炎症性肠病(inflammatory bowel disease, IBD)是一种慢性非特异性肠道炎症性疾病, 包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD)两种类型. IBD的确切病因尚未明确, 目前普遍认为是遗传、免疫、肠道菌群和环境等多种因素相互作用的结果. 在IBD发生和发展过程中, 氧化应激被认为是导致肠道损伤的关键因素之一[1,2]. 氧化应激是活性氧类(reactive oxygen species, ROS)和活性氮类(reactive nitrogen species, RNS)产生过多, 超出机体对氧化物的清除能力, 导致组织细胞损伤的病理生理过程. 随着对IBD研究和认识的逐步深入, ROS在IBD的病理生理过程中的作用越来越受到重视[3-5].
NADPH氧化酶(NADPH oxidase)家族是由Nox1-5、Duox1和Duox2等7个成员组成, 他们均能产生ROS, 其中Duox1、Duox2可产生H2O2. 研究发现NADPH氧化酶是肠道黏膜ROS的重要来源, 对肠道氧化应激起到了重要的作用[6,7]. Nox1在结肠有高表达, Duox2在胃肠道表达[8,9], 但有关Nox1和Duox2在IBD疾病进程中的研究还相当有限. 本研究通过建立不同浓度葡聚糖硫酸钠(dextran sulphate sodium, DSS)诱导的小鼠肠炎模型, 探讨在不同炎症程度时, 小鼠结肠组织中Nox1和Duox2蛋白和mRNA的表达水平, 进一步理解NADPH氧化酶Nox1和Duox2在肠炎发病机制中的作用.
健康清洁级C57BL/6小鼠(北京维通利华公司), 6-8周龄, 体质量为18-25 g, 饲养于河南科技大学第一附属医院新区医院动物实验中心, 用混合配方颗粒饲料(北京华阜康生物科技股份有限公司)饲养. DSS(分子量为36000-50000, 美国MP Biomedicals公司), 总RNA提取试剂TRIzol Reagent(美国Invitrogen公司), 逆转录试剂盒和实时定量PCR试剂盒(日本Takara公司), 引物由上海生工生物工程公司合成(表1), 免疫组织化学检测用Nox1一抗(武汉博士德生物)和Duox2一抗(北京博奥森), SABC免疫组织化学检测试剂盒(武汉博士德生物), 浓缩型DAB显色试剂盒(北京索莱宝公司), 氧化应激指标检测用丙二醛(malondialdehyde, MDA)和氧化型谷胱甘肽/还原型谷胱甘肽(oxidized glutathione/glutathione, GSSG/GSH)比率试剂盒(江苏海门碧云天生物技术研究所).
| 引物名称 | 引物序列(5'→3') | 产物大小(bp) |
| Nox1 | 上游引物: TTCCTCACTGGCTGGGATAG | 189 |
| 下游引物: AGTCCGAGGGCCACATAAGA | ||
| Duox2 | 上游引物: TGGTCCCAGCAATTATCTATG | 155 |
| 下游引物: CCACTGCCCTGATTTGTACTC | ||
| β-actin | 上游引物: GGCTGTATTCCCCTCCATCG | 154 |
| 下游引物: CCAGTTGGTAACAATGCCATGT |
1.2.1 分组及造模: 小鼠适应性喂养1 wk, 室内温度保持20 ℃-22 ℃, 湿度为50%左右, 明暗交替周期为12 h. 随机分为正常组、1.5%DSS组、3.0%DSS组, 每组10只. 称取适量DSS加入蒸馏水中, 分别配制成1.5%和3.0%DSS溶液. 正常组正常饮水, 1.5%DSS组、3%DSS组分别给予1.5%DSS溶液和3.0%DSS溶液自由饮用6 d, 均不另给予饮水; 各组小鼠均给予足量饲料.
1.2.2 取材: 于造模第7天脱颈椎处死所有小鼠, 打开胸腔心脏取血制备血清, 室温静置10 min后4 ℃ 3000 r/min离心10 min取上清, -80 ℃冰箱保存备用; 剖腹, 取全结肠并测量长度, 翻转结肠后, PBS漂洗, 自远端结肠始取约0.5 cm, 甲醛固定, 石蜡包埋, 4 μm厚度切片, 备免疫组织化学及HE染色使用. 再取1.0 cm, -80 ℃保存, 行实时定量PCR和生化测定.
1.2.3 观察指标: 每日定时测量小鼠体质量、观察小鼠摄食/饮水、活动度、大便性状、便血等状态, 参照Jackson等[10]的方法, 进行疾病活动指数(disease activity index, DAI)评分. DAI评分 = (体质量下降+大便性状+便血分数)/3(表2). 取材时测量全结肠长度, 肉眼观察结肠内血性内容物情况. 参照张静等[11]的方法进行便血评分, 结肠内血性内容物用0-3+标准评价: 0: 无出血, 1+: 结肠1/3出血, 2+: 结肠2/3出血, 3+: 整个结肠均有出血.
| 体质量下降(%) | 大便性状 | 便血 | 计分 |
| 0 | 正常 | 正常 | 0 |
| 1-5 | 1 | ||
| 6-10 | 松散 | 隐血阳性 | 2 |
| 11-15 | 3 | ||
| >15 | 稀便 | 肉眼血便 | 4 |
1.2.4 病理组织学观察: 采用HE染色法, 对结肠组织进行病理分析. 在高倍显微镜( × 400)下进行细胞计数, 每张切片随机选择10个视野, 每个视野观察100个细胞. 根据Esworthy等[12]的评分标准进行评分, 具体评分包括: 淋巴细胞和中性粒细胞浸润(0-3分); 潘氏细胞和 杯状细胞脱颗粒(0-2分); 上皮细胞反应, 如隐窝缺失(0-3分); 炎症病灶(0-3分). 急性炎症的临界值定义为6-7分.
1.2.5 氧化应激指标检测: 血清中MDA含量以及组织中GSSG/GSH比率的测定均按照试剂盒说明操作. GSSG/GSH比率的测定时, 取结肠组织10 mg, 加入100 μL蛋白去除试剂M溶液, 用玻璃匀浆器充分匀浆, 4 ℃静置10 min后, 10000 r/min 4 ℃离心10 min, 取上清备用.
1.2.6 免疫组织化学方法检测Nox1和Duox2的蛋白表达: 免疫组织化学染色, Nox1和Duox2一抗工作浓度分别为1:100、1:300, DAB显色, 苏木素复染. 在光学显微镜下进行细胞计数, 每张切片随机选择10个视野, 每个视野观察100个细胞. 染色细胞比率评分标准:<5%计0分, 5%-25%计1分, 26%-50%计2分, 51%-75%计3分, 76%-100%计4分; 染色强度评分标准: 细胞质内无染色计0分, 淡黄色计1分, 棕色计2分, 棕褐色计3分, 根据两项评分之积进行免疫组织化学染色评分.
1.2.7 实时定量PCR检测Nox1和Duox2 mRNA表达水平: TRIzol法提取总RNA, 用核酸定量仪测定RNA纯度和浓度. 取总RNA 2 μg, 按照逆转录试剂盒说明书逆转录合成cDNA, -20 ℃保存备用. 冰上配制PCR反应液, 反应体系25 μL: cDNA 2 μL, SYBR Premix EX Taq Ⅱ(2 × )12.5 μL, DEPC水8.5 μL, 上下游引物各1 μL. 于BIO-RAD Real-time PCR仪中进行PCR反应, 反应条件为: 95 ℃变性30 s; 95 ℃ 5 s、60 ℃ 30 s, 共40个循环. 结果以阈循环(Ct)值表示, 每个样本3个复孔, 取平均Ct值, β-actin作为内参, 采用2-∆∆Ct法分析mRNA相对表达量.
统计学处理 数据均用mean±SD表示, 采用SPSS19.0统计软件分析, 计量资料组间比较采用t检验, 计数资料行独立样本秩和检验, P<0.05为差异有统计学意义.
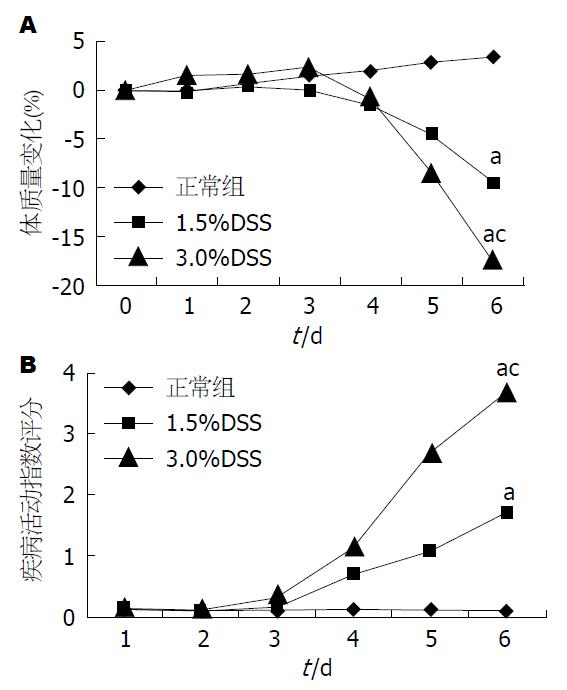
正常组小鼠每天摄食和饮水正常, 活动如常, 反应机警, 皮毛有光泽, 生长发育良好, 体质量增加; 1.5%DSS组于造模第5天出现懒动, 摄食/饮水减少, 体质量下降, 出现稀便、肛周潮湿现象, 第6天有4只出现血水样便, 但体质量下降均未超过10%; 3.0%DSS组造模第3天开始相继出现懒动、精神萎靡, 体毛凌乱, 摄食/饮水减少, 并出现稀便、肉眼血便、肛周潮湿现象, 体质量下降, 第6天有9只出现严重肉眼血便, 其中有8只体质量下降超过10%, 但无小鼠死亡. 1.5%DSS组、3.0%DSS组DAI评分与正常组相比均显著增高(P<0.05), 而且3%DSS组与1.5%DSS组相比DAI评分进一步增高(图1).
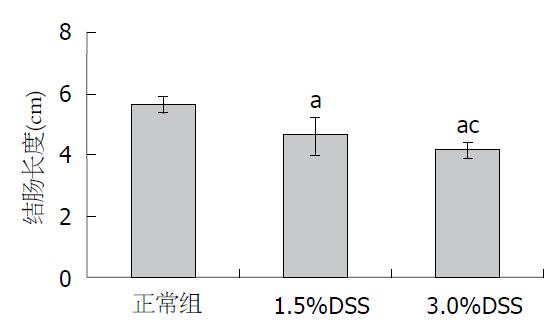
造模结束后, 1.5%DSS组、3.0%DSS组结肠长度均有不同程度的缩短, 其中3.0%DSS组缩短严重(均P<0.05). 正常组小鼠结肠内无血便(血便评分是0); 1.5%DSS组有6只小鼠结肠内存在轻度血便(评分是0.80±0.79); 而3.0%DSS组所有结肠内均有不同程度血便, 其中5只小鼠全结肠均有血便(评分是2.40±0.70), 各组血便评分结果差异均有统计学意义(均P<0.05)(图2).
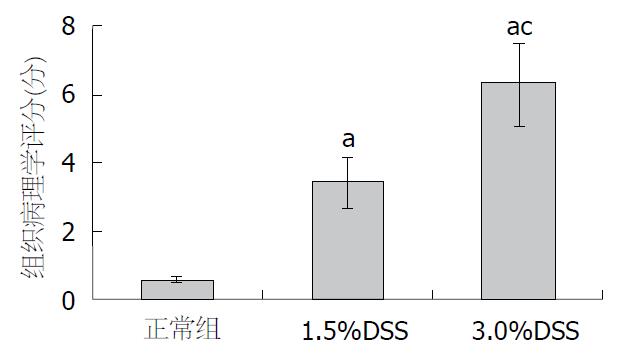
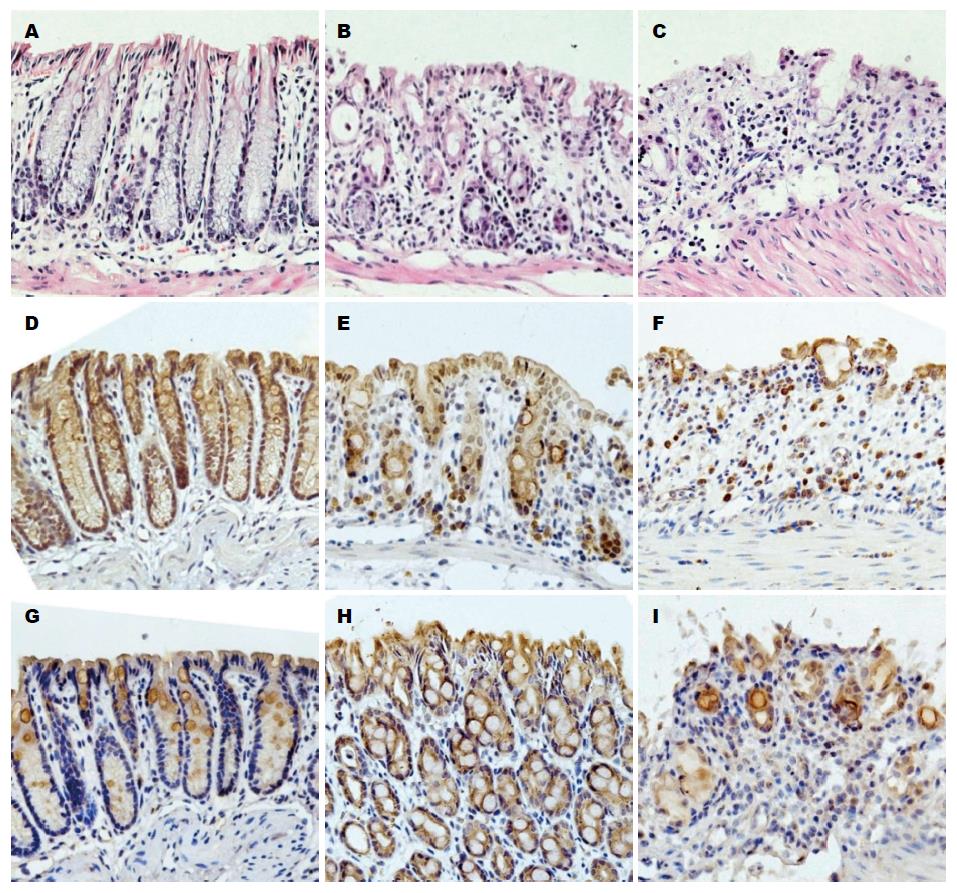
正常组小鼠病理观察可见结肠黏膜结构完整, 无炎性细胞浸润; 1.5%DSS组黏膜腺体基本完整, 局部有少量炎性细胞浸润或隐窝破坏, 呈轻度炎症改变; 3.0%DSS组可见黏膜上皮细胞广泛缺失, 腺体大多数不完整, 细胞结构排列紊乱, 杯状细胞消失, 中性粒细胞等炎症细胞浸润广泛, 呈严重炎症改变; 各组炎症程度有明显差别(均P<0.05)(图3, 图4A-C).
1.5%DSS组、3.0%DSS组小鼠血清MDA含量以及结肠组织中GSSG/GSH比率较正常组均呈不同程度升高; 其中3.0%DSS组MDA含量、GSSG/GSH比率最高(均P<0.05)(表3).
2.5.1 Nox1蛋白的表达: Nox1蛋白主要表达于正常结肠上皮细胞刷状缘和胞浆, 随着炎症程度加重Nox1蛋白在结肠上皮细胞表达下调. 1.5%DSS组Nox1蛋白表达较正常组明显减少, 3.0%DSS组只有少量表达(均P<0.05), 在炎症区域可见炎症样细胞呈阳性染色(表4, 图4D-F).
2.5.2 Duox2蛋白的表达: Duox2蛋白主要表达于结肠上皮细胞刷状缘, 炎症时胞浆也有少量表达; 正常组Duox2蛋白表达较少, 1.5%DSS组表达明显增加, 3.0%DSS组表达最低(均P<0.05)(表4, 图4G-I).
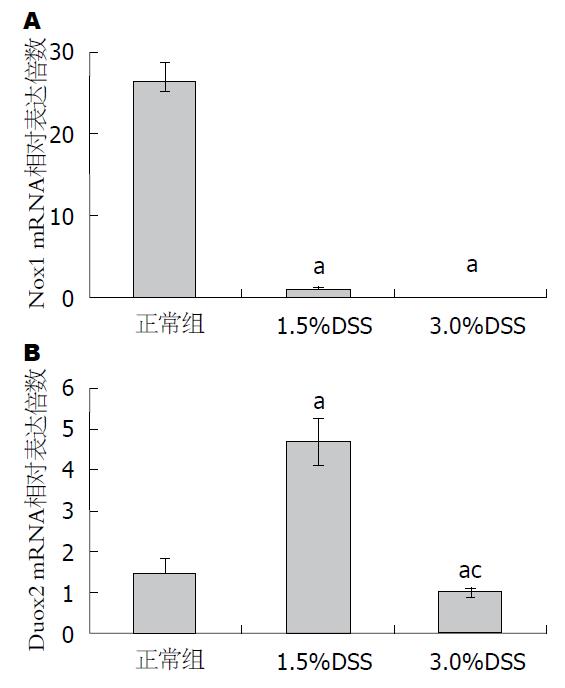
2.6.1 Nox1 mRNA的表达: 正常组Nox1 mRNA高表达, 是1.5%DSS组的26倍(P<0.05); 3.0%DSS组不表达(图5A).
2.6.2 Duox2 mRNA的表达: 1.5%DSS组Duox2 mRNA表达水平是正常组的3倍(P<0.05); 而3.0%DSS组的表达与正常组差异无统计学意义(图5B).
IBD在西方国家是常见病, 近年来由于生活和饮食习惯的变化, 我国IBD发病呈明显增加的趋势, 据最新研究[13,14]表明IBD的总报道病例数量在近10余年内增加了2.5倍, 尤其是CD增加了15.7倍. 临床上, IBD患者主要表现为腹痛、腹泻、黏液血便等, 可伴有各种肠道外症状和并发症, 病程迁延不愈, 严重影响患者生活质量[1,3,15]. 本实验建立的不同浓度DSS诱导的小鼠肠炎模型, 表现出了与人类UC类似的症状, 如体质量下降、腹泻、血便等, 结合镜下病理分析, 结果表明, 1.5%DSS诱导的肠炎模型呈轻微炎症改变, 3.0%DSS诱导的则呈重度急性炎症改变.
在IBD的发病过程中, 多种因素可导致易感个体肠道内环境的破坏, 引起肠道黏膜免疫功能失调, 从而造成黏膜屏障的损伤[16]. ROS是由氧分子衍生的活性小分子物质, 包括氧自由基(O2-)、氢过氧基(HO2-)、羟自由基(·OH)和H2O2等, 这些分子均十分活跃, 具有很强的化学反应活性. 研究证实, 在IBD动物模型和IBD患者的结肠黏膜中ROS和RNS的产生均增加, 其中ROS经常在疾病的早期阶段被观察到, 且与疾病的严重程度及进展相关[17-19]. ROS可激活核因子-κB(nuclear factor-κB, NF-κB)介导产生大量的细胞促炎因子, 如白介素(interleukin, IL)-1β、IL-8、IL-6、肿瘤坏死因子(tumor necrosis factor, TNF)-α及γ干扰素(interferon-γ, IFN-γ), 促进炎症反应[20,21].
MDA是脂质过氧化反应的代谢产物, 其含量反映了组织过氧化损伤程度, 他本身能使肠黏膜组织损害进一步加重. MDA的高低间接反映了机体细胞受自由基攻击的严重程度. 谷胱甘肽过氧化物酶(glutathion peroxidases, GPXs)是一组重要的过氧化物分解酶, 他能催化GSH变为GSSG, 使H2O2转化为水而被清除, GSSG/GSH比率的变化一定程度上可反映机体的抗氧化能力. 最新研究[22]显示, IBD患者血清中GPXs在疾病的缓解期处于低水平, 说明IBD患者抗氧化能力下降. 本实验中, 氧化应激指标检测结果表明, 随着DSS浓度增加, 炎症程度加重, 氧化应激指标呈不同程度升高, 提示炎症使机体处于不同程度的氧化应激状态之中, 氧化应激是导致肠道损伤的重要因素.
Nox1是产生ROS的NADPH氧化酶之一, 生理状态下主要在结肠表达[3], 其确切的病理生理功能目前尚不明确. Coant等[23]研究发现在结肠中, Nox1在调节细胞增殖、促进有丝分裂进而对维持 杯状细胞和吸收细胞功能稳态中发挥重要作用. Nox1在结肠的上皮细胞中高表达, Noxl源性ROS参与调节结肠上皮细胞生长和转化, 提示在IBD疾病进程中Nox1可能在宿主免疫防御中发挥重要作用[24]. 本研究结果显示Nox1蛋白和mRNA表达趋势一致; Nox1在正常的结肠黏膜组织中高表达, 提示Nox1在维持正常生理功能过程中发挥重要作用; 然而, 随着炎症程度加重, Nox1表达减少, 甚至不表达, 可能与炎症加重导致肠上皮细胞结构与功能受损有关.
Duox2作为肠道黏膜H2O2的主要产生者, 参与肠道黏膜先天免疫反应[25]. 最初认为Duox2仅仅是甲状腺中的H2O2合成酶, 参与甲状腺激素合成, 后来研究[8]发现Duox2存在于多种组织, 最近还发现Duox2蛋白在整个消化系均有表达. Duox2在生理情况下有抵御细菌侵入和调控肠道菌群的作用, 但产生过量的H2O2时可能会出现氧化应激, 引起组织损伤[6,7,26,27]. 临床研究[26,28]表明, IBD患者肠道病变组织上皮Duox2 mRNA和蛋白表达水平均上调. 对GPX1/2双敲除小鼠的研究[29-31]发现Duox2可能是结肠炎的候选易感基因, 提示Duox2可能在IBD的发病过程中发挥作用. 本实验中, 小鼠结肠组织中Duox2蛋白表达于肠上皮细胞刷状缘和胞浆, 这与Ramonaite等[19]的研究情况一致. Duox2蛋白在小鼠正常的结肠黏膜组织中表达, 说明Duox2可能在维持结肠组织正常生理功能, 如机体抵御病原微生物中有重要作用. Duox2蛋白与mRNA表达水平一致, 在轻度肠炎时表达较正常时增加, 提示Duox2在炎症过程中发挥作用, 而随着炎症程度加重, Duox2表达减少, 这可能与炎症加重导致肠黏膜上皮细胞损害有关.
在本实验中, 炎症程度随着DSS浓度增加而加重, 同时氧化应激指标升高, 然而, Nox1和Duox2表达并没有随炎症和氧化应激程度升高而增加, 尤其Nox1表达下调, 说明Nox1和Duox2产生的ROS并不是机体氧化应激的主要贡献者.
总之, Nox1在维持结肠组织正常生理功能中发挥重要作用, 而Duox2除了参与维持正常生理功能外, 可能还通过氧化应激途径在肠道黏膜炎症过程中发挥作用. 本研究只是初步探讨了在肠炎模型中不同炎症程度时Nox1和Duox2的表达, 有关他们具体的表达调控机制还有待于进一步研究, 以期为IBD治疗的药物开发提供新思路.
感谢陈攀、冯丹丹及祁冉在本试验中给予的大力帮助.
在我国炎症性肠病(inflammatory bowel disease, IBD)发病呈明显增加的趋势. 由于其病因未明, 病程迁延不愈, 治疗效果不令人满意, 严重影响患者生活质量, 故对IBD病因、发病机制和治疗的研究尤为迫切.
郑鹏远, 教授, 主任医师, 博士生导师, 副院长, 郑州大学第二附属医院消化科
在IBD发生和发展过程中, 氧化应激被认为是导致肠道损伤的关键因素之一. 氧化应激是活性氧类(reactive oxygen species, ROS)产生过多, 超出机体对氧化物的清除能力, 导致组织细胞损伤的病理生理过程. 随着对IBD研究和认识地逐步深入, ROS在IBD的病理生理过程中的作用越来越受到重视. 研究发现NADPH氧化酶是肠道黏膜ROS的重要来源, 对肠道氧化应激起到了重要的作用.
最近还发现NADPH氧化酶Nox1在结肠有高表达, Duox2在胃肠道表达. Duox2在生理情况下有抵御细菌侵入和调控肠道菌群的作用, 但产生过量的过氧化氢时可能会出现氧化应激, 引起组织损伤. 临床研究表明, IBD患者肠道病变组织上皮Duox2基因和蛋白表达水平均上调.
有关Nox1和Duox2在IBD疾病进程中的研究还相当有限. 本实验应用不同程度炎症的小鼠肠炎模型, 得出以下结论: Nox1主要在维持肠道正常生理功能中发挥作用, 而Duox2除了维持正常生理功能外, 可能还积极地参与肠炎发病过程.
本研究结果初步证明了Duox2积极地参与肠炎发病过程, 为进一步研究其相关表达调控机制提供基础, 以期为IBD治疗的药物开发提供新思路.
炎症性肠病(IBD): 是一种慢性非特异性肠道炎症性疾病, 包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病两种类型. 临床上, 患者主要表现为腹痛、腹泻、黏液血便等, 可伴有各种肠道外症状和并发症; NADPH氧化酶家族: 由7个成员组成, 包括Nox1和Duox2. 他们均能产生ROS, 其中Duox2可产生过氧化氢. NADPH氧化酶在机体的生理以及病理生理过程中发挥着重要作用; 葡聚糖硫酸钠(dextran sulphate sodium)诱导的小鼠肠炎模型: 是应用非常广泛的一种肠炎模型, 其临床表现、病变部位、病理学表现与人类UC相似.
本研究设计合理, 逻辑性强, 立足于消化内科常见病IBD, 对了解IBD发病机制具有一定意义.
编辑: 韦元涛 电编:闫晋利
| 1. | Kaser A, Zeissig S, Blumberg RS. Inflammatory bowel disease. Annu Rev Immunol. 2010;28:573-621. [PubMed] [DOI] |
| 2. | Circu ML, Aw TY. Intestinal redox biology and oxidative stress. Semin Cell Dev Biol. 2012;23:729-737. [PubMed] [DOI] |
| 3. | Bhattacharyya A, Chattopadhyay R, Mitra S, Crowe SE. Oxidative stress: an essential factor in the pathogenesis of gastrointestinal mucosal diseases. Physiol Rev. 2014;94:329-354. [PubMed] [DOI] |
| 4. | Rokutan K, Kawahara T, Kuwano Y, Tominaga K, Nishida K, Teshima-Kondo S. Nox enzymes and oxidative stress in the immunopathology of the gastrointestinal tract. Semin Immunopathol. 2008;30:315-327. [PubMed] [DOI] |
| 5. | Biasi F, Leonarduzzi G, Oteiza PI, Poli G. Inflammatory bowel disease: mechanisms, redox considerations, and therapeutic targets. Antioxid Redox Signal. 2013;19:1711-1747. [PubMed] [DOI] |
| 6. | Bedard K, Krause KH. The NOX family of ROS-generating NADPH oxidases: physiology and pathophysiology. Physiol Rev. 2007;87:245-313. [PubMed] [DOI] |
| 7. | Rada B, Leto TL. Oxidative innate immune defenses by Nox/Duox family NADPH oxidases. Contrib Microbiol. 2008;15:164-187. [PubMed] [DOI] |
| 8. | El Hassani RA, Benfares N, Caillou B, Talbot M, Sabourin JC, Belotte V, Morand S, Gnidehou S, Agnandji D, Ohayon R. Dual oxidase2 is expressed all along the digestive tract. Am J Physiol Gastrointest Liver Physiol. 2005;288:G933-G942. [PubMed] [DOI] |
| 9. | Geiszt M, Witta J, Baffi J, Lekstrom K, Leto TL. Dual oxidases represent novel hydrogen peroxide sources supporting mucosal surface host defense. FASEB J. 2003;17:1502-1504. [PubMed] |
| 10. | Jackson LN, Zhou Y, Qiu S, Wang Q, Evers BM. Alternative medicine products as a novel treatment strategy for inflammatory bowel disease. Am J Chin Med. 2008;36:953-965. [PubMed] [DOI] |
| 11. | 张 静, 韩 英, 纪 欣, 王 志红, 李 虹义, 郑 力. GSH在DSS诱导的小鼠实验性肠炎中的作用. 世界华人消化杂志. 2005;13:1400-1403 [10.11569/wcjd.v13.i12.1400]. |
| 12. | Esworthy RS, Kim BW, Larson GP, Yip ML, Smith DD, Li M, Chu FF. Colitis locus on chromosome 2 impacting the severity of early-onset disease in mice deficient in GPX1 and GPX2. Inflamm Bowel Dis. 2011;17:1373-1386. [PubMed] [DOI] |
| 13. | Ouyang Q, Xue LY. Inflammatory bowel disease in the 21(st) century in China: turning challenges into opportunities. J Dig Dis. 2012;13:195-199. [PubMed] [DOI] |
| 14. | Wang YF, Ouyang Q, Hu RW. Progression of inflammatory bowel disease in China. J Dig Dis. 2010;11:76-82. [PubMed] [DOI] |
| 15. | Fakhoury M, Negrulj R, Mooranian A, Al-Salami H. Inflammatory bowel disease: clinical aspects and treatments. J Inflamm Res. 2014;7:113-120. [PubMed] [DOI] |
| 16. | Maloy KJ, Powrie F. Intestinal homeostasis and its breakdown in inflammatory bowel disease. Nature. 2011;474:298-306. [PubMed] [DOI] |
| 17. | Zhu H, Li YR. Oxidative stress and redox signaling mechanisms of inflammatory bowel disease: updated experimental and clinical evidence. Exp Biol Med (Maywood). 2012;237:474-480. [PubMed] [DOI] |
| 18. | Dhillon SS, Fattouh R, Elkadri A, Xu W, Murchie R, Walters T, Guo C, Mack D, Huynh HQ, Baksh S. Variants in nicotinamide adenine dinucleotide phosphate oxidase complex components determine susceptibility to very early onset inflammatory bowel disease. Gastroenterology. 2014;147:680-689.e2. [PubMed] |
| 19. | Ramonaite R, Skieceviciene J, Kiudelis G, Jonaitis L, Tamelis A, Cizas P, Borutaite V, Kupcinskas L. Influence of NADPH oxidase on inflammatory response in primary intestinal epithelial cells in patients with ulcerative colitis. BMC Gastroenterol. 2013;13:159. [PubMed] [DOI] |
| 20. | Surh YJ. NF-kappa B and Nrf2 as potential chemopreventive targets of some anti-inflammatory and antioxidative phytonutrients with anti-inflammatory and antioxidative activities. Asia Pac J Clin Nutr. 2008;17 Suppl 1:269-272. [PubMed] |
| 21. | O'Sullivan B, Thompson A, Thomas R. NF-kappa B as a therapeutic target in autoimmune disease. Expert Opin Ther Targets. 2007;11:111-122. [PubMed] [DOI] |
| 22. | Achitei D, Ciobica A, Balan G, Gologan E, Stanciu C, Stefanescu G. Different profile of peripheral antioxidant enzymes and lipid peroxidation in active and non-active inflammatory bowel disease patients. Dig Dis Sci. 2013;58:1244-1249. [PubMed] [DOI] |
| 23. | Coant N, Ben Mkaddem S, Pedruzzi E, Guichard C, Tréton X, Ducroc R, Freund JN, Cazals-Hatem D, Bouhnik Y, Woerther PL. NADPH oxidase 1 modulates WNT and NOTCH1 signaling to control the fate of proliferative progenitor cells in the colon. Mol Cell Biol. 2010;30:2636-2650. [PubMed] [DOI] |
| 24. | Szanto I, Rubbia-Brandt L, Kiss P, Steger K, Banfi B, Kovari E, Herrmann F, Hadengue A, Krause KH. Expression of NOX1, a superoxide-generating NADPH oxidase, in colon cancer and inflammatory bowel disease. J Pathol. 2005;207:164-176. [PubMed] [DOI] |
| 25. | Lipinski S, Till A, Sina C, Arlt A, Grasberger H, Schreiber S, Rosenstiel P. DUOX2-derived reactive oxygen species are effectors of NOD2-mediated antibacterial responses. J Cell Sci. 2009;122:3522-3530. [PubMed] [DOI] |
| 26. | Grasberger H, El-Zaatari M, Dang DT, Merchant JL. Dual oxidases control release of hydrogen peroxide by the gastric epithelium to prevent Helicobacter felis infection and inflammation in mice. Gastroenterology. 2013;145:1045-1054. [PubMed] [DOI] |
| 27. | Katsuyama M, Matsuno K, Yabe-Nishimura C. Physiological roles of NOX/NADPH oxidase, the superoxide-generating enzyme. J Clin Biochem Nutr. 2012;50:9-22. [PubMed] [DOI] |
| 28. | Allaoui A, Botteaux A, Dumont JE, Hoste C, De Deken X. Dual oxidases and hydrogen peroxide in a complex dialogue between host mucosae and bacteria. Trends Mol Med. 2009;15:571-579. [PubMed] [DOI] |
| 29. | Esworthy RS, Kim BW, Rivas GE, Leto TL, Doroshow JH, Chu FF. Analysis of candidate colitis genes in the Gdac1 locus of mice deficient in glutathione peroxidase-1 and -2. PLoS One. 2012;7:e44262. [PubMed] [DOI] |
| 30. | Esworthy RS, Aranda R, Martín MG, Doroshow JH, Binder SW, Chu FF. Mice with combined disruption of Gpx1 and Gpx2 genes have colitis. Am J Physiol Gastrointest Liver Physiol. 2001;281:G848-G855. [PubMed] |