修回日期: 2015-02-10
接受日期: 2015-03-06
在线出版日期: 2015-04-08
目的: 研究吴茱萸碱对人肝癌细胞HepG2细胞外调节蛋白激酶(extracellular-regulated protein kinases 1/2, ERK1/2)表达的影响.
方法: Transwell小室检测吴茱萸碱对HepG2细胞侵袭及迁徙的影响. 集落形成实验检测吴茱萸碱对HepG2细胞集落形成能力的影响. Western blot检测HepG2细胞ERK1/2、phospho-ERK1/2(P-ERK1/2)蛋白.
结果: 吴茱萸碱5、25、50 μmol/L作用后, HepG2细胞侵袭细胞数分别为32.3个±1.3个、22.3个±2.5个、10.6个±3.7个, 对照组为97.6个±6.3个, 差异有统计学意义(P<0.05); 迁徙细胞数为57.7个±3.2个、26.8个±1.6个、15.4个±3.9个, 对照组为106.3个±3.2个, 差异有统计学意义(P<0.05). 5、25、50 μmol/L吴茱萸碱作用HepG2细胞集落形成数分别为147.0个±12.1个、94.3个±4.0个、0个, 对照组为231.3个±15.4个, 差异有统计学意义(P<0.05). Western blot分析5、25、50 μmol/L吴茱萸碱处理HepG2细胞24 h及30 μmol/L吴茱萸碱处理HepG2细胞24、48 h后, ERK1/2蛋白的表达无明显变化, 但其活化形式P-ERK1/2蛋白的表达量减少.
结论: 吴茱萸碱可显著抑制人肝癌HepG2细胞侵袭和迁徙及克隆增殖能力, 其机制可能与吴茱萸碱抑制ERK1/2蛋白活化有关.
核心提示: 吴茱萸碱影响肝癌HepG2细胞侵袭、迁徙与增殖中的作用机制可能与其抑制磷酸化细胞外调节蛋白激酶(phospho-extracellular regulated protein kinases 1/2)蛋白表达有关.
引文著录: 孙建超, 娄方方, 史云, 王豫萍. 吴茱萸碱对肝癌HepG2细胞侵袭和迁徙的影响. 世界华人消化杂志 2015; 23(10): 1546-1552
Revised: February 10, 2015
Accepted: March 6, 2015
Published online: April 8, 2015
AIM: To assess the effect of evodiamine on the invasion and metastasis of human hepatocellular carcinoma HepG2 cells and to discuss the underlying mechanism.
METHODS: The effect of evodiamine on the expression levels of ERK1/2 and p-ERK1/2 in HepG2 cells was assessed by Western blot. The invasion and metastasis of HepG2 cells were tested by transwell assays. Colony-forming ability was determined by colony formation assay.
RESULTS: After HepG2 cells were treated with 0, 5, 25, or 50 μmol/L evodiamine, the numbers of invasion cells were 97.6 ± 6.3, 32.3 ± 1.3, 22.3 ± 2.5, and 10.6 ± 3.7, respectively, and the numbers of metastatic cells were 106.3 ± 3.2, 57.7 ± 3.2, 26.8 ± 1.6, and 15.4 ± 3.9, respectively (P < 0.05). Evodiamine had a significant inhibitory effect on HepG2 cell colony-forming ability (P < 0.05). Evodiamine treatment down-regulated the expression of p-ERK1/2, but had no significant impact on ERK1/2 expression.
CONCLUSION: Evodiamine can inhibit the invasion, metastasis and colony-forming ability of human hepatocellular carcinoma HepG2 cells, and the possible mechanism may be related to down-regulation of p-ERK 1/2 protein.
- Citation: Sun JC, Lou FF, Shi Y, Wang YP. Evodiamine inhibits invasion and metastasis of human hepatocellular carcinoma HepG2 cells. Shijie Huaren Xiaohua Zazhi 2015; 23(10): 1546-1552
- URL: https://www.wjgnet.com/1009-3079/full/v23/i10/1546.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i10.1546
肝癌是危害我国人民健康的二号杀手, 也是全球癌性死亡的最主要的一个因素. 每年全球超过60万人被确诊为肝癌, 其中超过50%(约400000例)发生在中国[1,2]. 肝癌为富血管肿瘤, 肝癌细胞侵入静脉向肝内外转移是肝癌患者死亡的主要诱因[3]. 最新国内外研究[4,5]表明, 肝癌的发生发展与肝癌细胞Ras-丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路异常活化相关. MAPK信号转导通路, 又称细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)级联途径, 是将细胞外刺激信号传递到细胞核、介导细胞产生反应的信号传导通路中最为重要的一条通路. ERK是各条信号通路的交汇点, 包括两个重要成员ERK1/ERK2, 因此, ERK1/2有望成为肿瘤治疗的靶点. 研究证实, 吴茱萸碱可促进细胞凋亡和抑制肿瘤细胞的转移, 对肺癌、乳腺癌、胃癌、胶质细胞瘤等多种肿瘤细胞均有抑制增殖作用[6-9]. 本研究应用吴茱萸碱作用于人肝癌HepG2细胞, 研究吴茱萸碱对肝癌细胞侵袭和迁徙以及对ERK1/2蛋白表达的影响.
DMEM高糖培养基购自HyClone公司; 胎牛血清购自四季青公司; 人肝癌细胞株HepG2细胞由本中心实验室保存; Matrigel胶(索莱宝)、Transwell细胞培养板(millipore公司); PVDF膜、ECL发光液(millipore公司); P-ERK1/2单克隆抗体(CST); ERK1/2多克隆抗体(巴傲得).
1.2.1 细胞培养: 在含10%胎牛血清的HyClone DMEM高糖培养液中, 置于37 ℃、50 mL/L CO2培养箱中饱和湿度下培养, 待细胞生长至对数期时进行后续实验检测.
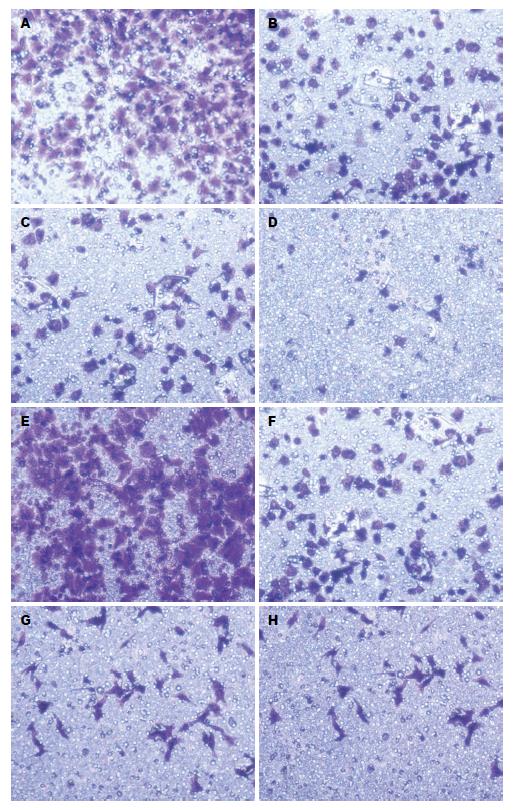
1.2.2 肝癌HepG2细胞体外侵袭与迁徙实验: Matrigel胶与DMEM培养基按1:8稀释成1 mg/mL悬液, Transwell小室内室面加入60 μL悬液, 室温静置1 h备用. 消化细胞调整细胞浓度至4 × 105个/mL, 取100 μL细胞悬液接种于Transwell小室内, 分别加入含吴茱萸碱的DMEM培养基100 μL, 根据前期实验结果, 使药物终浓度分别为5、25、50 μmol/L, 设置不含吴茱萸碱对照组, 每组3个复孔. 小室外加入含20%胎牛血清的完全培养基1 mL. 37 ℃、50 mL/L CO2培养箱中培养48 h, 棉签擦去内层细胞, 冷甲醇固定30 min, 0.1%结晶紫染色10 min, 200倍镜下随机选取5个视野, 计数穿到下室面的细胞, 计算平均值. 以穿膜细胞的相对数代表肝癌HepG2细胞的侵袭能力, 侵袭抑制率按如下公式计算: 细胞侵袭抑制率(%) = (对照组穿膜细胞数-试验组穿膜细胞数)/对照组穿膜细胞数 × 100%.
细胞迁徙试验除Transwell小室内不铺基质胶外, 其他操作相同. 以穿膜细胞的相对数代表肝癌HepG2细胞的迁徙能力. 迁徙抑制率按如下公式计算: 细胞迁徙抑制率(%) = (对照组穿膜细胞数-试验组穿膜细胞数)/对照组穿膜细胞数 × 100%.
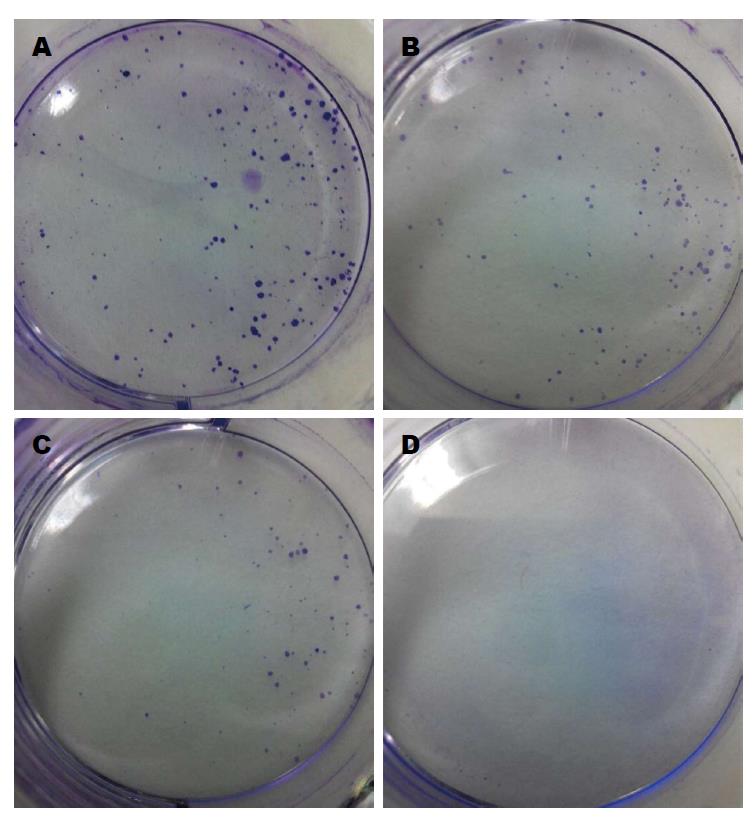
1.2.3 集落形成实验: 细胞以1 × 104/孔接种于六孔板内, 24 h后, 换含0、5、25、50 μmol/L吴茱萸碱的10%胎牛血清完全培养液处理24 h. 弃去含药培养液, 换10%胎牛血清完全培养液继续培养7 d, 冷甲醇固定30 min, 0.1%结晶紫染色10 min, 计数细胞数目>50个或直径>75 μm的集落. 集落形成率(%) = (对照组集落数-试验组集落数)/对照组集落数 × 100%.
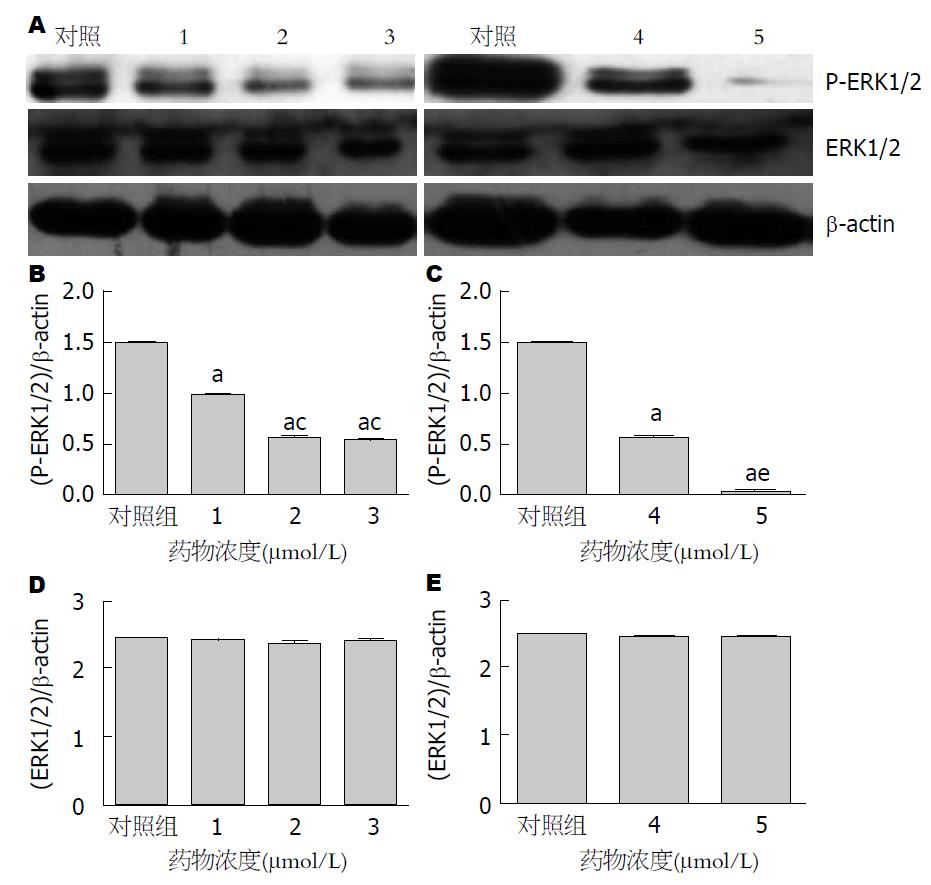
1.2.4 Western blot法检测细胞ERK1/2、P-ERK1/2蛋白表达情况: 待细胞铺满80%-90%时, 5、25、50 μmol/L吴茱萸碱的10%胎牛血清完全培养液处理; 30 μmol/L吴茱萸碱的10%胎牛血清完全培养液处理24、48 h. 收集细胞, 提取总蛋白, BCA蛋白定量法计算各组蛋白浓度. 每组取20 μg蛋白进行SDS-PAGE凝胶电泳. 湿转于PVDF膜上, 5%牛血清白蛋白(bovine serum albumin, BSA)室温封闭2 h, 兔抗人一抗ERK1/2(1:600)、P-ERK1/2(1:2000)4 ℃孵育12 h, 辣根过氧化物酶标记的羊抗兔二抗(1:20000)室温孵育1 h. TBST清洗后ECL发光液显色、曝光, Image J软件分析灰度值. 以对照组和药物组的目的条带和内参的比值进行半定量分析.
统计学处理 所有数据均用SPSS17.0统计软件分析, 实验数据均采用mean±SD表示. 各组间均数比较采用单因素方差分析, 组间比较采用t检验. P<0.05为差异具有统计学意义.
随吴茱萸碱药物浓度的增加, HepG2细胞穿过小室的细胞数量明显减少(P<0.05). 48 h后HepG2细胞穿过小室细胞计数结果如下(表1, 图1).
对照组、5、25、50 μmol/L吴茱萸碱处理组集落数分别为231.3个±15.4个、147.0个±12.1个、94.3个±4.0个、0个. 随药物浓度增加, 吴茱萸碱可显著抑制HepG2细胞克隆形成能力(P<0.05). 结果如图2所示.
吴茱萸碱作用HepG2细胞, ERK1/2蛋白表达无明显改变, 但P-ERK1/2蛋白表达量随吴茱萸碱药物浓度增加及作用时间延长, 表达量降低. 蛋白表达变化如图3所示.
吴茱萸碱为我国传统中药吴茱萸主要活性物质之一, 吴茱萸碱对于心血管系统[10,11]、内分泌系统[12,13]、免疫系统[14]等均具有较强的药理作用. 同时还有抗炎镇痛[15]、调节脂肪代谢[16]等作用. 最新研究表明, 吴茱萸碱对多种实体瘤及血液系统肿瘤均有良好的抑制效果: 赵绿翠等[17]发现吴茱萸碱下调周期蛋白A1、破坏Bcl-2/Bax比例进而诱导人结肠癌细胞凋亡; 高世勇等[18]将吴茱萸碱作用于肝癌细胞后可影响细胞微管蛋白聚集状态, 使细胞周期阻滞于G2/M期.
癌细胞的侵袭与迁徙是包括肿瘤细胞脱离原组织、远处传播、新环境中生存和增殖等多个环节的复杂过程[19-21]. 肿瘤的侵袭与转移是反映肿瘤恶性程度的良好指标, 与肿瘤的预后及复发息息相关[22,23]. Transwell小室法检测HepG2细胞侵袭与迁徙发现, 吴茱萸碱可显著抑制细胞侵袭与迁徙, 且随药物浓度增加, 抑制效果更明显. 克隆形成实验也表明吴茱萸碱能有效抑制HepG2细胞克隆增殖能力, 减少其在新环境中生存和增殖.
在所有真核细胞中均存在Ras/Raf/MEK/ERK这一高度保守的细包信号传导通路. Ras/Raf/MEK/ERK信号传导通路是"MAPK"众多通路中的一个, 他在多种致瘤性疾病中通常是上调的[24-26]. 肝癌发生涉及多条信号通路的活化, 其中MEK/ERK信号通路与肿瘤细胞的发生发展、增殖、侵袭与转移紧密相关. 各种刺激经不同的信息传导通路, 激活Ras形成级联反应Ras-Raf-MEK-ERK, Raf和MEK具有酪氨酸/苏氨酸活性, 是MAPKs上游信号作用的交汇靶点, MEK活化下游分子ERK, ERK磷酸化激活或失活多种蛋白, 同时活化的ERK进入细胞核诱导基因表达发挥功能: 介导细胞表面的外来信号转导细胞核内, 参与细胞分化、生长、增殖和凋亡, 并在细胞恶性转化及演变过程中起重要作用[27]. ERK是MAPK家族成员之一, 包括两个重要成员ERK1/ERK2. 在多种肿瘤中, 包括肝癌、肺癌、乳腺癌、结肠癌、前列腺癌等中发现ERK信号传导通路的过度活化[28-30]. 本研究用吴茱萸碱作用于HepG2细胞后, ERK1/2蛋白表达水平没有变化, 但其活化形式P-ERK1/2表达量显著降低. 随药物浓度增加及作用时间延长, 抑制效果更显著, 表明吴茱萸碱对于ERK1/2信号通路的活化有明显的抑制作用. 但25 μmol/L与50 μmol/L作用效果未出现明显差异, 这可能与药物作用浓度以达到饱和或者作用时间长短有关.
总之, 吴茱萸碱能够抑制HepG2细胞侵袭、迁徙及其克隆形成能力, 这可能与吴茱萸碱抑制ERK1/2蛋白活化相关.
肝癌是比较常见的肿瘤, 其在我国的发病率及死亡率均较高, 为危害人类健康的二号杀手, 肝癌细胞的侵袭与转移与肝癌的预后及复发息息相关. 吴茱萸碱为吴茱萸的主要活性成分之一, 具有良好的抗肿瘤效果. 为进一步明确其作用机制, 本文对肝癌细胞侵袭、迁徙与增殖作用的影响进行研究.
范学工, 教授, 中南大学湘雅医院感染病科; 肖文华, 主任医师, 中国人民解放军总医院第一附属医院肿瘤科; 秦建民, 主任医师, 上海中医药大学附属普陀医院普外科
吴茱萸碱的抗肿瘤作用效果明显, 然而其作用机制较为复杂, 尤其是其对肝癌HepG2细胞侵袭、迁徙与增殖中的作用机制尚不明确, 有待进一步研究.
已报道吴茱萸碱对多种肿瘤细胞的增殖、周期、侵袭具有抑制作用, 其机制可能与吴茱萸碱抑制与细胞侵袭、迁徙与增殖相关的信号通路中的相关因子.
我们通过观察吴茱萸碱对肝癌HepG2细胞侵袭、迁徙与增殖的影响及其对ERK信号转导通路中ERK1/2、P-ERK1/2蛋白表达的影响, 为其作用机制做了初步探究.
吴茱萸碱对多种实体瘤及血液系统恶性肿瘤均有良好的抑制作用, 因此探究其作用机制可以为临床癌症的治疗尤其是无法应用手术的恶性肿瘤提供新的药物及治疗方法.
本研究应用吴茱萸碱作用于人肝癌HepG2细胞, 对吴茱萸碱应用于肝细胞癌的治疗提供了较好的理论依据.
编辑: 郭鹏 电编:闫晋利
| 1. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013. CA Cancer J Clin. 2013;63:11-30. [PubMed] [DOI] |
| 2. | Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin. 2014;64:9-29. [PubMed] [DOI] |
| 3. | Monvoisin A, Neaud V, De Lédinghen V, Dubuisson L, Balabaud C, Bioulac-Sage P, Desmoulière A, Rosenbaum J. Direct evidence that hepatocyte growth factor-induced invasion of hepatocellular carcinoma cells is mediated by urokinase. J Hepatol. 1999;30:511-518. [PubMed] |
| 4. | Tian ZJ, An W. ERK1/2 contributes negative regulation to STAT3 activity in HSS-transfected HepG2 cells. Cell Res. 2004;14:141-147. [PubMed] |
| 5. | Huang B, Xiao E, Huang M. MEK/ERK pathway is positively involved in hypoxia-induced vasculogenic mimicry formation in hepatocellular carcinoma which is regulated negatively by protein kinase A. Med Oncol. 2015;32:408. [PubMed] [DOI] |
| 6. | Hong JY, Park SH, Min HY, Park HJ, Lee SK. Anti-proliferative effects of evodiamine in human lung cancer cells. J Cancer Prev. 2014;19:7-13. [PubMed] |
| 7. | Wang KL, Hsia SM, Yeh JY, Cheng SC, Wang PS, Wang SW. Anti-Proliferative Effects of Evodiamine on Human Breast Cancer Cells. PLoS One. 2013;8:e67297. [PubMed] |
| 8. | Shi HL, Wu XJ, Liu Y, Xie JQ. Berberine counteracts enhanced IL-8 expression of AGS cells induced by evodiamine. Life Sci. 2013;93:830-839. [PubMed] [DOI] |
| 9. | Liu AJ, Wang SH, Chen KC, Kuei HP, Shih YL, Hou SY, Chiu WT, Hsiao SH, Shih CM. Evodiamine, a plant alkaloid, induces calcium/JNK-mediated autophagy and calcium/mitochondria-mediated apoptosis in human glioblastoma cells. Chem Biol Interact. 2013;205:20-28. [PubMed] [DOI] |
| 10. | Rang WQ, Du YH, Hu CP, Ye F, Xu KP, Peng J, Deng HW, Li YJ. Protective effects of evodiamine on myocardial ischemia-reperfusion injury in rats. Planta Med. 2004;70:1140-1143. [PubMed] |
| 11. | Kobayashi Y, Hoshikuma K, Nakano Y, Yokoo Y, Kamiya T. The positive inotropic and chronotropic effects of evodiamine and rutaecarpine, indoloquinazoline alkaloids isolated from the fruits of Evodia rutaecarpa, on the guinea-pig isolated right atria: possible involvement of vanilloid receptors. Planta Med. 2001;67:244-248. [PubMed] |
| 12. | Yu PL, Chao HL, Wang SW, Wang PS. Effects of evodiamine and rutaecarpine on the secretion of corticosterone by zona fasciculata-reticularis cells in male rats. J Cell Biochem. 2009;108:469-475. [PubMed] [DOI] |
| 13. | Jiang ML, Zhang ZX, Li YZ, Wang XH, Yan W, Gong GQ. Antidepressant-like effect of evodiamine on chronic unpredictable mild stress rats. Neurosci Lett. 2015;588:154-158. [PubMed] [DOI] |
| 14. | Hu HY, Song ZY, Deng L, Zhang MX. Immunoregulatory effect of evodiamine in mice of various germlines. Zhongguo Shiyan Xueyexue Zazhi. 2008;16:886-891. [PubMed] |
| 15. | Cai Q, Wei J, Zhao W, Shi S, Zhang Y, Wei R, Zhang Y, Li W, Wang Q. Toxicity of Evodiae fructus on rat liver mitochondria: the role of oxidative stress and mitochondrial permeability transition. Molecules. 2014;19:21168-21182. [PubMed] [DOI] |
| 16. | Jiang DF, Li WT, Yang HL, Zhang ZZ, Chen D, Sun C. Long-term effects of evodiamine on expressions of lipogenesis and lipolysis genes in mouse adipose and liver tissues. Genet Mol Res. 2014;13:1038-1046. [PubMed] [DOI] |
| 17. | 赵 绿翠, 张 景勍, 游 智梅, 李 科琼, 罗 念, 李 静. 吴茱萸碱对人结肠癌细胞周期阻滞及凋亡的影响. 中国药理学与毒理学杂志. 2014;6:863-869. |
| 19. | Joyce JA, Pollard JW. Microenvironmental regulation of metastasis. Nat Rev Cancer. 2009;9:239-252. [PubMed] [DOI] |
| 20. | Danastas K, Combes V, Lindsay LA, Grau GE, Thompson MB, Murphy CR. VEGF111: new insights in tissue invasion. Front Physiol. 2015;6:2. [PubMed] [DOI] |
| 21. | Vella LJ. The emerging role of exosomes in epithelial-mesenchymal-transition in cancer. Front Oncol. 2014;4:361. [PubMed] [DOI] |
| 24. | Deschênes-Simard X, Kottakis F, Meloche S, Ferbeyre G. ERKs in cancer: friends or foes? Cancer Res. 2014;74:412-419. [PubMed] [DOI] |
| 25. | Davis DM, Purvis JE. Computational analysis of signaling patterns in single cells. Semin Cell Dev Biol. 2015;37:35-43. [PubMed] [DOI] |
| 26. | Osborne JK, Zaganjor E, Cobb MH. Signal control through Raf: in sickness and in health. Cell Res. 2012;22:14-22. [PubMed] [DOI] |
| 27. | Sosa MS, Avivar-Valderas A, Bragado P, Wen HC, Aguirre-Ghiso JA. ERK1/2 and p38α/β signaling in tumor cell quiescence: opportunities to control dormant residual disease. Clin Cancer Res. 2011;17:5850-5857. [PubMed] [DOI] |
| 28. | Weng CJ, Chau CF, Hsieh YS, Yang SF, Yen GC. Lucidenic acid inhibits PMA-induced invasion of human hepatoma cells through inactivating MAPK/ERK signal transduction pathway and reducing binding activities of NF-kappaB and AP-1. Carcinogenesis. 2008;29:147-156. [PubMed] |
| 29. | Gallelli L, Falcone D, Scaramuzzino M, Pelaia G, D'Agostino B, Mesuraca M, Terracciano R, Spaziano G, Maselli R, Navarra M. Effects of simvastatin on cell viability and proinflammatory pathways in lung adenocarcinoma cells exposed to hydrogen peroxide. BMC Pharmacol Toxicol. 2014;15:67. [PubMed] [DOI] |
| 30. | Dent P. ERK plays the baddie (again). Cancer Biol Ther. 2013;14:997-998. [PubMed] [DOI] |