修回日期: 2014-11-17
接受日期: 2014-11-19
在线出版日期: 2015-01-08
目的: 探讨外源性一氧化氮(nitric oxide, NO)诱导中分化胃癌细胞株(SGC-7901)凋亡的潜在机制.
方法: 采用不同浓度的外源性NO供体硝普钠(sodium nitroprusside, SNP)处理细胞, MTT法检测细胞的存活率; 荧光显微镜检测细胞的凋亡形态及凋亡率. 依据有无活性氧(reactive oxygen species, ROS)抑制剂N-乙酰半胱氨酸(N-acetyl-L-cysteine, NAC)和SNP作用细胞, 实验分4组: 对照组、NAC组、SNP组、NAC+SNP组. 采用荧光化学发光仪检测胞内ROS水平; 流式细胞仪检测细胞的凋亡; Western blot检测铜锌超氧化物歧化酶(Cu/Zn-superoxide dismutase, Cu/Zn-SOD)蛋白的表达. 所有数据采用SPSS17.0分析.
结果: (1)SNP可诱导胃癌细胞凋亡, 且有浓度及时间依赖性; (2)NAC组和对照组在细胞凋亡率及胞内ROS水平上差异无统计学意义(P>0.05); (3)较对照组, 单独SNP可使细胞凋亡率及胞内ROS水平明显升高(P<0.05); 而经NAC干预后, SNP引起的细胞凋亡率和胞内ROS水平均下降(P<0.05), 但仍高于对照组; (4)SNP可引起细胞Cu/Zn-SOD蛋白表达的降低.
结论: 外源性NO可通过抑制胃癌细胞Cu/Zn-SOD蛋白的表达而上调其ROS水平, 该功能可能参与其诱导的胃癌细胞凋亡途径.
核心提示: 外源性一氧化氮(nitric oxide)供体硝普钠(sodium nitroprusside, SNP)可诱导中分化胃癌细胞的凋亡, 且有浓度及时间依赖性; SNP可通过抑制胃癌细胞内铜锌超氧化物歧化酶(Cu/Zn-superoxide dismutase)蛋白的表达, 上调细胞内活性氧(reactive oxygen species)的水平, 而后经过级联反应, 启动胃癌细胞凋亡途径.
引文著录: 范丽丽, 李伟华. 外源性NO诱导胃癌SGC-7901细胞凋亡的作用机制. 世界华人消化杂志 2015; 23(1): 8-15
Revised: November 17, 2014
Accepted: November 19, 2014
Published online: January 8, 2015
AIM: To investigate the potential mechanism of exogenous nitric oxide (NO) induced apoptosis of moderately differentiated gastric cancer cells (SGC-7901).
METHODS: SGC-7901 cells were treated with different concentrations of sodium nitroprusside (SNP), which was used as the donor of exogenous NO. The survival rate of cells was detected by MTT assay. Cells were divided into four groups: a blank control group, a reactive oxygen species (ROS) inhibitor (N-acetyl-L-cysteine, NAC) group, an SNP group and an NAC + SNP group. Apoptotic cell morphology and apoptosis rate were evaluated by fluorescence microscopy. Levels of ROS were determined by fluorescent chemiluminescence. Protein levels of Cu/Zn-superoxide dismutase (Cu/Zn-SOD) were detected by Western blot analysis.
RESULTS: SNP induced apoptosis of SGC-7901 cells in a dose- and time-dependent manner. There were no significant differences in cell apoptosis rate or ROS level between the NAC group and blank control group (P >0.05). Compared to the blank control group, cell apoptosis rate and ROS were significantly increased in the SNP group and NAC + SNP group (P < 0.05). Cell apoptosis rate and ROS level were significantly increased in the SNP group compared to the NAC + SNP group (P < 0.05). SNP decreased Cu/Zn-SOD protein expression in SGC-7901 cells.
CONCLUSION: Exogenous NO can up-regulate ROS level in gastric cells by inhibiting Cu/Zn-SOD protein expression, which may be related to the mechanism by which NO induces apoptosis of gastric cancer cells.
- Citation: Fan LL, Li WH. Mechanism underlying exogenous nitric oxide induced gastric cancer SGC-7901 cell apoptosis. Shijie Huaren Xiaohua Zazhi 2015; 23(1): 8-15
- URL: https://www.wjgnet.com/1009-3079/full/v23/i1/8.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i1.8
硝普钠(sodium nitroprusside, SNP)是一种典型的慢性释放型一氧化氮(nitric oxide, NO)供体, 其可短期扩张血管, 被广泛用于临床和实验研究[1,2]. 目前研究证明SNP可诱发细胞凋亡[3,4]. 桑建荣等[3]研究表明外源性NO可阻滞胃癌细胞周期、抑制细胞生长和诱导细胞凋亡, 但其诱导细胞凋亡的机制尚不清楚.
活性氧(reactive oxygen species, ROS)是生物体内重要的信号分子并对生物生长发育有重要意义[5]. 近年来随着对ROS在肿瘤发生中作用机制的深入研究, 现已证实细胞内ROS水平的激增是引起细胞凋亡的重要途径之一[6,7].
铜锌超氧化物歧化酶(Cu/Zn-superoxide dismutase, Cu/Zn-SOD)作为生物体内超氧阴离子自由基的清洁剂, 具有防衰老和治疗疾病的作用[8]. NO是否通过调节Cu/Zn-SOD蛋白的表达来调控细胞内ROS水平, 进而诱导胃癌细胞凋亡, 目前尚无文献报道. 本研究将探讨外源性NO与细胞内ROS的关系及其诱导胃癌细胞凋亡的潜在机制.
胃癌SGC-7901细胞、DMEM培养基、新生牛血清(HyClone公司), 0.25%胰蛋白酶混合液(Gibco公司), SNP及N-乙酰半胱氨酸(N-acetyl-L-cysteine, NAC)(Sigma公司), MTT试剂、DAPI试剂和DCFH-DA荧光试剂(碧云天生物公司). 酶标仪(Thermo®RMK3), 上海普林斯顿生物科技发展有限公司; 荧光倒置显微镜(Olympus®RIX71-A12FL/PH), 上海普赫光电科技有限公司; 荧光化学发光分析仪(Fluoroskan Ascent®RFL), 山东爱博科技贸易有限公司; 智能掌控型流失细胞分析仪(BD FACS Verse™), 美国BD公司; ChemiDoc分子成像系统及Image Lab软件(ChemiDoc™ XRS+, BIORAD), 美国伯乐公司.
1.2.1 SGC-7901细胞的体外培养: 将SGC-7901细胞接种于培养皿中, 用含10%的新生牛血清、1/1000双抗的DMEM于37 ℃、50 mL/L CO2培养箱中孵育. 根据细胞生长状况每2-3 d更换培养液1次, 当细胞呈对数生长期时, 用于实验.
1.2.2 MTT测细胞存活率: (1)含0.25%胰蛋白酶的混合液消化细胞; (2)无菌条件下PBS吹打、离心(1000 r/min, 3 min); (3)加入适量含10%新生牛血清的DMEM培养液, 混匀, 计数; (4)以2×105个/mL密度接种于96孔板, 设7个复孔, 待细胞贴壁后, 加含不同浓度SNP(0、10、50、100、200、400、600、800、1000 μmol/L)的培养液孵育24、48 h; (5)每孔加20 μL MTT溶液(5 mg/mL), 再孵育4 h, 弃培养液, 每孔加150 μL DMSO, 振荡10 min; (6)酶标仪(Thermo®RMK3)测定490 nm波长处的吸光度(A)值, 计算细胞生长抑制率(inhibitory rate, IR). IR(%) = (正常对照组平均A值-药物处理组平均A值)/(正常对照组平均A值-空白对照组平均A值)×100%.
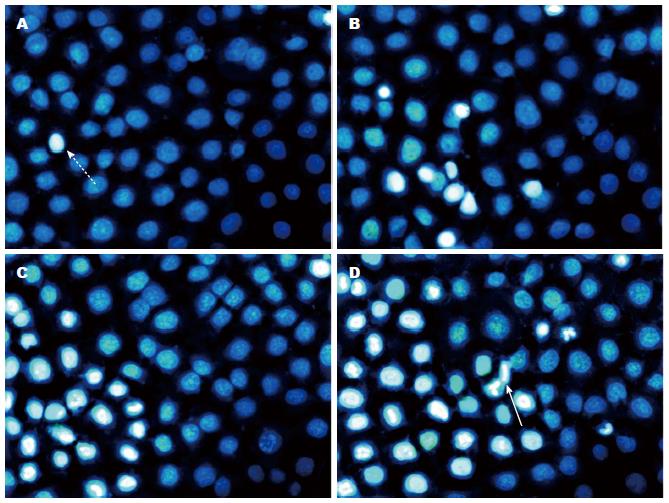
1.2.3 DAPI细胞核荧光染色: (1)将细胞接种于含载玻片的培养皿中, 37 ℃、50 mL/L CO2培养箱中孵育; (2)隔日更换含不同浓度SNP(0、200、400、800 μmol/L)的培养液, 孵育48 h; (3)弃培养液, 750 mL/L乙醇固定3 min, 加入1 mL DAPI染色剂(10 μmol/L)孵育30 min; (4)PBS漂洗3次, 荧光倒置显微镜(Olympus®RIX71)下观察细胞凋亡形态并计数凋亡细胞.
1.2.4 DCFH-DA荧光测定细胞内ROS水平: (1)将细胞接种于24孔板(2×105个/mL), 设5个复孔, 37 ℃、50 mL/L CO2培养箱中孵育24 h; (2)弃培养液, 加0.5 mL DCFH-DA(10 μmol/L), 充分混匀, 37 ℃避光反应20 min; (3)无血清的培养液漂洗3次, 每孔加入1 mL对应试剂: NAC(3 mmol/L)、SNP(400 μmol/L)、混合液(3 mmol/L NAC+400 μmol/L SNP)、培养液(空白对照); (4)荧光化学发光分析仪(Fluoroskan Ascent®RFL)实时检测刺激前后荧光的强弱(485 nm激发波长, 538 nm发射波长).
1.2.5 流式细胞仪检测细胞凋亡: (1)将对数生长期细胞以2×105个/mL接种于60 mm培养皿, 37 ℃、50 mL/L CO2培养箱中孵育; (2)待细胞贴壁后, 更换含不同试剂的培养液孵育48 h: NAC(3 mmol/L); SNP(400 μmol/L); 3 mmol/L NAC作用细胞2 h后, 再加入400 μmol/L SNP; 培养液(空白对照); (3)PBS漂洗2次, 制成500 μL的单细胞悬液; (4)取100 μL置于流式管, 加5 μL AnnexinV/FITC和5 μL PI溶液混匀, 室温避光孵育15 min, A-V缓冲液中和反应后流式细胞分析仪(BD FACS Verse™)检测.
1.2.6 Western blot法检测Cu/Zn-SOD蛋白表达: (1)按常规方法提取细胞总蛋白, Bradford法测定蛋白质浓度; (2)配制15%SDS-PAGE分离胶和5%浓缩胶, 每孔上样50 μg, 分离蛋白样品; (3)300 mA恒流转膜3 h; (4)取出并切割PVDF膜, 在5%脱脂牛奶中室温封闭2 h; (4)分别将膜以β-actin抗体和Cu/Zn-SOD抗体(1:1000稀释) 4 ℃孵育过夜; (5)用TBS-T(含有0.1%Tween-20的TBS)漂洗3次, 加入二抗即HRP标志的羊抗兔IgG(1:5000稀释), 室温孵育2 h; (6)再以TBS-T漂洗3次后, 用ECL Plus超敏发光剂(PE0010)显示阳性条带, 在ChemiDoc分子成像系统及Image Lab软件(ChemiDoc™ XRS+, BIORAD)下记录并分析结果.
统计学处理 结果以mean±SD表示, 统计分析用SPSS17.0软件, 组间比较用t检验和单因素方差(One-way ANOVA)分析, P<0.05为差异有统计学意义.
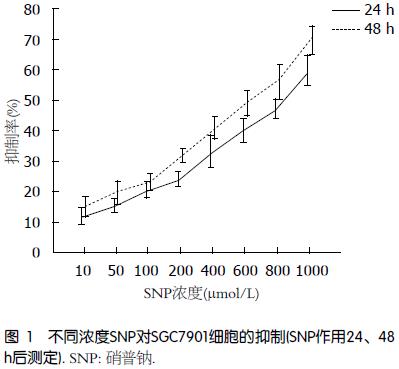
MTT法检测结果显示: SNP可抑制SGC-7901细胞的活性, 且该抑制率会随SNP浓度的升高而增强(图1). 此外同一浓度SNP对细胞的抑制率会随时间的推移而增加且差异具有显著统计学意义(P<0.01)(表1).
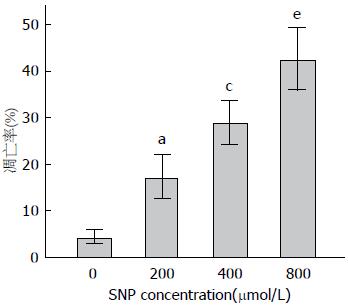
荧光结果显示: 各实验组的细胞凋亡率均明显高于对照组且差异具有统计学意义(F = 13.33, P = 0.000), 此外凋亡率会随药物浓度的增大而升高且各实验组间差异具有统计学意义(图2, 3). 凋亡率(%) = (早期凋亡+晚期凋亡)/总数细胞.
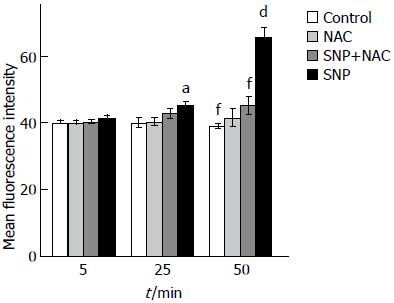
不同试剂刺激细胞后检测ROS荧光强度结果显示: 随着时间推移, SNP组和(SNP+NAC)组ROS荧光强度也随之增强(P<0.01); 但Control组和NAC组却无明显变化(P>0.05)(表2). SNP处理细胞50 min时, ROS水平达到峰值, 且各处理组间差异性更显著: SNP组细胞荧光强度(65.79±3.54)明显高于对照组(39.08±0.89)(P<0.01). 而(NAC+SNP)组细胞荧光强度(45.23±3.21), 虽比SNP组低(P<0.05), 但仍高于空白对照组(P<0.05). NAC组细胞的荧光强度与Control组差异无统计学意义(P>0.05)(表2, 图4).
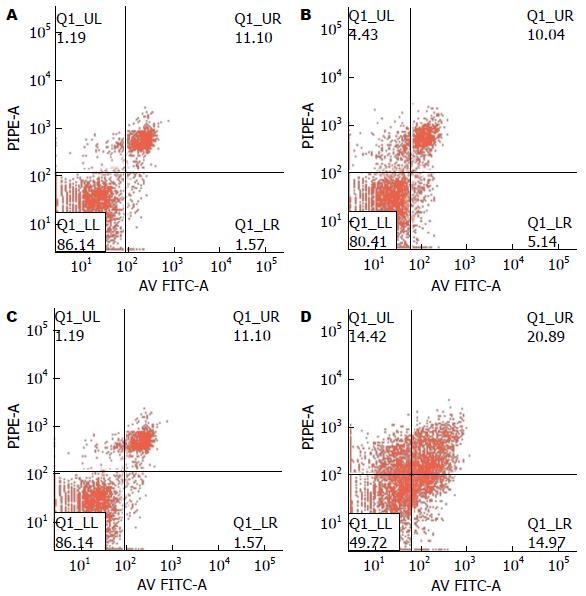
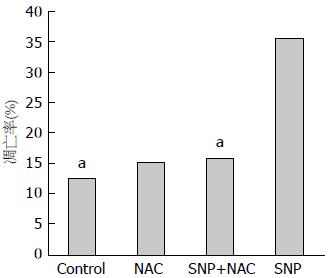
细胞总凋亡率 = 早期凋亡率+晚期凋亡率. 流式检测结果显示: 与Control组相比, NAC组细胞的总凋亡率无明显变化(P>0.05). 而SNP组细胞总凋亡率(20.89%±14.97%)明显高于对照组(11.10%±1.57%), 两者之间差异有明显统计学意义(P<0.05). 但用NAC预处理2 h后再加SNP时(即NAC+SNP组), 细胞凋亡率(9.99%±6.14%)较SNP组(20.89%±14.97%)有所下降, 且两者差异有统计学意义(P<0.05)(图5, 6).
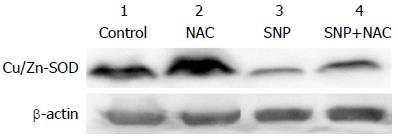
Western blot检测结果以Cu/Zn-SOD蛋白条带的灰度值与β-actin蛋白条带的灰度值的比值表示. Control组为12.68、NAC组为20.61、SNP(400 μmol/L)组为3.72、NAC+SNP组为5.70. SNP引起胃癌SGC-7901细胞内Cu/Zn-SOD蛋白表达量较对照组明显降低(图7).
目前研究表明外源性NO对肿瘤有细胞毒性和基因毒性, 其有潜在抗肿瘤作用[9,10]. SNP是典型的外源性NO供体, 其对多种肿瘤细胞具有杀伤效应[1]. 桑建荣等[3]研究表明外源性NO可抑制胃癌细胞的增殖, 但其机制尚不清楚. 本研究利用SNP探讨外源性NO对胃癌细胞增殖和凋亡的影响以及潜在的分子机制, 结果发现SNP可抑制胃癌SGC-7901细胞增殖, 且该抑制性呈剂量和时间依赖性, 这与上述研究结果相符.
肿瘤的抑制包含细胞增殖的抑制和细胞凋亡的诱发. 细胞凋亡是涉及细胞生物化学和形态等一系列特征性改变, 包括ROS的大量累积、凋亡蛋白的活化、细胞的皱缩、染色质的破裂等[11,12]. 细胞凋亡是肿瘤细胞发生发展中一个非常重要的环节. 本研究的荧光显微镜结果显示: 与空白对照组相比, SNP作用胃癌细胞时, 可诱导较多的细胞呈凋亡形态(比如细胞皱缩、染色质高度凝聚、核皱缩、核破裂等), 且凋亡量随SNP剂量的增大而升高, 这表明SNP可诱导胃癌细胞的凋亡.
ROS不仅参与肿瘤的诱发突变, 还可参与介导肿瘤的治疗, 这种双重作用主要取决于ROS自身的浓度[13-15]. 肿瘤细胞内ROS的产生在细胞增殖、迁移侵袭、新陈代谢中扮演着重要的角色[16-19]. 研究发现几乎所有肿瘤细胞内的ROS水平都明显高于正常细胞. Schafer等[20]证实消除ROS有助于肿瘤细胞在其胞外基质中存活. ROS与线粒体死亡受体介导的细胞凋亡密切相关, 且在药物作用下诱导细胞凋亡的作用更为明显[21-23]. 张春阳等[24]研究发现在NO诱导神经细胞凋亡的过程中, 胞浆及线粒体内ROS水平会随着NO浓度的变化而改变, 这表明ROS参与NO介导神经细胞凋亡. 李五生等[25]研究表明ROS可介导大黄素诱导的结肠癌细胞凋亡途径. 本研究通过DCFH-DA荧光法研究ROS是否参与外源性NO诱导的胃癌细胞凋亡途径. 结果显示单独SNP作用于胃癌细胞时, 细胞内ROS急剧上升; 而当SNP联合ROS抑制剂作用于胃癌细胞时, 胞内ROS有所降低, 但仍高于空白对照组. 这说明SNP可打破胃癌细胞内氧化还原平衡, 引发细胞内ROS升高, 而后者可能作为活化信号, 激活线粒体凋亡途径, 同时该效应正反馈于线粒体, 使细胞内ROS进一步升高, 从而促进细胞凋亡[21]. 另外本研究结果也表明, 较空白对照组, 单独SNP可使胃癌细胞凋亡率明显升高; 但当联合ROS抑制剂时, SNP诱导的细胞凋亡率将会下降, 这进一步证明SNP可升高细胞内的ROS的水平, 且该功能可能参与其诱导的胃癌细胞凋亡途径.
Cu/Zn-SOD是一类广泛存在于生物体内的金属酶, 能够催化超氧阴离子自由基发生歧化反应, 平衡机体内的氧自由基, 作为生物体内超氧阴离子自由基(如ROS等)的清洁剂, 他在防辐射、抗衰老、消炎、抑制肿瘤方面起重要作用[26,27]. 细胞内氧化-抗氧化体系中ROS的产生和清除保持平衡, 一旦平衡打破, 细胞内ROS的水平将会改变, 从而诱发细胞凋亡[28]. 本研究Western blot实验证实, SNP处理组中细胞内Cu/Zn-SOD蛋白的表达量明显低于对照组, 这表明SNP可抑制细胞内Cu/Zn-SOD蛋白的表达, 进而上调细胞内ROS水平, 促进胃癌细胞的凋亡.
总之, SNP可通过抑制胃癌细胞内Cu/Zn-SOD蛋白的表达, 上调细胞内ROS水平, 而后经过级联反应, 启动细胞凋亡途径. 然而其诱导胃癌细胞凋亡, 可能是ROS通过很多途径参与肿瘤细胞的凋亡途径, 如ROS可通过调节细胞凋亡过程中的相关信号分子的表达如蛋白激酶、蛋白磷酸化酶, 转录因子等, 进而参与细胞的凋亡途径[29-32]. 因此在今后的研究中我们将会从蛋白分子水平和基因水平进一步探讨细胞内ROS调节肿瘤细胞凋亡的相关机制, 从而为NO供体成为抗肿瘤药物提供更有力的依据.
感谢许永杰、董莉及李元在本试验中给予的大力帮助.
以往研究表明一氧化氮(nitric oxide, NO)供体有抗肿瘤作用的潜力, 但是各类肿瘤的生理病理过程不同, 我们有必要加强NO对给各类肿瘤杀瘤效应的特异性. 目前很多文献研究有关外源性NO分别对胃癌的发生、发展的影响, 但引起中分化胃癌细胞凋亡的机制目前仍无定论.
杜雅菊, 教授, 哈尔滨医科大学附属第二医院消化内科
活性氧(reactive oxygen species, ROS)是生物体内重要的信号分子并对生物生长发育有重要意义. 近年来关于ROS涉及癌症机制的研究也日益受到重视. 本文通过ROS生成变化和细胞凋亡率变化之间的关系, 并检测ROS相关酶及蛋白的变化, 阐明外源性NO对诱导中分化胃癌细胞凋亡的影响及可能的机制.
桑建荣等研究外源性NO可阻滞胃癌细胞周期、抑制细胞生长和诱导细胞凋亡, 但其诱导细胞凋亡的机制是从凋亡信号通路这方面阐述的. 本研究阐述外源性NO诱导胃癌细胞凋亡的机制着重从凋亡信号的启动机制阐述的: ROS可作为诱导信号分子, 经级联反应启动细胞凋亡途径.
NO为近年来的研究的热门课题, 而NO的杀瘤效应更引起了学术界的重视. 而且目前研究表明NO的杀瘤效应也可应用与胃癌的预防和治疗, 因此有必要深入探讨外源性NO在胃癌细胞中引起凋亡的作用机制, 为临床运用提供实验的依据.
本实验通过硝普钠(sodium nitro prusside, SNP)诱导中分化胃癌细胞凋亡的潜在机制, 为NO供体药物的抗癌治疗进一步的具体化, 为将来胃癌的预防、治疗等临床应用提供实验依据. 在今后的研究中我们将会从蛋白分子水平和基因水平进一步探讨细胞内ROS调节肿瘤细胞凋亡的相关机制, 从而为NO供体成为成为辅佐抗肿瘤药物提供更有力的依据.
SNP: NO供体, 实验室一般作为外源性NO来研究; Cu/Zn-SOD: 是生物体内抗氧化系统中的抗氧化酶, 能消除生物体在新陈代谢过程中产生的ROS.
以往研究发现外源性NO具有潜在抗肿瘤作用. 本文通过不同浓度的外源性NO供体SNP处理中分化胃癌细胞株(SGC-7901), 发现其可体外诱导肿瘤细胞株凋亡, 其机制可能是通过抑制Cu/Zn-SOD蛋白的表达而上调其ROS水平, 而后经过级联反应, 启动胃癌细胞凋亡途径. 为NO供体成为辅佐抗肿瘤药物提供了理论基础.
编辑: 韦元涛 电编:都珍珍
| 1. | Estévez AG, Sampson JB, Zhuang YX, Spear N, Richardson GJ, Crow JP, Tarpey MM, Barbeito L, Beckman JS. Liposome-delivered superoxide dismutase prevents nitric oxide-dependent motor neuron death induced by trophic factor withdrawal. Free Radic Biol Med. 2000;28:437-446. [PubMed] [DOI] |
| 2. | Pasero D, Rana NK, Bonato R, Ribezzo M, Ivaldi F, Ricci D, Grosso Marra W, Checco L, Lupo M, Boffini M. Inhaled nitric oxide versus sodium nitroprusside for preoperative evaluation of pulmonary hypertension in heart transplant candidates. Transplant Proc. 2013;45:2746-2749. [PubMed] [DOI] |
| 4. | Bechtel W, Bauer G. Modulation of intercellular ROS signaling of human tumor cells. Anticancer Res. 2009;29:4559-4570. [PubMed] |
| 5. | Pillai S, Oresajo C, Hayward J. Ultraviolet radiation and skin aging: roles of reactive oxygen species, inflammation and protease activation, and strategies for prevention of inflammation-induced matrix degradation - a review. Int J Cosmet Sci. 2005;27:17-34. [PubMed] [DOI] |
| 6. | Lau AT, Wang Y, Chiu JF. Reactive oxygen species: current knowledge and applications in cancer research and therapeutic. J Cell Biochem. 2008;104:657-667. [PubMed] [DOI] |
| 7. | Davis W, Ronai Z, Tew KD. Cellular thiols and reactive oxygen species in drug-induced apoptosis. J Pharmacol Exp Ther. 2001;296:1-6. [PubMed] |
| 8. | Yanase S, Onodera A, Tedesco P, Johnson TE, Ishii N. SOD-1 deletions in Caenorhabditis elegans alter the localization of intracellular reactive oxygen species and show molecular compensation. J Gerontol A Biol Sci Med Sci. 2009;64:530-539. [PubMed] [DOI] |
| 9. | Sullivan KJ, Kissoon N, Gauger C. Nitric oxide metabolism and the acute chest syndrome of sickle cell anemia. Pediatr Crit Care Med. 2008;9:159-168. [PubMed] [DOI] |
| 10. | Song Q, Tan S, Zhuang X, Guo Y, Zhao Y, Wu T, Ye Q, Si L, Zhang Z. Nitric Oxide Releasing d-α-Tocopheryl Polyethylene Glycol Succinate for Enhancing Antitumor Activity of Doxorubicin. Mol Pharm. 2014;11:4118-4129. [PubMed] [DOI] |
| 11. | Vander Heiden MG, Chandel NS, Williamson EK, Schumacker PT, Thompson CB. Bcl-xL regulates the membrane potential and volume homeostasis of mitochondria. Cell. 1997;91:627-637. [PubMed] [DOI] |
| 12. | Simon HU, Haj-Yehia A, Levi-Schaffer F. Role of reactive oxygen species (ROS) in apoptosis induction. Apoptosis. 2000;5:415-418. [PubMed] [DOI] |
| 14. | Filaire E, Toumi H. Reactive oxygen species and exercise on bone metabolism: friend or enemy? Joint Bone Spine. 2012;79:341-346. [PubMed] [DOI] |
| 15. | Zhang KH, Tian HY, Gao X, Lei WW, Hu Y, Wang DM, Pan XC, Yu ML, Xu GJ, Zhao FK. Ferritin heavy chain-mediated iron homeostasis and subsequent increased reactive oxygen species production are essential for epithelial-mesenchymal transition. Cancer Res. 2009;69:5340-5348. [PubMed] [DOI] |
| 16. | Nishikawa M. Reactive oxygen species in tumor metastasis. Cancer Lett. 2008;266:53-59. [PubMed] [DOI] |
| 17. | Wu WS. The signaling mechanism of ROS in tumor progression. Cancer Metastasis Rev. 2006;25:695-705. [PubMed] [DOI] |
| 18. | Sroka J, Madeja Z. [Reactive oxygen species in regulation of cell migration. The role of thioredoxin reductase]. Postepy Biochem. 2009;55:145-152. [PubMed] |
| 19. | Seifried HE, Anderson DE, Fisher EI, Milner JA. A review of the interaction among dietary antioxidants and reactive oxygen species. J Nutr Biochem. 2007;18:567-579. [PubMed] [DOI] |
| 20. | Schafer ZT, Grassian AR, Song L, Jiang Z, Gerhart-Hines Z, Irie HY, Gao S, Puigserver P, Brugge JS. Antioxidant and oncogene rescue of metabolic defects caused by loss of matrix attachment. Nature. 2009;461:109-113. [PubMed] [DOI] |
| 21. | Matés JM, Segura JA, Alonso FJ, Márquez J. Oxidative stress in apoptosis and cancer: an update. Arch Toxicol. 2012;86:1649-1665. [PubMed] [DOI] |
| 22. | Zhou Y, Shu F, Liang X, Chang H, Shi L, Peng X, Zhu J, Mi M. Ampelopsin induces cell growth inhibition and apoptosis in breast cancer cells through ROS generation and endoplasmic reticulum stress pathway. PLoS One. 2014;9:e89021. [PubMed] [DOI] |
| 23. | Gundala SR, Yang C, Mukkavilli R, Paranjpe R, Brahmbhatt M, Pannu V, Cheng A, Reid MD, Aneja R. Hydroxychavicol, a betel leaf component, inhibits prostate cancer through ROS-driven DNA damage and apoptosis. Toxicol Appl Pharmacol. 2014;280:86-96. [PubMed] [DOI] |
| 24. | 张 春阳, 卫 涛涛, 马 辉, 丁 尧, 陈 瓞延, 侯 京武, 陈 畅, 忻 文娟. 活性氧参与一氧化氮诱导的神经细胞凋亡. 生物化学与生物物理进展. 2001;28:81-85. |
| 26. | Sun J, Molitor J, Tower J. Effects of simultaneous over-expression of Cu/ZnSOD and MnSOD on Drosophila melanogaster life span. Mech Ageing Dev. 2004;125:341-349. [PubMed] [DOI] |
| 27. | Landis GN, Tower J. Superoxide dismutase evolution and life span regulation. Mech Ageing Dev. 2005;126:365-379. [PubMed] [DOI] |
| 28. | Valko M, Leibfritz D, Moncol J, Cronin MT, Mazur M, Telser J. Free radicals and antioxidants in normal physiological functions and human disease. Int J Biochem Cell Biol. 2007;39:44-84. [PubMed] [DOI] |
| 29. | Fang J, Nakamura H, Iyer AK. Tumor-targeted induction of oxystress for cancer therapy. J Drug Target. 2007;15:475-486. [PubMed] [DOI] |
| 30. | Gabriel B, Sureau F, Casselyn M, Teissié J, Petit PX. Retroactive pathway involving mitochondria in electroloaded cytochrome c-induced apoptosis. Protective properties of Bcl-2 and Bcl-XL. Exp Cell Res. 2003;289:195-210. [PubMed] [DOI] |
| 31. | Lee MJ, Kao SH, Hunag JE, Sheu GT, Yeh CW, Hseu YC, Wang CJ, Hsu LS. Shikonin time-dependently induced necrosis or apoptosis in gastric cancer cells via generation of reactive oxygen species. Chem Biol Interact. 2014;211:44-53. [PubMed] [DOI] |