修回日期: 2014-11-30
接受日期: 2014-12-05
在线出版日期: 2015-01-08
目的: 研究miR-181a、miR-181b在不同分化程度人胃癌细胞株和胃癌组织中的表达情况, 探索其在胃癌发生发展过程中的作用.
方法: 体外培养3种不同分化程度的胃癌细胞株(AGS、SGC-7901、MGC-803)及正常胃黏膜细胞GES-1, 收集28例胃癌患者手术切除的癌组织及正常组织样本, 通过实时定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)方法检测上述细胞和组织中miR-181a、miR-181b的表达量, 比较胃癌细胞与正常胃黏膜细胞、胃癌组织与正常胃组织中miR-181a、miR-181b表达的差异性.
结果: 经qRT-PCR方法检测发现, AGS、SGC-7901、MGC-803 3种胃癌细胞中miR-181a及miR-181b的表达量均高于GES-1细胞中的表达量(P<0.05), 而AGS、SGC-7901、MGC-803 3种胃癌细胞之间miR-181a及miR-181b的表达量差异均无统计学意义(P>0.05). 与正常胃组织相比, miR-181a、miR-181b在胃癌组织中的表达量显著升高(P<0.05). Ⅲ/Ⅳ期组胃癌组织中miR-181a、miR-181b的相对表达量高于Ⅰ/Ⅱ期组(P<0.05). 有淋巴结转移组胃癌组织中miR-181a、miR-181b的相对表达量高于无淋巴结转移组(P<0.05). miR-181a、miR-181b的相对表达量与年龄、性别、胃癌的分化程度无明显关系(P>0.05).
结论: miR-181a、miR-181b在胃癌细胞和组织中高表达, 两者的表达水平与胃癌的分期、淋巴结转移相关, 可能在胃癌的发生发展中发挥癌基因的作用.
核心提示: miR-181a、miR-181b在胃癌中表达上调, 表现为癌基因的作用; 两者的表达水平与胃癌的分期、淋巴结转移显著相关, 与胃癌的发生发展、侵袭转移有着密切关系.
引文著录: 姚育红, 廖爱军, 陈娟, 戴勇. miR-181a、miR-181b在人胃癌细胞和组织中的表达. 世界华人消化杂志 2015; 23(1): 30-36
Revised: November 30, 2014
Accepted: December 5, 2014
Published online: January 8, 2015
AIM: To investigate the expression of miR-181a and miR-181b in human gastric cancer cell lines and tissues, and to explore their role in the development and progression of gastric cancer.
METHODS: Three gastric cancer cell lines with different degrees of differentiation (AGS, SGC-7901, MGC-803) and normal gastric mucosa cell line GES-1 were cultured in vitro, and gastric cancer tissue and normal tissue samples from 28 patients who underwent surgical operation were collected. The expression levels of miR-181a and miR-181b in the above cell lines and tissues were detected by quantitative real-time polymerase chain reaction (qRT-PCR) and compared among different groups.
RESULTS: The expression of miR-181a and miR-181b in AGS, SGC-7901 and MGC-803 cells was significantly higher than that in GES-1 cells (P < 0.05), but had no significant difference among the three gastric cancer cell lines (P > 0.05). Compared with normal gastric tissues, the expression of miR-181a and miR-181b in gastric cancer tissues was significantly higher (P < 0.05). The expression of miR-181a and miR-181b was significantly higher in stage Ⅲ/Ⅳ gastric cancer tissues than in stage Ⅰ/Ⅱ (P < 0.05), and in gastric cancer patients with lymph node metastasis than in patients without (P < 0.05). There was no significant correlation between the expression of miR-181a/miR-181b and age, gender, or degree of tumor differentiation (P > 0.05).
CONCLUSION: MiR-181a and miR-181b are highly expressed in gastric cancer cell lines and tissues, and their expression levels in gastric cancer are associated with tumor stage and lymph node metastasis. They might play a role as oncogenes in gastric carcinogenesis.
- Citation: Yao YH, Liao AJ, Chen J, Dai Y. Expression of miR-181a and miR-181b in human gastric cancer cells and tissues. Shijie Huaren Xiaohua Zazhi 2015; 23(1): 30-36
- URL: https://www.wjgnet.com/1009-3079/full/v23/i1/30.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i1.30
微小RNA(microRNA, miRNA)是一类约19-23个核苷酸大小的非编码单链微小RNA[1,2], 调控人类约20%-30%的基因[3,4]. 他能与靶mRNA的3'端非翻译区(3' untranslated region, 3'UTR)序列不完全互补结合[5-8], 抑制靶mRNA翻译、导致目标蛋白表达减少, 在转录后水平调控靶基因的表达. miRNA能调控广泛的一系列生物学过程, 包括细胞分化、增殖和凋亡[9], 他的表达异常与肿瘤的发生、发展、转移有密切相关性. 每个miRNA可调控数百个靶基因的表达, 这些靶基因有可能是癌基因也有可能是抑癌基因, 相应的miRNA可能起到抑癌基因或是癌基因的作用[10].
miR-181家族是一种人类细胞中存在比较广泛的miRNA, 目前发现的miR-181家族成员主要有4种: miR-181a、miR-181b、miR-181c和miR-181d[11]. miR-181家族成员的表达与多种肿瘤显著相关. 大量研究结果显示, miR-181在急性髓细胞白血病(acute myelocytic leukemia, AML)[3]、肝癌[12]、大肠癌[13]、前列腺癌[14]等多种肿瘤中表达水平上调, 发挥癌基因的作用. 本实验为明确miR-181a、miR-181b与胃癌发生发展的相关性, 采用实时荧光定量PCR(quantitative real-time polymerase chain reaction, qRT-PCR)检测不同分化程度胃癌细胞株及胃癌组织中miR-181a、miR-181b的表达情况, 研究其在胃癌发生发展中的作用, 为探索胃癌诊断和治疗的新途径提供方向.
GES-1正常胃黏膜细胞, AGS人胃癌细胞, SGC-7901人胃癌细胞, MGC-803人胃癌细胞; 28例胃癌患者的胃癌组织及相应正常胃黏膜组织标本; RPMI-1640培养基, DMEM培养基, 胎牛血清, 胰蛋白酶; TRIzol试剂, U6、miR-181a、miR-181b基因引物, One Step PrimeScript® miRNA cDNA Synthesis Kit, SYBR® Premix Ex Taq™ Ⅱ.
1.2.1 细胞培养和组织收集: GES-1、SGC-7901、MGC-803细胞用含10%胎牛血清的RPMI-1640培养液, AGS细胞用含10%胎牛血清的DMEM培养液, 于37 ℃、50 mL/L CO2浓度、充分饱和湿度的CO2培养箱中培养, 取对数生长期细胞进行实验. 28例胃癌患者的胃癌组织及相应正常胃黏膜组织标本均来自于南华大学附属第一医院和南华大学附属第二医院肿瘤外科.
1.2.2 RNA的提取与检测: 提取细胞和组织中的总RNA, 采用紫外线吸收法检测RNA的浓度及纯度, 琼脂糖凝胶电泳检测RNA的完整性, 取浓度合适且纯度比值在1.8-2.2之间的、完整性好的RNA样本进行下一步实验.
1.2.3 qRT-PCR: 按37 ℃ 60 min、85 ℃ 5 s条件进行RT反应合成cDNA后, U6、miR-181a、miR-181b按下列条件进行PCR反应: 预变性: 95 ℃ 30 s; PCR反应: 95 ℃ 5 s, 60 ℃ 30 s, 50个循环; 融解曲线分析: 95 ℃ 60 s, 60 ℃ 60 s, 然后从60 ℃开始每10 s加热0.5 ℃直至95 ℃.
1.2.4 结果处理及分析: 以每个样本的U6作为内参, 以正常胃黏膜细胞(GES-1)、正常组织作为对照组, 采用2-△△Ct方法进行计算分析. 其中△△Ct = △Ct胃癌细胞/胃癌组织-△Ct正常细胞/配对正常组织, △Ct = CtmiR-181a/miR-181a-CtU6.
统计学处理 所得数据采用mean±SD表示, 应用SPSS13.0软件进行统计分析, 两组间差异分别采用配对样本t检验、两样本t检验, 多组间差异采用单因素方差分析(One-way ANOVA), P<0.05认为差异有统计学意义.
2.1.1 紫外线吸收法检测RNA的浓度及纯度: 经紫外线吸收测定法检测表明所用细胞和组织RNA样品的纯度较好, A260/280值均在1.8-2.2之间, 无明显蛋白质等有机物的污染及降解, RNA的浓度及纯度均符合实验要求(表1).
| 样品来源 | A260 | A280 | A260/280 | 浓度(ng/μL) |
| GES-1 | 0.331 | 0.172 | 1.92 | 1324 |
| MGC-803 | 0.516 | 0.260 | 1.98 | 2064 |
| SGC-7901 | 0.494 | 0.243 | 2.03 | 1976 |
| AGS | 0.442 | 0.212 | 2.08 | 1768 |
| 癌组织 | 0.658 | 0.337 | 1.95 | 2632 |
| 正常组织 | 0.576 | 0.285 | 2.02 | 2304 |
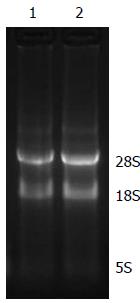
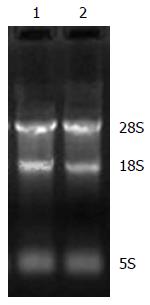
2.1.2 琼脂糖凝胶电泳检测RNA的完整性: 经琼脂糖凝胶电泳检测表明所用细胞和组织RNA样品均显示28S rRNA、18S rRNA、5S rRNA三条带, 且28S条带的亮度约为18S条带的2倍, RNA无明显降解, 完整性较好, 符合实验要求(图1, 2).
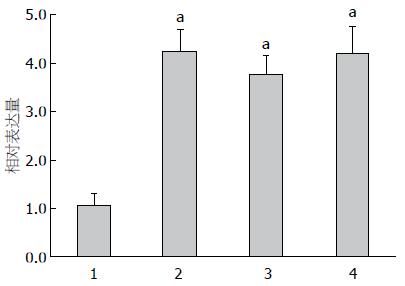
2.2.1 人胃癌细胞和正常胃黏膜细胞中miR-181a的表达比较: 如图3所示, 人胃癌细胞AGS、SGC-7901、MGC-803中miR-181a的表达量均高于其在GES-1细胞中的表达量, 差异有统计学意义(P<0.05); 而AGS、SGC-7901、MGC-803人胃癌细胞之间miR-181a的表达量差异无统计学意义(P>0.05).
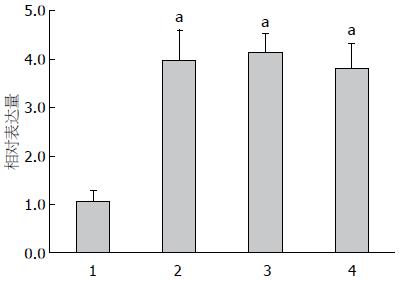
2.2.2 人胃癌细胞和正常胃黏膜细胞中miR-181b的表达比较: 如图4所示, AGS、SGC-7901、MGC-803人胃癌细胞中miR-181b的表达量均高于其在GES-1细胞中的表达量, 差异有统计学意义(P<0.05); 而AGS、SGC-7901、MGC-803人胃癌细胞之间miR-181b的表达量差异无统计学意义(P>0.05).
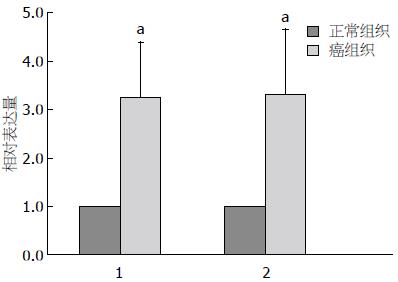
2.3.1 人胃癌组织和正常胃组织中miR-181a、miR-181b的表达比较: 如图5所示, 人胃癌组织中miR-181a、miR-181b的表达量均高于正常胃组织中的表达量, 差异有统计学意义(P<0.05).
2.3.2 人胃癌组织中miR-181a、miR-181b的表达与临床病理的相关性: 本实验共收集到28例胃癌患者手术组织样本, 其中男性15例、平均年龄59.8岁±7.2岁, 女性13例、平均年龄55.3岁±13.6岁. 如表2, 3所示, Ⅲ/Ⅳ期组胃癌组织中miR-181a、miR-181b的相对表达量高于Ⅰ/Ⅱ期组(P<0.05). 有淋巴结转移组中miR-181a、miR-181b的相对表达量高于无淋巴结转移组(P<0.05). miR-181a、miR-181b的相对表达量与年龄、性别、胃癌分化程度无关(P>0.05).
miRNA是一种广泛存在于真核生物中的内源性小分子RNA, 是由经核糖核酸酶Drosha切割、约70-90个碱基长度、具有发夹结构的前体miRNA通过Dicer核糖核酸酶切割生成[15,16], 由19-25个核苷酸组成. 以单拷贝、多拷贝或基因簇等多种形式存在于基因组中, 绝大部分定位于基因间隔区, 部分在内含子及编码区的互补链区, 具有高度保守性和组织、阶段特异性. miRNA有两种作用方式, 主要通过5'端与靶mRNA 3'UTR序列匹配互补, 抑制靶mRNA翻译、降低蛋白表达水平, 从而调节基因的表达, 不影响mRNA的稳定性; 也可以通过类似于siRNA的方式, 与靶mRNA序列互补后引起mRNA互补区特异性断裂, 导致基因沉默, 从而调控基因的表达[10,17,18]. 研究[19]发现, miRNA的表达水平在不同组织、不同发育阶段有明显差异性, 在细胞分化、增殖与凋亡、生长发育、新陈代谢、肿瘤形成等过程中扮演着重要角色.
miR-181家族是近年来受到众多关注的miRNA之一, 人类miR-181家族目前已知的有hsa-miR-181a-1、hsa-miR-181a-2、hsa-miR-181b-1、hsa-miR-181b-2、hsa-miR-181c和hsa-miR-181d 6个前体序列, 在转运至细胞质内后, 经Dicer酶切割, 加工成成熟序列, 参与细胞增殖、分化等一系列生物学过程. miR-181a、miR-181b是miR-181家族的重要成员, 能通过靶向调节K-ras、p27kip1[20]及Bcl-2[21]等基因, 调控肿瘤的发生发展, 在胃癌、肝癌、食管癌[22]、白血病[3]、神经胶质瘤[23]、口腔癌、肺癌[24]等多种肿瘤的形成及进展过程中发挥重要作用. Wang等[12]研究发现miR-181b在肝癌形成早期表达水平上调, 抑制miR-181b的表达能抑制肝癌细胞的增殖. Yang等[25]研究发现miR-181可通过调节细胞的运动, 参与口腔鳞状细胞癌的发生发展, 他的高表达与口腔癌的淋巴结转移、血管侵袭及不良预后密切相关. Zhang等[26]在研究miR-181a与胃癌的关系时, 发现胃癌中miR-181a的表达上调, miR-181a能通过调节肿瘤抑制基因KLF6促进胃癌细胞的增殖及转移, 在胃癌的进展中起癌基因的作用. Guo等[27]通过qRT-PCR等方法揭示: 与正常胃黏膜细胞相比, miR-181a、miR-181b、miR-181c、miR-181d在人胃癌细胞系中均表达上调. 其中miR-181b呈显著高表达, 他能通过调节基质金属蛋白酶组织抑制因子3(tissue inhibitor-3 of matrix metalloproteinases, TIMP-3)的蛋白表达, 调控胃癌细胞的增殖、侵袭与转移, 有可能成为抗胃癌治疗的一个潜在分子靶标.
RAS相关结构域家族蛋白1A(ras association domain family 1A, RASSF1A)是一种已被确认的抑癌基因[28,29], 本课题组前期研究在建立高表达RASSF1A基因胃癌SGC-7901细胞株[pcDNA3.1(+)-RASSF1A-SGC-7901细胞株]后, 利用miRNA芯片筛选转染前后细胞株中miRNA的差异表达, 发现与转染前细胞株相比miR-181a、miR-181b在pcDNA3.1(+)-RASSF1A-SGC-7901细胞株中的表达均显著下调, 并通过qRT-PCR验证, 结果与基因芯片结果一致[30]. 提示miR-181a、miR-181b的表达异常与胃癌的发生相关, 两者可能在胃癌中具有癌基因的作用. 本实验以前期研究为理论基础, 通过qRT-PCR SYBR Green Ⅰ方法, 检测3种不同分化程度的胃癌细胞, 高分化胃癌细胞系(AGS)[31]、中分化胃癌细胞系(SGC-7901)、低分化胃癌细胞系(MGC-803), 与正常人胃黏膜上皮细胞系(GES-1)中miR-181a、miR-181b的表达情况, 以表达稳定的U6作为内参基因, 采用2-△△Ct方法进行分析后, 发现AGS、SGC-7901、MGC-803胃癌细胞中miR-181a及miR-181b的相对表达量均高于GES-1细胞中的表达量(P<0.05), 而AGS、SGC-7901、MGC-803 3种胃癌细胞之间miR-181a及miR-181b的表达量差异均无统计学意义(P>0.05). 并且通过研究分析28例人胃癌组织样本中miR-181a、miR-181b的表达量, 发现与正常胃组织相比较, miR-181a、miR-181b在胃癌组织中表达水平显著升高(P<0.05), 两者的表达水平与胃癌的分期、淋巴结转移显著相关(P<0.05), 与年龄、性别、胃癌的分化程度无明显相关性(P>0.05). 表明miR-181a、miR-181b在胃癌中表达上调, 表现为癌基因的作用, 且两者的表达水平与胃癌的发生发展、侵袭转移有着密切关系. miR-181家族作为一种新发现的非蛋白编码基因, 其在肿瘤的发生发展、临床诊疗及预后判断等方面的研究价值已得到广泛的认可, 有可能成为胃癌的重要分子靶标, 为探索胃癌特异性诊断和治疗的新方法提供了理论依据.
感谢陈鳞、胡洪赛在本试验中给予的大力帮助.
RAS相关结构域家族蛋白1A(ras association do main family1A, RASSF1A)是一种已被确认的抑癌基因, 本课题前期在建立高表达RASSF1A基因胃癌SGC-7901细胞株后, 利用微小RNA(microRNA, miRNA)芯片筛选转染前后细胞株中miRNA的差异表达, 发现与转染前细胞株相比miR-181a、miR-181b在转染后细胞株中的表达均显著下调, 为进一步探索miR-181a、miR-181b在胃癌发生发展中的作用, 因而研究其在不同分化程度人胃癌细胞株和胃癌组织中的表达情况.
赵春玲, 副教授, 潍坊医学院细胞生物学教研室
胃癌是我国三大癌症之一, 其发生发展与多种癌基因的激活、抑癌基因的失活密切相关, 是现代肿瘤学研究的热点之一; 多种miRNA的表达及调控在胃癌的发生发展中具有重要意义, miR-181是广泛存在于人类细胞中的一种miRNA, 其在胃癌的发生发展中有着怎样的作用及其可能的作用机制尚不明确, 亟待人们进一步研究.
Guo等通过研究miR-181在人胃癌细胞系中的表达差异. 及其能通过调节金属蛋白酶组织抑制因子3(tissue inhibitor-3 of matrix metalloproteinases)的蛋白表达, 调控胃癌细胞的增殖、侵袭与转移, 对研究miR-181在胃癌中的作用机制有指导价值, 有一定的创新性.
国内研究miR-181与胃癌发生发展关系的报道比较少, 本课题通过研究miR-181a、miR-181b在胃癌细胞与正常胃黏膜细胞、胃癌组织与正常胃组织中的表达差异及其与临床病理的相关性, 分析其在胃癌中可能发挥的作用, 为胃癌诊断和治疗探索新途径, 具有一定的创新性.
miR-181在胃癌中高表达, 可能发挥癌基因的作用, 研究其可能的作用机制, 有成为诊断和治疗胃癌的重要分子靶标的前景, 为胃癌特异性诊治提供新途径.
miRNA: 是一类约19-23个核苷酸大小的非编码单链微小RNA; miR-181: 是一种人类细胞中存在比较广泛的miRNA, 目前发现的miR-181家族成员主要有四种: miR-181a、miR-181b、miR-181c和miR-181d; 实时荧光定量PCR(quantitative real-time polymerase chain reaction, qRT-PCR): 是一种通过对PCR扩增反应中的每一个循环产物的荧光信号的实时检测, 实现对起始模板定量及定性的分析方法.
本文通过研究miR-181a、miR-181b在胃癌中的表达, 分析其与胃癌的相关性, 对胃癌诊断和治疗新途径的探索具有一定的指导价值, 试验设计比较合理, 文字表达比较规范, 具有一定的创新性.
编辑: 韦元涛 电编:都珍珍
| 1. | le Sage C, Agami R. Immense promises for tiny molecules: uncovering miRNA functions. Cell Cycle. 2006;5:1415-1421. [PubMed] [DOI] |
| 2. | Takayama S, Wakasugi T, Funahashi H, Takeyama H. Strategies for gastric cancer in the modern era. World J Gastrointest Oncol. 2010;2:335-341. [PubMed] [DOI] |
| 3. | Chen H, Chen Q, Fang M, Mi Y. microRNA-181b targets MLK2 in HL-60 cells. Sci China Life Sci. 2010;53:101-106. [PubMed] [DOI] |
| 4. | Su H, Yang JR, Xu T, Huang J, Xu L, Yuan Y, Zhuang SM. MicroRNA-101, down-regulated in hepatocellular carcinoma, promotes apoptosis and suppresses tumorigenicity. Cancer Res. 2009;69:1135-1142. [PubMed] [DOI] |
| 5. | Shi XB, Tepper CG, deVere White RW. Cancerous miRNAs and their regulation. Cell Cycle. 2008;7:1529-1538. [PubMed] [DOI] |
| 6. | Ishida M, Shimabukuro M, Yagi S, Nishimoto S, Kozuka C, Fukuda D, Soeki T, Masuzaki H, Tsutsui M, Sata M. MicroRNA-378 Regulates Adiponectin Expression in Adipose Tissue: A New Plausible Mechanism. PLoS One. 2014;9:e111537. [PubMed] [DOI] |
| 7. | Wu XL, Cheng B, Li PY, Huang HJ, Zhao Q, Dan ZL, Tian DA, Zhang P. MicroRNA-143 suppresses gastric cancer cell growth and induces apoptosis by targeting COX-2. World J Gastroenterol. 2013;19:7758-7765. [PubMed] [DOI] |
| 8. | Yang J, Zhang JY, Song NH. [The role of miRNAs in androgen-independent progression of prostate cancer]. Zhonghua Nan Ke Xue. 2013;19:831-834. [PubMed] |
| 9. | Ventura A, Jacks T. MicroRNAs and cancer: short RNAs go a long way. Cell. 2009;136:586-591. [PubMed] [DOI] |
| 10. | Calin GA, Croce CM. MicroRNA-cancer connection: the beginning of a new tale. Cancer Res. 2006;66:7390-7394. [PubMed] [DOI] |
| 11. | Ji J, Yamashita T, Budhu A, Forgues M, Jia HL, Li C, Deng C, Wauthier E, Reid LM, Ye QH. Identification of microRNA-181 by genome-wide screening as a critical player in EpCAM-positive hepatic cancer stem cells. Hepatology. 2009;50:472-480. [PubMed] [DOI] |
| 12. | Wang B, Hsu SH, Majumder S, Kutay H, Huang W, Jacob ST, Ghoshal K. TGFbeta-mediated upregulation of hepatic miR-181b promotes hepatocarcinogenesis by targeting TIMP3. Oncogene. 2010;29:1787-1797. [PubMed] [DOI] |
| 13. | Nakajima G, Hayashi K, Xi Y, Kudo K, Uchida K, Takasaki K, Yamamoto M, Ju J. Non-coding MicroRNAs hsa-let-7g and hsa-miR-181b are Associated with Chemoresponse to S-1 in Colon Cancer. Cancer Genomics Proteomics. 2006;3:317-324. [PubMed] |
| 14. | Tong SJ, Liu J, Wang X, Qu LX. microRNA-181 promotes prostate cancer cell proliferation by regulating DAX-1 expression. Exp Ther Med. 2014;8:1296-1300. [PubMed] |
| 15. | Rahimi G, Jafari N, Khodabakhsh M, Shirzad Z, Dogaheh HP. Upregulation of microRNA Processing Enzymes Drosha and Dicer in Gestational Diabetes Mellitus. Gynecol Endocrinol. 2014; Oct 8:1-4. [Epub ahead of print]. [PubMed] [DOI] |
| 16. | Moreno-Moya JM, Vilella F, Simón C. MicroRNA: key gene expression regulators. Fertil Steril. 2014;101:1516-1523. [PubMed] [DOI] |
| 17. | Lewis BP, Burge CB, Bartel DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets. Cell. 2005;120:15-20. [PubMed] [DOI] |
| 18. | Doench JG, Petersen CP, Sharp PA. siRNAs can function as miRNAs. Genes Dev. 2003;17:438-442. [PubMed] [DOI] |
| 19. | O'Connell RM, Taganov KD, Boldin MP, Cheng G, Baltimore D. MicroRNA-155 is induced during the macrophage inflammatory response. Proc Natl Acad Sci U S A. 2007;104:1604-1609. [PubMed] [DOI] |
| 20. | Wang X, Gocek E, Liu CG, Studzinski GP. MicroRNAs181 regulate the expression of p27Kip1 in human myeloid leukemia cells induced to differentiate by 1,25-dihydroxyvitamin D3. Cell Cycle. 2009;8:736-741. [PubMed] [DOI] |
| 21. | Ouyang YB, Lu Y, Yue S, Giffard RG. miR-181 targets multiple Bcl-2 family members and influences apoptosis and mitochondrial function in astrocytes. Mitochondrion. 2012;12:213-219. [PubMed] [DOI] |
| 23. | Conti A, Aguennouz M, La Torre D, Tomasello C, Cardali S, Angileri FF, Maio F, Cama A, Germanò A, Vita G. miR-21 and 221 upregulation and miR-181b downregulation in human grade II-IV astrocytic tumors. J Neurooncol. 2009;93:325-332. [PubMed] [DOI] |
| 24. | Gao W, Yu Y, Cao H, Shen H, Li X, Pan S, Shu Y. Deregulated expression of miR-21, miR-143 and miR-181a in non small cell lung cancer is related to clinicopathologic characteristics or patient prognosis. Biomed Pharmacother. 2010;64:399-408. [PubMed] [DOI] |
| 25. | Yang CC, Hung PS, Wang PW, Liu CJ, Chu TH, Cheng HW, Lin SC. miR-181 as a putative biomarker for lymph-node metastasis of oral squamous cell carcinoma. J Oral Pathol Med. 2011;40:397-404. [PubMed] [DOI] |
| 26. | Zhang X, Nie Y, Du Y, Cao J, Shen B, Li Y. MicroRNA-181a promotes gastric cancer by negatively regulating tumor suppressor KLF6. Tumour Biol. 2012;33:1589-1597. [PubMed] [DOI] |
| 27. | Guo JX, Tao QS, Lou PR, Chen XC, Chen J, Yuan GB. miR-181b as a potential molecular target for anticancer therapy of gastric neoplasms. Asian Pac J Cancer Prev. 2012;13:2263-2267. [PubMed] |
| 28. | Donninger H, Clark J, Rinaldo F, Nelson N, Barnoud T, Schmidt ML, Hobbing KR, Vos MD, Sils B, Clark GJ. The RASSF1A Tumor Suppressor Regulates XPA-Mediated DNA repair. Mol Cell Biol. 2014; Nov 3. pii: MCB.00202-14. [Epub ahead of print]. [PubMed] |
| 29. | Bilgrami SM, Qureshi SA, Pervez S, Abbas F. Promoter hypermethylation of tumor suppressor genes correlates with tumor grade and invasiveness in patients with urothelial bladder cancer. Springerplus. 2014;3:178. [PubMed] [DOI] |
| 30. | 陈 鳞. RASSF1A基因对人胃癌SGC-7901细胞miRNA表达谱的影响. 衡阳: 南华大学 2012; . |
| 31. | Barranco SC, Townsend CM, Casartelli C, Macik BG, Burger NL, Boerwinkle WR, Gourley WK. Establishment and characterization of an in vitro model system for human adenocarcinoma of the stomach. Cancer Res. 1983;43:1703-1709. [PubMed] |