修回日期: 2014-11-11
接受日期: 2014-11-25
在线出版日期: 2015-01-08
目的: 探讨早期胃癌(early gastric cancer, EGC)组织中基质细胞衍生因子-1α(stromal cell-derived factor-1α, SDF-1α)的表达情况与EGC淋巴结转移危险性关系.
方法: 采用免疫组织化学方法检测168例EGC组织石蜡标本的SDF-1α的表达情况.
结果: EGC组织中SDF-1α阳性组和SDF-1α阴性组分别为72例(42.9%)和96例(57.1%). SDF-1α阳性组和阴性组在年龄、性别、肿瘤大小(>20 mm)、大体类型、浸润深度和组织分化程度之间差异无统计学意义. 然而, SDF-1α阳性组与淋巴血管浸润和淋巴结转移之间存在显著相关性. 单因素分析结果表明, 淋巴血管侵袭、未分化组织和SDF-1α阳性表达是影响EGC患者淋巴结转移的危险因素. 多变量分析显示, 淋巴血管侵袭(HR = 3.753, 95%CI: 1.674-8.415, P = 0.001)、未分化组织(HR = 2.038, 95%CI: 1.100-3.775, P = 0.024)和SDF-1α阳性表达(HR = 3.631, 95%CI: 1.101-11.977, P = 0.034)是预测EGC淋巴结转移的独立危险因素.
结论: SDF-1α高表达与EGC淋巴结转移危险性密切相关, 肿瘤细胞表达SDF-1α是EGC淋巴结转移的一个预测指标.
核心提示: 基质细胞衍生因子-1α(stromal cell-derived factor-1α, SDF-1α)高表达与EGC淋巴结转移危险性密切相关, 肿瘤细胞表达SDF-1α是EGC淋巴结转移的一个预测指标, 可为EGC高危人群筛选和胃癌手术时机提供重要信息.
引文著录: 郎博娟, 胡余昌, 陈路, 唐立华, 马金阳. 早期胃癌SDF-1α表达与淋巴结转移的关系. 世界华人消化杂志 2015; 23(1): 116-120
Revised: November 11, 2014
Accepted: November 25, 2014
Published online: January 8, 2015
AIM: To investigate the relationship between the expression of stromal cell-derived factor-1α (SDF-1α) and the risk of lymph node metastasis in early gastric cancer (EGC).
METHODS: We examined the expression of SDF-1α in 168 archival tissue specimens of EGC by immunohistochemical method.
RESULTS: Of the included specimens, 72 (42.9%) and 96 (57.1%) were grouped into SDF-1α-positive and SDF-1α-negative groups, respectively. No significant differences existed with respect to age, gender, proportion of tumors > 20 mm in size, macroscopic type, depth of invasion or histology between the SDF-1α-positive and SDF-1α-negative groups. However, the SDF-1α-positive group was significantly correlated with lymphovascular invasion and lymph node metastasis. Univariate analysis indicated that lymphovascular invasion, undifferentiated histology and SDF-1α positivity were risk factors significantly affecting lymph node metastasis in patients with EGC. Multivariate analysis showed that lymphovascular invasion [hazard ratio (HR) = 3.753, 95% confidence interval (CI): 1.674-8.415; P = 0.001], undifferentiated histology (HR = 2.038, 95%CI: 1.100-3.775; P = 0.024) and SDF-1α positivity (HR = 3.631, 95%CI: 1.101-11.977; P = 0.034) were independent risk factors for lymph node metastasis in EGC.
CONCLUSION: Our findings suggest that SDF-1α expression is closely related to the risk of lymph node metastasis in EGC, and SDF-1α expression in tumor cells is a predictive marker of lymph node metastasis in EGC.
- Citation: Lang BJ, Hu YC, Chen L, Tang LH, Ma JY. Relationship between expression of stromal cell-derived factor-1α and lymph node metastasis in early gastric cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(1): 116-120
- URL: https://www.wjgnet.com/1009-3079/full/v23/i1/116.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i1.116
早期胃癌(early gastric cancer, EGC)是指癌组织浸润仅限于黏膜层或黏膜下层, 不论是否有淋巴结转移. 由于大规模的筛查和诊断技术的进步使得EGC的发病率有所增加. 虽然EGC手术治疗预后一般都是很好的, 并且5年生存率>90%, 但有淋巴结转移的患者较无淋巴结转移的患者有更低的存活率[1]. 准确预测淋巴结侵袭对选择胃癌恰当切除治疗时机是有重要意义的. EGC淋巴结阴性患者可选择微创内镜下黏膜切除术或内镜黏膜下剥离术治疗, 而EGC淋巴结阳性患者要行胃大部切除术并进行淋巴结清扫术[2,3]. 因此, 明确EGC淋巴结转移的生物学特性可能有助于识别高危险的患者群, 并有助于为那些患者制定更合理的治疗方案. 有研究[4]表明基质细胞衍生因子-1α (stromal cell-derived factor-1α, SDF-1α)在原发性胃癌各期中的差异表达与患者预后密切相关, SDF-1α可以作为一个生物标志物. 本研究旨在探讨EGC患者SDF-1α表达与淋巴结转移之间的相关性.
选取宜昌市中心人民医院2010-01-01/2014-01-31经手术治疗的EGC患者168例, 所有入选患者均为胃腺癌. 所有患者对他们的治疗和后续研究都签了知情同意书. 胃癌分期按2010年美国癌症联合会(American Joint Committee on Cancer, AJCC)发表的第七版《恶性肿瘤的TNM分期》为准. 患者临床病例资料归纳情况详如表1. 病理标本均按《中国胃癌诊治规范》进行处理. 肿瘤大小、大体类型及浆膜受侵情况按术时绘图并记录, 所有手术切除标本经40 g/L甲醛固定, 常规石蜡包埋后行4 µm连续切片, 每例均行HE染色和免疫组织化学染色.
| 变量 | n | SDF-1α表达 | P值 | |
| 阳性 | 阴性 | |||
| 年龄(岁) | 0.149 | |||
| <65 | 97 | 37 | 60 | |
| ≥65 | 71 | 35 | 36 | |
| 性别 | 0.303 | |||
| 男性 | 119 | 54 | 65 | |
| 女性 | 49 | 18 | 31 | |
| 肿瘤大小(mm) | 0.547 | |||
| <20 | 61 | 28 | 33 | |
| ≥20 | 107 | 44 | 63 | |
| 大体类型 | 0.205 | |||
| 隆起型 | 22 | 13 | 9 | |
| 平坦型 | 15 | 6 | 9 | |
| 凹陷型 | 115 | 44 | 71 | |
| 混合型 | 16 | 9 | 7 | |
| 浸润深度 | 0.418 | |||
| 黏膜层 | 11 | 6 | 5 | |
| 黏膜下层 | 157 | 66 | 91 | |
| 淋巴血管浸润 | 0.010 | |||
| 无 | 63 | 19 | 44 | |
| 有 | 105 | 53 | 52 | |
| 组织分化 | 0.527 | |||
| 分化型 | 98 | 44 | 54 | |
| 未分化型 | 70 | 28 | 42 | |
| 淋巴结转移 | 0.004 | |||
| 无 | 134 | 50 | 84 | |
| 有 | 34 | 22 | 12 | |
1.2.1 免疫组织化学染色检测: 采用ABC法染色, ABC试剂盒购自美国Abcam公司. 组织切片经二甲苯脱蜡、酒精水化后, 浸入3%的双氧水中30 min, 以阻断内源性过氧化物酶的活性, 然后将玻片置入0.01 mol/L, pH 6.0的柠檬酸缓冲液中加热30 min, 以充分暴露抗原. 滴加鼠抗人SDF-1α抗体(MAB350, USA), 4 ℃孵育过夜, 再滴加第二抗体, 室温下反应20 min, 过氧化物酶反应15 min. 随后经二胺基联苯胺四盐酸盐显色5 min, 再经苏木素复染, 脱水、透明、封片. 每次染色均以磷酸盐缓冲液代替一抗作阴性对照; 并用已知阳性片作阳性对照.
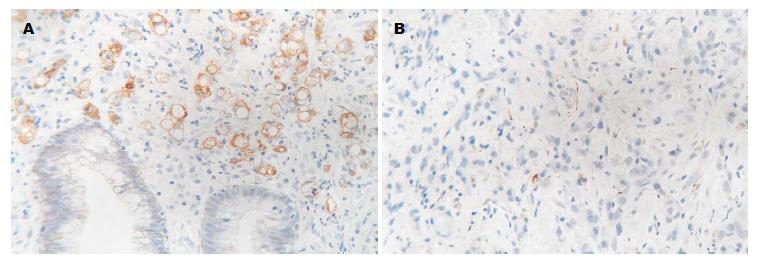
1.2.2 结果判断: 所有的标本均由两位中级以上有经验的病理科医师进行双盲法阅片. 阳性判断标准: 以腺细胞管腔表面和细胞质内呈棕黄色颗粒为准, 且其着色强度高于背景非特异性染色. 若有0%-10%的肿瘤细胞表达SDF-1α则为阴性(-); 若有11%以上的肿瘤细胞表达SDF-1α则为阳性(+)[4].
统计学处理 应用SPSS16.0软件包进行分析, SDF-1α的表达和各临床病理特征等因素的差异比较采用χ2检验. 分析淋巴结转移危险因素采用逻辑回归分析. P<0.05为差异具有统计学意义.
SDF-1α主要表达于肿瘤细胞质和细胞膜(图1). SDF-1α表达阳性率为42.9%(72/168).
对168例EGC中SDF-1α表达和临床病理特征分析发现, SDF-1α的阳性表达与年龄、性别、肿瘤大小、大体类型、浸润深度和组织分化程度等差异无统计学意义(P>0.05); 与淋巴血管侵袭(P = 0.01)和淋巴结转移(P = 0.004)等差异有统计学意义(P<0.05)(表1).
为了评估可能会影响EGC淋巴结转移的各种临床病理因素的临床意义, 我们进行了单因素分析. 淋巴血管侵袭(HR = 3.604, 95%CI: 1.677-7.743, P = 0.001)、未分化组织(HR = 2.258, 95%CI: 1.297-3.933, P = 0.004)和SDF-1α阳性表达(HR = 2.023, 95%CI: 1.107-3.695, P = 0.022)是影响EGC患者淋巴结转移的重要危险因素(表2); 多因素分析发现淋巴血管侵袭(HR = 3.753, 95%CI: 1.674-8.415, P = 0.001)、未分化组织(HR = 2.038, 95%CI: 1.100-3.775, P = 0.024)和SDF-1α阳性表达(HR = 3.631, 95%CI: 1.101-11.977, P = 0.034)是预测EGC患者淋巴结转移的独立危险因素(表3).
| 因素 | 危险比 | 95%置信区间 | P值 |
| 年龄(>65岁) | 2.678 | 0.820-8.744 | 0.103 |
| 性别 | 1.661 | 0.922-2.992 | 0.091 |
| 肿瘤大小(>20 mm) | 1.360 | 0.460-3.991 | 0.604 |
| 大体类型(凹陷型) | 1.120 | 0.383-3.201 | 0.805 |
| 浸润深度(黏膜下层) | 1.410 | 0.502-3.973 | 0.502 |
| 淋巴血管侵袭(有) | 3.604 | 1.677-7.743 | 0.001 |
| 组织分化(未分化) | 2.258 | 1.297-3.933 | 0.004 |
| SDF-1α表达(阳性) | 2.023 | 1.107-3.695 | 0.022 |
| 因素 | 危险比 | 95% 置信区间 | P值 |
| 年龄(>65岁) | 1.450 | 0.432-4.931 | 0.504 |
| 性别 | 1.413 | 0.411-4.792 | 0.601 |
| 肿瘤大小(>20 mm) | 2.192 | 0.562-8.623 | 0.306 |
| 大体类型(凹陷型) | 1.146 | 0.799-2.148 | 0.284 |
| 浸润深度(黏膜下层) | 1.365 | 0.462-3.994 | 0.607 |
| 淋巴血管侵袭(有) | 3.753 | 1.674-8.415 | 0.001 |
| 组织分化(未分化) | 2.038 | 1.100-3.775 | 0.024 |
| SDF-1α表达(阳性) | 3.631 | 1.101-11.977 | 0.034 |
SDF-1α, 也被称为CXCL12, 是一个小的细胞因子类蛋白质, 主要是调节白细胞转运到某些器官并维持正常的免疫系统功能. 然而, 除了他在免疫系统的作用之外, SDF-1α在不同肿瘤患者正常和肿瘤组织中差异性表达是很清楚的, 而且SDF-1α在肿瘤增殖、进展、血管生成和转移中发挥着重要作用[5]. 有报道表明该趋化因子SDF-1α及其受体趋化因子受体4[chemokine (C-X-C motif) receptor 4, CXCR4]参与肿瘤进展和转移过程[6].
胃癌根治性手术后EGC预后良好. 淋巴结转移被认为是EGC一个重要的预后因素, 无淋巴结转移的EGC患者5年生存率约95%, 而有淋巴结转移的患者5年生存率约83%[7]. 因此, 已有许多研究关于确定预测EGC淋巴结转移的因子, 尤其是生物标志物. 本研究结果表明SDF-1α在肿瘤细胞中的表达是EGC患者淋巴结转移的一个独立的危险因素. 然而, 关于有哪些特征的EGC易于发生淋巴结转移仍未达成共识.
最近一些研究[8,9]表明, SDF-1α表达与恶性神经胶质瘤, 前列腺癌等多种肿瘤的进展和转移密切相关. 在胃癌中, 有研究报道说, SDF-1α的表达与淋巴结转移、浸润深度、淋巴管浸润、肿瘤大小及较高分期等有着重要的关系. 此外, SDF-1α阳性组比SDF-1α阴性组的术后结果要差, 两组比较差异有统计学意义, 提示SDF-1α是胃癌的一个独立预后因素[10]. 还有研究[11]发现, SDF-1α在肠型胃癌中的表达与淋巴血管浸润、淋巴结转移和肝脏转移等有显著性相关. 这些研究结果让我们猜测SDF-1α是EGC一个预测淋巴结转移的指标.
在本研究中, 人们发现, EGC患者SDF-1α表达与淋巴血管浸润和淋巴结转移有显著相关性, 而SDF-1α的表达与年龄、性别、肿瘤大小、大体类型、浸润深度或组织学类型没有相关性(表1). 单因素分析结果表明淋巴血管浸润、未分化组织和SDF-1α表达是EGC患者淋巴结转移的危险因素(表2). 此外, 多因素分析明确表明SDF-1α的表达是淋巴结转移、淋巴血管浸润或未分化组织独立危险因素. 这些结果表明, 肿瘤细胞SDF-1α表达是EGC患者一个有用的预测淋巴结转移的标志物.
SDF-1α能促进胃癌的进展, 包括淋巴结转移的机制仍不清楚. SDF-1α参与肿瘤进展过程的可能机制是以自分泌或旁分泌方式发挥作用. 同样在脑肿瘤细胞中SDF-1α的表达及其趋化因子受体的特征是以自分泌或旁分泌机制来刺激肿瘤细胞, 从而导致更具侵袭潜能[12]. 随后, 有报道显示人多形性胶质母细胞瘤细胞系和原代培养细胞中SDF-1α自分泌或旁分泌具有促有丝分裂活动特性[13]. Guleng等[14]报道, SDF-1α的过度表达能促进人类垂体肿瘤的自分泌或旁分泌细胞增殖. 另一种可能的机制是, SDF-1α通过肿瘤微环境吸引内皮细胞而促进肿瘤血管生成. 脑肿瘤细胞病理性分泌的SDF-1α增加了循环内皮祖细胞的生成[15]. 此外, 抑制SDF-1α/CXCR4受体通路而抑制肿瘤血管生成则可以抑制胃肠肿瘤的生长[16].
总之, 本研究表明, 肿瘤SDF-1α表达是预测EGC患者淋巴结转移的一个独立危险因素, 也表明SDF-1α是一个非常有价值的预测指标. 需要进一步研究阐明肿瘤细胞分泌SDF-1α与胃癌致病机制之间的关系.
明确早期胃癌(early gastric cancer, EGC)淋巴结转移的生物学特性, 可能有助于识别高危险的患者群, 寻找淋巴结转移的生物标志物具有重要的预测意义. EGC患者基质细胞衍生因子-1α(stromal cell-derived factor-1α, SDF-1α)的表达与淋巴结转移间的关系有待进一步研究.
肖恩华, 教授, 中南大学湘雅二医院放射教研室
准确预测淋巴结侵袭和转移对胃癌治疗时机选择具有重要意义, 因此探索EGC淋巴结转移相关的因子是亟待研究的问题之一.
相关研究提示SDF-1α在不同肿瘤癌旁组织和肿瘤组织中差异性表达是很清楚的, 而且SDF-1α在肿瘤增殖、进展、血管生成和转移中发挥着重要作用. 有报道表明该趋化因子SDF-1α及其受体趋化因子受体4参与肿瘤进展和转移过程.
本研究探索了SDF-1α在EGC中的表达与淋巴结转移之间的关系, 为预测淋巴结转移提供了一种新的方法.
临床实践中淋巴结转移被认为是EGC一个重要的预后因素, 检测肿瘤SDF-1α表达是预测EGC患者淋巴结转移的一个独立危险因素, 具有重要的预后意义.
肿瘤高危人群: 主要是指有恶性肿瘤家族史、或有不良生活习惯、或职业因素长期接触有毒有害物质、或生存环境遭污染、或遭受特殊微生物感染的人群.
本文对EGC患者中SDF-1α表达与淋巴结转移相关性进行了研究, 表明SDF-1α表达是预测EGC患者淋巴结转移的一个独立危险因素, 具有一定的临床应用价值, 值得临床医生阅读.
编辑: 郭鹏 电编:都珍珍
| 1. | Folli S, Morgagni P, Roviello F, De Manzoni G, Marrelli D, Saragoni L, Di Leo A, Gaudio M, Nanni O, Carli A. Risk factors for lymph node metastases and their prognostic significance in early gastric cancer (EGC) for the Italian Research Group for Gastric Cancer (IRGGC). Jpn J Clin Oncol. 2001;31:495-499. [PubMed] [DOI] |
| 2. | Kwee RM, Kwee TC. Predicting lymph node status in early gastric cancer. Gastric Cancer. 2008;11:134-148. [PubMed] [DOI] |
| 3. | Brennan MF. Current status of surgery for gastric cancer: a review. Gastric Cancer. 2005;8:64-70. [PubMed] [DOI] |
| 4. | Iwasa S, Yanagawa T, Fan J, Katoh R. Expression of CXCR4 and its ligand SDF-1 in intestinal-type gastric cancer is associated with lymph node and liver metastasis. Anticancer Res. 2009;29:4751-4758. [PubMed] |
| 5. | Döring Y, Pawig L, Weber C, Noels H. The CXCL12/CXCR4 chemokine ligand/receptor axis in cardiovascular disease. Front Physiol. 2014;5:212. [PubMed] [DOI] |
| 6. | Boudot A, Kerdivel G, Lecomte S, Flouriot G, Desille M, Godey F, Leveque J, Tas P, Le Dréan Y, Pakdel F. COUP-TFI modifies CXCL12 and CXCR4 expression by activating EGF signaling and stimulates breast cancer cell migration. BMC Cancer. 2014;14:407. [PubMed] [DOI] |
| 7. | Li C, Kim S, Lai JF, Oh SJ, Hyung WJ, Choi WH, Choi SH, Zhu ZG, Noh SH. Risk factors for lymph node metastasis in undifferentiated early gastric cancer. Ann Surg Oncol. 2008;15:764-769. [PubMed] [DOI] |
| 8. | Qin L, Gong C, Chen AM, Guo FJ, Xu F, Ren Y, Liao H. Peroxisome proliferatoractivated receptor γ agonist rosiglitazone inhibits migration and invasion of prostate cancer cells through inhibition of the CXCR4/CXCL12 axis. Mol Med Rep. 2014;10:695-700. [PubMed] |
| 9. | Würth R, Bajetto A, Harrison JK, Barbieri F, Florio T. CXCL12 modulation of CXCR4 and CXCR7 activity in human glioblastoma stem-like cells and regulation of the tumor microenvironment. Front Cell Neurosci. 2014;8:144. [PubMed] [DOI] |
| 10. | Razmkhah M, Ghaderi A. SDF-1alpha G801A polymorphism in Southern Iranian patients with colorectal and gastric cancers. Indian J Gastroenterol. 2013;32:28-31. [PubMed] [DOI] |
| 11. | Song IC, Liang ZL, Lee JC, Huang SM, Kim HY, Oh YS, Yun HJ, Sul JY, Jo DY, Kim S. Expression of stromal cell-derived factor-1α is an independent risk factor for lymph node metastasis in early gastric cancer. Oncol Lett. 2011;2:1197-1202. [PubMed] |
| 12. | Barbieri F, Bajetto A, Stumm R, Pattarozzi A, Porcile C, Zona G, Dorcaratto A, Ravetti JL, Minuto F, Spaziante R. Overexpression of stromal cell-derived factor 1 and its receptor CXCR4 induces autocrine/paracrine cell proliferation in human pituitary adenomas. Clin Cancer Res. 2008;14:5022-5032. [PubMed] [DOI] |
| 13. | Bajetto A, Barbieri F, Dorcaratto A, Barbero S, Daga A, Porcile C, Ravetti JL, Zona G, Spaziante R, Corte G. Expression of CXC chemokine receptors 1-5 and their ligands in human glioma tissues: role of CXCR4 and SDF1 in glioma cell proliferation and migration. Neurochem Int. 2006;49:423-432. [PubMed] [DOI] |
| 14. | Guleng B, Tateishi K, Ohta M, Kanai F, Jazag A, Ijichi H, Tanaka Y, Washida M, Morikane K, Fukushima Y. Blockade of the stromal cell-derived factor-1/CXCR4 axis attenuates in vivo tumor growth by inhibiting angiogenesis in a vascular endothelial growth factor-independent manner. Cancer Res. 2005;65:5864-5871. [PubMed] [DOI] |
| 15. | Li M, Ransohoff RM. The roles of chemokine CXCL12 in embryonic and brain tumor angiogenesis. Semin Cancer Biol. 2009;19:111-115. [PubMed] |