修回日期: 2013-12-28
接受日期: 2014-01-10
在线出版日期: 2014-03-28
目的: 探讨生存素survivin基因启动子区单核苷酸多态性(single nucleotide polymorphism, SNP)与结肠癌遗传易感性及临床意义的相关性.
方法: 采用聚合酶链反应-限制性片段长度多态技术(PCR-RFLP)分别检测217例结肠癌患者与198例正常对照组的survivin基因启动子区-31G/C、-241T/C、-625G/C和-644T/C位点单核苷酸多态性.
结果: 发现-31G/C位点含G等位基因(CG+GG)的结肠癌组频率(60.8%)较正常对照组频率(72.7%)显著降低, 具有统计学意义(P = 0.010, OR = 0.582, 95%CI: 0.385-0.882); 同时, -31G/C位点G变异与肿瘤的分化程度(P = 0.019)、肿瘤的浸润范围(P = 0.008)及远处转移(P = 0.0008)均相关. 而survivin基因启动子区其他3个多态性位点各基因变异型在结肠癌组和正常对照组分布无明显差别, 在分化程度、肿瘤浸润范围、淋巴结转移、远处转移等因素上均无统计学差异.
结论: -31G/C位点携带G等位基因较不携带G等位基因患结肠癌的风险明显下降, 并且G变异基因型能显著降低结肠癌的恶性程度, 是结肠癌的保护因素.
核心提示:Survivin基因启动子区-31G/C位点携带G等位基因较不携带G等位基因患结肠癌的风险明显下降, 并且G变异基因型能显著降低结肠癌的恶性程度, 是结肠癌的保护因素.
引文著录: 朱正明, 欧阳喜, 罗洪亮, 黄俊, 朱培谦. Survivin基因启动子区多态性与结肠癌易感性及临床意义的相关性. 世界华人消化杂志 2014; 22(9): 1334-1340
Revised: December 28, 2013
Accepted: January 10, 2014
Published online: March 28, 2014
AIM: To investigate the clinical significance of survivin gene promoter polymorphisms and their association with susceptibility to colon cancer.
METHODS: The -31G/C, -241T/C, -625G/C and -644T/C single nucleotide polymorphisms in the survivin gene promoter region were genotyped in 217 colon cancer specimens and 198 normal people specimens by PCR-RFLP.
RESULTS: The frequency of the -31G/C locus containing the G allele (CG + GG) in colon cancer patients (60.8%) was significantly lower than that in the normal control group (60.8% vs 72.7%, P = 0.010, OR = 0.582, 95%CI: 0.385-0.882). The -31G/C site G variation was associated with tumor differentiation (P = 0.019), extent of tumor invasion (P = 0.008), and distant metastasis (P = 0.0008). Other three survivin polymorphisms had no significant differences between the colon cancer group and normal control group, and showed no significant correlation with tumor differentiation, tumor invasion, lymph node metastasis or tumor distant metastasis.
CONCLUSION: The -31G/C locus carrying the G allele significantly decreases susceptibility to colon cancer, and the G variant genotype is a protective factor against colon cancer.
- Citation: Zhu ZM, Ouyang X, Luo HL, Huang J, Zhu PQ. Survivin gene promoter polymorphisms: Clinical significance and association with susceptibility to colon cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(9): 1334-1340
- URL: https://www.wjgnet.com/1009-3079/full/v22/i9/1334.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i9.1334
结肠癌是胃肠道中常见的恶性肿瘤, 以41-65岁发病率高, 现已成为恶性疾病的主要死因之一. 在我国, 随着人口老龄化以及环境的恶化, 结肠癌发病率可能继续保持上升趋势, 严重影响着人们的身心健康. 各地资料显示, 随着人民生活水平的提高, 饮食结构的改变, 结肠癌的发病率呈逐年上升趋势. 国内外学者已经普遍认识到结肠癌的发生是一个多阶段发展的过程, 涉及多个癌基因的激活和抑癌基因的失活. 个体遗传因素和环境的相互作用是结肠癌发生发展的主要原因[1]. 生存素(survivin)是凋亡抑制蛋白(inhibition apoptosis protein, IAP)家族的新成员, 也是这个家族中最小的成员, 由146个氨基酸组成[2], 他广泛表达于人类的胚胎组织和恶性肿瘤组织中, 但是几乎不存在于正常的分化的细胞[3]. survivin基因被公认为目前所发现的最强大的凋亡抑制基因[4], 在抑制细胞凋亡、调节细胞周期、促进细胞增殖及细胞转化等方面均发挥着重要作用, 从而影响肿瘤的发生发展[5-7]. 单核苷酸多态性(single nucleotide polymorphism, SNP)在基因组中具有高密度和遗传稳定性的特点, 是个体间遗传差异的主要来源, 也是肿瘤等多种基因疾病的发病基础. 以SNP为研究目标将有助于揭示肿瘤的发病基础. 我们从Genebank发现survivin基因有4个常见SNP位点: -31G/C、-241T/C、-625G/C和-644T/C, 我们推测这些位点的变异可能改变survivin基因的转录启动效率, 从而影响肿瘤的发生发展. 本研究旨在探讨survivin基因启动子区SNP与结肠癌的发生发展的关系, 为结肠癌的早期诊断和个体化治疗提供理论依据.
收集2010-01/2011-10在南昌大学第二附属医院确诊为原发性结肠癌的患者外周静脉血标本217例以及正常对照组清晨外周静脉血标本198例, 各2 mL, EDTA-Na抗凝, -20 ℃保存, 用于PCR检测. 结肠癌组排除家族性腺瘤病和遗传性结肠癌, 正常对照组为来我院体检者, 均证实身体健康. 所有结肠癌组和正常对照组均无血缘关系. 收集并整理结肠癌组和正常对照组临床病理资料, 记录年龄、性别、吸烟、饮酒、家族史、肿瘤分化程度及TNM分期. 结肠癌组病理分期按2003年UICC临床分期标准. 本实验均得到所有对象知情同意签字, 并取得医院伦理委员会批准.
1.2.1 总DNA的提取: 用DNA提取试剂盒(北京全式金生物技术公司)提取每份抗凝外周血的总DNA, 操作均按说明书进行. 采用紫外分光光度计(珠海黑马医学仪器有限公司)测定DNA纯度并进行定量, 波长设定为260和280 nm.
1.2.2 survivin基因启动子区SNP位点基因型检测: 引物设计及合成: 采用Oligo Primer 6.0软件设计, 由Invitrogen公司合成. 引物序列如下: -31G/C位点: 上游引物: 5'-GACTACAACTCCCGGCACACCCCGC-3', 下游引物: 5'-CCCAGGAGGCCGGGCAGTCTCACCC-3'片段长度297 bp; -241T/C: 上游引物: 5'-TGGCACCCTGTAAAGCTCTCCTG-3', 下游引物: 5'-GGGCAACGTCGGGGCAC-3', 片段长度619 bp; -644T/C: 上游引物5'-GCTGCACTCCATCCCTCCCCGGT-3', 下游引物: 5'-GGCAGAGGGTGCAGTGAGC-3', 片段长度: 185 bp; -625G/C: 上游引物5'-GTYCATTTGTCCTTCATGCGC-3', 下游引物5'-GGCAGAGGGTGCAGTGAGC-3', 片段长度164 bp. 在PCR反应管中依次加入ddH2O 31.25 μL、10×PCR 缓冲液5 μL、25 mmol/L MgCl2 5 μL、10 mmol/L dNTPs 1 μL, 上、下游引物各2.5 μL、5 U/μL Taq 酶0.25 μL、cDNA模板2.5 μL上下游引物各2.5 μL, 充分混匀成50 μL PCR反应体系. 94 ℃变性5 min; (94 ℃, 1 min; 58 ℃-61 ℃ 30 s; 72 ℃, 1 min)共35循环; 最后72 ℃ 7 min延伸.
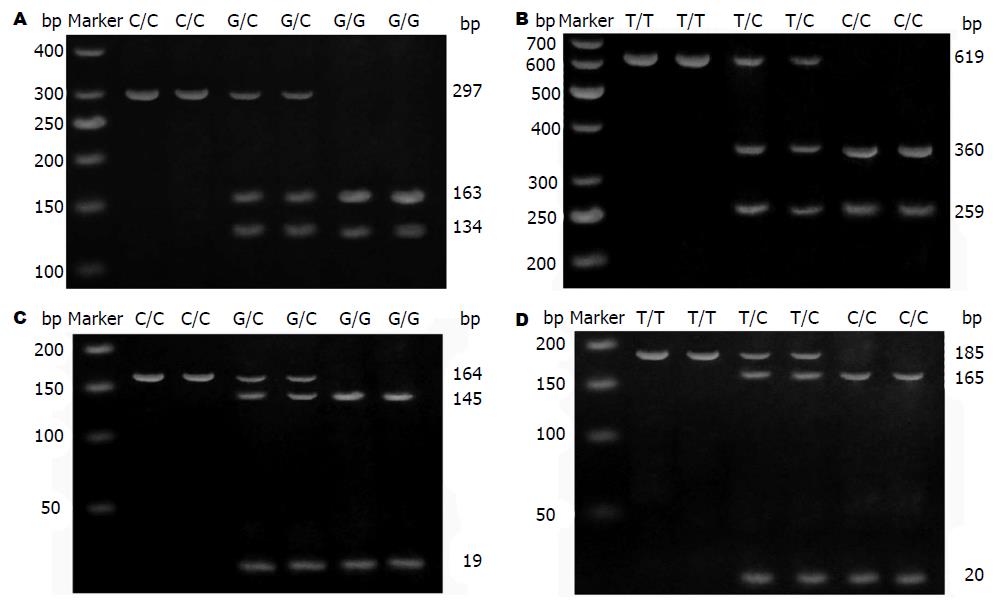
PCR扩增后所得产物经酶切反应后行琼脂糖凝胶电泳检测基因型. 含-31G/C位点片段对应限制性内切酶为EcoO109Ⅰ限制性内切酶(New England Biolabs, USA), 酶切反应结果判断标准为GG型: 163、134 bp, CC型: 297 bp, GC型: 163、134、297 bp; 含-241T/C位点片段对应限制性内切酶为HaeⅡ限制性内切酶(New England Biolabs, USA), 酶切反应结果判断标准为CC型: 360、259 bp, TT型: 619 bp, TC型: 360、259、619 bp; 含-625G/C位点片段对应限制性内切酶为BstUⅠ限制性内切酶(New England Biolabs, USA), 酶切反应结果判断标准为GG型: 145、19 bp, CC型: 164 bp, GC型: 145、19、164 bp; 含-644T/C位点片段对应限制性内切酶为BstUⅠ限制性内切酶(New England Biolabs, USA), 酶切反应结果判断标准为CC型: 165、20 bp, TT型: 185 bp, TC型: 165、20、185 bp.
统计学处理 应用SPSS17.0软件进行统计学分析, 以优势比(odds ratio, OR)及其95%可信区限(confidence interval, CI)表示相对风险度. SNP位点基因型进行哈迪-温伯格平衡(hardy-weinberg equilibrium, HWE)检验和连锁平衡分析. 以χ2检验比较结肠癌组和正常对照组之间各基因型分布的差异. 采用χ2检验和Fisher确切概率法统计分析各基因型与肿瘤分期、分化程度、淋巴结转移等临床病理因素的关系. 所有的统计检验均为双侧概率检验, P<0.05为差异具有统计学意义.
本实验217例结肠癌组和198例正常对照组一般资料如表1. 结肠癌组与正常对照组在年龄、性别因素上比较无统计学差异(P>0.05). 与正常对照组相比, 结肠癌组在吸烟史、饮酒史、家族史及肿瘤家族史等暴露因素上有明显差异(P = 0.006, P = 0.018, P = 0.013).
| 变量 | 结肠癌组 | 正常对照组 | P值 |
| n | 217 | 198 | |
| 性别 | 0.350 | ||
| 男 | 139(64.1) | 118(59.6) | |
| 女 | 78(35.9) | 80(40.4) | |
| 年龄(岁) | 0.545 | ||
| <50 | 33(15.2) | 35(17.7) | |
| 50-70 | 136(62.7) | 127(64.1) | |
| >70 | 48(22.1) | 36(18.2) | |
| 吸烟史 | 0.006 | ||
| 是 | 131(60.4) | 93(47.0) | |
| 否 | 86(39.6) | 105(53.0) | |
| 饮酒史 | 0.018 | ||
| 是 | 77(35.5) | 49(24.7) | |
| 否 | 140(64.5) | 149(75.3) | |
| 肿瘤家族史 | 0.013 | ||
| 是 | 43(19.8) | 22(11.1) | |
| 否 | 174(80.2) | 178(89.9) | |
所提取的各样品的DNA经紫外分光光度计检测, A260/280为1.8-2.0, 提示所提取DNA纯度较纯.含-31G/C位点扩增后片段为297 bp, G变异型能被EcoO109I限制性内切酶酶切, 故GG型产生两个片段(163、134 bp), CC型只产生一个片段(297 bp), GC型产生3个片段(163、134、297 bp). 与此类似, 含-241T/C位点扩增后片段为619 bp, C变异型能被HaeⅡ限制性内切酶酶切, 故CC型产生两个片段(360、259 bp), TT型只产生一个片段(619 bp), TC型产生3个片段(360、259、619 bp). 含-625G/C位点扩增后片段为164 bp, G变异型能被BstUⅠ限制性内切酶酶切, 故GG型产生两个片段(145、19 bp), CC型只产生一个片段(164 bp), GC型产生3个片段(145、19、164 bp). 含-644T/C位点扩增后片段为185 bp, C变异型能被HaeⅡ限制性内切酶酶切, 故CC型产生两个片段(165、20 bp), TT型只产生一个片段(185 bp), TC型产生3个片段(165、20、185 bp). 经2%琼脂糖凝胶电泳后, -31G/C、-241T/C、-625G/C和-644T/C 4个位点酶切结果与预期相符(图1).
Survivin基因启动子区-31G/C、-241T/C、-625G/C和-644T/C位点基因型在结肠癌组和正常对照组的分布频率如表2示. 对比结肠癌组和正常对照组之间各基因型分布的差异, 发现-31G/C位点含G等位基因(CG+GG)结肠癌组频率(60.8%)较正常对照组频率(72.7%)显著降低, 具有统计学意义(P = 0.010, OR = 0.582, 95%CI: 0.385-0.882), 提示-31G/C位点携带G等位基因较不携带G等位基因患结肠癌的风险明显下降. 而另外3个多态性位点各基因变异型之间在结肠癌组和正常对照组分布无明显差别.
| 基因型 | 结肠癌组 | 正常对照组 | P值 | OR (95%CI) |
| n | 217 | 120 | ||
| -31G/C | ||||
| CC | 85(39.2) | 54(27.3) | - | 1.000(ref.) |
| CG | 53(24.4) | 56(28.3) | 0.049 | 0.601(0.362-0.999) |
| GG | 79(36.4) | 88(44.4) | 0.016 | 0.570(0.361-0.900) |
| CG+GG | 132(60.8) | 144(72.7) | 0.010 | 0.582(0.385-0.882) |
| -241T/C | ||||
| TT | 208(95.9) | 194(98.0) | - | 1.000(ref.) |
| TC | 7(3.2) | 4(2.0) | 0.436 | 1.632(0.470-5.663) |
| CC | 2(0.9) | 0(0) | 0.174 | 1.933(1.759-2.124) |
| TC+CC | 9(4.1) | 4(2.0) | 0.214 | 2.099(0.636-6.925) |
| -625G/C | ||||
| CC | 23(10.6) | 16(8.1) | - | 1.000(ref.) |
| CG | 77(35.5) | 70(35.3) | 0.463 | 0.765(0.374-1.565) |
| GG | 117(53.9) | 112(56.6) | 0.362 | 0.727(0.365-1.447) |
| CG+GG | 194(89.4) | 182(91.9) | 0.380 | 0.742(0.380-1.448) |
| -644T/C | ||||
| TT | 131(60.4) | 129(65.2) | - | 1.000(ref.) |
| TC | 59(27.1) | 49(24.7) | 0.458 | 1.186(0.756-1.860) |
| CC | 27(12.4) | 20(10.1) | 0.373 | 1.329(0.867-1.500) |
| TC+CC | 86(39.6) | 69(34.8) | 0.314 | 1.227(0.823-1.830) |
由于-241T/C位点C变异型在结肠癌组和对照组样本分布均低于1%, 我们对于此位点不进行分析. 其他3个位点SNP不同基因型与结肠癌病理分期的关系如表3. -31G/C位点G变异与肿瘤的分化程度(P = 0.019)、肿瘤的浸润范围(P = 0.008)、远处转移(P = 0.0008)均相关, G变异基因型能显著降低结肠癌的恶性程度, G变异是结肠癌的保护因素. -625G/C与-644T/C位点不同基因型在肿瘤分化程度、肿瘤范围、淋巴结转移、远处转移等因素上均无统计学差异.
| -31G/C | -625G/C | -644T/C | |||||||
| CC | CG+GG | P值 | CC | CG+GG | P值 | TT | TC+CC | P值 | |
| 分化程度 | 0.019 | 0.725 | 0.443 | ||||||
| 高分化 | 15 | 39 | 6 | 48 | 29 | 25 | |||
| 中分化 | 29 | 53 | 7 | 75 | 53 | 29 | |||
| 低分化 | 41 | 40 | 10 | 71 | 49 | 32 | |||
| 肿瘤范围 | 0.008 | 0.062 | 0.314 | ||||||
| T1 | 3 | 11 | 3 | 11 | 10 | 4 | |||
| T2 | 8 | 19 | 6 | 21 | 15 | 12 | |||
| T3 | 31 | 67 | 9 | 87 | 63 | 33 | |||
| T4 | 43 | 36 | 5 | 75 | 43 | 37 | |||
| 淋巴结转移 | 0.890 | 0.962 | 0.078 | ||||||
| N0 | 20 | 36 | 7 | 49 | 36 | 20 | |||
| N1 | 35 | 55 | 9 | 81 | 60 | 30 | |||
| N2 | 22 | 29 | 5 | 46 | 23 | 28 | |||
| N3 | 8 | 12 | 2 | 18 | 12 | 8 | |||
| 远处转移 | 0.008 | 0.100 | 0.844 | ||||||
| M0 | 77 | 101 | 16 | 162 | 108 | 70 | |||
| M1 | 8 | 31 | 7 | 32 | 23 | 16 | |||
survivin基因被公认为目前所发现的最强大的凋亡抑制基因, 一方面通过与细胞周期调节因子CDK4结合, 使CDK2/cyclinE活化和Rb磷酸化,促进细胞由G1期进入S期, 促进细胞分化, 并且能躲避G2/M期细胞凋亡监视, 抵抗自身介导的细胞凋亡, 促进细胞的异常增殖[8,9]; 另一方面survivin蛋白通过直接抑制细胞凋亡信号通路下游的终未效应因子Caspase3、Caspase7的活性以及干扰内源性凋亡信号通路上游Caspase9的活化来阻断各种刺激诱导的细胞凋亡过程, 从而实现其抗凋亡作用[10]. survivin基因作为一种凋亡抑制基因, 已有研究证实他 的表达产物能促进癌细胞的有丝分裂的进展和G1/S期转换[11], 从而在肿瘤的发生、发展中起重要作用. 以往的研究证实survivin基因几乎与所有人类常见的恶性肿瘤, 如肺癌、肝癌、胰腺癌、前列腺癌和乳腺癌的发生发展有关, 并且survivin基因在这些癌组织内都是过度表达[12].
SNP是指在基因水平上由单个核苷酸的变异引起的DNA序列多样性. 这种序列的多样性对于遗传表型起到了一定的累加作用[13]. survivin基因启动子区有4个常见SNP位点-31G/C、 -241T/C、-625G/C和-644T/C, 我们推测这些位点的变异可能改变survivin基因转录启动效率, 改变survivin蛋白表达情况从而影响肿瘤的发生发展. 鉴于此, 本实验研究survivin基因启动子区4个SNP位点与结肠癌遗传易感性及临床意义的相关性. 本研究结果显示, 发现-31G/C位点G变异能明显降低结肠癌的患病风险, G变异是结肠癌发病的一个保护因素. 这与Qin等[14]研究的survivin基因-31G>C多态性与患肿瘤的风险: 29项研究的荟萃分析的结果相符, 并且这一位点的多态性在其他相关恶性肿瘤中也有相似的研究结果[15,16]. 我们推测survivin基因启动子区-31G/C位点G变异, 降低survivin基因的转录活性使survivin蛋白表达量下降, 从而减少结肠癌的发生发展. survivin基因启动子区的细胞周期依赖性元件(cell cycle dependent element, CDE)/细胞周期同源区(cell cycle homology region, CHR)激活后能启动G2/M期的周期依赖的survivin基因高表达, -31G/C位点位于CDE/CHR区. C等位基因能与上游调控元件结合而启动survivin基因表达, -31G/C位点G变异等位基因通过改变CDE/CHR调控元件结合位点的特异序列阻遏上游调控元件与CDE/CHR元件的结合从而降低survivin基因的表达[17]. 这解释了本研究中正常对照组中G变异等位基因频率多于结肠癌组. 这与黄俊等研究的survivin基因启动子区-31C/G单核苷酸多态性与中国华南地区散发性结直肠癌CRC遗传易感性报到的结果相符[18]. 此外, 本研究还发现-31G/C位点G变异与肿瘤的分化程度、肿瘤的浸润范围、远处转移均相关, 与C等位基因型相比, G变异基因型能显著降低结肠癌的恶性程度. G变异通过减少survivin的表达, 影响后者与DNA双链断裂修复蛋白的相互作用, 进而调整DNA-PKcs的活性, 诱导DNA损伤, 来调节肿瘤的分化和转移[19].
此外, 本研究结果显示survivin基因启动子区其他3个多态性位点基因变异与结肠癌的易感性无明显相关性. 我们发现-241T/C、-625G/C和-644T/C 3个位点不位于非顺式作用元件或是转录因子结合位点, 故此三个多态性位点可能为无意义序列碱基, 因此可以解释这三个位点的基因变异与survivin基因表达无明显相关性.
总之, survivin基因启动子区-31G/C位点G变异通过降低survivin蛋白的表达来降低结肠癌的易感性, 并抑制结肠癌, 降低结肠癌的恶性程度. 本课题的不足之处在于样本量偏少, 以及样本的局限性, 为此我们后续的研究将扩大样本量并建立适当的动物模型, 探索survivin基因激活后具体的信号传递分子机制, 为结肠癌的发生发展提供新的研究思路, 并为临床药物治疗提供重要依据.
结肠癌是最常见的消化系恶性肿瘤之一. 近年来, 随着食物结构和生活方式的改变, 我国的结肠癌发病率和死亡率呈逐年上升趋势. 结肠癌的发生和发展已被证实是一个多步骤、多阶段及多基因改变参与的过程, 随着其发病机制研究的不断深入, 细胞增殖和凋亡的失衡在结直肠癌发生发展中的作用日益受到关注.
顾岩, 教授, 主任医师, 上海交通大学医学院附属上海第九人民医院普外科
survivin基因在肿瘤组织中被激活而参与肿瘤的发生发展并影响预后, 他的表达意味着疾病复发危险性较高和对放化疗耐受. 虽然目前对survivin的研究取得一定进展, 但仍有许多问题尚未阐明, 针对survivin的靶向治疗试验尚处于起步阶段.
多项研究表明-31G/C多态性与CDE/CHR抑制因子结合序列改变、启动子活动改变有关, 是survivin启动子中的一个功能性SNP位点. 此SNP位点的G等位基因能够形成一个CDE元件, 因而影响survivin转录, 而C等位基因不能形成此抑制元件, 所以不同的等位基因型能对survivin表达造成不同的影响.
本文检测了survivin基因启动子区4个常见SNP位点在结肠癌患者中的基因型分布情况及其与临床病理特征之间的关系, 进而对survivin基因启动子区多态常性与结肠癌易感性及临床意义的相关性进行分析.
本文提示survivin基因启动子区-31G/C位点G变异通过降低survivin蛋白的表达来降低结肠癌的易感性, 并抑制结肠癌, 降低结肠癌的恶性程度.
本文结合临床, 对于临床工作具有一定的意义.
编辑: 田滢 电编: 鲁亚静
| 2. | Jarrin M, Mansergh FC, Boulton ME, Gunhaga L, Wride MA. Survivin expression is associated with lens epithelial cell proliferation and fiber cell differentiation. Mol Vis. 2012;18:2758-2769. [PubMed] |
| 3. | Kawata N, Tsuchiya N, Horikawa Y, Inoue T, Tsuruta H, Maita S, Satoh S, Mitobe Y, Narita S, Habuchi T. Two survivin polymorphisms are cooperatively associated with bladder cancer susceptibility. Int J Cancer. 2011;129:1872-1880. [PubMed] [DOI] |
| 4. | Watson AJ. An overview of apoptosis and the prevention of colorectal cancer. Crit Rev Oncol Hematol. 2006;57:107-121. [PubMed] [DOI] |
| 5. | Johnson ME, Howerth EW. Survivin: a bifunctional inhibitor of apoptosis protein. Vet Pathol. 2004;41:599-607. [PubMed] [DOI] |
| 6. | Li F, Brattain MG. Role of the Survivin gene in pathophysiology. Am J Pathol. 2006;169:1-11. [PubMed] [DOI] |
| 7. | Fukuda S, Pelus LM. Survivin, a cancer target with an emerging role in normal adult tissues. Mol Cancer Ther. 2006;5:1087-1098. [PubMed] [DOI] |
| 8. | Saleem M, Murtaza I, Witkowsky O, Kohl AM, Maddodi N. Lupeol triterpene, a novel diet-based microtubule targeting agent: disrupts survivin/cFLIP activation in prostate cancer cells. Biochem Biophys Res Commun. 2009;388:576-582. [PubMed] [DOI] |
| 9. | Dallaglio K, Palazzo E, Marconi A, Dumas M, Truzzi F, Lotti R, Bontè F, Pincelli C. Endogenous survivin modulates survival and proliferation in UVB-treated human keratinocytes. Exp Dermatol. 2009;18:464-471. [PubMed] [DOI] |
| 10. | Sah NK, Khan Z, Khan GJ, Bisen PS. Structural, functional and therapeutic biology of survivin. Cancer Lett. 2006;244:164-171. [PubMed] [DOI] |
| 11. | Antonacopoulou AG, Floratou K, Bravou V, Kottorou A, Dimitrakopoulos FI, Marousi S, Stavropoulos M, Koutras AK, Scopa CD, Kalofonos HP. The survivin -31 snp in human colorectal cancer correlates with survivin splice variant expression and improved overall survival. Cell Oncol (Dordr). 2011;34:381-391. [PubMed] [DOI] |
| 12. | Hsieh YS, Tsai CM, Yeh CB, Yang SF, Hsieh YH, Weng CJ. Survivin T9809C, an SNP located in 3'-UTR, displays a correlation with the risk and clinicopathological development of hepatocellular carcinoma. Ann Surg Oncol. 2012;19 Suppl 3:S625-S633. [PubMed] [DOI] |
| 14. | Qin Q, Zhang C, Zhu H, Yang X, Xu L, Liu J, Lu J, Zhan L, Cheng H, Sun X. Association between survivin -31G& gt; C polymorphism and cancer risk: meta-analysis of 29 studies. J Cancer Res Clin Oncol. 2014;140:179-188. [PubMed] [DOI] |
| 15. | Upadhyay R, Khurana R, Kumar S, Ghoshal UC, Mittal B. Role of survivin gene promoter polymorphism (-31G& gt; C) in susceptibility and survival of esophageal cancer in northern India. Ann Surg Oncol. 2011;18:880-887. [PubMed] [DOI] |
| 16. | Borges Bdo N, Burbano RR, Harada ML. Survivin -31C/G polymorphism and gastric cancer risk in a Brazilian population. Clin Exp Med. 2011;11:189-193. [PubMed] [DOI] |
| 17. | Wagner M, Schmelz K, Dörken B, Tamm I. Epigenetic and genetic analysis of the survivin promoter in acute myeloid leukemia. Leuk Res. 2008;32:1054-1060. [PubMed] [DOI] |
| 18. | 黄 俊, 汪 建平, 王 磊, 刘 焕亮, 魏 宜胜, 黄 美近, 傅 新晖, 陈 静, 陈 典克. Survivin基因启动子区-31C/G多态性与散发性结直肠癌遗传易感性的关系. 中山大学学报. 2010;31:59-63. |
| 19. | Capalbo G, Dittmann K, Weiss C, Reichert S, Hausmann E, Rödel C, Rödel F. Radiation-induced survivin nuclear accumulation is linked to DNA damage repair. Int J Radiat Oncol Biol Phys. 2010;77:226-234. [PubMed] [DOI] |