修回日期: 2014-01-20
接受日期: 2014-02-03
在线出版日期: 2014-03-28
目的: 分析非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)与自身免疫异常的关系.
方法: 经肝活检确诊的NAFLD患者132例分为NAFLD合并自身免疫性肝病(autoimmune liver diseases, AILD)组、NAFLD合并其他自身免疫性疾病(除外AILD)组、NAFLD合并自身免疫现象组、NAFLD组. 收集各组研究对象临床生化、自身抗体、影像学及肝组织学指标, 应用SPSS17.0进行统计学分析.
结果: AST组1与组4之间比较差异有统计学意义(P<0.05), 血清免疫球蛋白G(immunoglobulin G, IgG)组1、组2、组3分别与组4比较差异均有统计学意义(P<0.05), 肝脏硬度值、肝纤维化、炎症程度组1分别与组2、组3、组4比较差异均有统计学意义(P<0.05).
结论: IgG、肝脏硬度值、肝纤维化和炎症程度与自身免疫异常严重程度有关, IgG和肝脏硬度值可作为长期随访指标.
核心提示: 本研究对132例非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)患者进行自身抗体检测及肝脏组织活检, 结果发现IgG、肝脏硬度值、肝纤维化和炎症程度与自身免疫异常严重程度有关, 且IgG和肝脏硬度值可作为长期随访指标. 目前, 对于NAFLD患者合并自身免疫性肝病(autoimmune liver diseases)的诊断, 仍需依赖肝组织病理学.
引文著录: 吴凤娟, 徐芸, 保洁, 刘象. 非酒精性脂肪性肝病合并自身免疫异常132例. 世界华人消化杂志 2014; 22(9): 1294-1299
Revised: January 20, 2014
Accepted: February 3, 2014
Published online: March 28, 2014
AIM: To analyze the relationship between non-alcoholic fatty liver disease (NAFLD) and autoimmune diseases.
METHODS: One hundred and thirty-two patients with biopsy-proven NAFLD were divided into four groups: 1 [patients with NAFLD and autoimmune liver disease (AILD)], 2 (patients with NAFLD and autoimmune disease except AILD), 3 (patients with NAFLD and autoimmune phenomena) and 4 (patients with NAFLD alone). All data on clinical and biochemistry indexes, autoantibodies, imaging findings and liver histology were analyzed.
RESULTS: The difference in AST was statistically significant between groups 1 and 4 (P < 0.05). There were significant differences in IgG in groups 1, 2 and 3 compared with group 4 (P < 0.05 for all). Liver stiffness, fibrosis stage and inflammation level were different significantly between group 1 and groups 2, 3 and 4 (P < 0.05 for all).
CONCLUSION: The levels of IgG, liver stiffness, liver fibrosis and hepatic inflammation were correlated with the severity of autoimmune problems. IgG and liver stiffness may act as long-term follow-up indicators.
- Citation: Wu FJ, Xu Y, Bao J, Liu X. Non-alcoholic fatty liver disease complicated with autoimmune problems: Analysis of 132 cases. Shijie Huaren Xiaohua Zazhi 2014; 22(9): 1294-1299
- URL: https://www.wjgnet.com/1009-3079/full/v22/i9/1294.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i9.1294
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是以肝实质细胞脂肪变性为特征, 无过量饮酒史, 排除其他肝病的临床病理综合征, 是代谢综合征的重要组分[1]. 包括单纯性脂肪肝(nonalcoholic simple fatty liver, NAFL)、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)、肝硬化和隐源性肝硬化. 近年来, 生活方式的改变使以NAFLD为基础的慢性肝病日益增多, NAFLD在欧美发达国家已成为慢性肝病的首要原因, 在我国亦仅次于病毒性肝炎而居第2位[2,3]. 其发病机制目前尚不明确, 肝活检仍为其诊断和分型的金标准. 自身免疫(autoimmune)是机体免疫系统对自身组织细胞发生免疫应答的现象, 当免疫应答造成组织细胞病理损伤并出现临床症状者, 则表现为自身免疫性疾病[4]. 自身免疫性肝病(autoimmune liver diseases, AILD)是一组肝脏病理损害和肝功能异常为主要表现的自身免疫性疾病, 主要包括自身免疫性肝炎(autoimmune hepatitis, AIH)、原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)、原发性硬化性胆管炎(primary sclerosing cholangitis, PSC)等[5], 其表现主要根据不同程度的转氨酶升高、高丙种球蛋白血症、自身抗体的检出和特征性组织学改变. 自身免疫现象(autoimmune phenomena)是指有至少一种自身抗体阳性, 但不能确诊为任何一种自身免疫性疾病的临床现象[6,7].
目前对无病毒感染、伴有肥胖、伴或不伴自身抗体阳性的慢性肝病的诊断日益备受临床关注, 对其发病机制及相关性的研究亦将成为热点课题.
搜集2011-08/2013-10于郑州大学第一附属医院消化内科住院的NAFLD患者, 研究对象均选自经超声及肝活检诊断的NAFLD患者132例, 根据临床及病理学特征分为四组: NAFLD合并AILD组(n = 7), 男2例, 女5例, 平均年龄56岁±9岁; NAFLD合并其他自身免疫性疾病(除AILD)组(n = 14), 男5例, 女9例, 平均年龄44岁±11岁; NAFLD合并自身免疫现象组(n = 33), 男13例, 女20例, 平均年龄47岁±11岁; NAFLD组(n = 78), 男34例, 女44例, 平均年龄43岁±13岁. NAFLD诊断标准依据2012年美国非酒精性脂肪性肝病诊疗指南[8], 病理学报告标准参照美国国立卫生研究院NASH临床研究网病理工作组指南[9], AIH诊断参照2002年美国肝病学会(AASLD)制定的AIH诊疗指南[10]. 研究对象均为本地区长期居住人口, 收集其相关资料.
1.2.1 ELISA法抗体检测及肝脏活检: 收集研究对象一般特征[年龄、体质量指数(body mass index, BMI)、腰臀比、血压]、临床生化指标[丙氨酸转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、碱性磷酸酶(alkaline phosphatase, ALP)、总胆固醇、甘油三酯、胰岛素抵抗指数等]、自身抗体(抗核抗体ANA、抗平滑肌抗体ASMA、抗线粒体抗体AMA、IgG等)及肝脏硬度值、肝组织学结果. 其中BMI为晨起空腹测得数值得出; 生化指标由清晨空腹抽取正中静脉血2 mL测得; 自身抗体用ELISA法测出, 试剂盒由CUSABIO公司生产; 肝组织标本由16 G穿刺针在超声定位后穿刺获得, 40 g/L甲醛溶液固定, 镜下至少包括3个以上汇管区, 穿刺标本作连续切片, 进行HE、Masson、网状纤维染色, 试剂由中杉金桥公司生产.
1.2.2 肝活检病理学评估: 根据2001年《病毒性肝炎防治方案》[11]慢性肝炎病理分级分期及美国国立卫生研究院NASH临床研究网病理工作组指南, 采用0-4级分法评估NAFLD纤维化程度(S)和炎症活动程度(G). AIH特征性表现包括: 突出的界面炎, 汇管区中重度淋巴细胞浆细胞浸润, 明显的桥接坏死或融合严重的淋巴细胞炎症样变, 以及肝细胞玫瑰花结的形成. 脂肪变程度根据肝活检标本脂肪样变所占比例分为轻、中、重度, 轻度: 肝细胞脂肪变占5%-33%; 中度: 肝细胞脂肪变占33%-66%; 重度: 肝细胞脂肪变占66%以上.
统计学处理 采用SPSS17.0统计学软件对数据进行处理. 计量资料以mean±SD表示, 采用单因素方差分析、K-W检验; 计数资料以例数或百分率描述, 采用χ2检验、秩和检验; 检验水准α = 0.05. P<0.05为差异有统计学意义.
组1为NAFLD合并AILD组; 组2为NAFLD合并其他自身免疫性疾病(除外AILD)组, 其中NAFLD合并多发性肌炎4例、合并强直性脊柱炎2例、合并干燥综合征4例、合并类风湿性关节炎(RF)4例; 组3为NAFLD合并自身免疫现象组; 组4为NAFLD组. 四组患者一般特征、生化及代谢相关指标比较见表1, 4组患者在性别、年龄、BMI、腰臀比、血压方面比较差异均无统计学意义(P>0.05); ALT、ALP、HOMA-R、TG四组间比较差异均无统计学意义(P>0.05); AST、IgG、肝脏硬度值在四组间比较差异有统计学意义(P<0.05), AST组1与组4之间比较差异有统计学意义(P<0.05), 组1与组2、组3, 组4与组2、组3, 2与组3之间比较均无统计学意义; IgG组1、组2、组3分别与组4比较差异均有统计学意义(P<0.05), 组1、组2、组3之间比较差异无统计学意义; 肝脏硬度值组1分别与组2、组3、组4比较差异均有统计学意义(P<0.05), 组2、组3、组4之间比较差异无统计学意义.
| 组1 | 组2 | 组3 | 组4 | F/χ2 | P值 | |
| n | 7 | 14 | 33 | 78 | ||
| 性别(男)n(%) | 2(28.6) | 5(35.7) | 13(39.4) | 34(43.6) | 0.860 | 0.878 |
| 年龄(岁) | 56±9 | 44±11 | 47±11 | 43±13 | 2.380 | 0.076 |
| BMI(kg/m2) | 26.7±2.6 | 26.0±3.4 | 26.1±2.6 | 26.9±2.9 | 0.450 | 0.718 |
| 腰臀比 | 0.95±0.07 | 0.97±0.07 | 0.97±0.05 | 0.98±0.05 | 0.323 | 0.809 |
| 收缩压(mmHg) | 130±16 | 129±13 | 121±11 | 124±14 | 1.208 | 0.314 |
| 舒张压(mmHg) | 82±10 | 82±10 | 79±8 | 82±9 | 0.335 | 0.800 |
| ALT(U/L) | 133.0±180.6 | 86.8±40.6 | 93.6±44.4 | 87.4±59.3 | 1.385 | 0.709 |
| AST(U/L) | 101.9±143.7 | 61.2±19.2 | 75.2±30.8 | 55.7±32.6 | 8.752 | 0.033 |
| ALP(U/L) | 110.6±52.8 | 91.1±48.5 | 99.8±46.9 | 77.5±35.8 | 6.868 | 0.076 |
| TG(mg/dL) | 2.3±0.7 | 1.9±0.7 | 2.2±0.8 | 2.1±1.0 | 0.464 | 0.709 |
| HOMA-R | 3.1±1.0 | 3.5±2.1 | 2.5±0.8 | 2.7±1.1 | 3.871 | 0.276 |
| IgG(g/L) | 17.2±3.1 | 14.9±2.7 | 14.6±3.5 | 11.6±3.3 | 8.380 | 0.001 |
| 肝脏硬度值 | 17.0±7.7 | 10.3±2.9 | 11.0±2.8 | 8.8±2.8 | 10.3 | 0.001 |
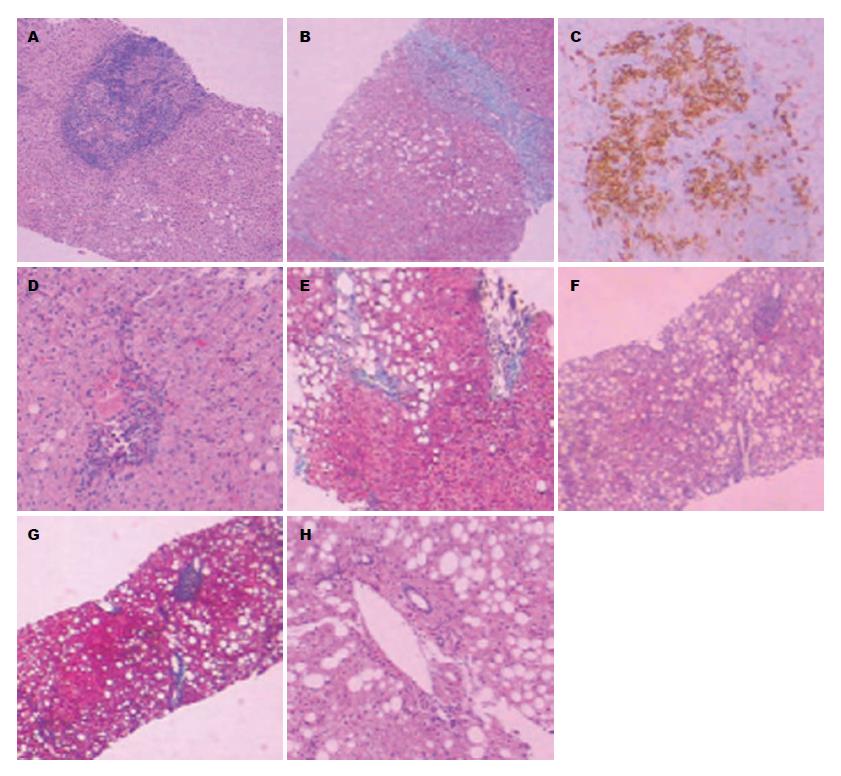
4组患者肝活检后纤维化分期、炎症程度分级及脂肪变程度比较如表2, 图1. 四组患者比较, 肝纤维化程度、炎症程度差异有统计学意义(P<0.05), 肝脂肪变程度比较差异无统计学意义(P>0.05). 肝纤维化程度、炎症程度组1分别与组2、组3、组4比较差异均有统计学意义(P<0.05), 组2、组3、组4之间比较差异无统计学意义.
| 组1 | 组2 | 组3 | 组4 | P值 | |
| n | 7 | 14 | 33 | 78 | |
| 肝纤维化 | 0.001 | ||||
| S0 | 0(0) | 3(21.4) | 9(27.3) | 28(35.9) | |
| S1 | 1(14.3) | 7(50) | 19(57.6) | 36(46.1) | |
| S2 | 5(71.4) | 3(21.4) | 5(15.1) | 13(16.7) | |
| S3 | 1(14.3) | 1(7.2) | 0(0) | 1(1.3) | |
| S4 | 0(0) | 0(0) | 0(0) | 0(0) | |
| 炎症活动 | 0.033 | ||||
| G1 | 1(14.3) | 8(57.1) | 19(57.6) | 50(64.1) | |
| G2 | 4(57.1) | 4(28.6) | 13(39.4) | 26(33.3) | |
| G3 | 2(28.6) | 2(14.3) | 1(3.0) | 2(2.6) | |
| G4 | 0(0) | 0(0) | 0(0) | 0(0) | |
| 脂肪变 | 0.794 | ||||
| 轻度 | 3(42.9) | 6(42.9) | 11(33.4) | 25(32.1) | |
| 中度 | 3(42.9) | 5(35.7) | 14(42.4) | 32(41.0) | |
| 重度 | 1(14.2) | 3(21.4) | 8(24.2) | 21(26.9) |
NAFLD合并AIH合并PBC3例, NAFLD合并AIH3例, NAFLD合并PBC1例, 7例患者IgG均升高, 3例NAFLD合并AIH患者抗体ANA均阳性(1:320), AIH评分>15分, 1例NAFLD合并PBC患者抗体AMA阳性(1:320), AIH评分小于10分, 3例NAFLD合并重叠综合征(AIH+PBC)患者抗体ANA、AMA均阳性, 并合并肝肾微粒体抗体(liver-kidney microsomal antibody, LKM-1)等多种抗体阳性(表3).
| 诊断 | 性别 | BMI(kg/m2) | ALT(U/L) | ALP(U/L) | TG(mg/dL) | HOM-A-R | IgG(g/L) | 抗体 | 肝脏硬度值(kpa) | G | S | AIH评分 | |
| NAFLD并重叠 | 女 | 32.4 | 22 | 96 | 1.69 | 3.8 | 21.4 | ANA1:100 LKM-1 | AMA1:320 | 15.2 | 2 | 2 | 14 |
| 女 | 25.1 | 526 | 191 | 1.98 | 2.52 | 12.96 | ANA1:100 SSA(+++) | AMA1:320 sp100(+) | 12.8 | 2 | 2 | 13 | |
| 女 | 24.8 | 37 | 69 | 2.63 | 2.2 | 16.6 | ANA1:320 IgG4(+) | AMA1:100 | 28.6 | 3 | 3-4 | 8 | |
| NAFLD并AIH | 女 | 26 | 63 | 178 | 3.31 | 2.46 | 21.3 | ANA1:320 SMA(±) Anti-ASGPR(±) | 16 | 1 | 2 | 18 | |
| 男 | 25.8 | 112 | 77 | 2.62 | 2.23 | 15.47 | ANA1:320 | 6.5 | 2 | 1 | 15 | ||
| 女 | 26.4 | 156 | 103 | 2.32 | 4.8 | 16.9 | ANA1:320 | SSA(+) | 13.9 | 3 | 2 | 16 | |
| NAFLD并PBC | 男 | 26.7 | 15 | 60 | 1.24 | 3.5 | 15.8 | AMA1:320 | 25.7 | 2 | 2 | 6 | |
近年来, 随着生活方式的改变, NAFLD已成为肝功能酶学异常和慢性肝病的最常见原因之一, 其发病可能与肝脏脂质代谢障碍、胰岛素抵抗、遗传、免疫等因素相关. NAFLD常有肝脏网状内皮系统功能障碍以及炎性细胞和促炎细胞因子浸润, 此观点已被动物实验证实[12]; 肠道微生物菌群是调节异位脂肪沉积的关键, 有研究表明[13]炎症因子导致的微生物菌丛失调可加剧肝脏脂肪变和NAFLD的治疗难度.
目前认为慢性炎症反应是AILD和NAFLD的共同病变基础. NAFLD患者肝脏大量脂肪因子的分泌使机体处于慢性炎症状态, 同时, 增加的游离脂肪酸使肝脏脂质过度沉积, 趋化大量巨噬细胞, 进而诱发自身免疫反应; 过多的脂质可使机体处于氧化应激状态, 产生的活性氧族通过与TNF-α、FAS配体作用诱导肝细胞凋亡, 并可激活核转录因子, 调节炎症因子的表达, 引起肝组织纤维化. 有文献报道脂肪因子瘦素可诱导Th1细胞启动自身免疫反应[14]. 对NASH和PBC小鼠模型的肝脏病理学研究也发现, NASH小鼠病理学上可出现界面炎、汇管区炎性细胞浸润以及小胆管损伤样改变, 并可检测出自身抗体, 如ANA, 但PBC小鼠病理学未发现NASH样改变.
本研究发现, NAFLD患者和NAFLD合并AILD、合并其他自身免疫性疾病(除AILD)、合并自身免疫现象患者一般特征并无显著差别, AST组1高于组2、组3、组4, 但只有组1与组4比较差异有统计学意义(P<0.05); IgG在组1、组2、组3均升高, 组4正常, 组1、组2、组3分别与组4比较差异均有统计学意义(P<0.05), 而组1、组2、组3之间差异无统计学意义, 此结果与国外研究结果相一致[15]. IgG升高可怀疑NAFLD合并自身免疫异常, 但不能作为鉴别的依据. 肝脏剪切波弹性成像(supersonic shear imaging, SSI)目前作为一种新技术被应用于此项研究中, 有文献报道[16]SSI测得肝脏硬度值与肝纤维化程度正相关, 对于肝活检有风险者及病情长期随访有重大意义. 本组研究中, 四组肝脏硬度值均升高(参考值<6.2 kpa), 组1升高显著, 组1分别与组2、组3、组4比较差异均有统计学意义(P<0.05). 此外, 四组肝活检结果比较, 肝纤维化分级、炎症活动分期组1明显高于组2、组3、组4, 组1分别与另三组比较差异有统计学意义(P<0.05), 此结果与SSI测得肝脏硬度值结果相一致. 表明肝脏硬度值可作为除肝活检外病情长期随访的可靠指标. NAFLD合并其他自身免疫性疾病(除AILD)、合并自身免疫现象患者可表现为多种自身抗体阳性, 而肝组织学未发现AIH特征性改变, 表明NAFLD患者是否合并AILD确诊需依据肝组织学表现, 以避免临床误诊率和不必要的治疗.
AILD和NAFLD目前尚缺乏代表性血清标志物, ANA阳性高度怀疑AIH的可能, 但其诊断仍需要依据国际自身免疫性肝病组织报道的AIH评分系统[17]. 有西方国家研究表明, 20%-30%的NAFLD患者可合并有自身抗体阳性, 但是自身抗体阳性的NAFLD患者中只有10%够标准诊断NAFLD合并AIH, 尤其NASH所致肝硬化的女性患者可有很高的ANA或SMA滴度, 很难将其与抗体滴度低的AIH患者区分[7]. 目前对于NAFLD患者合并AILD的诊断, 仍需依赖肝组织病理学. 研究中发现血清IgG、肝脏硬度值在四组之间比较中有统计学意义, 可作为长期随访指标. 本研究针对中原地区NAFLD患者, 进一步深入研究仍需要纳入不同地区、大样本量观察, 为NAFLD患者的长期随访及疾病早期预防提供指导意义.
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)在欧美发达国家已成为慢性肝病的首要原因, 在我国亦仅次于病毒性肝炎而居第2位; 自身免疫性肝病(autoimmune liver diseases, AILD)是晚期慢性肝功能衰竭的主要原因之一, 目前也是国内肝病领域研究的新热点.
王怡, 主任医师, 天津市传染病医院, 天津市肝病研究所
对无病毒感染、伴有肥胖、伴或不伴自身抗体阳性的慢性肝病的诊断日益备受临床关注,目前尚缺乏对其发病机制及相关性的进一步研究.
Yatsuji等研究发现高滴度抗核抗体合并NAFLD高危因素人群容易发生自身免疫性疾病,刘玉兰等发现慢性炎症反应是AILD和NAFLD的共同病变基础,但对NAFLD合并自身免疫异常的研究目前仍缺乏相关的临床数据.
本课题对132例NAFLD患者进行分组研究, 结果发现IgG、肝脏硬度值、肝纤维化和炎症程度与自身免疫异常严重程度有关, 且IgG和肝脏硬度值可作为长期随访指标.
本文选材好, 思路清晰, 分析透彻, 通过临床研究所得出的结果为临床医生规范化诊疗、避免误诊及不必要的治疗提供了的依据.
编辑: 田滢 电编: 鲁亚静
| 1. | Krawczyk M, Bonfrate L, Portincasa P. Nonalcoholic fatty liver disease. Best Pract Res Clin Gastroenterol. 2010;24:695-708. [PubMed] |
| 2. | Farrell GC, Wong VW, Chitturi S. NAFLD in Asia--as common and important as in the West. Nat Rev Gastroenterol Hepatol. 2013;10:307-318. [PubMed] [DOI] |
| 3. | Zhou YJ, Li YY, Nie YQ, Ma JX, Lu LG, Shi SL, Chen MH, Hu PJ. Prevalence of fatty liver disease and its risk factors in the population of South China. World J Gastroenterol. 2007;13:6419-6424. [PubMed] [DOI] |
| 6. | Barcellini W, Iurlo A, Radice T, Imperiali FG, Zaninoni A, Fattizzo B, Guidotti F, Bianchi P, Fermo E, Consonni D. Increased prevalence of autoimmune phenomena in myelofibrosis: relationship with clinical and morphological characteristics, and with immunoregulatory cytokine patterns. Leuk Res. 2013;37:1509-1515. [PubMed] [DOI] |
| 7. | Yatsuji S, Hashimoto E, Kaneda H, Taniai M, Tokushige K, Shiratori K. Diagnosing autoimmune hepatitis in nonalcoholic fatty liver disease: is the International Autoimmune Hepatitis Group scoring system useful? J Gastroenterol. 2005;40:1130-1138. [PubMed] [DOI] |
| 8. | Chalasani N, Younossi Z, Lavine JE, Diehl AM, Brunt EM, Cusi K, Charlton M, Sanyal AJ. The diagnosis and management of non-alcoholic fatty liver disease: practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Hepatology. 2012;55:2005-2023. [PubMed] [DOI] |
| 9. | Farrell GC, Chitturi S, Lau GK, Sollano JD. Guidelines for the assessment and management of non-alcoholic fatty liver disease in the Asia-Pacific region: executive summary. J Gastroenterol Hepatol. 2007;22:775-777. [PubMed] [DOI] |
| 10. | Czaja AJ, Freese DK. Diagnosis and treatment of autoimmune hepatitis. Hepatology. 2002;36:479-497. [PubMed] [DOI] |
| 12. | Pasarín M, La Mura V, Gracia-Sancho J, García-Calderó H, Rodríguez-Vilarrupla A, García-Pagán JC, Bosch J, Abraldes JG. Sinusoidal endothelial dysfunction precedes inflammation and fibrosis in a model of NAFLD. PLoS One. 2012;7:e32785. [PubMed] [DOI] |
| 13. | Wood NJ. Microbiota: Dysbiosis driven by inflammasome deficiency exacerbates hepatic steatosis and governs rate of NAFLD progression. Nat Rev Gastroenterol Hepatol. 2012;9:123. [PubMed] [DOI] |
| 14. | Fernández-Riejos P, Najib S, Santos-Alvarez J, Martín-Romero C, Pérez-Pérez A, González-Yanes C, Sánchez-Margalet V. Role of leptin in the activation of immune cells. Mediators Inflamm. 2010;2010:568343. [PubMed] [DOI] |
| 15. | Cho DH, Choi MS, Kim DH, Kim DY, Shim SG, Lee JH, Koh KC, Paik SW, Yoo BC, Rhee JC. [A prospective study on the prevalence and clinical significance of autoantibodies in patients with suspected nonalcoholic fatty liver disease]. Korean J Hepatol. 2005;11:261-267. [PubMed] |