修回日期: 2014-01-20
接受日期: 2014-02-03
在线出版日期: 2014-03-28
调节性T(regulatory T, Treg)细胞包含有不同的亚群, 在诱导和维持机体对自身和同种异体抗原免疫耐受中具有重要的作用. CD4+CD25+Foxp3+ Treg细胞是目前研究的最广泛和深入的调节性T细胞. 大量研究显示, CD4+CD25+Foxp3+ Treg细胞功能或数量的异常可引起多种自身免疫性疾病以及器官移植排斥反应. 因此, CD4+CD25+Foxp3+ Treg细胞在诱导和维持肝移植免疫耐受方面可能具有较好的应用前景. 本文就调节性T细胞的历史、分类、诱导免疫耐受的机制以及与肝移植免疫耐受的关系作如下综述.
核心提示: 新型免疫抑制剂的应用极大地改善了肝移植术后的短期预后, 但远期疗效有限. 诱导肝移植免疫耐受是解决这一问题最理想的方法. CD4+CD25+Foxp3+ Treg细胞可以通过多种机制参与器官移植免疫耐受的形成, 在诱导和维持肝移植免疫耐受过程中起着重要作用, 可能具有较好的临床应用前景.
引文著录: 廖晖, 杨定华. CD4+CD25+Foxp3+ Treg细胞与肝移植免疫耐受的关系. 世界华人消化杂志 2014; 22(9): 1226-1234
Revised: January 20, 2014
Accepted: February 3, 2014
Published online: March 28, 2014
Several subgroups of regulatory T (Treg) cells play crucial roles in both induction and maintenance of immune tolerance to self-antigens and alloantigens. The most extensively and comprehensively studied regulatory T cell subgroup is CD4+CD25+Foxp3+ Treg cells. Numerous studies indicate that insufficiency or dysfunction of CD4+CD25+Foxp3+ Treg cells is responsible for the development of many autoimmune diseases and rejections after organ transplantation. Therefore, harnessing CD4+CD25+Foxp3+ Treg cells may provide a promising approach for inducing and maintaining liver transplant tolerance. In this review, we will focus on the history and classification of regulatory T cells, the mechanisms by which regulatory T cells induce transplant tolerance and their roles in liver transplant tolerance.
- Citation: Liao H, Yang DH. CD4+CD25+Foxp3+ Treg cells and liver transplant tolerance. Shijie Huaren Xiaohua Zazhi 2014; 22(9): 1226-1234
- URL: https://www.wjgnet.com/1009-3079/full/v22/i9/1226.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i9.1226
对于终末期肝病来说, 肝移植(liver transplantation, LT)可能是唯一有效的方法. 在手术技术日趋成熟之后, LT排斥反应已成为影响移植物长期存活的重要因素[1]. LT术后, 需要长期乃至终生应用免疫抑制剂, 才能有效地控制排斥反应, 维持移植肝脏长期、有功能的存活. 目前, 临床上常用的免疫抑制剂均具有多种不良反应, 如糖尿病、高血压、慢性肾功能损害以及对感染和肿瘤易感性增加等[1]. 因此, 诱导LT受者产生针对供者抗原特异性的免疫耐受, 才是彻底解决LT排斥反应最理想的措施. CD4+CD25+Foxp3+ 调节性T(regulatory T, Treg)细胞约占外周血CD4+ T细胞的5%-10%, 是免疫系统中重要的调节细胞, 可以抑制自身反应性T细胞和同种反应性T细胞的功能, 他所介导的免疫调节反应是机体对自身和同种异体抗原产生免疫耐受的重要机制[2,3]. 近年来, 大量的研究发现, CD4+CD25+Foxp3+ Treg细胞在诱导和维持LT免疫耐受中起着重要的作用.
早在20世纪70年代初, 科学家就发现T细胞除了具有促进免疫反应的功能外, 还有一部分T细胞具有抑制免疫反应的作用, 这部分T细胞被称为抑制性T细胞(suppressor T cells)[4]. 当时普遍认为, 抑制性T细胞通过主要组织溶性复合体(major histocompatibility complex, MHC)基因I-J亚区编码的抗原决定簇发挥免疫抑制作用, 但后来的研究未能在MHC基因中发现I-J亚区[5,6]; 同时, 由于未能确定该细胞亚群特异性的标志, 因此对于是否存在"抑制性T细胞", 存在争议, 甚至有人在解释免疫抑制现象时, 故意回避使用"抑制性T细胞"一词[7]. 直到1995年, Sakaguchi等[8]发现, 将CD4+CD25- T细胞输入裸鼠体内, 可诱发多种自身免疫性疾病; 如果输入CD4+CD25- T细胞后, 立即输入CD4+CD25+ T细胞, 可防止自身免疫性疾病的发生; 如果输入CD4+CD25- T细胞后, 用抗原刺激裸鼠, 可引起异常强烈的免疫反应, 此时输入CD4+CD25+ T细胞, 可使免疫反应正常化. 因此, Sakaguchi等[8]认为CD4+CD25+ T细胞中包含有一群具有免疫抑制功能的T细胞亚群, 在维持机体自身免疫耐受中具有重要的作用, 后来这群细胞被称为Treg细胞. 一年后, Asano等[9]发现, 出生后第3天切除小鼠的胸腺, 会影响外周CD4+CD25+ T细胞的出现, 以及引起严重的自身免疫性疾病, 提示CD4+CD25+ T细胞来源于胸腺. 2002年Zheng等[10]报道, 人外周血中的初始T细胞(CD4+CD25-)在转化生长因子-β(transforming growth factor-β, TGF-β)的诱导下, 可转化为具有免疫抑制功能的CD4+CD25+ T细胞. 从而证明, Treg细胞还可来源于外周初始T细胞. 2003年, 日本科学家[11]和美国科学家[12]几乎在同一时间发现转录因子Foxp3特异性表达于CD4+CD25+ T细胞, 将Foxp3基因导入CD4+CD25- T细胞中, 可以使其获得Treg细胞表型, 在体内、体外均具有免疫抑制作用, 从而确立了Foxp3在调控Treg细胞分化发育和维持其免疫抑制功能中的重要地位[13]. Foxp3是迄今为止, Treg细胞最具有特异性的标志物, 他的出现极大地推动了Treg细胞的研究进展.
回顾Treg细胞的研究历史, 可以发现免疫学家在解释T细胞介导的免疫抑制现象时, 会把"抑制性T细胞"与"调节性T细胞"这两个词, 相互替换使用. 起初"抑制性T细胞"的使用频率远远高于"调节性T细胞", 但是在20世纪80年代末至90年代初期, 由于不少免疫学家对于是否存在抑制性T细胞持怀疑态度, 因此回避使用"抑制性T细胞"一词, 而倾向于使用"调节性T细胞"[14]. 故"调节性T细胞"一直沿用至今.
Asano等[9]发现正常小鼠出生后, 外周淋巴组织中无CD4+CD25+ T细胞, 3 d后, 外周淋巴组织才开始出现CD4+CD25+ T细胞, 2 wk内达到成年水平(约占CD4+ T细胞的5%-10%). 如果出生后第3天切除小鼠的胸腺, 外周淋巴组织出现CD4+CD25+ T细胞的时间, 将延迟至出生后的第10天, 成年后CD4+CD25+ T细胞明显低于正常小鼠[9]. 这说明小鼠出生后第3-10天, 外周淋巴组织中出现的CD4+CD25+ T细胞来自胸腺, 现在被称为天然调节性T细胞(natural Treg cells, nTreg). 出生后第3天切除胸腺的小鼠延迟出现的CD4+CD25+ T细胞来自何处呢?Asano等[9]将Thy-1.1+ CD4+CD25- T细胞注入出生后第3天切除胸腺的小鼠(Thy-1.1-), 一段时间后在外周淋巴组织中可检测到Thy-1.1+ CD4+CD25+ T细胞. 说明CD4+CD25- T细胞在外周淋巴组织中可以转化为CD4+CD25+ T细胞, 遗憾的是作者没有检测这群CD4+CD25+ T细胞是否具有免疫抑制功能, 因此并没有证明CD4+CD25- T细胞可以转化为Treg细胞. 因为有研究表明CD4+CD25- T细胞活化后也可以上调CD25分子, 成为CD4+CD25+ 效应性T细胞, 但不具有免疫抑制功能[2,15]. 之后, 有研究发现初始T细胞(CD4+CD25-)在TGF-β诱导下, 可上调CD25分子, 表达Foxp3, 转化为具有免疫抑制功能的CD4+CD25+ T细胞[10,16]. 现在, 由初始T细胞转化而来的具有免疫抑制功能的T细胞被称为诱导性调节性T细胞(induced Treg cells, iTreg). 因此, Treg细胞除了来源于胸腺外, 还可以来源于外周初始T细胞.
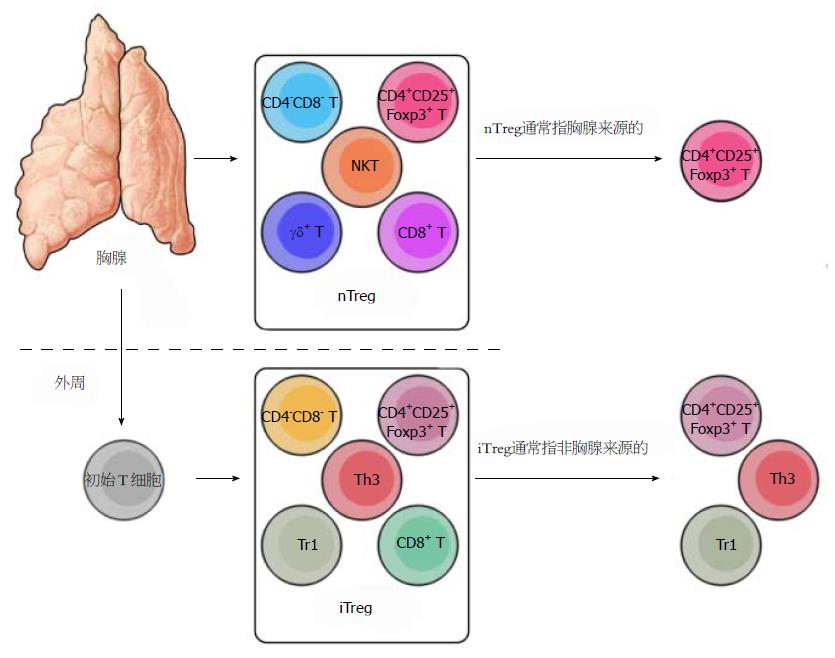
由此可见, Treg细胞不是均一的细胞群, 包含有不同的亚群(图1). 根据来源不同, Treg细胞可大致分为nTreg和iTreg细胞[17]. nTreg细胞指来源于胸腺, 具有免疫抑制功能的T细胞. 根据表面标志物的不同, nTreg细胞可进一步分为CD4+CD25+Foxp3+ nTreg细胞、CD8+ nTreg细胞、CD4-CD8- nTreg细胞、γδ+nTreg细胞和NKT细胞. 一般情况下, nTreg细胞指胸腺来源的CD4+CD25+Foxp3+ T细胞. iTreg细胞指初始T细胞在不同的细胞因子的作用下转化而来的具有免疫抑制功能的T细胞, 主要包括CD4+CD25+Foxp3+ iTreg细胞、Tr1细胞、Th3细胞、CD8+ iTreg细胞和CD4-CD8- iTreg细胞. 一般情况下iTreg细胞指前三者. 在此特别说明, 以下所提及的"nTreg细胞"特指胸腺来源的CD4+CD25+Foxp3+ Treg细胞, "iTreg细胞"特指由初始T细胞转化而来的CD4+CD25+Foxp3+ Treg细胞.
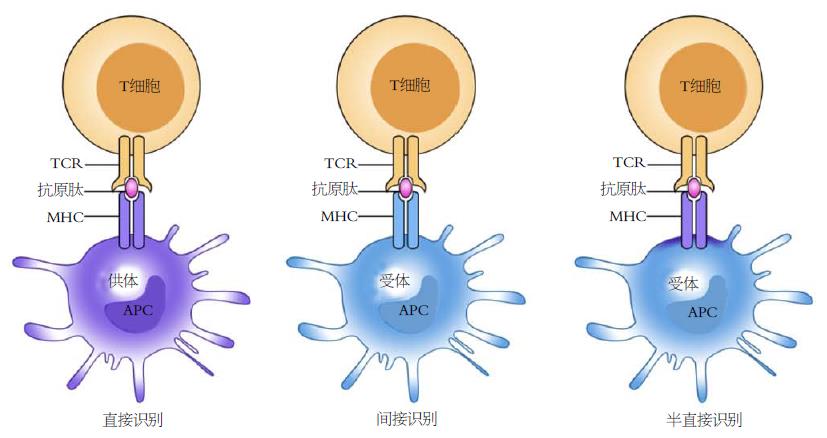
在器官移植术中, 由于供受体遗传背景不同, 受体的免疫系统可以识别移植物中的抗原并产生免疫应答, 同时移植物中残留的免疫细胞也可以识别受体组织中的抗原并产生免疫应答, 此为移植排斥反应. 前者被称为宿主抗移植物反应, 主要包括超急性排斥反应、急性排斥反应和慢性排斥反应; 后者被称为移植物抗宿主反应. 现已证明多种免疫细胞可参与排斥反应, 但是CD4+ T细胞和CD8+ T细胞是参与同种异体排斥反应的主要效应细胞[18,19]. T细胞可以通过3种方式识别同种异体抗原, 分别为直接识别、间接识别和半直接识别, 如图2所示. 直接识别是指移植物中的抗原提呈细胞(antigen-presenting cells, APC)将其表面的MHC-抗原肽复合物直接递呈给受体的同种反应性T细胞; 间接识别是指供体抗原经过受体APC处理、加工后, 以受体MHCⅡ类分子-供体抗原肽复合物的形式递呈给受体CD4+同种反应性T细胞; 半直接识别是指供体APC与受体APC进行细胞膜片段交换时, 有可能将MHC-抗原肽复合物交换至对方, 最后由受体APC将供体的MHC-抗原肽复合物递呈给受体同种反应性T细胞[18,19]. 同种反应性T细胞识别同种异体抗原后(第一信号)还需要CD28分子提供的第二信号才能被激活[19]. 第二信号可以降低同种反应性T细胞的活化阈值, 促进白介素-2(interleukin-2, IL-2)的分泌, 而IL-2(第三信号)又可以促进同种反应性T细胞活化、增殖和预防活化诱导的细胞凋亡[19]. 因此. 移植排斥反应从本质上来说是一种免疫反应.
首先, Treg细胞可以通过APC抑制同种反应性T细胞的活化、增殖和功能. Treg细胞持续性高表达CTLA-4(CD152), CTLA-4与B7的亲和力是CD28分子的20倍, 可与初始T细胞表面的CD28分子竞争性地结合APC表面的B7分子, 从而减弱甚至阻断T细胞活化的信号[20]. CTLA-4与B7分子结合后还可以诱导APC表达吲哚胺2,3双加氧酶(indoleamine 2,3-dioxygenase, IDO), 促进色氨酸的分解代谢, 从而抑制T细胞的增殖或诱导其凋亡[21]. 因此, CTLA-4在诱导移植免疫耐受中具有重要的作用[22,23]. Treg细胞还表达淋巴细胞活化基因-3, 可与MHCⅡ类分子以高亲和力结合, 向APC内传导抑制性信号, 抑制APC的成熟[24,25]. Treg细胞的某些表面分子, 如淋巴细胞功能相关抗原和神经菌毛素(neuropilin-1)的表达水平也高于初始T细胞, 可促进Treg细胞与APC结合[26,27].
其次, Treg细胞可通过分泌TGF-β、IL-10和IL-35等细胞因子抑制排斥反应. 虽然体外实验证明Treg是通过细胞间的接触而发挥免疫抑制作用, 不依赖细胞因子, 但体内实验却证实Treg细胞还可以通过分泌细胞因子, 发挥免疫抑制作用[28]. Treg细胞分泌的TGF-β, 除了可以直接抑制效应性T细胞的增殖和功能外[29,30], 还可以通过诱导APC表达IDO和Foxp3+Treg细胞参与器官移植免疫耐受的形成[31,32]. Treg细胞还可分泌IL-10, 阻断IL-10信号通路可以终止Treg细胞诱导的小鼠皮肤移植免疫耐受[22]. 供体来源的Treg细胞分泌的IL-10在控制骨髓移植后移植物抗宿主病中具有重要作用[33]. 最近有研究发现, Treg细胞还可分泌IL-35, 并且在体外实验中证明IL-35是Treg细胞发挥非细胞接触性免疫抑制作用的重要因子[22,34].
还有, Treg细胞可以通过改变周围的微环境抑制排斥反应. Treg细胞持续表达高亲和力的IL-2受体(CD25-CD122-CD132三聚体), 可大量消耗周围环境中效应性T细胞赖于生存的IL-2, 从而诱导效应性T细胞发生凋亡[35]. Treg细胞还高表达胞外水解酶CD39和CD73, CD39可以将ATP水解成AMP, AMP又可以被CD73水解成腺苷[36]. 一方面可消耗T细胞活化所需的能量(ATP)[37]; 另一方面产生的腺苷还可激活效应性T细胞表面的腺苷受体2A, 不仅可以抑制T细胞的增殖, 还可以抑制IL-6的表达以及促进TGF-β的分泌, 有利于iTreg细胞的形成[36,38,39]. CD39缺陷的Treg细胞诱导小鼠皮肤移植免疫耐受的能力明显低于正常Treg细胞[36].
再有, Treg细胞可以通过穿孔素(perforin)[40]、颗粒酶(granzyme)[41]、凋亡诱导配体受体DR5[42]、半乳凝素(galectin-1)[43]和γ干扰素[44]等直接杀伤效应性T细胞. 此外, Treg细胞还可以通过传染性免疫耐受(infectious tolerance)诱导更多的初始T细胞转变为具有免疫抑制功能的T细胞[45,46].
早在1975年, 就有科学家提出抑制性T细胞(Treg细胞)可以诱导小鼠同种异体皮肤移植免疫耐受[47]. 现已证实, Treg细胞在诱导和维持同种异体器官移植免疫耐受中具有重要作用[48]. 有关Treg细胞与LT免疫耐受的文献最早见于1984年, Myburgh等[49]利用全身淋巴照射(total lymphoid irradiation, TLI)的方法成功地诱导了狒狒同种异体LT免疫耐受, 作者推测移植物长期存活的原因可能是TLI可以促进受体抑制性T细胞增殖. 这一推测之后被Fujiki等证实. Fujiki等[50]发现, TLI可以显著延长大鼠同种异体LT(DA→Lewis)受体的生存时间(>100 d), 照射组移植肝(未被照射)内CD4+和CD8+ T细胞凋亡的数量以及Treg细胞的数量明显高于未照射组. 提示TLI可以通过促进效应性T细胞凋亡和Treg细胞形成来诱导和维持LT免疫耐受. 目前, 诱导LT免疫耐受的方法有很多, 研究表明这些方法或多或少都与Treg细胞有关. Sato等[51]报道, 反复、多次从门静脉输入供体来源的血液可明显减少活体LT术后急性排斥反应的发生率, 并且可以迅速减少免疫抑制剂的用量, 主要的机制包括促进Treg细胞的形成和诱导移植肝脏形成大嵌合体. Abe等[52]在大鼠LT模型中也发现, 供体特异性输血可以通过促进Treg细胞形成来诱导LT免疫耐受. 近年来, 雷帕鸣与其他诱导免疫耐受的方法(如未成熟树突状细胞)联合应用取得了较好的实验结果, 已成为诱导移植免疫耐受领域的研究热点[53,54]. 其中非常重要的原因是, 与其他免疫抑制剂(如糖皮质激素、他克莫司和环孢素A等)相比, 雷帕鸣可以促进Treg细胞的形成, 并且维持其功能稳定[55]. 肝星状细胞(hepatic stellate cells, HSCs)[56]、间充质干细胞(mesenchymal stem cells, MSCs)[57]以及供体来源的凋亡淋巴细胞[58], 最近也被认为与LT免疫耐受有关, 研究表明这些细胞诱导LT免疫耐受的机制也与其能够诱导Treg细胞形成有关.
Treg细胞在诱导和维持自发性免疫耐受中具有重要的作用. Li等[59]发现, 小鼠LT自发性免疫耐受组(C57BL/10→C3H/HeJ), 移植肝和脾脏中Treg细胞的比例(CD4+CD25+ T/T)明显高于对照组, 术前或术后用CD25抗体清除受体CD4+CD25+ T细胞, 可引发急性排斥反应. 还有研究报道, Th17/Treg细胞功能失调与LT免疫耐受和急性排斥反应有关. 大鼠LT自发性免疫耐受组(BN→Lewis)中Th17细胞相关的细胞因子(IL-17、IL-6和IL-23)和转录因子(RORγt)表达水平明显低于排斥组(Lewis→BN), 而Treg细胞相关的细胞因子(IL-10和TGF-β)和转录因子(Foxp3)则明显高于排斥组[60]; 排斥反应组的情况正好相反, 并且IL-17、IL-6、IL-23、RORγt的表达水平与排斥反应的严重程度呈正相关, 而IL-10、TGF-β和Foxp3的表达水平与排斥反应的严重程度呈负相关[60]. 最近, Zhang等[61]在大鼠LT急性排斥反应模型中也发现, 排斥反应与受体外周血中Treg细胞下降有关.
Pu等[62]对nTreg细胞诱导大鼠LT(DA→Lewis)免疫耐受的能力进行了直接地研究. 作者分别于LT术后第1天和第7天从阴茎背静脉输入1×106 nTreg细胞, 发现未作任何治疗的大鼠平均生存时间为12 d; 短期服用他克莫司[0.1 mg/(kg·d), 术后1-7 d]的大鼠平均生存时间为28 d; 输注新鲜nTreg细胞的大鼠平均生存时间为22 d; 输注第三方(BN)抗原刺激过的nTreg细胞的大鼠平均生存时间为18 d; 输注供体抗原刺激过的nTreg细胞的大鼠平均生存时间为28 d; 而短期服用他克莫司+输注供体抗原刺激过的nTreg细胞的大鼠生存时间均超过60 d[62]. 上述结果充分说明Treg细胞确实可延长移植肝的存活时间, 但效果并不优于短期小剂量应用他克莫司, 似乎提示Treg细胞诱导LT免疫耐受的能力非常有限. 但作者并不这样认为, 因为有研究表明nTreg细胞在炎性环境中不稳定, 容易丢失Foxp3, 失去免疫抑制功能, 甚至转化为炎性细胞[63], 而iTreg细胞在炎性环境中却表现的较稳定[64]. 最近, Feng等[65]在小鼠缺血再灌注模型中也证实iTreg细胞比nTreg细胞更稳定. 因此, 利用iTreg细胞诱导LT免疫耐受可能会取得更好的效果. 另外, Pu等[62]的研究发现短期服用他克莫司+输注Treg细胞可以显著延长移植肝的存活时间. 但有研究表明, 他克莫司不利于Treg细胞的生长和发育[66]. 而在Pu等的研究中他克莫司+输注Treg细胞却取得了"1+1>2"的效果. 可能的解释是, LT术后他克莫司可以抑制排斥反应, 减轻Treg细胞所处环境中的炎症程度, 更有利Treg细胞的存活和作用的发挥, 故而产生协同作用. 与他克莫司相反, 目前大量的研究表明, 雷帕鸣不仅可以选择性地扩增nTreg细胞, 增强其免疫抑制功能和稳定其表型(即使在炎性环境中)[63,67-69], 还可以促进iTreg细胞生成[70,71]. 据此, 我们推测联合应用雷帕鸣与输注iTreg细胞可能在诱导和维持LT免疫耐受方面具有更好的应用前景.
Treg细胞可以通过多种机制抑制器官移植排斥反应, 在诱导和维持同种异体LT免疫耐受中具有重要的作用. 目前需解决的问题有: (1)在排斥反应LT模型中进一步确定Treg细胞作用的大小, 直接比较nTreg与iTreg细胞的疗效以及明确Treg细胞疗法是否优于免疫抑制剂; (2)优化iTreg细胞的诱导方案或nTreg细胞的扩增方案, 以便获得功能强大、表型稳定的Treg细胞; (3)目前, LT术后彻底放弃使用免疫抑制剂是不切实际的想法, 较为可行的方案是短期或小剂量应用免疫抑制剂+Treg细胞疗法, 因此, 有必要明确各种免疫抑制剂对Treg细胞的影响.
肝移植(liver transplantation, LT)是目前治疗终未期肝病最有效的方法. 但移植术后长期乃至终生应用免疫抑制剂, 不仅会加重患者的经济负担, 而且免疫抑制剂本身的不良反应也会严重地影响移植受者的生存质量. 因此, 如何诱导LT受者产生免疫耐受一直以来都是LT研究领域的一大热点.
何晓顺, 教授, 中山大学附属第一医院
CD4+CD25+Foxp3+ 调节性T(regulatory T, Treg)细胞是外周免疫耐受机制的重要组成部分. 他可以抑制自身反应性T淋巴细胞和同种反应性T淋巴细胞的功能, 是机体对自身和同种异体抗原产生免疫耐受的重要机制. 目前, CD4+CD25+Foxp3+ Treg细胞在诱导实体器官移植(如LT)免疫耐受方面的研究, 主要处于动物实验阶段.
CD4+CD25+Foxp3+细胞在骨髓移植中的应用已进入了临床研究阶段, 得出的结论是Treg细胞可以促进宿主免疫系统重建, 降低移植物抗宿主病的发生率和肿瘤的复发, 是安全有效的.
本文重点阐述了CD4+CD25+Foxp3+ Treg细胞参与器官移植免疫耐受的机制及其对动物LT免疫排斥反应的影响. 此外, 文章还深入浅出地阐述了Treg细胞的研究历史和分类.
成功地诱导和维持肝移植免疫耐受可以减轻患者的经济负担, 降低甚至消除免疫抑制剂对移植受者生存质量的影响. 目前, Treg细胞在骨髓移植研究中显现出了迷人的临床应用前景. 如果能够通过Treg细胞成功地诱导并维持肝移植免疫耐受, 可以带来巨大的经济和社会效益.
本文综述了目前国内外Treg细胞在诱导和维持肝移植免疫耐受的研究进展, 对于Treg细胞疗法在肝移植领域的应用有一定的参考价值.
编辑: 田滢 电编: 鲁亚静
| 1. | Lim KB, Schiano TD. Long-term outcome after liver transplantation. Mt Sinai J Med. 2012;79:169-189. [PubMed] [DOI] |
| 2. | Suri-Payer E, Amar AZ, Thornton AM, Shevach EM. CD4+CD25+ T cells inhibit both the induction and effector function of autoreactive T cells and represent a unique lineage of immunoregulatory cells. J Immunol. 1998;160:1212-1218. [PubMed] |
| 3. | Issa F, Robb RJ, Wood KJ. The where and when of T cell regulation in transplantation. Trends Immunol. 2013;34:107-113. [PubMed] [DOI] |
| 4. | Gershon RK, Cohen P, Hencin R, Liebhaber SA. Suppressor T cells. J Immunol. 1972;108:586-590. [PubMed] |
| 5. | Kronenberg M, Steinmetz M, Kobori J, Kraig E, Kapp JA, Pierce CW, Sorensen CM, Suzuki G, Tada T, Hood L. RNA transcripts for I-J polypeptides are apparently not encoded between the I-A and I-E subregions of the murine major histocompatibility complex. Proc Natl Acad Sci USA. 1983;80:5704-5708. [PubMed] [DOI] |
| 6. | Volpé R. Suppressor T lymphocyte dysfunction is important in the pathogenesis of autoimmune thyroid disease: a perspective. Thyroid. 1993;3:345-352. [PubMed] [DOI] |
| 7. | Bloom BR, Salgame P, Diamond B. Revisiting and revising suppressor T cells. Immunol Today. 1992;13:131-136. [PubMed] [DOI] |
| 8. | Sakaguchi S, Sakaguchi N, Asano M, Itoh M, Toda M. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. J Immunol. 1995;155:1151-1164. [PubMed] |
| 9. | Asano M, Toda M, Sakaguchi N, Sakaguchi S. Autoimmune disease as a consequence of developmental abnormality of a T cell subpopulation. J Exp Med. 1996;184:387-396. [PubMed] [DOI] |
| 10. | Zheng SG, Gray JD, Ohtsuka K, Yamagiwa S, Horwitz DA. Generation ex vivo of TGF-beta-producing regulatory T cells from CD4+CD25- precursors. J Immunol. 2002;169:4183-4189. [PubMed] |
| 11. | Hori S, Nomura T, Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3. Science. 2003;299:1057-1061. [PubMed] [DOI] |
| 12. | Fontenot JD, Gavin MA, Rudensky AY. Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nat Immunol. 2003;4:330-336. [PubMed] [DOI] |
| 13. | Gao Y, Lin F, Su J, Gao Z, Li Y, Yang J, Deng Z, Liu B, Tsun A, Li B. Molecular mechanisms underlying the regulation and functional plasticity of FOXP3(+) regulatory T cells. Genes Immun. 2012;13:1-13. [PubMed] [DOI] |
| 14. | Beissert S, Schwarz A, Schwarz T. Regulatory T cells. J Invest Dermatol. 2006;126:15-24. [PubMed] [DOI] |
| 15. | Itoh M, Takahashi T, Sakaguchi N, Kuniyasu Y, Shimizu J, Otsuka F, Sakaguchi S. Thymus and autoimmunity: production of CD25+CD4+ naturally anergic and suppressive T cells as a key function of the thymus in maintaining immunologic self-tolerance. J Immunol. 1999;162:5317-5326. [PubMed] |
| 16. | Fu S, Zhang N, Yopp AC, Chen D, Mao M, Chen D, Zhang H, Ding Y, Bromberg JS. TGF-beta induces Foxp3 + T-regulatory cells from CD4 + CD25 - precursors. Am J Transplant. 2004;4:1614-1627. [PubMed] [DOI] |
| 17. | Shalev I, Schmelzle M, Robson SC, Levy G. Making sense of regulatory T cell suppressive function. Semin Immunol. 2011;23:282-292. [PubMed] [DOI] |
| 18. | Sagoo P, Lombardi G, Lechler RI. Relevance of regulatory T cell promotion of donor-specific tolerance in solid organ transplantation. Front Immunol. 2012;3:184. [PubMed] [DOI] |
| 19. | Wood KJ, Goto R. Mechanisms of rejection: current perspectives. Transplantation. 2012;93:1-10. [PubMed] [DOI] |
| 20. | Wing K, Onishi Y, Prieto-Martin P, Yamaguchi T, Miyara M, Fehervari Z, Nomura T, Sakaguchi S. CTLA-4 control over Foxp3+ regulatory T cell function. Science. 2008;322:271-275. [PubMed] [DOI] |
| 21. | Wing K, Yamaguchi T, Sakaguchi S. Cell-autonomous and -non-autonomous roles of CTLA-4 in immune regulation. Trends Immunol. 2011;32:428-433. [PubMed] [DOI] |
| 22. | Kingsley CI, Karim M, Bushell AR, Wood KJ. CD25+CD4+ regulatory T cells prevent graft rejection: CTLA-4- and IL-10-dependent immunoregulation of alloresponses. J Immunol. 2002;168:1080-1086. [PubMed] |
| 23. | Zhang T, Fresnay S, Welty E, Sangrampurkar N, Rybak E, Zhou H, Cheng XF, Feng Q, Avon C, Laaris A. Selective CD28 blockade attenuates acute and chronic rejection of murine cardiac allografts in a CTLA-4-dependent manner. Am J Transplant. 2011;11:1599-1609. [PubMed] [DOI] |
| 24. | Bayry J, Triebel F, Kaveri SV, Tough DF. Human dendritic cells acquire a semimature phenotype and lymph node homing potential through interaction with CD4+CD25+ regulatory T cells. J Immunol. 2007;178:4184-4193. [PubMed] |
| 25. | Liang B, Workman C, Lee J, Chew C, Dale BM, Colonna L, Flores M, Li N, Schweighoffer E, Greenberg S. Regulatory T cells inhibit dendritic cells by lymphocyte activation gene-3 engagement of MHC class II. J Immunol. 2008;180:5916-5926. [PubMed] |
| 26. | Onishi Y, Fehervari Z, Yamaguchi T, Sakaguchi S. Foxp3+ natural regulatory T cells preferentially form aggregates on dendritic cells in vitro and actively inhibit their maturation. Proc Natl Acad Sci USA. 2008;105:10113-10118. [PubMed] [DOI] |
| 27. | Sarris M, Andersen KG, Randow F, Mayr L, Betz AG. Neuropilin-1 expression on regulatory T cells enhances their interactions with dendritic cells during antigen recognition. Immunity. 2008;28:402-413. [PubMed] [DOI] |
| 28. | Sakaguchi S, Wing K, Yamaguchi T. Dynamics of peripheral tolerance and immune regulation mediated by Treg. Eur J Immunol. 2009;39:2331-2336. [PubMed] [DOI] |
| 29. | Green EA, Gorelik L, McGregor CM, Tran EH, Flavell RA. CD4+CD25+ T regulatory cells control anti-islet CD8+ T cells through TGF-beta-TGF-beta receptor interactions in type 1 diabetes. Proc Natl Acad Sci USA. 2003;100:10878-10883. [PubMed] [DOI] |
| 30. | Li MO, Wan YY, Sanjabi S, Robertson AK, Flavell RA. Transforming growth factor-beta regulation of immune responses. Annu Rev Immunol. 2006;24:99-146. [PubMed] [DOI] |
| 31. | Pallotta MT, Orabona C, Volpi C, Vacca C, Belladonna ML, Bianchi R, Servillo G, Brunacci C, Calvitti M, Bicciato S. Indoleamine 2,3-dioxygenase is a signaling protein in long-term tolerance by dendritic cells. Nat Immunol. 2011;12:870-878. [PubMed] [DOI] |
| 32. | Regateiro FS, Howie D, Cobbold SP, Waldmann H. TGF-β in transplantation tolerance. Curr Opin Immunol. 2011;23:660-669. [PubMed] [DOI] |
| 33. | Tawara I, Sun Y, Liu C, Toubai T, Nieves E, Evers R, Alrubaie M, Mathewson N, Tamaki H, Reddy P. Donor- but not host-derived interleukin-10 contributes to the regulation of experimental graft-versus-host disease. J Leukoc Biol. 2012;91:667-675. [PubMed] [DOI] |
| 34. | Chaturvedi V, Collison LW, Guy CS, Workman CJ, Vignali DA. Cutting edge: Human regulatory T cells require IL-35 to mediate suppression and infectious tolerance. J Immunol. 2011;186:6661-6666. [PubMed] [DOI] |
| 35. | Pandiyan P, Zheng L, Ishihara S, Reed J, Lenardo MJ. CD4+CD25+Foxp3+ regulatory T cells induce cytokine deprivation-mediated apoptosis of effector CD4+ T cells. Nat Immunol. 2007;8:1353-1362. [PubMed] [DOI] |
| 36. | Deaglio S, Dwyer KM, Gao W, Friedman D, Usheva A, Erat A, Chen JF, Enjyoji K, Linden J, Oukka M. Adenosine generation catalyzed by CD39 and CD73 expressed on regulatory T cells mediates immune suppression. J Exp Med. 2007;204:1257-1265. [PubMed] [DOI] |
| 37. | Yip L, Woehrle T, Corriden R, Hirsh M, Chen Y, Inoue Y, Ferrari V, Insel PA, Junger WG. Autocrine regulation of T-cell activation by ATP release and P2X7 receptors. FASEB J. 2009;23:1685-1693. [PubMed] [DOI] |
| 38. | Zarek PE, Huang CT, Lutz ER, Kowalski J, Horton MR, Linden J, Drake CG, Powell JD. A2A receptor signaling promotes peripheral tolerance by inducing T-cell anergy and the generation of adaptive regulatory T cells. Blood. 2008;111:251-259. [PubMed] [DOI] |
| 39. | Han KL, Thomas SV, Koontz SM, Changpriroa CM, Ha SK, Malech HL, Kang EM. Adenosine A₂A receptor agonist-mediated increase in donor-derived regulatory T cells suppresses development of graft-versus-host disease. J Immunol. 2013;190:458-468. [PubMed] [DOI] |
| 40. | Czystowska M, Strauss L, Bergmann C, Szajnik M, Rabinowich H, Whiteside TL. Reciprocal granzyme/perforin-mediated death of human regulatory and responder T cells is regulated by interleukin-2 (IL-2). J Mol Med (Berl). 2010;88:577-588. [PubMed] [DOI] |
| 41. | Kubach J, Lutter P, Bopp T, Stoll S, Becker C, Huter E, Richter C, Weingarten P, Warger T, Knop J. Human CD4+CD25+ regulatory T cells: proteome analysis identifies galectin-10 as a novel marker essential for their anergy and suppressive function. Blood. 2007;110:1550-1558. [PubMed] [DOI] |
| 42. | Ren X, Ye F, Jiang Z, Chu Y, Xiong S, Wang Y. Involvement of cellular death in TRAIL/DR5-dependent suppression induced by CD4(+)CD25(+) regulatory T cells. Cell Death Differ. 2007;14:2076-2084. [PubMed] [DOI] |
| 43. | Garín MI, Chu CC, Golshayan D, Cernuda-Morollón E, Wait R, Lechler RI. Galectin-1: a key effector of regulation mediated by CD4+CD25+ T cells. Blood. 2007;109:2058-2065. [PubMed] [DOI] |
| 44. | Koenecke C, Lee CW, Thamm K, Föhse L, Schafferus M, Mittrücker HW, Floess S, Huehn J, Ganser A, Förster R. IFN-γ production by allogeneic Foxp3+ regulatory T cells is essential for preventing experimental graft-versus-host disease. J Immunol. 2012;189:2890-2896. [PubMed] [DOI] |
| 45. | Zheng SG, Wang JH, Gray JD, Soucier H, Horwitz DA. Natural and induced CD4+CD25+ cells educate CD4+CD25- cells to develop suppressive activity: the role of IL-2, TGF-beta, and IL-10. J Immunol. 2004;172:5213-5221. [PubMed] |
| 46. | Gravano DM, Vignali DA. The battle against immunopathology: infectious tolerance mediated by regulatory T cells. Cell Mol Life Sci. 2012;69:1997-2008. [PubMed] [DOI] |
| 47. | Kilshaw PJ, Brent L, Pinto M. Suppressor T cells in mice made unresponsive to skin allografts. Nature. 1975;255:489-491. [PubMed] |
| 48. | Shalev I, Selzner N, Shyu W, Grant D, Levy G. Role of regulatory T cells in the promotion of transplant tolerance. Liver Transpl. 2012;18:761-770. [PubMed] [DOI] |
| 49. | Myburgh JA, Smit JA, Stark JH, Browde S. Total lymphoid irradiation in kidney and liver transplantation in the baboon: prolonged graft survival and alterations in T cell subsets with low cumulative dose regimens. J Immunol. 1984;132:1019-1025. [PubMed] |
| 50. | Fujiki M, Esquivel CO, Martinez OM, Strober S, Uemoto S, Krams SM. Induced tolerance to rat liver allografts involves the apoptosis of intragraft T cells and the generation of CD4(+)CD25(+)FoxP3(+) T regulatory cells. Liver Transpl. 2010;16:147-154. [PubMed] [DOI] |
| 51. | Sato Y, Chikako T, Oya H, Yamamoto S, Kokai H, Miura K, Hatakeyama K. Regulatory T-cell activation among patients who displayed operational tolerance following intra-portal administration of donor-specific antigens in living donor liver transplantation. Transplant Proc. 2012;44:560-564. [PubMed] [DOI] |
| 52. | Abe Y, Urakami H, Ostanin D, Zibari G, Hayashida T, Kitagawa Y, Grisham MB. Induction of Foxp3-expressing regulatory T-cells by donor blood transfusion is required for tolerance to rat liver allografts. PLoS One. 2009;4:e7840. [PubMed] [DOI] |
| 53. | Li X, Li JJ, Yang JY, Wang DS, Zhao W, Song WJ, Li WM, Wang JF, Han W, Zhang ZC. Tolerance induction by exosomes from immature dendritic cells and rapamycin in a mouse cardiac allograft model. PLoS One. 2012;7:e44045. [PubMed] [DOI] |
| 54. | Wang GY, Yang Y, Li H, Zhang J, Li MR, Zhang Q, Chen GH. Rapamycin combined with donor immature dendritic cells promotes liver allograft survival in association with CD4(+) CD25(+) Foxp3(+) regulatory T cell expansion. Hepatol Res. 2012;42:192-202. [PubMed] [DOI] |
| 55. | Lu L, Qian XF, Rao JH, Wang XH, Zheng SG, Zhang F. Rapamycin promotes the expansion of CD4(+) Foxp3(+) regulatory T cells after liver transplantation. Transplant Proc. 2010;42:1755-1757. [PubMed] [DOI] |
| 56. | Jiang G, Yang HR, Wang L, Wildey GM, Fung J, Qian S, Lu L. Hepatic stellate cells preferentially expand allogeneic CD4+ CD25+ FoxP3+ regulatory T cells in an IL-2-dependent manner. Transplantation. 2008;86:1492-1502. [PubMed] [DOI] |
| 57. | Xia X, Chen W, Ma T, Xu G, Liu H, Liang C, Bai X, Zhang Y, He Y, Liang T. Mesenchymal stem cells administered after liver transplantation prevent acute graft-versus-host disease in rats. Liver Transpl. 2012;18:696-706. [PubMed] [DOI] |
| 58. | Cheng J, Zhou L, Qin YS, Wang Y, Xie HY, Feng XW, Zheng SS. Donor apoptotic lymphocyte transfusion-induced liver allograft tolerance by up-regulation of CD4(+)CD25(+) regulatory T cells in peripheral blood. Transplant Proc. 2009;41:3893-3897. [PubMed] [DOI] |
| 59. | Li W, Kuhr CS, Zheng XX, Carper K, Thomson AW, Reyes JD, Perkins JD. New insights into mechanisms of spontaneous liver transplant tolerance: the role of Foxp3-expressing CD25+CD4+ regulatory T cells. Am J Transplant. 2008;8:1639-1651. [PubMed] [DOI] |
| 60. | Li J, Lai X, Liao W, He Y, Liu Y, Gong J. The dynamic changes of Th17/Treg cytokines in rat liver transplant rejection and tolerance. Int Immunopharmacol. 2011;11:962-967. [PubMed] [DOI] |
| 61. | Zhang Y, Zhao H, Bo L, Yang Y, Lu X, Sun J, Wen J, He X, Yin G. Total body irradiation of donors can alter the course of tolerance and induce acute rejection in a spontaneous tolerance rat liver transplantation model. Sci China Life Sci. 2012;55:774-781. [PubMed] [DOI] |
| 62. | Pu LY, Wang XH, Zhang F, Li XC, Yao AH, Yu Y, Lv L, Li GQ. Adoptive transfusion of ex vivo donor alloantigen-stimulated CD4(+)CD25(+) regulatory T cells ameliorates rejection of DA-to-Lewis rat liver transplantation. Surgery. 2007;142:67-73. [PubMed] [DOI] |
| 63. | Yurchenko E, Shio MT, Huang TC, Da Silva Martins M, Szyf M, Levings MK, Olivier M, Piccirillo CA. Inflammation-driven reprogramming of CD4+ Foxp3+ regulatory T cells into pathogenic Th1/Th17 T effectors is abrogated by mTOR inhibition in vivo. PLoS One. 2012;7:e35572. [PubMed] [DOI] |
| 64. | Lan Q, Fan H, Quesniaux V, Ryffel B, Liu Z, Zheng SG. Induced Foxp3(+) regulatory T cells: a potential new weapon to treat autoimmune and inflammatory diseases? J Mol Cell Biol. 2012;4:22-28. [PubMed] [DOI] |
| 65. | Feng M, Wang Q, Zhang F, Lu L. Ex vivo induced regulatory T cells regulate inflammatory response of Kupffer cells by TGF-beta and attenuate liver ischemia reperfusion injury. Int Immunopharmacol. 2012;12:189-196. [PubMed] [DOI] |
| 66. | Levitsky J, Mathew JM, Abecassis M, Tambur A, Leventhal J, Chandrasekaran D, Herrera N, Al-Saden P, Gallon L, Abdul-Nabi A. Systemic immunoregulatory and proteogenomic effects of tacrolimus to sirolimus conversion in liver transplant recipients. Hepatology. 2013;57:239-248. [PubMed] [DOI] |
| 67. | Zeiser R, Leveson-Gower DB, Zambricki EA, Kambham N, Beilhack A, Loh J, Hou JZ, Negrin RS. Differential impact of mammalian target of rapamycin inhibition on CD4+CD25+Foxp3+ regulatory T cells compared with conventional CD4+ T cells. Blood. 2008;111:453-462. [PubMed] [DOI] |
| 68. | Tresoldi E, Dell'Albani I, Stabilini A, Jofra T, Valle A, Gagliani N, Bondanza A, Roncarolo MG, Battaglia M. Stability of human rapamycin-expanded CD4+CD25+ T regulatory cells. Haematologica. 2011;96:1357-1365. [PubMed] [DOI] |
| 69. | Hester J, Schiopu A, Nadig SN, Wood KJ. Low-dose rapamycin treatment increases the ability of human regulatory T cells to inhibit transplant arteriosclerosis in vivo. Am J Transplant. 2012;12:2008-2016. [PubMed] [DOI] |
| 70. | Sauer S, Bruno L, Hertweck A, Finlay D, Leleu M, Spivakov M, Knight ZA, Cobb BS, Cantrell D, O'Connor E. T cell receptor signaling controls Foxp3 expression via PI3K, Akt, and mTOR. Proc Natl Acad Sci USA. 2008;105:7797-7802. [PubMed] [DOI] |