修回日期: 2014-01-22
接受日期: 2014-02-03
在线出版日期: 2014-03-28
目的: 探讨两种不同肠内营养(enteral nutrition, EN)制剂对小鼠肝切除术后肝脏再生及其结构功能的影响.
方法: 建立小鼠70%肝切除术后口服EN模型, ♂ICR小鼠72只随机均分为70%肝切除对照组(术后常规饮食)、EN混悬液TP-MCT组(70%肝切除后选用TP-MCT喂养)、EN混悬液SP组(70%肝切除后选用SP喂养). 检测术后1、3、7 d肝功能指标, 肝再生情况和残肝组织病理学改变及相关炎性因子的情况.
结果: 与对照组相比, SP组及TP-MCT组术后1、3、7 d外周血中谷丙转氨酶、谷草转氨酶有所降低, 差异有统计学意义(P<0.05); 与对照组相比, SP组及TP-MCT组术后第1天血清抗炎因子白介素-10(interleukin-10, IL-10)水平有所上升, 血清促炎因子IL-6水平有所降低(P<0.05); 与对照组相比, HE染色及PCNA显示SP组和TP-MCT组术后肝再生明显, 肝脏结构得到恢复, 特别是SP组于术后1、3、7 d呈现显著性肝脏再生.
结论: 小鼠肝切除后予以EN, 可以保护术后肝脏结构功能, 促进肝再生, 应用EN混悬液SP优于TP-MCT.
核心提示: 该论文重点探讨了肠内营养混悬液TP-MCT和SP对70%肝组织切除小鼠的肝再生及炎症反应水平的影响, 结果从不同营养制剂辅助或支持肝再生的角度提示临床医师重视肝组织切除手术后营养支持治疗的重要性, 结果证实营养支持治疗对肝再生有支持作用, 最大的亮点是对临床治疗有较大的参考价值.
引文著录: 段飞, 陈靓, 訾雪剑, 伏旭, 姚辉, 伏晓, 仇毓东. 不同肠内营养制剂对小鼠肝切除术后肝再生及其结构功能的影响. 世界华人消化杂志 2014; 22(9): 1193-1200
Revised: January 22, 2014
Accepted: February 3, 2014
Published online: March 28, 2014
AIM: To investigate the effects of two kinds of enteral nutrition preparations on liver regeneration and function in mice after partial hepatectomy (PH).
METHODS: A mouse model of oral enteral nutrition (EN) after 70%PH was used in this study. Seventy-two male ICR mice were randomly divided into a PH control group (routine diet after PH), a TP-MCT group (EN with TP-MCT after PH) and a SP group (EN with Peptisorb after PH). Serum samples and liver tissue specimens were collected 1, 3 and 7 d after PH. Serum samples were used to measure the levels of alanine aminotransferase (ALT), aspartate transaminase (AST), albumin, interleukin-6 (IL-6) and IL-10. The liver tissue specimens were used to measure the proliferation of hepatocytes and the morphology of liver tissue by immunohistostaining and HE staining.
RESULTS: In comparison with the PH control group, serum levels of ALT and AST on days 1, 3 and 7 decreased significantly in the TP-MCT group and SP group (P < 0.05 for all). Compared with the PH control group, the level of IL-6 on day 1 decreased significantly in the TP-MCT group and SP group, but the level of IL-10 increased significantly in the TP-MCT group and SP group (P < 0.05 for all). Liver regeneration was enhanced significantly on days 1, 3 and 7 in the TP-MCT group and SP group, especially in the SP group.
CONCLUSION: Enteral nutrition can well protect mouse liver function and promote liver regeneration after PH, with SP (Peptisorb) having a better effect.
- Citation: Duan F, Chen L, Zi XJ, Fu X, Yao H, Fu X, Qiu YD. Effects of two kinds of enteral nutrition preparations on liver regeneration and function in mice after partial hepatectomy. Shijie Huaren Xiaohua Zazhi 2014; 22(9): 1193-1200
- URL: https://www.wjgnet.com/1009-3079/full/v22/i9/1193.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i9.1193
在当今外科学领域, 学者们正积极致力于运用精准肝脏外科的理念和技术来保护肝切除术后肝功能, 减少术后并发症[1,2]. 近年来, 在手术技术与理念飞速发展的同时, 肠内营养(enteral nutrition, EN)在围手术期中营养支持治疗中的作用越来越受到重视[3,4]. 相关基础研究表明, EN不仅能提供能量支持, 控制术后过度炎症反应, 更有利于肝脏的结构和功能的维护[5,6]. 目前临床上常用的EN制剂分为整蛋白型(EN混悬液TP-MCT, 商品名康全甘)和短肽游离氨基酸混合型(EN混悬液SP, 商品名百普力), 而对于肝切除围手术期EN制剂的选择目前并无相关文献报道. 本研究采用小鼠70%肝切除模型, 通过围手术期喂养上述两种不同类型的营养制剂, 旨在探讨不同EN制剂对肝切除术后肝脏结构功能恢复和肝再生的影响, 为EN在肝脏外科的应用提供有价值的实验依据.
实验采用♂ICR小鼠72只, 8-15周龄, 体质量25-30 g(购自南京大学附属鼓楼医院动物实验中心). 饲养室温度为18 ℃-22 ℃, 湿度为60%, 每天光照12 h(6:00-18:00). 动物被随机分为3组(每组24只): 70%肝切除对照组(术后常规饮食)、TP-MCT组(70%肝切除术后行TP-MCT口服EN支持)、SP组(70%肝切除术后行SP口服EN支持). EN混悬液TP-MCT(TP-MCT, 商品名"康全甘", 1 kal/mL, 批号: H20093283), EN混悬液SP(peptisorb, 商品名"百普力", 1 kal/mL, 批号: H20010285), 小鼠抗PCNA购自Invitrogen公司.
1.2.1 模型建立: 肝切除对照组术前禁食12 h, 不禁水, 行70%肝切除后行常规饮食. 其他EN两组术前2 d起分别给予各自对应的EN液进行喂养, 增加小鼠胃肠道适应, 至术前12 h停止, 术前不禁水, 完成70%肝切除后, 开始建立肝切除术后口服EN模型, 即同组每2只小鼠置于1笼, 每笼配备2个标有刻度的喂养瓶, 分别灌装饮用水和对应EN液, 供小鼠随意饮用, 此外不再供给小鼠其他任何营养能量来源. 喂养瓶每日消毒换新并灌注新鲜营养液, 同时计算并记录每笼每日营养液消耗量[7]. 所有小鼠均采用乙醚吸入麻醉, 上述70%肝切除术即经典的Higgins-Anderson 70%肝切除术, 依次切除小鼠左叶及中叶后关腹[8].
1.2.2 标本处理: 各组分别于肝切除术后1、3、7 d处死小鼠, 小鼠处死前称其体质量, 处死后取出残肝, 生理盐水漂洗后称质量, 残肝组织保存方法: (1)部分组织固定在40 g/L甲醛保存; (2)部分组织放置液氮和-80 ℃冰箱中保存.
1.2.3 术后血清学指标检测: 各组小鼠分别于肝切除术后1、3、7 d处死前取血, 用生化分析仪检测血清中谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate transaminase, AST)及白蛋白的水平.
1.2.4 组织病理学检测: 各组分别于肝切除术后1、3、7 d取0.5 cm×0.5 cm×0.5 cm左右小鼠肝组织在40 g/L甲醛中固定后, 包埋切片行HE染色, 并进行厚度为5 μm的连续切片, HE染色观察肝脏病理结构的改变; PCNA免疫组织化学染色按试剂盒说明书进行, 免疫组织化学阳性结果判定标准: 以细胞核呈界限清楚的棕黄色-黄色反应为阳性. 每张切片随机选择相邻5个高倍视野, 每个视野计数100个肝细胞, 然后计算其平均阳性率.
1.2.5 血清白介素-6(interleukin-6, IL-6)、IL-10检测: 取各组小鼠1、3、7 d冻存血清, 使用炎性因子检测试剂盒(BD公司)检测血清IL-6、IL-10水平.
统计学处理 采用SPSS16.0统计软件分析, 实验数据以mean±SD表示, 两组间均数差异采用独立样本t检验, P<0.05差异具有统计学意义.
所有各组小鼠试验过程中处死前均未出现死亡. TP-MCT组与SP组间术后日均EN液消耗量差异无统计学意义(P>0.05)(表1).
| 分组 | 术后时间(d) | ||
| 1 | 2-3 | 4-7 | |
| TP-MCT组 | 14.8±2.6 | 21.4±3.2 | 21.2±2.8 |
| SP组 | 13.6±3.5 | 19.3±3.2 | 19.6±1.7 |
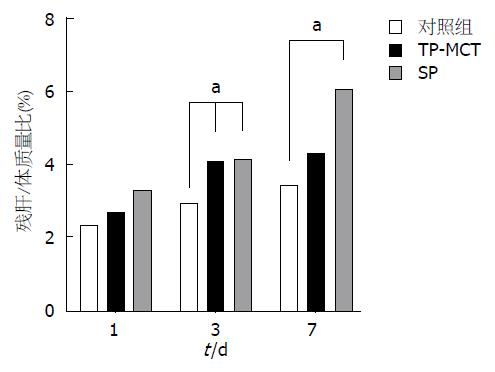
与对照组比较, 肝切除术后3 d EN两组小鼠残肝/体质量比有所增高, 差异具有统计学意义(P<0.05); 与对照组相比, 术后7 d SP组残肝/体质量比有所增高, 差异具有统计学意义(P<0.05); SP与TP-MCT组间差异无统计学意义(P>0.05)(图1).
与对照组比较, 肝切除术后1、3、7 d两组EN组血清ALT、AST水平有所降低, 差异具有统计学意义(P<0.05); 与TP-MCT组比较, SP组血清ALT、AST水平的差异无统计学意义(P>0.05)(表2, 表3); 与对照组比较, 术后1、3、7 d两组EN组血清白蛋白水平的差异无统计学意义(P>0.05)(表4).
| 分组 | 术后时间(d) | ||
| 1 | 3 | 7 | |
| 对照组 | 25.2±1.5 | 27.3±1.2 | 30.7±1.2 |
| TP-MCT组 | 26.7±0.8 | 29.8±0.9 | 33.6±1.5 |
| SP组 | 28.7±1.1 | 31.3±0.8 | 36.8±1.3 |
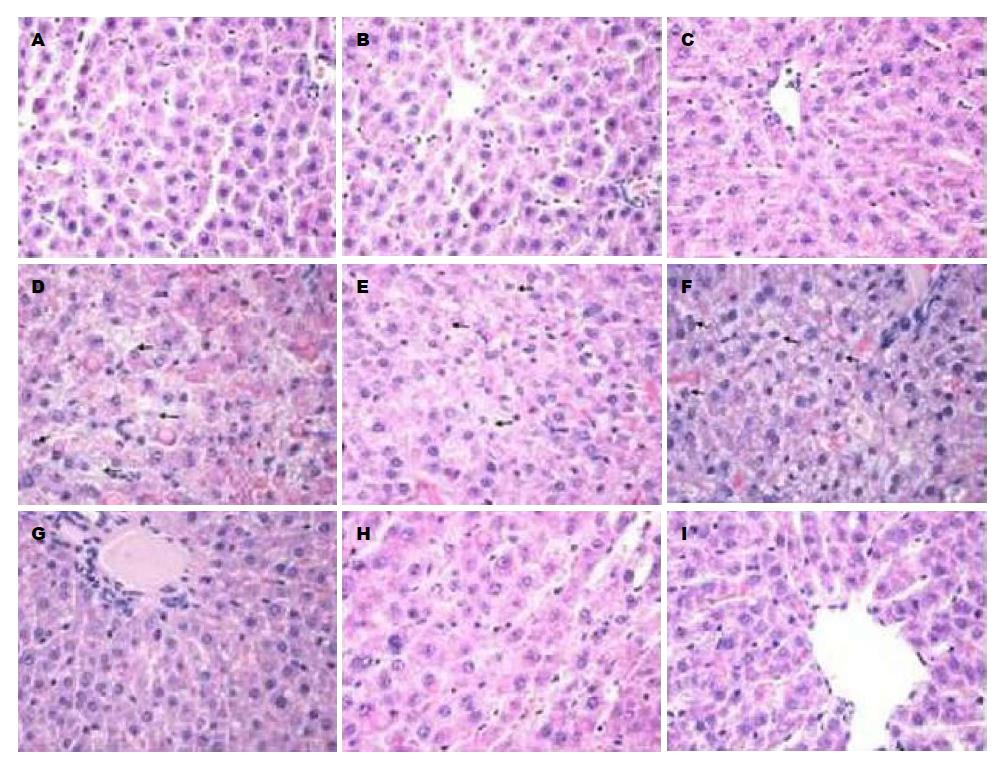
HE染色切片显示: 对照组肝切除术后1、3 d肝细胞呈现明显肿胀和气球样变改变, 汇管区炎症细胞浸润明显, 肝细胞排列混乱, 肝小叶结构不清; TP-MCT组肝切除术后3、7 d肝细胞肿胀和气球样变有所改善, 但肝细胞排列、肝小叶结构改善不明显, 可见少量分裂相伴核增大; SP组1、3、7 d肝细胞均无明显肿胀及气球样变, 汇管区仅少量炎症细胞浸润, 肝小叶结构清晰, 肝细胞排列整齐, 肝索、肝窦清楚, 可见较多分裂相伴核增大(图2).
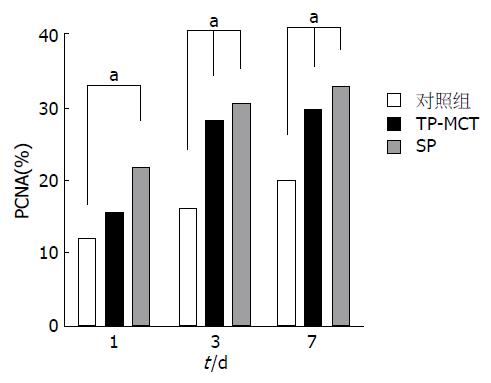
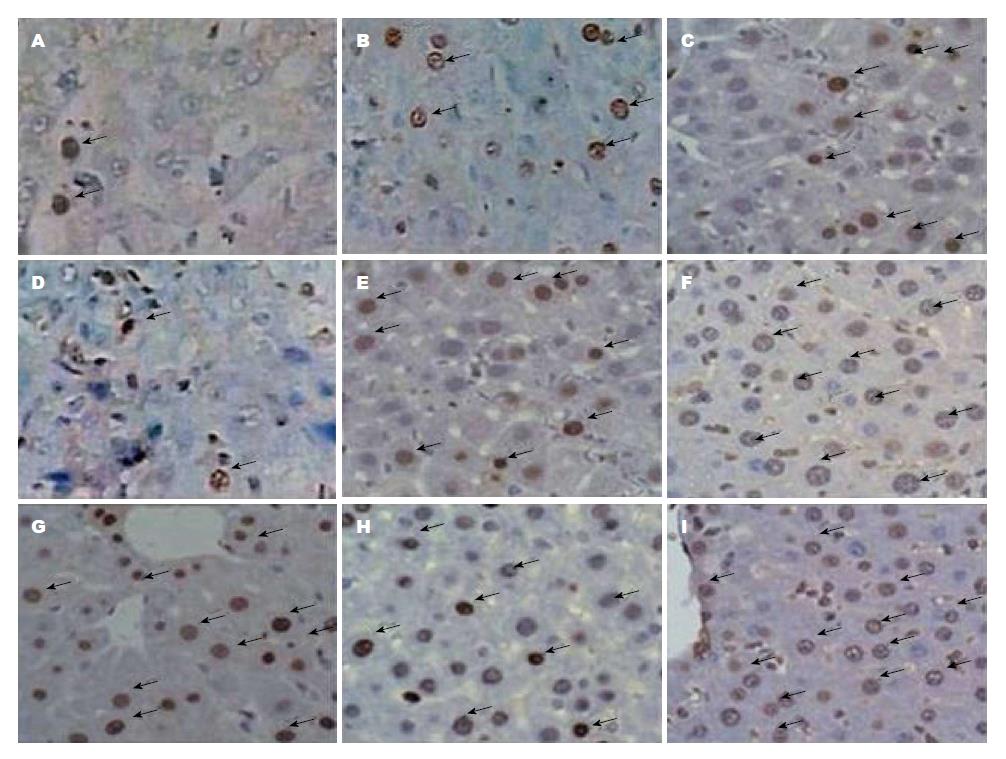
与对照组相比, TP-MCT组肝切除术后第3天、第7天PCNA染色细胞明显增加, 差异具有统计学意义(P<0.05); 而SP组1、3、7 d PCNA染色细胞均显著增加, 差异具有统计学意义(P<0.05); SP与TP-MCT组间差异无统计学意义(P>0.05)(图3, 4).
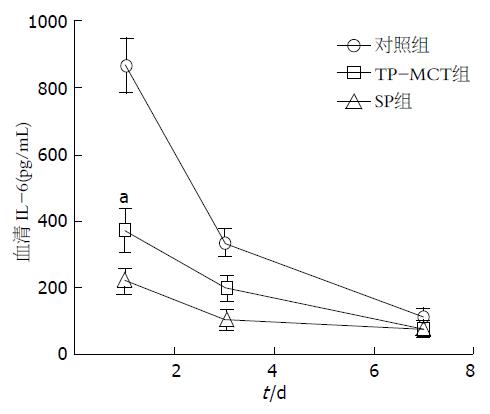
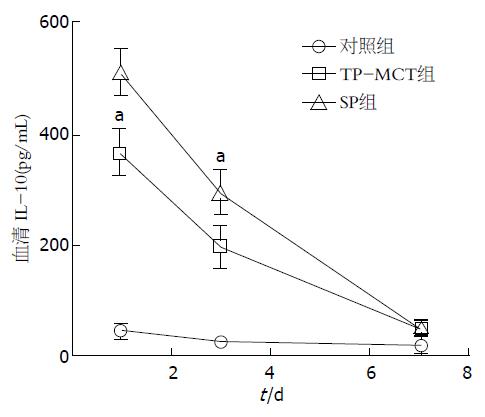
(1)与对照组比较, 两组EN组肝切除术后第1天血清IL-6水平降低, 差异具有统计学意义(P<0.05); 与TP-MCT组比较, SP组肝切除术后1、3、7 d血清IL-6水平的差异无统计学意义(P>0.05); (2)与对照组相比, 两组EN组肝切除术后第1天血清IL-10水平上升, 差异有统计学意义(P<0.05); 与对照组相比, SP组术后第3天血清IL-10水平升高, 差异有统计学意义(P<0.05)(图5, 6).
肝切除术作为肝脏外科最主要的治疗手段面临着重大变革, 以精确的术前评估、精细的手术操作和精良的术后处理为核心的肝脏精准外科日益受到关注[1,9,10]. 长期的临床实践证明, 对于肝脏肿瘤采取肝切除术有望提高患者的无瘤生存率, 但是病灶切除后的残余肝脏能否维持功能、顺利修复再生将直接影响患者的生存, 而围手术期采用有针对性的营养支持治疗可明显减轻患者肝功能损害, 显著降低并发症, 对肝再生有促进作用[11-13]. 我们的前期研究证实: 大鼠肝切除围手术期静脉应用ω-3不饱和脂肪酸(ω-3PUFA)可抑制血清中炎症因子的释放, 控制门静脉系统的内毒素血症, 有效保护肝功能和肝脏紧密连接, 促进肝再生[14,15]. 但较之肠外营养, 目前EN作为目前外科临床营养支持的首选途径已经达成共识并已广泛引用于临床, EN具有促进肠蠕动功能的恢复, 保护肠道黏膜, 防止肠道细菌移位, 改善肠肝循环, 加速门静脉系统的血液循环, 促进胃肠道激素的分泌等作用, 使整个过程更加符合生理, 同时各种营养物质和营养因子直接进入肝脏, 为创伤后的肝脏提供良好的营养环境, 促进肝脏蛋白质的合成[16,17]. 目前已有大量临床研究表明围手术期早期采用EN支持治疗和特异性营养成分可以促进患者胃肠功能恢复, 减轻肝功能损害并降低肠外营养相关并发症如胆汁淤积、导管感染等的发生率[18-20]. 但是, 肝脏切除围手术期应用何种EN制剂更有利于患者的恢复成了目前临床上迫切要了解的问题, 同时EN制剂对于术后肝再生和肝脏结构功能恢复的影响作用目前还不清楚[21-23]. 因此, 我们选择TC-MCT、SP两种目前临床上常用的EN制剂作对照, 初步探讨了不同EN制剂对小鼠部分肝切除术后肝脏再生和结构功能的影响.
本实验重点观察了在口服EN条件下两种EN制剂对小鼠70%肝切除术后对肝再生及肝脏结构功能恢复有无促进作用. 研究结果显示, 通过血清学指标检测发现, 与肝切除对照组相比, EN两组术后1、3 d血清ALT、AST均明显降低, 而SP效果更为显著, 说明EN对肝切除术后早期有很强的肝功能保护作用, 使肝损害得以很大的缓解, 使创伤后的肝脏提前进入恢复阶段. 与对照组相比, 术后血清白蛋白水平EN两组无明显变化, 说明两种EN制剂对肝脏白蛋白合成功能影响不大, 这可能与白蛋白的半衰期时间较长有关, 后续研究可以检测血清前白蛋白, 其半衰期仅有2 d, 能更好地反映术后急性期肝脏合成代谢的变化[24]. HE染色及PCNA染色显示与对照组相比, EN两组术后肝脏结构的得到了更好的恢复且肝再生明显, 而SP效果更具优势, PCNA结果显示特别是在早期即肝切除术后1 d, 与对照组相比, 肝脏再生即出现显著性差异, 这与残肝/体质量比这一大体宏观结果当中SP晚期即术后7 d的优势得以体现不谋而合. 这可能由于肝切除术后肠屏障受到应激性损伤导致营养吸收不良所致, 而SP作为短肽混合游离氨基酸型EN制剂, 较之整蛋白型EN制剂TC-MCT, 创伤应激条件下更易于被机体吸收利用, 减轻胃肠道负担, 从而能更好地恢复肝切除术后肠屏障, 促进营养物质的代谢吸收, 为肝脏再生及其结构功能的恢复良好的物质基础; 而肠屏障和肝脏结构及肝脏紧密连接等密切相关, 所以, 术后早期恢复肠屏障功能还有利于促进肝再生及肝脏小叶结构的修复[25-27]. 同时围手术期营养EN能够很好地抑制全身炎性因子及促进抗炎因子的释放, 从而减少机体的应激性创伤, 本研究中, 术后应用EN于肝切除术后早期能很好地促进抗炎因子IL-10及抑制炎性因子IL-6的释放, 而SP对于其效果更为明显, 这也与其他同类研究结果相类似[28-30]. 所以我们认为术后应用EN制剂, 尤其是短肽游离氨基酸混合型制剂可以在一定程度上可以减轻肝内实质组织和非实质组织的损伤, 更有效的促进肝切除术后肝再生和肝脏结构恢复.
总之, 本研究在小鼠70%肝切除后口服EN模型的基础上, 采用围手术期应用两种目前临床常用EN制剂的方法, 通过肝脏血清学指标, 组织病理学检测和相关炎性因子的比较, 对比了不同EN制剂对于肝切除术后的影响. 本研究结果显示肝切除术后早期应用EN特别是短肽游离氨基酸混合型EN制剂可以保护术后肝脏结构及加速肝功能的恢复, 并有效的促进肝再生, 为临床上肝切除术后EN制剂的选择以及进一步研究EN支持在肝切除中的应用提供了一定的借鉴意义.
肠内营养(enteral nutrition, EN)在围手术期中营养支持治疗中的作用越来越受到重视. EN不仅能提供能量支持, 控制术后过度炎症反应, 更有利于肝脏的结构和功能的维护. 目前临床上常用的EN制剂分为整蛋白型(EN混悬液TP-MCT, 商品名康全甘)和短肽游离氨基酸混合型(EN混悬液SP, 商品名百普力), 而对于肝切除围手术期EN的制剂的选择目前并无相关文献报道.
潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院干细胞与组织器官工程研究中心
本研究采用小鼠70%肝切除模型, 通过围手术期喂养上述两种不同类型的营养制剂, 旨在探讨不同EN制剂对肝切除术后肝脏结构功能恢复和肝再生的影响, 为EN在肝脏外科的应用提供有价值的实验依据.
EN作为外科营养支持的首选途径目前已经得到业界的广泛认同, EN较之肠外营养, 可以维持肠壁完整, 抑制肠源性感染, 增加门静脉血流, 促进胃肠激素释放, 刺激肝再生, 更加符合生理等诸多优点.
目前已有大量文章已经证实肝脏外科中营养支持的必要性, 且临床类型文章居多,从基础层面探讨营养支持对于肝脏再生及结构功能恢复机制类型的文章较少.
运用转化医学的方法, 通过基础实验探究机制, 取得结果, 指导临床肝脏外科围手术期EN制剂的选择.
本文具有一定科学性和应用价值.
编辑: 田滢 电编: 鲁亚静
| 1. | Fan ST. Precise hepatectomy guided by the middle hepatic vein. Hepatobiliary Pancreat Dis Int. 2007;6:430-434. [PubMed] |
| 3. | Fan ST, Lo CM, Lai EC, Chu KM, Liu CL, Wong J. Perioperative nutritional support in patients undergoing hepatectomy for hepatocellular carcinoma. N Engl J Med. 1994;331:1547-1552. [PubMed] |
| 5. | Qiu Y, Wang M, Tan T, Yuan X, Ding Y. Effects of n-3 polyunsaturated fatty acids on hepatic tight junction after partial hepatectomy in rats. Transplant Proc. 2011;43:1480-1483. [PubMed] [DOI] |
| 7. | Javid PJ, Greene AK, Garza J, Gura K, Alwayn IP, Voss S, Nose V, Satchi-Fainaro R, Zausche B, Mulkern RV. The route of lipid administration affects parenteral nutrition-induced hepatic steatosis in a mouse model. J Pediatr Surg. 2005;40:1446-1453. [PubMed] |
| 8. | Mezera V, Kučera O, Moravcová A, Peterová E, Červinková Z. Epigallocatechin gallate does not accelerate the early phase of liver regeneration after partial hepatectomy in rats. Dig Dis Sci. 2013; Dec 8. [Epub ahead of print]. [PubMed] |
| 10. | 董 家鸿, 杨 世忠, 段 伟东, 纪 文斌, 蔡 守旺, 王 敬, 史 宪杰, 姜 凯, 夏 红天, 何 蕾. 精准肝脏外科技术在复杂肝脏占位性病变切除中的应用. 中华外科杂志. 2009;21:1610-1615. |
| 11. | Omata J, Fukatsu K, Maeshima Y, Moriya T, Murakoshi S, Noguchi M, Okamoto K, Fukazawa S, Saitoh D, Mochizuki H. Enteral nutrition rapidly reverses total parenteral nutrition-induced impairment of hepatic immunity in a murine model. Clin Nutr. 2009;28:668-673. [PubMed] [DOI] |
| 13. | Okabayashi T, Nishimori I, Sugimoto T, Maeda H, Dabanaka K, Onishi S, Kobayashi M, Hanazaki K. Effects of branched-chain amino acids-enriched nutrient support for patients undergoing liver resection for hepatocellular carcinoma. J Gastroenterol Hepatol. 2008;23:1869-1873. [PubMed] [DOI] |
| 14. | Yan XP, Wang S, Yang Y, Qiu YD. Effects of n-3 polyunsaturated fatty acids on rat livers after partial hepatectomy via LKB1-AMPK signaling pathway. Transplant Proc. 2011;43:3604-3612. [PubMed] [DOI] |
| 16. | Black D, Lyman S, Heider TR, Behrns KE. Molecular and cellular features of hepatic regeneration. J Surg Res. 2004;117:306-315. [PubMed] |
| 18. | Richter B, Schmandra TC, Golling M, Bechstein WO. Nutritional support after open liver resection: a systematic review. Dig Surg. 2006;23:139-145. [PubMed] [DOI] |
| 19. | Kaido T, Mori A, Ogura Y, Hata K, Yoshizawa A, Iida T, Yagi S, Uemoto S. Impact of enteral nutrition using a new immuno-modulating diet after liver transplantation. Hepatogastroenterology. 2010;57:1522-1525. [PubMed] |
| 20. | Weimann A, Braga M, Harsanyi L, Laviano A, Ljungqvist O, Soeters P, Jauch KW, Kemen M, Hiesmayr JM, Horbach T. ESPEN Guidelines on Enteral Nutrition: Surgery including organ transplantation. Clin Nutr. 2006;25:224-244. [PubMed] [DOI] |
| 21. | Javid PJ, Collier S, Richardson D, Iglesias J, Gura K, Lo C, Kim HB, Duggan CP, Jaksic T. The role of enteral nutrition in the reversal of parenteral nutrition-associated liver dysfunction in infants. J Pediatr Surg. 2005;40:1015-1018. [PubMed] [DOI] |
| 22. | Kaufman SS. Prevention of parenteral nutrition-associated liver disease in children. Pediatr Transplant. 2002;6:37-42. [PubMed] [DOI] |
| 23. | Rayes N, Seehofer D, Theruvath T, Schiller RA, Langrehr JM, Jonas S, Bengmark S, Neuhaus P. Supply of pre- and probiotics reduces bacterial infection rates after liver transplantation--a randomized, double-blind trial. Am J Transplant. 2005;5:125-130. [PubMed] [DOI] |
| 24. | Robinson MK, Trujillo EB, Mogensen KM, Rounds J, McManus K, Jacobs DO. Improving nutritional screening of hospitalized patients: the role of prealbumin. JPEN J Parenter Enteral Nutr. 2003;27:389-395; quiz 439. [PubMed] [DOI] |
| 25. | Miele L, Valenza V, La Torre G, Montalto M, Cammarota G, Ricci R, Mascianà R, Forgione A, Gabrieli ML, Perotti G. Increased intestinal permeability and tight junction alterations in nonalcoholic fatty liver disease. Hepatology. 2009;49:1877-1887. [PubMed] [DOI] |
| 26. | Kakazu E, Kanno N, Ueno Y, Shimosegawa T. Extracellular branched-chain amino acids, especially valine, regulate maturation and function of monocyte-derived dendritic cells. J Immunol. 2007;179:7137-7146. [PubMed] |
| 27. | Fouts DE, Torralba M, Nelson KE, Brenner DA, Schnabl B. Bacterial translocation and changes in the intestinal microbiome in mouse models of liver disease. J Hepatol. 2012;56:1283-1292. [PubMed] [DOI] |
| 28. | Bourdi M, Eiras DP, Holt MP, Webster MR, Reilly TP, Welch KD, Pohl LR. Role of IL-6 in an IL-10 and IL-4 double knockout mouse model uniquely susceptible to acetaminophen-induced liver injury. Chem Res Toxicol. 2007;20:208-216. [PubMed] |
| 29. | Shibata M, Hirota M, Nozawa F, Okabe A, Kurimoto M, Ogawa M. Increased concentrations of plasma IL-18 in patients with hepatic dysfunction after hepatectomy. Cytokine. 2000;12:1526-1530. [PubMed] |
| 30. | Tsiaousi ET, Hatzitolios AI, Trygonis SK, Savopoulos CG. Malnutrition in end stage liver disease: recommendations and nutritional support. J Gastroenterol Hepatol. 2008;23:527-533. [PubMed] [DOI] |