修回日期: 2014-01-13
接受日期: 2014-01-16
在线出版日期: 2014-03-18
目的: 探讨三叶因子3(trefoil factor 3, TFF3)在人肝细胞癌(hepatocellular carcinoma, HCC)中表达及其与患者临床病理特征和预后的关系.
方法: 建立组织微阵列平台, 应用免疫组织化学两步法检测90例HCC肿瘤组织和90例癌旁非肿瘤组织中TFF3的表达情况.
结果: HCC肿瘤组织中TFF3阳性表达率为62.1%, 癌旁非肿瘤组织中TFF3阳性表达率为33.8%, 两者之间差异具有统计学意义(P<0.01); HCC肿瘤组织中TFF3蛋白的表达与肿瘤的大小以及肿瘤TNM分期分别呈显著正相关(P = 0.026和0.015), 与患者的无复发生存期呈负相关(P = 0.043).
结论: TFF3可能参与HCC的发生和进展, 可以作为判定HCC预后的一种潜在标志物.
核心提示: 本文使用组织微阵列平台, 应用免疫组织化学两步法检测肝细胞癌三叶因子3(trefoil factor 3, TFF3)的表达状况, 结果显示TFF3在肝细胞癌中过表达, 并且与病程进展和患者预后生存期相关, 提示TFF3可能参与肝细胞癌的发生和进展, 可以作为判定肝细胞癌预后的一种潜在标志物.
引文著录: 尚允利, 钱叶本. 三叶因子3在肝细胞癌组织中的表达及临床意义. 世界华人消化杂志 2014; 22(8): 1141-1145
Revised: January 13, 2014
Accepted: January 16, 2014
Published online: March 18, 2014
AIM: To investigate clinical significance of expression of trefoil factor 3 (TFF3) in hepatocellular carcinoma (HCC).
METHODS: The expression of TFF3 was examined by immunohistochemical method on tissue chips containing 90 cases of HCC and 90 cases of non-tumor hepatic tissues.
RESULTS: The positive rate of TFF3 expression in HCC was significantly higher than that in non-tumor hepatic tissues (62.1% vs 33.8%, P < 0.01). TFF3 expression was significantly correlated with tumor size, TNM stage (P = 0.026 and 0.015) and relapse-free survival (P = 0.043).
CONCLUSION: TFF3 may play an important role in the development and progression of HCC, and the expression of TFF3 might be a potential marker for evaluating the prognosis of HCC.
- Citation: Shang YL, Qian YB. Clinical significance of expression of trefoil factor 3 in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(8): 1141-1145
- URL: https://www.wjgnet.com/1009-3079/full/v22/i8/1141.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i8.1141
肝细胞癌(hepatocellular carcinoma, HCC)一种常见的恶性肿瘤, 其发病率和死亡率在全球范围内有逐年增高趋势[1]. 由于HCC临床早期症状不明显, 难以做到早期发现早期治疗, 因此很多患者术后肿瘤常见复发转移, 导致远期生存率不佳[2]. 因此, 研究HCC发生发展的分子机制, 发掘其中重要的调控分子, 确定有效的生物学标志物和治疗靶点, 对提高HCC患者的治疗效果和生存质量有着重要意义[3]. 三叶因子3(trefoil factor 3, TFF3)是在1991年由Suemori[4]从大鼠空肠中发现的, 分子仅由59个氨基酸组成, 含有1个P结构域, 存在单聚体和二聚体两种形式, 主要分布于肠黏膜. 近年来, TFF3在肿瘤中的作用日益受到重视. 目前TFF3在肝细胞癌中的研究鲜有报道, 本研究采用免疫组织化学技术检测HCC肿瘤组织及癌旁非肿瘤组织TFF3的表达, 分析其与HCC临床病理特征关系, 探讨其在HCC发病过程中的生物学意义.
收集2004-01/2007-08安徽医科大学第一附属医院普外科HCC病例90例, 患者平均年龄51.5岁±11.6岁. 按第6版国际抗癌协会TNM分期标准进行临床分期, Edmondson分级标准进行组织学分级. 所有HCC患者均有详细生存资料, 包括术后总生存期和术后无复发生存期, 并且术前均未做化疗、免疫或放射治疗. 另收集每例病例手术标本中距离肿瘤组织边缘2 cm以外的非肿瘤性肝组织. 所有组织均以40 g/L中性甲醛固定过夜, 石蜡包埋, 常规行苏木精-伊红(HE)染色, 经组织病理诊断证实. 浓缩型鼠抗人TFF3单克隆抗体购于美国Abcam公司, 工作浓度1:100. 通用型EnVision两步法免疫组织化学试剂盒及DAB显色剂均购自北京中杉金桥公司.
1.2.1 组织微阵列制备: 首先, 复查每例标本HE染色切片, 选取代表性组织位点, 然后使用显微镜定位器进行定位. 每例病例选取4枚组织(癌组织和癌旁非肿瘤组织各2枚); 使用组织微阵列制备仪制作7×8点阵的空白蜡块; 选取内径为1.5 mm的取样针, 在相应组织蜡块上找到取样位置, 通过取样、点样, 经过二次包埋后制成的组织微阵列蜡块. 每枚蜡块为56个组织点阵, 即包含56枚组织点; 以4 μm厚度连续切片, 敷贴于10%多聚赖氨酸预先处理的载玻片上.
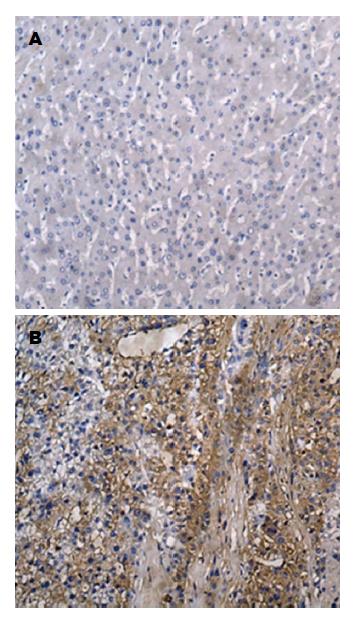
1.2.2 免疫组织化学检测TFF3的表达及结果判定: 具体免疫组织化学操作按说明书染色步骤进行. 以PBS缓冲液代替一抗作为阴性对照, 余步骤相同. 采用双盲法, 由两位病理医师独立观察. TFF3以细胞胞质内出现淡黄色至棕黄色颗粒为阳性细胞. TFF3阳性细胞计数: 每个样本随机计数5个高倍视野(400倍)的阳性细胞数, 计算每个视野的阳性率, 得出平均数, 按下列方法进行评分: 阳性细胞<33%为1分, 33%-67%为2分, >67%为3分; 阳性细胞着色深度: 无着色或弱表达为1分, 棕黄色为2分, 棕褐色为3分. 将两项积分相乘: ≥4分被认为是阳性, 反之为阴性[5].
统计学处理 采用SPSS10.0软件进行统计学分析. 其中样本阳性率之间比较采用χ2检验, 阳性率与患者临床病理特征之间关系采用非参数Spearman等级相关检验, 患者生存率的组间比较采用Kaplan-Meier生存曲线法及Log-rank检验, P<0.05为差异有统计学意义.
TFF3阳性染色主要定位于细胞胞质(图1). HCC肿瘤组织和癌旁非肿瘤组织中均有不同程度的TFF3阳性表达. 90例HCC肿瘤组织中TFF3阳性表达率为62.1%, 90例癌旁非肿瘤组织中TFF3阳性表达率为33.8%, 两者之间差异具有统计学意义(P<0.01)(表1).
HCC肿瘤组织中TFF3蛋白的表达与肿瘤大小及临床TNM分期均呈显著正相关(P = 0.026和P = 0.015), 而与患者年龄、性别、组织学分级、HBsAg感染和肝硬化状况均无显著相关性(P>0.05)(表2).
| 临床病理特征 | n | TFF3 | P值 |
| 年龄(岁) | 0.543 | ||
| ≤55 | 54 | 32(59.3) | |
| >55 | 36 | 19(52.8) | |
| 性别 | 0.458 | ||
| 男 | 73 | 40(54.8) | |
| 女 | 17 | 11(64.7) | |
| 肝硬化 | 0.435 | ||
| 有 | 81 | 47(58.0) | |
| 无 | 9 | 4(44.4) | |
| HBsAg | 0.458 | ||
| 阳性 | 73 | 40(54.8) | |
| 阴性 | 17 | 11(64.7) | |
| 肿瘤大小(cm) | 0.026 | ||
| <5 | 26 | 10(38.5) | |
| ≥5 | 64 | 41(64.1) | |
| 组织学分级 | 0.150 | ||
| I | 11 | 9(81.8) | |
| II | 68 | 35(51.5) | |
| III | 11 | 7(63.6) | |
| 临床分期 | 0.015 | ||
| I - II | 67 | 33(49.3) | |
| III - IV | 23 | 19(78.3) |
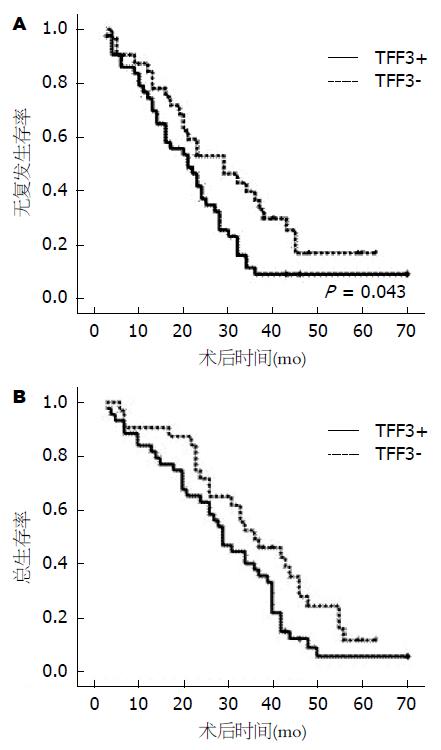
采用Kaplan-Meier曲线法和Log-rank检验对肿瘤细胞TFF3表达与HCC患者总生存率和无复发生存率关系进行单因素生存分析: TFF3阳性表达患者无复发生存率显著低于阴性表达患者(P = 0.043). TFF3阳性表达患者总生存率低于阴性表达患者, 但未达到统计学意义(P = 0.062)(图2).
近年来, TFF3是研究较多的小分子多肽三叶因子家族成员之一, 研究发现其过度表达是多种恶性肿瘤预后不良的表现之一, 可能在促进肿瘤演进方面发挥了重要作用. Yamachika[6]研究发现TFF3具有抑制胃癌细胞黏附、促进细胞侵袭和阻断细胞凋亡的作用. Taupin等[7]通过制造大鼠胃黏膜病变模型, 发现在从胃黏膜化生到不典型增生再到胃癌这一过程中, TFF3的表达逐步增高, 提示TFF3可能参与了胃黏膜恶性转化的过程, 其表达的改变可能是胃黏膜癌变的早期分子事件. Chan等[8]也发现在胃癌组织中TFF3存在异常表达, 并能够上调Rat-2细胞中侵袭相关基因的表达. 体内外研究显示: TFF3可以促进鸡胚绒毛尿囊膜的血管生成, 从而诱导人脐静脉内皮细胞形成类微血管结构, 提示其可能参与了血管生成[9]. Dhar等[5]研究显示TFF3能够促进胃癌的转移和复发, 其机制可能是TFF3在肿瘤微血管生成方面扮演重要角色. 细胞周期、DNA修复、血管生成和凋亡等都涉及到相关基因的CpG岛甲基化, CpG岛甲基化在肿瘤发生、发展过程中可能发挥着关键作用[10]. Okada等[11]发现TFF3的过表达参与了肝脏肿瘤的发生, 异常的启动区CpG岛甲基化可能对TFF3表达发挥重要的调控作用, 由此推测肝癌组织可能通过启动区CpG岛甲基化促进TFF3的表达, 进而影响血管生成, 促进肿瘤的侵袭、转移, 其具体机制还有待进一步证实.
目前国内关于TFF3在HCC中的表达及其与预后相关性的研究尚未见报道. 本研究采用免疫组织化学方法检测肝脏肿瘤中TFF3蛋白表达情况, 结果显示, HCC肿瘤组织TFF3表达显著高于癌旁非肿瘤组织, 结果与皮肤黏液癌、乳腺癌、胃癌、结肠癌、前列腺癌等多种恶性肿瘤报道一致[5,12-15], 提示其可能参与了HCC的发生过程. Yamachika等[6]应用免疫组织化学方法检测209例原发性胃腺癌病理组织标本, 结果显示TFF3在胃癌患者中表达率女性明显高于男性, 并且在男性胃癌患者中TFF3表达与进展状况、浸润性生长以及肿瘤淋巴结转移有关, 提示TFF3高表达可能是胃癌患者预后不良的标志. 本研究结果显示, 肝细胞癌肿瘤组织中TFF3表达与年龄、性别、分化程度以及淋巴结转移无关, 但与肿瘤的大小以及临床TNM分期呈显著正相关, 提示TFF3参与HCC的发生、发展过程, 可能是一种HCC预后不良的标志物. Dhar等[5]发现TFF3可作为胃癌患者的无复发生存率的独立评价预后指标, 提示TFF3高表达的胃癌患者具有较高的复发风险. 本研究进一步显示TFF3表达与HCC患者的无复发生存率呈显著负相关, 结合文献报道, 提示TFF3可能作为HCC预后不良的一种标志物.
总之, TFF3作为HCC发生过程中的重要因子, 可能参与了HCC恶性转化和进展的过程, 是患者预后不良的一个潜在标志物. TFF3基因可能成为HCC新的分子标志物, 对HCC的早期诊断、评估预后及治疗模式的选择有着重要的临床参考价值.
研究肝细胞癌发生发展的分子机制, 确定有效的生物学标志物和治疗靶点, 对提高患者的治疗效果和生存质量有着重要意义.
孙星, 副教授, 副主任医师, 上海交通大学附属第一人民医院普外科
近年研究发现三叶因子3(trefoil factor 3)表达在多种恶性肿瘤的发生发展过程中发挥了重要作用, 但在肝细胞癌中的研究鲜有报道.
Yamachika应用免疫组织化学方法检测了胃腺癌TFF3表达, 发现TFF3表达与肿瘤进展状况、浸润性生长以及肿瘤淋巴结转移有关. Dharet发现TFF3可作为胃癌患者的无复发生存率的独立评价预后指标.
本文在国内首次大样本检测了肝细胞癌和癌旁非肿瘤组织TFF3表达, 并分析其与患者临床病理特征和预后的关系.
肝细胞癌是一种常见的、预后差的恶性肿瘤, 治疗效果一直不佳. 该研究结果提示TFF3可能参与了肝细胞癌发生发展进展, 提示TFF3可能用于肝细胞癌治疗和预后判定的一个潜在靶点.
编辑: 郭鹏 电编: 鲁亚静
| 1. | El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology. 2007;132:2557-2576. [PubMed] [DOI] |
| 2. | Tang ZY, Ye SL, Liu YK, Qin LX, Sun HC, Ye QH, Wang L, Zhou J, Qiu SJ, Li Y. A decade's studies on metastasis of hepatocellular carcinoma. J Cancer Res Clin Oncol. 2004;130:187-196. [PubMed] [DOI] |
| 3. | Du Y, Cao GW. Challenges of incorporating gene expression data to predict HCC prognosis in the age of systems biology. World J Gastroenterol. 2012;18:3941-3944. [PubMed] [DOI] |
| 4. | Suemori S, Lynch-Devaney K, Podolsky DK. Identification and characterization of rat intestinal trefoil factor: tissue- and cell-specific member of the trefoil protein family. Proc Natl Acad Sci USA. 1991;88:11017-11021. [PubMed] [DOI] |
| 5. | Dhar DK, Wang TC, Tabara H, Tonomoto Y, Maruyama R, Tachibana M, Kubota H, Nagasue N. Expression of trefoil factor family members correlates with patient prognosis and neoangiogenesis. Clin Cancer Res. 2005;11:6472-6478. [PubMed] [DOI] |
| 6. | Yamachika T, Werther JL, Bodian C, Babyatsky M, Tatematsu M, Yamamura Y, Chen A, Itzkowitz S. Intestinal trefoil factor: a marker of poor prognosis in gastric carcinoma. Clin Cancer Res. 2002;8:1092-1099. [PubMed] |
| 7. | Taupin D, Pedersen J, Familari M, Cook G, Yeomans N, Giraud AS. Augmented intestinal trefoil factor (TFF3) and loss of pS2 (TFF1) expression precedes metaplastic differentiation of gastric epithelium. Lab Invest. 2001;81:397-408. [PubMed] [DOI] |
| 8. | Chan VY, Chan MW, Leung WK, Leung PS, Sung JJ, Chan FK. Intestinal trefoil factor promotes invasion in non-tumorigenic Rat-2 fibroblast cell. Regul Pept. 2005;127:87-94. [PubMed] |
| 9. | Semenza GL. Regulation of mammalian O2 homeostasis by hypoxia-inducible factor 1. Annu Rev Cell Dev Biol. 1999;15:551-578. [PubMed] [DOI] |
| 11. | Okada H, Kimura MT, Tan D, Fujiwara K, Igarashi J, Makuuchi M, Hui AM, Tsurumaru M, Nagase H. Frequent trefoil factor 3 (TFF3) overexpression and promoter hypomethylation in mouse and human hepatocellular carcinomas. Int J Oncol. 2005;26:369-377. [PubMed] |
| 12. | Leung WK, Yu J, Chan FK, To KF, Chan MW, Ebert MP, Ng EK, Chung SC, Malfertheiner P, Sung JJ. Expression of trefoil peptides (TFF1, TFF2, and TFF3) in gastric carcinomas, intestinal metaplasia, and non-neoplastic gastric tissues. J Pathol. 2002;197:582-588. [PubMed] [DOI] |
| 13. | Vestergaard EM, Borre M, Poulsen SS, Nexø E, Tørring N. Plasma levels of trefoil factors are increased in patients with advanced prostate cancer. Clin Cancer Res. 2006;12:807-812. [PubMed] |
| 14. | May FE, Westley BR. Expression of human intestinal trefoil factor in malignant cells and its regulation by oestrogen in breast cancer cells. J Pathol. 1997;182:404-413. [PubMed] [DOI] |
| 15. | Balcer-Kubiczek EK, Harrison GH, Xu JF, Gutierrez PL. Coordinate late expression of trefoil peptide genes (pS2/TFF1 and ITF/TFF3) in human breast, colon, and gastric tumor cells exposed to X-rays. Mol Cancer Ther. 2002;1:405-415. [PubMed] |