修回日期: 2013-09-08
接受日期: 2014-02-03
在线出版日期: 2014-03-18
目的: 对比观察VEGF165b重组蛋白(recombinant human VEGF165b protein, rhVEGF165b)与贝伐珠单抗对人胃癌裸鼠移植瘤生长的影响及作用机制.
方法: 用人胃癌细胞BGC-823接种于裸鼠皮下, 建立裸鼠移植瘤模型, 随机分为3组, 每组21只: rhVEGF165b组(腹腔注射rhVEGF165b 10 μg/kg)、贝伐珠单抗组(腹腔注射贝伐珠单抗5 mg/kg)、对照组(腹腔注射生理盐水10 mL/kg), 分别于1、2、3 wk测量裸鼠移植瘤体积及瘤质量, 免疫组织化学方法检测肿瘤组织中CD34表达(以阳性细胞数计算肿瘤微血管密度), TUNEL方法检测肿瘤组织细胞凋亡.
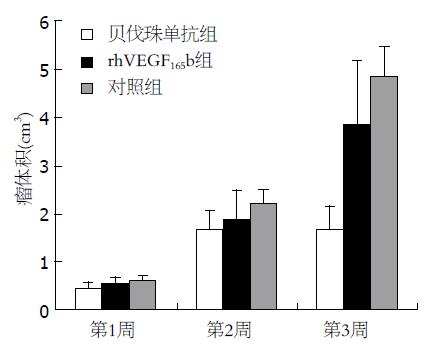
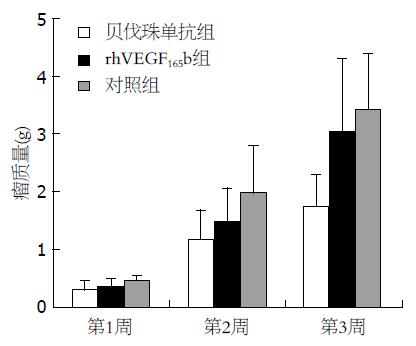
结果: 贝伐珠单抗组移植瘤体积(cm3)及瘤质量(g)在第1、2、3周均小于对照组(1 wk: 0.453±0.119 vs 0.637±0.084, 0.32±0.097 vs 0.46±0.093; 2 wk: 1.691±0.381 vs 2.238±0.29, 1.168±0.524 vs 2.013±0.833; 3 wk: 1.709±0.474 vs 4.872±0.594, 1.747±0.557 vs 3.463±0.986, 均P<0.05), 而rhVEGF165b组仅在第1、2周较对照组小(1 wk: 0.546±0.132 vs 0.637±0.084, 1.894±0.599 vs 0.46±0.093; 2 wk: 1.894±0.599 vs 2.238±0.29, 1.537±0.568 vs 2.013±0.833, 均P<0.05), 第3周其体积及瘤质量大于贝伐珠单抗组(3 wk: 3.843±1.339 vs 1.709±0.474, 3.066±1.281 vs 1.747±0.557, P<0.05), 与对照组无明显差异. rhVEGF165b组、贝伐珠单抗组CD34的表达水平在第1、2、3周均低于对照组(P<0.05, P<0.01), 凋亡指数高于对照组(P<0.05, P<0.01); 与贝伐珠单抗组相比, 第1周rhVEGF165b组CD34的表达水平更低(P<0.05), 但第2、3周却高于贝伐珠单抗组(P<0.01); rhVEGF165b组的凋亡指数在第1周明显高于贝伐珠单抗组(P<0.01), 而第2、3周却低于贝伐珠单抗组(P<0.05).
结论: rhVEGF165b、贝伐珠单抗对人胃癌移植瘤的生长有明显抑制作用, rhVEGF165b早期抑制血管生成、促进细胞凋亡表现更为明显.
核心提示: VEGF165b重组蛋白(recombinant human VEGF165b protein, rhVEGF165b)、贝伐珠单抗对人胃癌移植瘤的生长有明显抑制作用, rhVEGF165b早期抑制血管生成、促进细胞凋亡表现更为明显.
引文著录: 吴海荣, 关云艳, 吴锡平, 诸静芬. VEGF165b重组蛋白与贝伐珠单抗对人胃癌裸鼠移植瘤CD34表达及细胞凋亡的影响. 世界华人消化杂志 2014; 22(8): 1058-1063
Revised: September 8, 2013
Accepted: February 3, 2014
Published online: March 18, 2014
AIM: To investigate the effect of recombinant human VEGF165b protein (rhVEGF165b) and bevacizumab on expression of CD34 and cell apoptosis in human gastric carcinoma xenografts in nude mice.
METHODS: Thirty male nude mice were used to establish the human gastric carcinoma xenograft model. The mice were randomly divided into three groups: a rhVEGF165b group (intraperitoneal injection, 10 μg/kg), a bevacizumab group (intraperitoneal injection, 5 mg/kg) and a control group. Tumor growth was detected by measuring tumor volume and weight. The expression of CD34 and apoptosis of tumor cells were detected by immunohistochemistry and TdT-mediated dUTP nick end labeling (TUNEL) assay at weeks 1, 2 and 3, respectively.
RESULTS: Tumor volume and weight at weeks 1 and 2 in the rhVEGF165b group (week 1: 0.546 ± 0.132 vs 0.637 ± 0.084, 1.894 ± 0.599 vs 0.46 ± 0.093; week 2: 1.894 ± 0.599 vs 2.238 ± 0.29, 1.537 ± 0.568 vs 2.013 ± 0.833; P < 0.05 for all) and at weeks 1, 2 and 3 in the bevacizumab group (week 1: 0.453 ± 0.119 vs 0.637 ± 0.084, 0.320 ± 0.097 vs 0.460 ± 0.093; week 2: 1.691 ± 0.381 vs 2.238 ± 0.290, 1.168 ± 0.524 vs 2.013 ± 0.833; week 3: 1.709 ± 0.474 vs 4.872 ± 0.594, 1.747 ± 0.557 vs 3.463 ± 0.986, P < 0.05 for all) were significantly smaller than those in the control group. At week 3, tumor volume and weight were significantly larger in the rhVEGF165b group than in the bevacizumab group (3.843 ± 1.339 vs 1.709 ± 0.474, 3.066 ± 1.281 vs 1.747 ± 0.557, P < 0.05 for both). Microvascular density (MVD) and apoptosis index (AI) at weeks 1, 2 and 3 in the rhVEGF165b group and bevacizumab group were significantly different from those in the control group. MVD and AI also differed significantly between the rhVEGF165b group and bevacizumab group.
CONCLUSION: Both rhVEGF165b and bevacizumab can inhibit the growth of human gastric carcinoma cells possibly by inhibiting angiogenesis and inducing apoptosis, with rhVEGF165b having a more significant effect in early stage.
- Citation: Wu HR, Guan YY, Wu XP, Zhu JF. Effect of recombinant human VEGF165b protein and bevacizumab on expression of CD34 and cell apoptosis in human gastric carcinoma xenografts in nude mice. Shijie Huaren Xiaohua Zazhi 2014; 22(8): 1058-1063
- URL: https://www.wjgnet.com/1009-3079/full/v22/i8/1058.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i8.1058
目前, 恶性肿瘤已超过心脑血管疾病而位居致死原因的首位[1,2]. 有研究表明, 肿瘤的生长与血管内皮生长因子(vascular endothelial growth factor, VEGF)表达密切相关[3,4], VEGF165是体内最多的亚型. VEGF165b作为VEGF的新型剪接变构体, 具有抑制VEGF165所诱导的血管内皮细胞增殖、迁移生成的作用[5], 目前尚无VEGF165b对胃癌作用方面的研究. 本研究通过与贝伐珠单抗比较, 探讨rhVEGF165b对胃癌的治疗作用、机制, 从而为能否以VEGF165b为新靶点治疗该病提供初步的理论依据.
人胃癌细胞株BGC-823为本实验室传代培养; ♀Balb/c裸鼠, 4-5周龄, 体质量12-15 g, 购自上海斯莱克实验动物有限公司, SPF级条件饲养; 贝伐珠单抗注射液: Roche Pharma(Schweiz) Ltd, 批号: B3426; rhVEGF165b: R&D, 批号: HNC0910101; TUNEL原位检测试剂盒, 南京凯基, 货号: KGA7022; CD34抗体, 武汉博士德生物有限公司, 货号: BA0532; SP试剂盒, 福州迈新生物科技有限公司, 货号: kit-9999; 日本OLYMPUS显微镜IX51.
1.2.1 移植瘤模型建立: 收集培养的人低分化前胃癌细胞BGC-823悬液, 浓度为1×107个/mL, 取0.1 mL接种于裸鼠右侧腋窝皮下, 注射局部出现明显皮丘, 8 d后所有裸鼠均出现75-100 mm3大小的皮下结节, 移植瘤模型建立成功.
1.2.2 分组: 已成功建立皮下移植瘤模型的裸鼠随机分为对照组、贝伐珠单抗组及rhVEGF165b组, 每组21只, 3 d给药1次. 贝伐珠单抗组予腹腔注射贝伐珠单抗5 mg/kg, rhVEGF165b组予腹腔注射rhVEGF165b 10 μg/kg, 对照组给予等量生理盐水溶液. 于第1、2、3周测量瘤体体积及瘤质量, 并留取标本.
1.2.3 移植瘤体积及瘤质量测定: 于第1、2、3周分别用游标卡尺测量肿瘤的长度、宽度, 肿瘤体积V = 1/2×a×b2. V为肿瘤体积, a、b分别为肿瘤的长短径. 处死裸鼠后剥离瘤组织, 称取瘤质量.
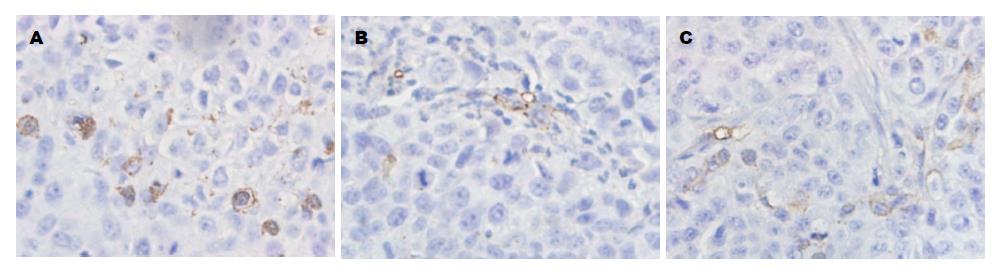
1.2.4 CD34的表达: 瘤体甲醛固定, 石蜡包埋切片, 脱蜡, 采用CD34抗体, SP免疫组织化学方法, DAB显色, 苏木素复染, 棕黄色环形为血管阳性表达. 微血管密度(microvascular density, MVD)计数结果判定, 参照Weidner方法[6], 先在低倍镜(×10)下扫视整个切片, 选取高血管密度区, 再在高倍镜(×40)下计数被染成棕黄色的血管数目, 取3个视野的平均值.
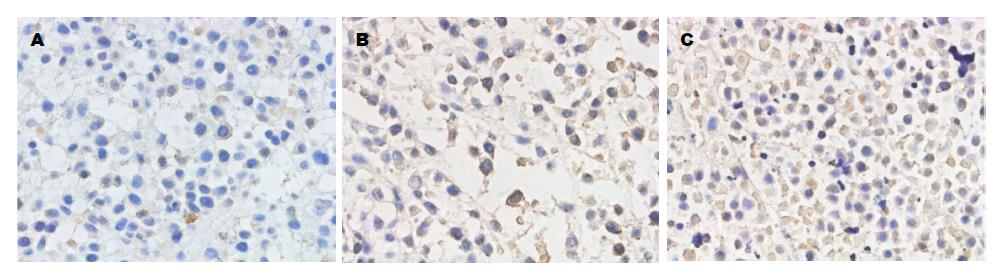
1.2.5 TUNEL方法检测细胞凋亡: 按照试剂盒说明书进行操作, 用DNA酶处理过的切片为阳性对照, 以PBS替代TUNEL反应液为阴性对照, 光学显微镜下取5个高倍视野观察拍照, 凋亡细胞为棕黄色, 正常细胞为蓝紫色, 计算出细胞凋亡指数(AI) = 凋亡细胞数/肿瘤细胞总数×100%.
统计学处理 用Stata8.0软件进行分析, 计量资料数据均以mean±SD表示, 统计采用t检验, P<0.05为差异有统计学意义.
贝伐珠单抗组移植瘤体积及瘤质量在第1、2、3周均小于对照组(P<0.05), 而rhVEGF165b组仅在第1、2周较对照组小(P<0.05) , 第3周其体积及瘤质量大于贝伐珠单抗组(P<0.05), 与对照组无明显差异(表1, 2, 图1, 2).
CD34主要表达于血管内皮细胞胞膜, 呈棕黄色至棕褐色, 逗点状、小管状或条索状, 分布不均呈异质性. rhVEGF165b组、贝伐珠单抗组MVD在第1、2、3周均低于对照组(P<0.05、P<0.01), 而rhVEGF165b组在第1周时MVD较贝伐珠单抗组低(P<0.05), 第3周却高于贝伐珠单抗组(P<0.01)(表3, 图3).
肿瘤的生长和转移均依赖于血管的形成, 在促进血管生成因子中, 作用最强且研究最广泛的就是VEGF. VEGF165是体内最多的亚型, 其生物活性最强且cDNA扩增丰度最高, 故在临床和动物实验中应用最广. 但在2002年Bates等[7]分离出VEGF的新型剪接变构体-VEGF165b, 其选择性剪接发生于外显子8的远端, 在结构上与VEGF165相比, 仅表现为终末6个氨基酸的不同, 但其可和VEGF165竞争性地与VEGFR2结合, 但仅能部分激动VEGFR2[8], 从而起到抑制VEGF165所诱导的内皮细胞增殖、迁移及血管舒张、血管生成的作用. VEGF165b也能与VEGFR1受体结合, 但亲合力的大小目前还不明确[9]. 研究显示VEGF165b广泛表达于正常组织中, 而在肾细胞癌、前列腺癌、恶性黑色素瘤、糖尿病患者眼组织中及先兆子痫胎盘中表达均下调[10-12], 在且应用外源性VEGF165b抑制了新生血管及肿瘤的生长[13]. 另外, VEGF165/VEGF165b的变化也与肾脏足细胞分化状态有关, 在分化的足细胞VEGF165b表达增高[14,15]. Rennel等[16]将结肠癌细胞种植于裸鼠颈背部皮下, 24 h后或肿瘤直径达4-5 mm时开始皮下或腹腔内注射重组VEGF165b蛋白, 结果也显示VEGF165b抑制了该肿瘤的生长, 且这一作用呈剂量依赖型, 但不影响血液动力学及肝脏的功能和形态学变化. 除此之外, VEGF165b也有抑制激光诱导的脉络膜新生血管生成的作用[17].
目前针对VEGF的靶向治疗主要包括VEGF单克隆抗体、VEGFR酪氨酸激酶抑制剂. 贝伐珠单抗属于单克隆抗体, 是直接作用于VEGF的人源化单克隆抗体, 含有93%人IgG骨架及7%鼠源结合区域. 可与VEGF结合, 阻止其与内皮细胞表面的VEGFR结合, 特异封闭VEGF的生物学功能, 如内皮细胞有丝分裂原活性、血管通透性、血管生成活性等[18,19]. 临床试验显示, 贝伐珠单抗与抗肿瘤方案联合治疗胃癌, 可明显提高生存率、显著延长患者的生存期[20], 但目前尚缺乏评估对该药敏感性的生物学指标. Yamashita-Kashima等[21]应用9种不同类型的人胃癌细胞株构建移植瘤模型, 其中有6种胃癌细胞株(包括GXF97、MKN-45、MKN-28、4-1ST、SC-08-JCK和SC-09-JCK)对贝伐珠单抗敏感, 另外3种(SCH、SC-10-JCK和NCI-N87)对其不敏感, 而且VEGF表达水平可以作为判断对该药是否敏感的生物学指标. 由此可见, 贝伐珠单抗并不是对所有类型的胃癌有效, 且由于单克隆抗体常有免疫原性, 而且在某些组织中可诱导血管退行性变[22], 而实验显示VEGF165b对生理性血管生成没有影响[23], 因此从这方面看来VEGF165b比贝伐珠单抗具有一定的优越性.
我们的前期实验显示, 与癌旁正常组织相比, 胃癌组织中也有VEGF165b表达的下调, 因此我们推测rhVEGF165b也具有抑制胃癌生长的作用. 在实验中, 我们以BGC-823细胞株构建了胃癌的动物模型, 观察并比较了rhVEGF165b和贝伐珠单抗对胃癌移植瘤的作用, 结果显示rhVEGF165b具有抑制瘤体血管生成和促进癌细胞凋亡的作用, 因此也就抑制了胃癌裸鼠移植瘤的生长, 这种效应在第1、2周比较明显, 但第3周时rhVEGF165b作用则弱于贝伐珠单抗, 这可能与后期随着肿瘤的增长VEGF165b重组蛋白的剂量亦需相应增加有关. 尽管如此, 我们可以看出rhVEGF165b有望成为治疗胃癌的新选择.
恶性肿瘤已超过心脑血管疾病而位居致死原因的首位. 胃癌是常见消化系统恶性肿瘤之一, 严重危害人类生命和健康, 如何提高治疗效果仍然是世界范围内关注的课题.
张小晋, 主任医师, 北京积水潭医院; 蒋敬庭, 教授, 常州市第一人民医院(苏州大学附属第三医院)肿瘤生物诊疗中心
研究表明肿瘤的生长与血管内皮生长因子(vascular endothelial growth factor, VEGF)表达密切相关, VEGF165是体内最多的亚型, 其生物活性最强且cDNA扩增丰度最高, VEGF165b作为VEGF的新型剪接变构体,具有抑制VEGF165所诱导的血管内皮细胞增殖、迁移生成的作用.
有研究表明, 补充VEGF165b对肾细胞癌、前列腺癌、结肠癌新生血管生成及肿瘤的生长有一定的抑制作用.
目前尚无VEGF165b对胃癌作用方面的研究,通过与贝伐珠单抗比较, 探讨rhVEGF165b对胃癌的治疗作用、机制.
rhVEGF165b具有抑制瘤体血管生成和促进癌细胞凋亡的作用,抑制了胃癌裸鼠移植瘤的生长, 以VEGF165b为新靶点治疗提供初步的理论依据.
本文设计合理, 实验方法得当, 结论可信, 论文质量较好, 有科学性.
编辑: 田滢 电编: 鲁亚静
| 1. | Hotta K, Oyama T, Akamatsu T, Tomori A, Hasebe O, Nakamura N, Kojima E, Suga T, Miyabayashi H, Ohta H. A comparison of outcomes of endoscopic submucosal dissection (ESD) For early gastric neoplasms between high-volume and low-volume centers: multi-center retrospective questionnaire study conducted by the Nagano ESD Study Group. Intern Med. 2010;49:253-259. [PubMed] [DOI] |
| 2. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 3. | Martins SF, Reis RM, Rodrigues AM, Baltazar F, Filho AL. Role of endoglin and VEGF family expression in colorectal cancer prognosis and anti-angiogenic therapies. World J Clin Oncol. 2011;2:272-280. [PubMed] |
| 4. | Li SG, Ye ZY, Zhao ZS, Tao HQ, Wang YY, Niu CY. Correlation of integrin beta3 mRNA and vascular endothelial growth factor protein expression profiles with the clinicopathological features and prognosis of gastric carcinoma. World J Gastroenterol. 2008;14:421-427. [PubMed] [DOI] |
| 6. | Weidner N. Intratumor microvessel density as a prognostic factor in cancer. Am J Pathol. 1995;147:9-19. [PubMed] |
| 7. | Bates DO, Cui TG, Doughty JM, Winkler M, Sugiono M, Shields JD, Peat D, Gillatt D, Harper SJ. VEGF165b, an inhibitory splice variant of vascular endothelial growth factor, is down-regulated in renal cell carcinoma. Cancer Res. 2002;62:4123-4131. [PubMed] |
| 8. | Cébe Suarez S, Pieren M, Cariolato L, Arn S, Hoffmann U, Bogucki A, Manlius C, Wood J, Ballmer-Hofer K. A VEGF-A splice variant defective for heparan sulfate and neuropilin-1 binding shows attenuated signaling through VEGFR-2. Cell Mol Life Sci. 2006;63:2067-2077. [PubMed] [DOI] |
| 9. | Glass CA, Harper SJ, Bates DO. The anti-angiogenic VEGF isoform VEGF165b transiently increases hydraulic conductivity, probably through VEGF receptor 1 in vivo. J Physiol. 2006;572:243-257. [PubMed] |
| 10. | Pritchard-Jones RO, Dunn DB, Qiu Y, Varey AH, Orlando A, Rigby H, Harper SJ, Bates DO. Expression of VEGF(xxx)b, the inhibitory isoforms of VEGF, in malignant melanoma. Br J Cancer. 2007;97:223-230. [PubMed] [DOI] |
| 11. | Perrin RM, Konopatskaya O, Qiu Y, Harper S, Bates DO, Churchill AJ. Diabetic retinopathy is associated with a switch in splicing from anti- to pro-angiogenic isoforms of vascular endothelial growth factor. Diabetologia. 2005;48:2422-2427. [PubMed] [DOI] |
| 12. | Bates DO, MacMillan PP, Manjaly JG, Qiu Y, Hudson SJ, Bevan HS, Hunter AJ, Soothill PW, Read M, Donaldson LF. The endogenous anti-angiogenic family of splice variants of VEGF, VEGFxxxb, are down-regulated in pre-eclamptic placentae at term. Clin Sci (Lond). 2006;110:575-585. [PubMed] [DOI] |
| 13. | Woolard J, Wang WY, Bevan HS, Qiu Y, Morbidelli L, Pritchard-Jones RO, Cui TG, Sugiono M, Waine E, Perrin R. VEGF165b, an inhibitory vascular endothelial growth factor splice variant: mechanism of action, in vivo effect on angiogenesis and endogenous protein expression. Cancer Res. 2004;64:7822-7835. [PubMed] [DOI] |
| 14. | Cui TG, Foster RR, Saleem M, Mathieson PW, Gillatt DA, Bates DO, Harper SJ. Differentiated human podocytes endogenously express an inhibitory isoform of vascular endothelial growth factor (VEGF165b) mRNA and protein. Am J Physiol Renal Physiol. 2004;286:F767-F773. [PubMed] [DOI] |
| 15. | Schumacher VA, Jeruschke S, Eitner F, Becker JU, Pitschke G, Ince Y, Miner JH, Leuschner I, Engers R, Everding AS. Impaired glomerular maturation and lack of VEGF165b in Denys-Drash syndrome. J Am Soc Nephrol. 2007;18:719-729. [PubMed] [DOI] |
| 16. | Rennel ES, Hamdollah-Zadeh MA, Wheatley ER, Magnussen A, Schüler Y, Kelly SP, Finucane C, Ellison D, Cebe-Suarez S, Ballmer-Hofer K. Recombinant human VEGF165b protein is an effective anti-cancer agent in mice. Eur J Cancer. 2008;44:1883-1894. [PubMed] [DOI] |
| 17. | Tayama M, Furuhata T, Inafuku Y, Okita K, Nishidate T, Mizuguchi T, Kimura Y, Hirata K. Vascular endothelial growth factor 165b expression in stromal cells and colorectal cancer. World J Gastroenterol. 2011;17:4867-4874. [PubMed] [DOI] |
| 18. | Ferrara N, Hillan KJ, Gerber HP, Novotny W. Discovery and development of bevacizumab, an anti-VEGF antibody for treating cancer. Nat Rev Drug Discov. 2004;3:391-400. [PubMed] [DOI] |
| 20. | Shah MA, Ramanathan RK, Ilson DH, Levnor A, D'Adamo D, O'Reilly E, Tse A, Trocola R, Schwartz L, Capanu M. Multicenter phase II study of irinotecan, cisplatin, and bevacizumab in patients with metastatic gastric or gastroesophageal junction adenocarcinoma. J Clin Oncol. 2006;24:5201-5206. [PubMed] [DOI] |
| 21. | Yamashita-Kashima Y, Fujimoto-Ouchi K, Yorozu K, Kurasawa M, Yanagisawa M, Yasuno H, Mori K. Biomarkers for antitumor activity of bevacizumab in gastric cancer models. BMC Cancer. 2012;12:37. [PubMed] |
| 22. | Baffert F, Le T, Sennino B, Thurston G, Kuo CJ, Hu-Lowe D, McDonald DM. Cellular changes in normal blood capillaries undergoing regression after inhibition of VEGF signaling. Am J Physiol Heart Circ Physiol. 2006;290:H547-H559. [PubMed] [DOI] |