修回日期: 2014-01-31
接受日期: 2014-02-18
在线出版日期: 2014-03-18
肝损伤是各种生物及化学因素引起的肝组织病理性损伤. 肝损伤后的修复工作一直是肝脏研究的重点内容, 其机制涉及许多信号通路、细胞因子和转录因子. 细胞转导子和转录活化子3(signal transducers and activators of transcription 3, STAT3)是细胞转导子和转录活化子家族(STATs)的一员, 是位于胞质内的信号转录因子. 近年研究发现, STAT3的激活在肝损伤后修复过程中发挥重要作用, 通过促进肝细胞增殖, 加快损伤肝脏修复速度. 通过调节糖类及脂质代谢, 维持机体内环境稳态. 通过激活肝保护性急性期蛋白表达, 增强肝脏对抗细菌感染, 化学物质及药物导致的急性肝损伤的能力. 本文将从STAT3相关信号通路的构成, 调节方式及肝损伤后修复作用做一综述.
核心提示: 本文着重介绍了细胞转导子和转录活化子3(signal transducers and activators of transcription 3)在肝损伤后保护中的重要作用, 包括促进肝细胞增殖, 维持肝脏糖脂代谢稳定以及增强肝脏受损后的保护性急性期反应.
引文著录: 陈欣黎, 孟强, 刘克辛. STAT3信号通路在肝损伤保护中的作用. 世界华人消化杂志 2014; 22(8): 1051-1057
Revised: January 31, 2014
Accepted: February 18, 2014
Published online: March 18, 2014
Liver injury is a complicated pathological process caused by multiple biological and chemical factors. The repair mechanism after liver injury is the focus of liver research, involving numerous signaling pathways, cytokines and transcription factors. Signal transducer and activator of transcription 3 (STAT3) is a cytoplasmic signal transcription factor which belongs to the signal transducers and activators of transcription family and plays a critical role in the process of liver injury repair. STAT3 activation boosts the process of liver repair by promoting hepatocyte proliferation, maintains homeostasis by regulating metabolism of carbohydrates and lipids, and prevents the liver from bacterial infection and acute liver injury induced by toxic chemicals and drugs by increasing the expression of beneficial acute phase proteins. This review focuses on the composition of STAT3 signaling pathway and its role in liver injury repair.
- Citation: Chen XL, Meng Q, Liu KX. Role of STAT3 signaling pathway in repair of liver injury. Shijie Huaren Xiaohua Zazhi 2014; 22(8): 1051-1057
- URL: https://www.wjgnet.com/1009-3079/full/v22/i8/1051.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i8.1051
近年来, 随着人们生活水平的提高以及对药物的过度依赖, 肝损伤的发病率逐年增加[1]. 对于肝损伤的患者, 如果未进行及时有效的治疗, 往往会导致肝纤维化发生, 最终导致肝脏的衰竭坏死[2]. 如何维持肝损伤后肝脏内环境的稳态以及肝细胞的再生代偿能力, 进而提高损伤后肝脏恢复效果已成为当今急需解决的课题之一. 细胞转导子和转录活化子3(signal transducers and activators of transcription 3, STAT3)作为细胞转导子和转录活化子家族(STATs)的一员, 与肝脏的关系最为密切, 是构成JAK-STAT通路的重要组成部分[3-7], 并与多种细胞因子直接相关.本文简要阐述了肝损伤机制, 细胞转导子和转录活化子家族各成员在肝脏中的作用, STAT3的基本性质, 着重对STAT3的肝保护机制做一综述.
肝脏是人体最大的代谢器官, 担负着人体重要的生理功能. 目前常见的肝损伤类型主要包括肝炎病毒、细菌或寄生虫等导致的生物性肝损伤以及药物、工业毒物或乙醇等导致的化学性肝损伤. 其中药物、乙醇等导致的化学性肝损伤最为严重. 根据美国急性肝衰竭研究组织(United States Acute Liver Failure Study Group, USALFSG)公布的消息显示, 药物诱导的肝损伤已经占到急性肝衰竭的50%[8]. 为此, 美国食品和药物监督管理局(U.S. Food and Drug Administration, FDA)已经宣布, 溴芬酸钠、乙溴替丁及曲格列酮3种药物在某些情况下会对肝脏造成一定的损害而退市[9-11]. 目前虽然化学性肝损伤的很多机制仍然未知, 但总体可以概括为两条途经: 直接肝脏毒性及不良性免疫反应[1], 一方面, 具有生物活性的化学物质进入体内后, 可以和蛋白质、脂质、核酸等生物大分子相互作用, 从而导致蛋白质功能障碍、脂质过氧化、DNA损伤及氧化应激反应等, 最终导致细胞内离子梯度紊乱和钙库功能失调, 从而引起肝细胞死亡[12]; 另一方面, 肝细胞功能丧失及死亡会激活先天性及获得性免疫反应, 导致库普弗细胞(Kupffer cells, KC)、自然杀伤细胞(natural killer, NK)、自然杀伤T细胞(natural killer T, NKT)等免疫细胞释放, 这些免疫细胞通过产生促炎性因子及分泌趋化因子, 进一步加速炎性细胞进入肝脏加重肝损伤[13,14].
STATs是Darnell[15]在1994年研究干扰素信号通路时发现的一类胞浆转录因子家族. 到目前为止, 在生物体中总共发现十几种STAT家族成员, 其中在哺乳动物中主要存在STAT1-4、STAT5a、STAT5b、STAT6 7种主要基因型[3,5](表1). STATs既是信号传导子, 又是转录因子, 同时也是酪氨酸蛋白激酶偶联受体信号通路的重要组成部分, 主要与酪氨酸蛋白激酶家族JAK(janus kinase)偶联, 以JAK-STAT信号通路的形式参与信号调节过程[3].
| STATs | 相关通路因子 | 肝脏中的作用 |
| STAT1 | IFN-α/β | 抗病毒 |
| IFN-γ | 抗肿瘤, 抗炎和促凋亡作用 | |
| STAT2 | IFN-α/β | 抗病毒作用 |
| IFN-γ(IL-28/IL-29) | ||
| STAT3 | IL-6和相关细胞因子 | 急性期反应 |
| IL-22 | 肝再生及肝保护作用 | |
| STAT4 | IL-12 | 加重缺血再灌注损伤 |
| STAT5 | 生长激素 | 包括代谢酶, 生长因子在内的众多肝脏基因的调节 |
| STAT6 | IL-4 | 促进T细胞肝炎 |
| IL-13 | 减轻缺血再灌注损伤 |
STAT主要由以下6个结构域构成: N端结构域、Coiled-coil结构域、DNA结合域、铰链域、SH2结构域和转录活化结构域[16,17](图1). 其中SH2结构域是最为保守和重要的结构域, 其上的705位酪氨酸的磷酸化在STAT3形成二聚体的过程中发挥重要作用. 其C端的转录活化结构域中含有一些丝氨酸结合位点, 能够被丝氨酸激酶所活化, 参与到STAT3的转录活性调节中[17].
JAK-STAT通路由一系列蛋白激酶瀑布组成, 在哺乳动物中JAK家族包括JAK1、JAK2、JAK3和Tyk2 4位成员[4,5,18]. 在哺乳动物中, JAK-STAT通路是很多细胞因子及生长因子的重要调节通路, 在细胞增殖、分化、迁移和凋亡中发挥重要作用.
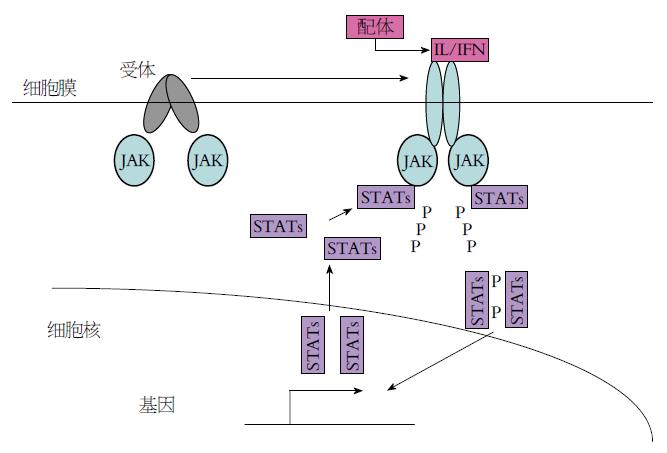
JAK-STAT通路主要以如下方式进行调节. (1)信号跨膜转导: 配体与受体α(或和β)亚基结合, 形成活化的α、β二聚体或α、β、γ三聚体. JAK与受体胞质部分膜旁区Box1结合, 催化受体C端酪氨酸残基磷酸化, 形成磷酸化酪氨酸位点进而激活STAT磷酸化; (2)STAT活化: STAT借助自身的SH2结构和磷酸化酪氨酸残基形成互补的活性二聚体; (3)STAT由胞质向核内转位: 活化的STAT二聚体由胞质向核内转位, 与DNA特定序列结合, 调控基因表达, STAT与DNA结合还需自身一些丝氨酸和苏氨酸残基的磷酸化, 可能由有丝分裂原激活的蛋白激酶(MAPKinase)参与磷酸化[4-7](图2).
STAT3的编码基因位于人类第17号染色体, STAT3最初因其致癌作用被归为癌基因, 是癌细胞信号传导的关键节点. 随着对STAT3研究的不断深入, 进一步发现STAT3具有显著的抗凋亡和促有丝分裂活性, 能够上调一系列细胞存活及增殖相关基因[19-21]. 这暗示着STAT3可能在各个器官尤其是人体唯一具有再生功能的肝脏的有丝分裂及抗凋亡过程中有着更为广泛的作用. 随后的多年研究发现, STAT3在肝脏中可以被白介素-6(interleukin-6, IL-6), 白血病抑制因子(leukemia inhibitory factor, LIF), 睫状神经营养因子(ciliary neurotrophic factor, CNTF)等细胞因子激活, 近来又发现HCV NS5A和HBX等肝炎病毒也同样能够激活肝脏中STAT3的磷酸化, 进而将胞外信号分子传入细胞核中激活或抑制相关基因表达[22-27].
STAT3作为转录因子家族的一员, 主要负责调控Bcl-2、Bcl-xL、Mcl-1、FLIP、Ref-1、Cyclin D1、c-myc等基因的转录过程. 近年来, STAT3在肝保护中的重要作用逐渐被阐明, 总结起来, 主要表现在3个方面: (1)STAT3的激活可以促进肝损伤后肝细胞的增殖; (2)STAT3维持肝脏糖平衡及脂质代谢稳定; (3)STAT3增强肝脏急性期反应.
肝脏在受到损伤后, 非损伤部位肝组织的再生对于恢复肝脏功能至关重要. 1995年, Cressman等[28]发现, 部分肝切除后30 min, STAT3与DNA结合能力有所增加, 并在3 h后达到最初的30倍. 有报道显示, STAT3能够延长肝细胞周期G1期, 进而使肝细胞有更为充裕的时间合成再生所需的各种蛋白质、糖类、脂类、RNA等生化物质[29]. Li等[21]使用STAT3基因敲除小鼠Alb-STAT3fl/fl发现, 当STAT3基因缺失时, 5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxyuridine, BrdU)标记阳性小鼠肝细胞数明显减少, 说明Alb-STAT3fl/fl小鼠肝细胞DNA合成能力减弱, 细胞增殖明显延缓. 且G1期细胞周期素家族CyclinD1表达降低, Cyclin E表达时间延迟. 另一方面, STAT3能够激活包括c-myc、c-jun等原癌基因表达, 研究发现c-myc, c-jun通过JNK/c-Jun通路诱导细胞周期由G0期向G1期转变加快细胞周期, 同时激活Cyclin D1表达促进细胞增殖[30,31]. 上述结果表明, 当肝脏发生损伤时, 一方面, STAT3表达应急性上调并且与DNA的结合能力增强. 另一方面, STAT3直接或间接激活细胞周期素Cyclin D1和Cyclin E表达, 加快细胞有丝分裂, 通过两方面联合作用促进肝损伤后的肝细胞增殖.
肝脏在机体能量平衡及糖脂代谢过程中起重要作用, 肝脏能够通过糖原释放及糖异生作用维持血糖平衡, 通过分泌胆汁, 合成脂肪、脂肪酸及胆固醇等维持脂质代谢稳定. 当肝组织广泛受损时, 肝细胞表面胰岛素受体大量受损, 胰岛素抵抗症状明显加重. 同时, 肝细胞将葡萄糖合成糖原的能力大大降低, 糖异生作用增强, 使得血糖浓度进一步升高, 破坏体内糖平衡[32,33].
5.2.1 STAT3维持糖代谢平衡: 研究表明, STAT3能够抑制肝脏糖异生作用, 改善胰岛素抵抗症状. 2004年, Inoue等[34]将肝特异性STAT3基因敲除小鼠(L-ST3KO)与野生小鼠相比较, 正常状态下血糖浓度大致相同, 但胰岛素浓度明显偏高, 分别对两种小鼠注射等量胰岛素, L-ST3KO小鼠血糖浓度下降速率明显慢于野生鼠. 表明L-ST3KO小鼠较野生小鼠出现了明显的胰岛素抵抗症状. 对L-ST3KO小鼠注射带有STAT3活性基因的腺病毒AxCASTAT-3C并使其在小鼠体内稳定表达后发现, 小鼠血糖和血浆胰岛素浓度明显降低, 并且糖异生基因磷酸烯醇丙酮酸羧基酶1基因(phosphoenolpyruvate carboxykinase 1, Pck1)和葡萄糖-6-磷酸酶基因(glucose-6-phosphatase, G6pc)的表达明显下调. Pck1和G6pc基因是糖异生关键基因. Pck1基因编码磷酸烯醇丙酮酸羧激酶, 是糖异生作用在肝脏和肾脏进行的关键酶. G6pc基因编码葡萄糖-6-磷酸酶. 葡萄糖-6-磷酸酶催化糖原分解和糖异生的最后一步环节. 两者都在糖异生作用的最关键环节发挥着调节作用. 进一步研究发现, 给予正常小鼠葡萄糖或者静脉注射胰岛素能诱导STAT3的磷酸化, 在肝脏特异性STAT3基因敲除小鼠中, 颅内室注射胰岛素的降血糖作用减弱, 表明STAT3促进胰岛素在大脑中的作用, 并进一步抑制肝脏葡萄糖合成[35]. 上述结果表明, STAT3在维持体内糖平衡过程中发挥很大作用, 且此作用与抑制糖异生基因Pck1和G6pc的表达及促进胰岛素在大脑中作用的发挥有直接的关系.
5.2.2 STAT3改善肝细胞脂质代谢: 肝脏作为脂肪酸合成和脂蛋白合成的中心场所, 在脂质代谢中扮演重要的角色. 当肝脏脂质代谢紊乱时, 包括B型氧化作用, 极低密度脂蛋白分泌和胆汁酸合成途径在内的多种肝脏功能将会发生机能障碍[36]. 目前包括法尼醇X受体(farnesoid X receptor, FXR), 维甲酸X受体(retinoid-X receptor, RXR)等核受体及Cyp3A1等胆汁酸合成酶参与肝脏脂质代谢过程中. 有研究表明, IL-6诱导的STAT3通路可能参与到肝损伤后的肝脏脂质代谢过程中. 长期给予IL-6能够改善高脂和酒精饮食肝脏甘油三酯分泌及肝脏胆汁酸β-氧化过程. 使用油红O染色发现, IL-6处理10 d后, 高脂和酒精饮食肝脏中的大脂肪滴明显降低, 肝功能改善[37,38]. 上述结果说明, IL-6能改善肝脏中的脂质代谢. 进一步的研究发现, IL-6处理后, 正常老鼠中STAT3的磷酸化高于肥胖的OB/OB老鼠, 说明STAT3的磷酸化与肝脏的脂质的代谢之间有着直接的联系. 另有研究说明, 将显性抑制的STAT3基因转入视网膜血管内皮细胞后, 瘦素激活血管内皮生长因子(vascular endothelial growth factor, VEGF)表达的作用几乎完全消失[39]. VEGF可刺激血管细胞生成、分化和生长, 在肝再生过程中毛细血管的出芽生长中发挥重要作用, 为葡萄糖、脂质等进入肝细胞, 保障受损肝组织生长提供了有利条件[40-43].
急性期反应是人体受到感染、组织损伤、手术、肿瘤生长或免疫失调等应激源致使机体部分或整体功能失调时, 在短时间内(数小时至数日)机体自主产生包括促炎性细胞因子释放, 脉管系统和免疫细胞激活, 急性期蛋白生成等在内的显著性变化[44-46]. 大多数急性期蛋白例如铜蓝蛋白补体因子3(ceruloplasmin and complement factor-3, C3), 结合珠蛋白(haptoglobin), C-反应蛋白(C-reactive protein, CRP), 血清淀粉样蛋白A(serum amyloid A protein, SAA)等都是抑制细菌生长, 恢复机体内环境稳态等保护蛋白, 在肝脏对抗细菌感染, 化学物质及药物导致的急性肝损伤过程中发挥重要作用[47-49]. Alonzi等[45]使用STAT3基因选择性敲除小鼠MX+STAT3 fl/fl与对照组小鼠对比发现, 在LPS以及IL-6诱导的急性期反应过程中, C3、SAA等急性期蛋白在MX+STAT3 fl/fl小鼠中表达明显低于对照组小鼠. STAT3与细胞核因子-κB p65亚基(NF-κB p65, RelA)的基因突变小鼠中, 肝炎引起的肝脏急性期反应几乎停滞[50]. 进一步研究发现, STAT3通过自身反应元件与大多数急性期蛋白基因的5'-调节区结合, 直接调节基因表达强弱. 除此之外, STAT3还能够在包括翻译、转录稳定性及翻译后调节等方面对至少部分急性期蛋白基因进行转录后调节[51-53]. 上述研究表明, STAT3在肝脏的急性期反应的产生、发展以及急性期蛋白的激活表达中发挥至关重要的作用.
STAT3能够被IL-6家族细胞因子、IL-22及肝脏病毒蛋白在内的众多细胞因子及病毒蛋白激活. 活化后的STAT3在肝保护过程中发挥重要的作用, 主要表现在: (1)部分肝切除后, STAT3能够通过应急性激活, 直接或间接诱导肝脏细胞内Cyclin D1及Cyclin E的表达, 调控细胞周期, 促进肝细胞增殖; (2)STAT3在糖及脂质代谢过程中, 通过加强胰岛素在脑中作用强度、抑制糖异生关键基因Pck1和G6pc减缓糖异生作用, 降低血糖含量以及减轻胰岛素抵抗的症状. 同时通过加强血管内皮生长因子的表达等方式改善肝脏脂质代谢; (3)STAT3能够增强急性期反应蛋白C3、SAA等表达量, 进而恢复肝脏内环境稳态, 有益于肝损伤后肝脏的恢复效果.
总之, STAT3信号通路在肝保护过程中发挥着必不可少的调控作用. 在不的将来, 很可能会有专门针对STAT3信号通路的肝保护药物用于急慢性肝损伤的治疗过程. 深入研究STAT3信号通路有利与我们更好地理解肝损伤的复杂机制, 能够进一步为患者提供药理学或基因水平的更加安全有效的治疗方案.
药物滥用、酗酒等因素导致的急慢性肝损伤的发病率逐年增加. 研究发现, 肝损伤后内环境稳态的维护以及肝细胞的再生代偿过程对于损伤后肝脏修复过程至关重要. 细胞转导子和转录活化子3(signal transducers and activators of transcription 3, STAT3)是细胞转导子和转录活化子家族(STATs)的重要成员, 能够以同源二聚体的形式进入细胞核内, 直接参与基因的转录过程. 在胞内主要与酪氨酸蛋白激酶家族JAK(janus kinase)偶联, 以JAK-STAT3通路形式参与白介素-6(interleukin-6, IL-6), 白血病抑制因子(leukemia inhibitory factor, LIF)等胞外信号分子在肝细胞内的信号传递过程并具有显著的抗凋亡和促有丝分裂活性. 近来研究发现, STAT3能够直接或间接的调节肝修复过程中重要基因的表达, 成为肝修复必不可少的调节因子.
金山, 主任医师, 内蒙古医学院附属医院普通外科
STAT3及相关信号通路肝保护作用的机制是目前肝脏研究的热点, 如何通过调节相关细胞因子及通路, 诱导STAT3在损伤后肝脏中的适度表达是目前肝脏研究中新的方向.
Inoue等研究者发现, 肝特异性STAT3基因敲除小鼠相对于野生小鼠, 胰岛素浓度明显偏高, 出现胰岛素抵抗症状. 注射含有STAT3活性基因的腺病毒AxCASTAT-3C后, 胰岛素抵抗症状减弱, 且糖异生关键基因Pck1和G6pc表达明显的降低.
本文简要概述了肝损伤过程, STATs家族分型, STAT3的基本性质包括其结构, 作用方式及上游调节因子. 着重阐述了STAT3与肝保护的关系, 并在此基础上进一步分析了STAT3发挥肝保护作用的机制, 对研发肝保护治疗的药物有重要的指导意义.
STAT3可能作为肝保护药物的治疗靶点, 通过药物激活JAK-STAT3通路或许可以成为肝脏损伤后修复的新的靶点, 为临床肝病治疗提供新的思路.
本文作为综述性文章, 层次、逻辑、整体把握较好.
编辑: 郭鹏 电编: 鲁亚静
| 2. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] [DOI] |
| 3. | Al Zaid Siddiquee K, Turkson J. STAT3 as a target for inducing apoptosis in solid and hematological tumors. Cell Res. 2008;18:254-267. [PubMed] [DOI] |
| 4. | O'Shea JJ, Gadina M, Schreiber RD. Cytokine signaling in 2002: new surprises in the Jak/Stat pathway. Cell. 2002;109 Suppl:S121-S131. [PubMed] [DOI] |
| 5. | Kisseleva T, Bhattacharya S, Braunstein J, Schindler CW. Signaling through the JAK/STAT pathway, recent advances and future challenges. Gene. 2002;285:1-24. [PubMed] [DOI] |
| 6. | Gimeno R, Lee CK, Schindler C, Levy DE. Stat1 and Stat2 but not Stat3 arbitrate contradictory growth signals elicited by alpha/beta interferon in T lymphocytes. Mol Cell Biol. 2005;25:5456-5465. [PubMed] [DOI] |
| 7. | Murray PJ. The JAK-STAT signaling pathway: input and output integration. J Immunol. 2007;178:2623-2629. [PubMed] |
| 8. | Ostapowicz G, Fontana RJ, Schiødt FV, Larson A, Davern TJ, Han SH, McCashland TM, Shakil AO, Hay JE, Hynan L. Results of a prospective study of acute liver failure at 17 tertiary care centers in the United States. Ann Intern Med. 2002;137:947-954. [PubMed] [DOI] |
| 9. | Hunter EB, Johnston PE, Tanner G, Pinson CW, Awad JA. Bromfenac (Duract)-associated hepatic failure requiring liver transplantation. Am J Gastroenterol. 1999;94:2299-2301. [PubMed] [DOI] |
| 10. | Withdrawal of medicinal products containing ebrotidine: liver toxicity. WHO Inform Exchange Syst. 1998;72:1. |
| 11. | Kohlroser J, Mathai J, Reichheld J, Banner BF, Bonkovsky HL. Hepatotoxicity due to troglitazone: report of two cases and review of adverse events reported to the United States Food and Drug Administration. Am J Gastroenterol. 2000;95:272-276. [PubMed] [DOI] |
| 12. | Blazka ME, Wilmer JL, Holladay SD, Wilson RE, Luster MI. Role of proinflammatory cytokines in acetaminophen hepatotoxicity. Toxicol Appl Pharmacol. 1995;133:43-52. [PubMed] [DOI] |
| 13. | Blazka ME, Elwell MR, Holladay SD, Wilson RE, Luster MI. Histopathology of acetaminophen-induced liver changes: role of interleukin 1 alpha and tumor necrosis factor alpha. Toxicol Pathol. 1996;24:181-189. [PubMed] [DOI] |
| 14. | Reilly TP, Brady JN, Marchick MR, Bourdi M, George JW, Radonovich MF, Pise-Masison CA, Pohl LR. A protective role for cyclooxygenase-2 in drug-induced liver injury in mice. Chem Res Toxicol. 2001;14:1620-1628. [PubMed] [DOI] |
| 15. | Darnell JE, Kerr IM, Stark GR. Jak-STAT pathways and transcriptional activation in response to IFNs and other extracellular signaling proteins. Science. 1994;264:1415-1421. [PubMed] [DOI] |
| 16. | Ren Z, Mao X, Mertens C, Krishnaraj R, Qin J, Mandal PK, Romanowski MJ, McMurray JS, Chen X. Crystal structure of unphosphorylated STAT3 core fragment. Biochem Biophys Res Commun. 2008;374:1-5. [PubMed] [DOI] |
| 17. | Hoey T, Schindler U. STAT structure and function in signaling. Curr Opin Genet Dev. 1998;8:582-587. [PubMed] [DOI] |
| 18. | Rawlings JS, Rosler KM, Harrison DA. The JAK/STAT signaling pathway. J Cell Sci. 2004;117:1281-1283. [PubMed] [DOI] |
| 19. | Bromberg JF, Wrzeszczynska MH, Devgan G, Zhao Y, Pestell RG, Albanese C, Darnell JE. Stat3 as an oncogene. Cell. 1999;98:295-303. [PubMed] [DOI] |
| 20. | Fukada T, Hibi M, Yamanaka Y, Takahashi-Tezuka M, Fujitani Y, Yamaguchi T, Nakajima K, Hirano T. Two signals are necessary for cell proliferation induced by a cytokine receptor gp130: involvement of STAT3 in anti-apoptosis. Immunity. 1996;5:449-460. [PubMed] [DOI] |
| 21. | Li W, Liang X, Kellendonk C, Poli V, Taub R. STAT3 contributes to the mitogenic response of hepatocytes during liver regeneration. J Biol Chem. 2002;277:28411-28417. [PubMed] [DOI] |
| 22. | Nguyen VA, Gao B. Cross-talk between alpha(1B)-adrenergic receptor (alpha(1B)AR) and interleukin-6 (IL-6) signaling pathways. Activation of alpha(1b)AR inhibits il-6-activated STAT3 in hepatic cells by a p42/44 mitogen-activated protein kinase-dependent mechanism. J Biol Chem. 1999;274:35492-35498. [PubMed] [DOI] |
| 23. | Chen J, Kunos G, Gao B. Ethanol rapidly inhibits IL-6-activated STAT3 and C/EBP mRNA expression in freshly isolated rat hepatocytes. FEBS Lett. 1999;457:162-168. [PubMed] [DOI] |
| 24. | Auernhammer CJ, Melmed S. Leukemia-inhibitory factor-neuroimmune modulator of endocrine function. Endocr Rev. 2000;21:313-345. [PubMed] [DOI] |
| 25. | Sleeman MW, Anderson KD, Lambert PD, Yancopoulos GD, Wiegand SJ. The ciliary neurotrophic factor and its receptor, CNTFR alpha. Pharm Acta Helv. 2000;74:265-272. [PubMed] [DOI] |
| 26. | Waris G, Huh KW, Siddiqui A. Mitochondrially associated hepatitis B virus X protein constitutively activates transcription factors STAT-3 and NF-kappa B via oxidative stress. Mol Cell Biol. 2001;21:7721-7730. [PubMed] [DOI] |
| 27. | Gong G, Waris G, Tanveer R, Siddiqui A. Human hepatitis C virus NS5A protein alters intracellular calcium levels, induces oxidative stress, and activates STAT-3 and NF-kappa B. Proc Natl Acad Sci USA. 2001;98:9599-9604. [PubMed] [DOI] |
| 28. | Cressman DE, Diamond RH, Taub R. Rapid activation of the Stat3 transcription complex in liver regeneration. Hepatology. 1995;21:1443-1449. [PubMed] [DOI] |
| 29. | Taub R. Liver regeneration 4: transcriptional control of liver regeneration. FASEB J. 1996;10:413-427. [PubMed] |
| 30. | Morello D, Fitzgerald MJ, Babinet C, Fausto N. c-myc, c-fos, and c-jun regulation in the regenerating livers of normal and H-2K/c-myc transgenic mice. Mol Cell Biol. 1990;10:3185-3193. [PubMed] [DOI] |
| 31. | Schwabe RF, Bradham CA, Uehara T, Hatano E, Bennett BL, Schoonhoven R, Brenner DA. c-Jun-N-terminal kinase drives cyclin D1 expression and proliferation during liver regeneration. Hepatology. 2003;37:824-832. [PubMed] [DOI] |
| 33. | Radziuk J, Pye S. Hepatic glucose uptake, gluconeogenesis and the regulation of glycogen synthesis. Diabetes Metab Res Rev. 2001;17:250-272. [PubMed] [DOI] |
| 34. | Inoue H, Ogawa W, Ozaki M, Haga S, Matsumoto M, Furukawa K, Hashimoto N, Kido Y, Mori T, Sakaue H. Role of STAT-3 in regulation of hepatic gluconeogenic genes and carbohydrate metabolism in vivo. Nat Med. 2004;10:168-174. [PubMed] [DOI] |
| 35. | Inoue H, Ogawa W, Asakawa A, Okamoto Y, Nishizawa A, Matsumoto M, Teshigawara K, Matsuki Y, Watanabe E, Hiramatsu R. Role of hepatic STAT3 in brain-insulin action on hepatic glucose production. Cell Metab. 2006;3:267-275. [PubMed] [DOI] |
| 36. | Nguyen P, Leray V, Diez M, Serisier S, Le Bloc'h J, Siliart B, Dumon H. Liver lipid metabolism. J Anim Physiol Anim Nutr (Berl). 2008;92:272-283. [PubMed] [DOI] |
| 38. | Hong F, Radaeva S, Pan HN, Tian Z, Veech R, Gao B. Interleukin 6 alleviates hepatic steatosis and ischemia/reperfusion injury in mice with fatty liver disease. Hepatology. 2004;40:933-941. [PubMed] [DOI] |
| 39. | Suganami E, Takagi H, Ohashi H, Suzuma K, Suzuma I, Oh H, Watanabe D, Ojima T, Suganami T, Fujio Y. Leptin stimulates ischemia-induced retinal neovascularization: possible role of vascular endothelial growth factor expressed in retinal endothelial cells. Diabetes. 2004;53:2443-2448. [PubMed] [DOI] |
| 40. | Ninomiya M, Shirabe K, Terashi T, Ijichi H, Yonemura Y, Harada N, Soejima Y, Taketomi A, Shimada M, Maehara Y. Deceleration of regenerative response improves the outcome of rat with massive hepatectomy. Am J Transplant. 2010;10:1580-1587. [PubMed] [DOI] |
| 41. | Ding BS, Nolan DJ, Butler JM, James D, Babazadeh AO, Rosenwaks Z, Mittal V, Kobayashi H, Shido K, Lyden D. Inductive angiocrine signals from sinusoidal endothelium are required for liver regeneration. Nature. 2010;468:310-315. [PubMed] [DOI] |
| 42. | Hernandez-Gea V, Friedman SL. Pathogenesis of liver fibrosis. Annu Rev Pathol. 2011;6:425-456. [PubMed] [DOI] |
| 43. | Fernández M, Semela D, Bruix J, Colle I, Pinzani M, Bosch J. Angiogenesis in liver disease. J Hepatol. 2009;50:604-620. [PubMed] [DOI] |
| 44. | Gruys E, Toussaint MJ, Niewold TA, Koopmans SJ. Acute phase reaction and acute phase proteins. J Zhejiang Univ Sci B. 2005;6:1045-1056. [PubMed] [DOI] |
| 45. | Alonzi T, Maritano D, Gorgoni B, Rizzuto G, Libert C, Poli V. Essential role of STAT3 in the control of the acute-phase response as revealed by inducible gene inactivation [correction of activation] in the liver. Mol Cell Biol. 2001;21:1621-1632. [PubMed] [DOI] |
| 46. | Ebersole JL, Machen RL, Steffen MJ, Willmann DE. Systemic acute-phase reactants, C-reactive protein and haptoglobin, in adult periodontitis. Clin Exp Immunol. 1997;107:347-352. [PubMed] [DOI] |
| 47. | Christensen MB, Sørensen JC, Jacobsen S, Kjelgaard-Hansen M. Investigation of the solubility and the potentials for purification of serum amyloid A (SAA) from equine acute phase serum--a pilot study. BMC Res Notes. 2013;6:152. [PubMed] [DOI] |
| 48. | Christenson K, Björkman L, Ahlin S, Olsson M, Sjöholm K, Karlsson A, Bylund J. Endogenous Acute Phase Serum Amyloid A Lacks Pro-Inflammatory Activity, Contrasting the Two Recombinant Variants That Activate Human Neutrophils through Different Receptors. Front Immunol. 2013;4:92. [PubMed] [DOI] |
| 49. | Okemefuna AI, Nan R, Miller A, Gor J, Perkins SJ. Complement factor H binds at two independent sites to C-reactive protein in acute phase concentrations. J Biol Chem. 2010;285:1053-1065. [PubMed] [DOI] |
| 50. | Quinton LJ, Blahna MT, Jones MR, Allen E, Ferrari JD, Hilliard KL, Zhang X, Sabharwal V, Algül H, Akira S. Hepatocyte-specific mutation of both NF-κB RelA and STAT3 abrogates the acute phase response in mice. J Clin Invest. 2012;122:1758-1763. [PubMed] [DOI] |
| 51. | Bode JG, Albrecht U, Häussinger D, Heinrich PC, Schaper F. Hepatic acute phase proteins--regulation by IL-6- and IL-1-type cytokines involving STAT3 and its crosstalk with NF-κB-dependent signaling. Eur J Cell Biol. 2012;91:496-505. [PubMed] [DOI] |