修回日期: 2014-01-05
接受日期: 2014-01-10
在线出版日期: 2014-03-08
目的: 观察洛哌丁胺构建的大鼠便秘模型中水通道蛋白家族中AQP3和AQP8蛋白及其mRNA定量表达, 探讨洛哌丁胺构建大鼠便秘模型对AQP3和AQP8的影响.
方法: SD♂大鼠30只, 随机分为5组, 造模开始时处死1组大鼠, 检测结肠传输功能及结肠组织的AQP3, 8表达水平, 作为基准参考线. 剩余4组予以洛哌丁胺1.5 mg/(kg•d)灌胃, 诱导造模. 分别于造模的第3、7天和造模成功后第3、7天各处死一组模型大鼠, 检测结肠传输及AQP3, AQP8蛋白及其mRNA定量表达.
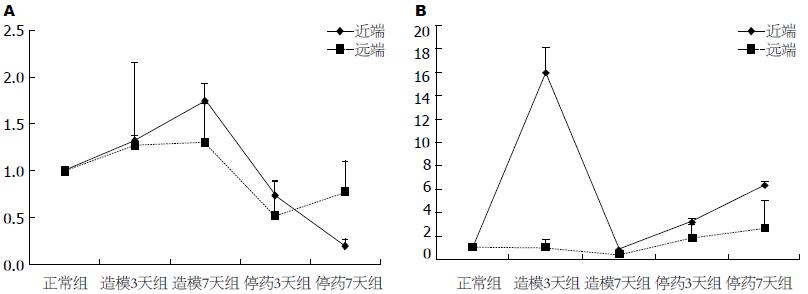
结果: 大鼠粪便含水量在诱导便秘模型的过程中明显减少, 停药后7 d, 粪便内的水分并不能自发恢复至正常(2.29 g±1.17 g vs 0.80 g±0.27 g, P = 0.01<0.05). 试验过程中, 大鼠结肠传输功能未发生改变(67.72% vs 58.64%, P = 0.971>0.05). AQP8远端表达停药7 d上升, 与造模7 d时相比, 差异有统计学意义(0.43±0.31 vs 2.66±0.87, P = 0.008). AQP8近端表达给药后迅速上升至较高水平, 与正常组对照具有统计学意义(15.96±2.13, P = 0.00), 停药7 d后其表达再次上升, 与给药7 d相比, 差异有统计学意义(6.37±0.23 vs 0.79±0.13, P = 0.015). 停药后, AQP3在结肠近端持续表达下降, 与正常对照组相比, 差异有统计学意义(0.20±0.06, P = 0.04).
结论: 洛哌丁胺能够提高模型大鼠结肠AQP8表达, 促进肠道跨膜水运输, 减少粪便含水量而导致便秘.
核心提示: 本研究以构建实验模型为基础, 研究洛哌丁胺对水通道蛋白的影响, 探讨其可能的机制, 为动物造模研究便秘提供新的理论基础.
引文著录: 吴霜, 程滢瑞, 周锦勇, 吴本升, 陈玉根, 杨柏霖. 洛哌丁胺构建大鼠便秘模型对水通道蛋白AQP3和AQP8的影响. 世界华人消化杂志 2014; 22(7): 969-974
Revised: January 5, 2014
Accepted: January 10, 2014
Published online: March 8, 2014
AIM: To observe the differential expression of AQP3 and 8 in loperamide induced constipation in rats, and to explore the role of these two proteins in constipation.
METHODS: Thirty male SD rats were randomly divided into five groups. One group was killed at the beginning to measure intestinal transit function and the expression of AQP3 and 8 in human colonic epithelial cells as basic references. Loperamide [1.5 mg/(kg•d)] was given by intragastric administration in the remaining four groups of rats to induce constipation. Two groups of rats were killed on days 3 and 7 after initial loperamide administration, respectively, while the other two groups were killed 3 and 7 d after last loperamide administration, respectively. Intestinal transmission function was determined, and the expression of AQP3 and 8 was detected.
RESULTS: Intestinal transit function kept stable (67.72% vs 58.64%, P > 0.05) throughout the experimental process, while fecal water content decreased. The fecal water content could not return to normal 7 d after stopping loperamide (2.29 g ± 1.17 g vs 0.80 g ± 0.27 g, P = 0.01). AQP8 expression in the proximal colon had an upward trend 3 to 7 d after the initial loperamide administration, greatly higher than that in the normal control group (P = 0.00). Seven days after stopping loperamide, AQP8 had a rising trend in both the proximal and distal colons (0.43 ± 0.31 vs 2.66 ± 0.87, P = 0.008), while AQP3 expression declined (6.37 ± 0.23 vs 0.79 ± 0.13, P = 0.015).
CONCLUSION: Loperamide enhances the expression of AQP8 in the intestine of rats, which facilitates water movement across the membrane. Deficient water absorption may play a role in the pathogenesis of loperamide induced constipation.
- Citation: Wu S, Cheng YR, Zhou JY, Wu BS, Chen YG, Yang BL. Expression of AQP3 and 8 in loperamide induced constipation in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(7): 969-974
- URL: https://www.wjgnet.com/1009-3079/full/v22/i7/969.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i7.969
结肠上皮细胞分布紧密, 限制了细胞旁路吸收, 跨细胞转运成为结肠水分吸收的主要途径. 水通道是存在于哺乳动物和植物细胞膜上转运水的特异性孔道, 该孔道是由一系列具有同源性的内在膜蛋白家族成员所组成, 快速转运水分子及小分子溶质通过细胞膜, 从而维持结肠水平衡[1]. 洛哌丁胺是常见止泻药物, 研究认为其主要通过阻断外周阿片受体[2]、抑制钙调蛋白的功能[3]和电压依赖性钙离子通道[4]这3大机制抑制肠道蠕动及肠液分泌, 是常用来制作便秘模型的药物[5,6]. 目前没有研究对洛哌丁胺抑制肠液分泌与水通道蛋白的相关性的报道. 本文通过研究洛哌丁胺诱导大鼠便秘模型中AQP3、AQP8的表达变化, 探索洛哌丁胺是否通过调节水通道蛋白表达而发挥抑制肠液分泌的作用.
♂SD大鼠30只, 清洁级, 体质量145-165 g, 购自中国人民解放军南京军区医学动物实验中心[SCXK(军)2007-012)]. 清洁级, 均放入代谢笼中独立饲养, 室内温度20 ℃-25 ℃, 湿度45%-55%, 人工光照, 明暗各12、24 h自由饮水. 洛哌丁胺(批号: 11101952, 江苏恒瑞医药股份有限公司), 10%活性炭. 将实验用药洛哌丁胺按照动物与人用药量比换算成相应的剂量[5](分别为20.5、1.575 mg/kg), 生理盐水调配. RNA稳定剂RNAlater(德国QIAGEN); RNA提取试剂TRIzol(美国Invitrogen公司); DEPC(南京凯基生物技术有限公司); 酚氯仿(Sigma公司); 逆转录试剂盒DDR047A(TaKaRa公司); Real-time PCR试剂盒SYBR Green PCR Master Mix(美国ABI公司), 其他试剂均为国产分析纯. 低温高速离心机5804R、各种规格微量加样器、紫外分光光度计(德国EPPENDORF公司); 7900HT型荧光定量PCR仪(美国ABI公司).
1.2.1 引物设计: 检索NCBI GenBank数据库, 以GAPDH作为内参基因. 应用Primer Premier3.0软件分别设计其PCR引物. 引物由Invitrogen公司合成(表1).
| 基因 | 上游引物 | 下游引物 | 产物大小(bp) |
| AQP3 | GCCATTGTTGACCCTTATAACAAC | AGTGAAAAGGCGAGGTCCAA | 150 |
| AQP8 | CTGTGTGTATGGGT GCCGTCAA | AGATCCCACCACCTGCCAGGA | 102 |
| GAPDH | TGGGTGTGAACCACGAGAA | GGCATGGACTGTGGTCATGA | 102 |
1.2.2 实验分组、造模及给药: 参照文献[5]报道的方法进行造模. ♂SD大鼠30只, 随机分为5组, 造模开始时处死一组大鼠, 观察正常大鼠结肠内存留粪便粒数、实时定量QPCR检测大鼠结肠组织AQP3, AQP8 mRNA表达, 并作为基准参考线. 剩余四组作为实验组予以洛哌丁胺1.5 mg/(kg•d)加生理盐水配成混悬液灌胃, 灌胃2 d, 共7 d.
1.2.3 观察指标: (1)一般情况观察: 分别在洛哌丁胺干预的第3、7天和停药后第3、7天观察模型动物的一般情况(体质量、进食量、进水量、粪便干湿质量等); (2)碳末推进试验和结肠存留粪便粒数: 在洛哌丁胺干预的第3、7天和停药后第3、7天处死一组大鼠. 大鼠处死前, 均禁食不禁水12 h, 用10%的活性炭悬液2 mL灌胃, 40 min后颈椎脱臼处死. 大鼠处死后, 迅速剖腹, 记录从直肠到回盲部存留的粪便粒数. 摘除从幽门到直肠末端的全部肠道, 置于托盘中, 将肠管拉直后测量肠管的长度, 即幽门至肛门处长度, 在松弛状态下测量肠道的全长及活性碳混悬液在肠道内推进的长度, 并计算活性碳混悬液推进长度与肠道全长的百分比. 按下列公式计算: 碳末推进百分率(%) = [碳末前端与幽门的距离(cm)/肠道总长度(cm)]×100%; (3)实时定量PCR检测AQP3, 8检测: 模型动物处死后立即在距盲肠2 cm近端结肠及距直肠2 cm远端结肠取新鲜肠壁组织150 mg, 放入PBS中清洗后, 迅速浸入5倍于组织体积的RNA稳定剂RNAlater中, 4 ℃冰箱中保存. 将剪取的结肠组织150 mg从RNAlater液体中捞出后用TRIzol法提取总RNA. 取2 μL RNA加入98 μL DEPC水中, 紫外分光光度仪测定RNA样品在260 nm和280 nm处的吸光度(A)值. RNA纯度用A260/280比值反映. 按照Real-time PCR试剂盒说明书进行实时荧光PCR定量检测, 反应总体系为20 μL(SYBR mix、样品cDNA、水、上游引物、下游引物分别为10.0、2.0、6.8、0.4、0.4 μL), 反应条件为95 ℃预变性30 s、95 ℃ 5 s、60 ℃ 30 s、循环40次, 最后加溶解曲线(95 ℃ 15 s、60 ℃ 1 min、95 ℃ 15 s). 在ABI公司7900PCR仪上反应. 每份样品均进行3个复孔测定, 设阴性对照. 通过分析软件得到样品阈值循环数(threshold cycle, Ct)和相对的拷贝定量, 再进行样本之间的比较. 采用2-∆∆Ct方法对QPCR结果进行数据分析, 计算∆Ct = 目的基因Ct-内参基因Ct; ∆∆Ct = ∆Ct (造模组)-∆Ct (正常组); 相差倍数 = 2-∆∆Ct, 其中正常对照组的数值设定为1.
统计学处理 统计分析采用SPSS17.0软件包进行数据处理, 所有数据均用mean±SD表示. 采用单因素方差分析, P<0.05为差异有统计学意义. P<0.01为差异有显著统计学意义.
造模共历时7 d, 造模过程中未有大鼠死亡. 造模7 d后, 模型大鼠较正常组及给药3 d时的体质量有明显上升, 与此同时, 排便量减少, 说明大鼠体重增多与肠腔内积留的粪团相关. 粪便含水量在诱导便秘模型的过程中明显减少(P = 0.022), 停药后14 d, 粪便内的水分并不能自发恢复至正常. 试验过程中, 大鼠结肠传输功能未发生改变(P = 0.971). 各组动物在结肠取材时均未见黏膜色素沉着(表2).
| 分组 | 正常组 | 模型组(3 d) | 模型组(7 d) | 模型组(10 d) | 模型组(14 d) |
| 体质量 | 175.42±8.38 | 176.56±12.08 | 195.52±18.74a | 215.75±17.04 | 250.31±13.35 |
| 进食量 | 27.50±8.45 | 22.34±6.22 | 23.89±8.12 | 26.88±5.20 | 28.75±7.42 |
| 进水量 | 28.50±11.01 | 34.14±12.62 | 32.84±10.58 | 44.79±16.95 | 47.08±17.38 |
| 粪便干质量 | 4.14±0.69 | 4.02±0.88 | 3.32±0.84 | 1.78±0.62a | 1.74±0.33 |
| 粪便湿质量 | 7.43±0.96 | 7.56±1.45 | 5.70±1.64 | 2.58±0.83a | 3.16±0.72 |
| 粪便含水量 | 2.29±1.17 | 3.54±0.64 | 2.48±1.34 | 0.80±0.27a | 1.39±0.42 |
| 结肠粪便粒数 | 42.14±5.70 | 37.00±5.37 | 32.69±6.89 | 39.10±12.27 | 43.73±6.89 |
| 肠道传输功能(%) | 67.72 | 63.10 | 58.64 | 58.92 | 61.35 |
造模过程中, 结肠AQP3蛋白定量逐渐上升, 但与正常对照组比较差异无统计学意义(给药3 d, P = 0.998; 给药7 d, P = 0.994); 停药后, AQP3在结肠近端持续表达下降, 与正常对照组相比, 差异有统计学意义(P = 0.04); 结肠远端表达在停药3 d下降后, 停药7 d逐渐增加, 与正常对照组相比, 差异无统计学意义(P = 0.88)(图1A).
AQP8远端表达在造模后有所下降, 与正常组比较无统计学意义(P = 0.537), 停药后表达上升, 停药7 d较造模7 d相比, 差异有统计学意义(P = 0.008). 近端表达给药后迅速上升至较高水平, 差异有统计学意义(P = 0.00), 造模7 d后发生跌降, 与正常组相比, 差异有统计学意义(P = 0.00), 停药7 d后其表达再次上升, 差异有统计学意义(P = 0.015)(图1B).
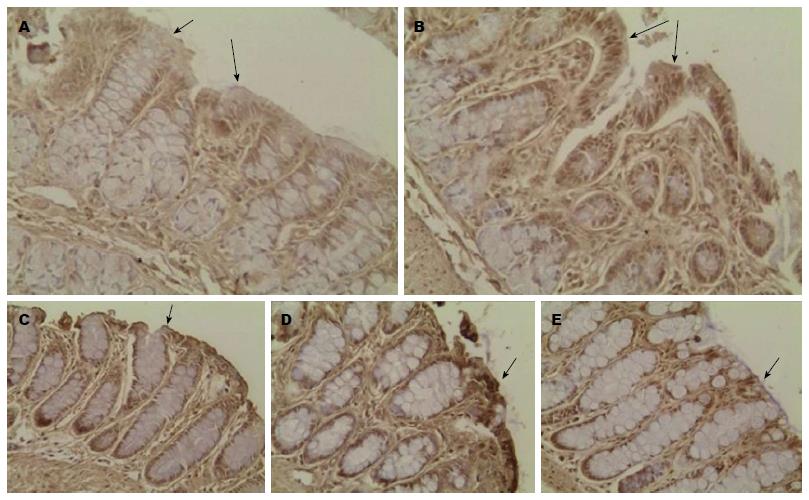
在免疫组织化学研究中, 可见正常肠腔表面上皮细胞胞浆及胞膜着色. AQP8轻度着色于正常大鼠结肠黏膜, 主要位于上皮细胞顶点, 给药后AQP8重度着色, 持续给药着色程度较前下降, AQP8表达下降, 停药后AQP8在结肠黏膜上皮内的表达进一步下降, 染色着色程度类似于正常黏膜, 研究结果与其PCR检测蛋白表达的变动曲线具有一致性. AQP3在绒毛上皮细胞染色, 隐窝细胞杯状细胞内未见染色. 高分辨放大后可见AQP3主要着色于远端结肠黏膜, 近端结肠表达不明显, 停药后AQP3着色程度下降(表3, 图2).
| 近/远端 | 正常组 | 给药3 d | 给药7 d | 停药3 d | 停药7 d | |
| AQP3 | 远端 | +++ | +++D | ++ | ++ | +E |
| 近端 | ++ | +++ | +++ | + | ++ | |
| AQP8 | 远端 | ++ | ++ | + | ++ | + |
| 近端 | +A | +++B | ++C | ++ | ++ |
正常人体粪便含水量为65%-85%, 罗马Ⅲ便秘诊断将"持续或累计至少12 wk存在硬块或颗粒状大便"作为诊断标准之一. 过去人们认为粪便内水分吸收是继发于渗透压改变, 但结肠上皮细胞分布紧密, 限制了细胞旁路吸收, 跨细胞转运成为结肠水分吸收的主要途径. 水通道蛋白是快速转运水分子及小分子溶质通过细胞膜的特殊通道, 具有0-13种不同亚型[7], 消化上皮细胞内至少存在6种AQPs表达, 其中AQP3、AQP4、AQP8、AQP9在结肠有表达. 本研究主要探讨AQP3及AQP8在大鼠结肠内受洛哌丁胺造模影响下的表达变化. AQP3, 8分布于肠上皮细胞内, 可将肠腔内水分快速吸收入血, 改变肠腔内分泌环境. AQP3在远端结肠及直肠大量表达, 在结肠内上皮基底部或顶端无定论, 而结肠水分吸收主要位于近端, 本实验中AQP3在远端表达存在变化, 但对肠腔内水分吸收改变影响较小. AQP8特异性表达于上皮细胞顶端[8], Hardin[9]在上皮细胞囊泡中也发现了AQP8表达, 对肠腔内水分吸收与分泌的表动具有敏感性, 能针对肠腔内环境改变作出迅速调整, 在活动期炎性肠病患者结肠的溃疡黏膜表面, AQP8免疫染色呈斑片状且不连续着色. Fischer等[10]运用原位杂交技术检测正常人及结直肠肿瘤上皮细胞内水通道蛋白表达, 发现AQP8表达于正常结肠内复层纤毛柱状上皮细胞, 肿瘤结肠上皮内基本无表达.
大鼠造模成功后, 大鼠表现为明显的便秘体征: 毛发失去光泽, 体质量增加, 食欲下降, 与正常组相比, 精神状态萎靡, 而不同时间段检测大鼠肠道传输功能未发生明显改变, 肠道内水分明显减少导致粪块积存在肠腔, 表明洛哌丁胺构建大鼠便秘模型对肠道传输功能无明显影响, 主要改变肠腔内分泌状态, 进一步对水通道蛋白AQP3和AQP8检测发现, 负责结肠水分吸收的近端肠腔内AQP8大量表达, 在不同造模时期与正常组相比, 存在统计学意义, AQP3和AQP8的表达变化可能是洛哌丁胺造成大鼠便秘的原因.
查阅相关文献后, 发现调控水通道蛋白的主要因素主要包括: 丝氨酸或部分苏氨酸磷酸化机制、组氨酸质化作用或与二价阳离子结合(如Ca2+)[11]. 根据亚型不同, PH对AQPs影响也不同, AQP3已被证实在由中性至酸性环境(pH 7.4-5.6)下[12], 水分子通过减少. 二价阳离子Ca2+对动物或植物AQPs均有影响, 对AQPs某些亚型具有抑制作用, 这种Ca2+抑制作用主要由钙调蛋白介导. Ca2+增加4倍后拟南芥属植物的透水性明显下降, 钙离子抑制位点及pH抑制位点不同, 这两种机制完全独立[13,14]. 分子动力学及晶体学研究发现, 水通道蛋白的关闭及开放由D环决定[15], 二价阳离子作用于D环特定氨基酸及蛋白氨基端的离子间相互作用及氢键, 使通道小孔处于稳定的关闭状态. 目前研究认为洛哌丁胺的止泻机制包括: 阻断外周阿片受体、抑制钙调蛋白的功能以及电压依赖性钙离子通道. 洛哌丁胺具有非阿片样作用, 可抑制钙调蛋白和阻滞钙离子通道, 达到止泻目的. 由此推测洛哌丁胺能够提高模型大鼠结肠AQP8表达, 促进肠道跨膜水运输, 减少粪便含水量而导致便秘. 其主要机制可能是抑制钙调蛋白及阻滞钙离子通道.
动物实验和临床研究均发现蒽醌类药物可以损伤肠神经系统, 从而导致便秘, 检测结果发现此模型的肠道传输功能和结肠神经病理变化与慢传输型便秘的病理特征基本相同. 但蒽醌类药物大黄中药成分复杂, 对水通道蛋白及Cajal等多种细胞均有影响.
刘宝林, 教授, 中国医科大学附属盛京医院
已有研究发现, 养阴润肠方的通便机制可能为通过促进Cajal间质细胞的再生及修复而达到促进肠动力, 从而实现通便的作用. 但在观察养阴润肠方对水通道蛋白的表达影响实验中发现纯中药大黄造模对水通道蛋白产生不可预知的影响, 干扰后期中药表达. 洛哌丁胺构建大鼠便秘模型用以观察水通道蛋白表达变化的科学性尚需进一步研究.
目前研究表明洛哌丁胺可以在转录水平上调腹泻大鼠结肠黏膜AQP4表达, 使结肠对肠腔内水分的吸收增加.
目前构建大鼠便秘模型多用大黄, 大黄为中药制剂, 成分复杂, 且大黄造模的周期较长, 很有可能不同成分对Cajal细胞及水通道蛋白或是其他目前临床尚未发现的离子通道、神经细胞均产生影响, 为了更清晰观测到水通道蛋白的变化, 本研究采用洛哌丁胺构建便秘模型, 验证在水通道蛋白研究中的科学性与合理性.
本文对传统造模方式研究水通道蛋白提出质疑, 探寻新的造模方式, 并深入挖掘作用机制, 具有创新性及科学性.
编辑: 田滢 电编:鲁亚静
| 1. | Benga G. Water channel proteins (later called aquaporins) and relatives: past, present, and future. IUBMB Life. 2009;61:112-133. [PubMed] [DOI] |
| 2. | Awouters F, Niemegeers CJ, Janssen PA. Pharmacology of antidiarrheal drugs. Annu Rev Pharmacol Toxicol. 1983;23:279-301. [PubMed] [DOI] |
| 3. | Zavecz JH, Jackson TE, Limp GL, Yellin TO. Relationship between anti-diarrheal activity and binding to calmodulin. Eur J Pharmacol. 1982;78:375-377. [PubMed] |
| 4. | Reynolds IJ, Gould RJ, Snyder SH. Loperamide: blockade of calcium channels as a mechanism for antidiarrheal effects. J Pharmacol Exp Ther. 1984;231:628-632. [PubMed] |
| 5. | Zhou M, Jia P, Chen J, Xiu A, Zhao Y, Zhan Y, Chen P, Zhang J. Laxative effects of Salecan on normal and two models of experimental constipated mice. BMC Gastroenterol. 2013;13:52. [PubMed] [DOI] |
| 6. | 钱 伯初, 史 红, 郑 晓亮. 正常和便秘模型动物排便实验研究进展. 中国临床药理学与治疗学. 2007;12:1339-1343. |
| 7. | Harries WE, Akhavan D, Miercke LJ, Khademi S, Stroud RM. The channel architecture of aquaporin 0 at a 2.2-A resolution. Proc Natl Acad Sci U S A. 2004;101:14045-14050. [PubMed] [DOI] |
| 8. | Koyama Y, Yamamoto T, Tani T, Nihei K, Kondo D, Funaki H, Yaoita E, Kawasaki K, Sato N, Hatakeyama K. Expression and localization of aquaporins in rat gastrointestinal tract. Am J Physiol. 1999;276:C621-C627. [PubMed] |
| 9. | Hardin JA, Wallace LE, Wong JF, O'Loughlin EV, Urbanski SJ, Gall DG, MacNaughton WK, Beck PL. Aquaporin expression is downregulated in a murine model of colitis and in patients with ulcerative colitis, Crohn's disease and infectious colitis. Cell Tissue Res. 2004;318:313-323. [PubMed] [DOI] |
| 10. | Fischer H, Stenling R, Rubio C, Lindblom A. Differential expression of aquaporin 8 in human colonic epithelial cells and colorectal tumors. BMC Physiol. 2001;1:1. [PubMed] [DOI] |
| 11. | Santoni V, Vinh J, Pflieger D, Sommerer N, Maurel C. A proteomic study reveals novel insights into the diversity of aquaporin forms expressed in the plasma membrane of plant roots. Biochem J. 2003;373:289-296. [PubMed] [DOI] |
| 12. | Zeuthen T, Klaerke DA. Transport of water and glycerol in aquaporin 3 is gated by H(+). J Biol Chem. 1999;274:21631-21636. [PubMed] [DOI] |
| 13. | Németh-Cahalan KL, Kalman K, Hall JE. Molecular basis of pH and Ca2+ regulation of aquaporin water permeability. J Gen Physiol. 2004;123:573-580. [PubMed] [DOI] |
| 14. | Kalman K, Németh-Cahalan KL, Froger A, Hall JE. Phosphorylation determines the calmodulin-mediated Ca2+ response and water permeability of AQP0. J Biol Chem. 2008;283:21278-21283. [PubMed] [DOI] |