修回日期: 2014-01-20
接受日期: 2014-02-03
在线出版日期: 2014-03-08
目的: 研究自噬相关因子beclin1、mTOR及LC3-B在大肠腺瘤癌变过程中的表达差异, 并探讨与临床病理因素之间的相关性.
方法: 采用免疫组织化学方法, 在结直肠60例低级别上皮内瘤变腺瘤(low-grade intraepithelial neoplasia, LGIN)、60例高级别上皮内瘤变腺瘤(high-grade intraepithelial neoplasia, HGIN)、80例腺瘤癌变组织及30例正常黏膜组织中检测beclin1、mTOR及LC3-B的表达, 并分析其相关性以及与临床病理因素的关系.
结果: (1)beclin1与LC3-B在腺瘤癌变组中的表达明显高于LGIN组及正常肠黏膜(P<0.05), 但与HGIN组无差别(P>0.05), mTOR在腺瘤癌变组中的表达高于其他3组(P<0.05), 在HGIN与LGIN组中的表达无统计学意义(P>0.05), 但均高于正常肠黏膜组(P<0.05); (2)在腺瘤癌变组中, beclin1与LC3-B表达与肿瘤的大小有关, mTOR及表达与肿瘤的大小及浸润有关, 而在LGIN腺瘤组与HGIN腺瘤组三者与各临床病理因素无相关性; (3)beclin1与LC3-B两者在LGIN腺瘤组、HGIN腺瘤组及腺瘤癌变组中的表达均呈正相关(r = 0.390、r = 0.306、r = 0.443, P<0.05); mTOR与LC3-B在HGIN腺瘤组及腺瘤癌变组中的表达呈正相关(r = 0.284、r = 0.223, P<0.05), 而在LGIN腺瘤组中无相关.
结论: 自噬及其调控因子beclin1、mTOR可能在大肠腺瘤恶性转化中发挥重要作用, 与腺瘤癌变进展密切相关.
核心提示: 本文应用免疫组织化学的方法检测beclin1、mTOR及LC3-B在腺瘤-腺癌序列中的表达, 有助于阐释在腺瘤癌变过程的不同阶段中自噬发挥的重要作用, 且通过相关性分析, 有助于阐明自噬调控过程的优势靶点, 为进一步的临床应用提供理论基础.
引文著录: 何双, 吴淑华, 胡金龙, 温菲菲, 孙晨博. 自噬调控因子beclin1及mTOR在大肠腺瘤癌变过程中的表达及意义. 世界华人消化杂志 2014; 22(7): 920-926
Revised: January 20, 2014
Accepted: February 3, 2014
Published online: March 8, 2014
AIM: To investigate the significance of expression of autophagy regulatory molecules beclin1 and mTOR in the malignant transformation of colorectal adenoma.
METHODS: Immunohistochemistry was used to detect the expression of beclin1, mTOR and LC3-B in 30 cases of normal colorectal mucosa, 60 cases of low-grade intraepithelial neoplasia (LGIN), 60 cases of high-grade intraepithelial neoplasia (HGIN) and 80 cases of colorectal carcinoma.
RESULTS: The expression of both beclin1 and LC3-B in colorectal cancer was significantly higher than that in LGIN and normal mucosa (P < 0.05), but there was no significant difference in the expression of beclin1 between colorectal cancer and HGIN (P > 0.05). The expression of mTOR in colorectal cancer was significantly higher than that in normal mucosa, LGIN and HGIN (P < 0.05), but no significant difference was found between LGIN and HGIN. In colorectal cancer, the expression of both beclin1 and LC3-B was related to tumor size; the expression of mTOR was associated with tumor size and depth of invasion; the expression of beclin1, mTOR and LC3-B in LGIN and HGIN was not related to clinicopathologic characteristics. There was a positive correlation between the expression of beclin1 and LC3-B in LGIN, HGIN and colorectal carcinoma (r = 0.390, 0.306, 0.443, P < 0.05). The expression of mTOR was not related to that of LC3-B in LGIN, but mTOR expression was positively associated with LC3-B expression in both HGIN and colorectal cancer (r = 0.284, 0.223, P < 0.05).
CONCLUSION: Autophagy may play a critical role in the malignant transformation of colorectal adenoma.
- Citation: He S, Wu SH, Hu JL, Wen FF, Sun CB. Significance of expression of autophagy related factors beclin1 and mTOR in malignant transformation of colorectal adenoma. Shijie Huaren Xiaohua Zazhi 2014; 22(7): 920-926
- URL: https://www.wjgnet.com/1009-3079/full/v22/i7/920.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i7.920
结直肠癌, 又称大肠癌, 是人类常见的恶性肿瘤之一. 研究表明大多数大肠癌来自腺瘤的恶变, 其中由腺瘤演变为腺癌的过程约10-15年[1]. 因此, 研究大肠腺瘤演变为癌的演进过程及其机制, 对于早期预测腺瘤恶变, 有效防止腺瘤恶变, 具有重要的临床意义. 近年来发现肿瘤的发生不仅与细胞的增殖、凋亡有关, 并且与细胞的自噬有关, 自噬作为一种新的程序性细胞死亡方式其生物学意义以及与肿瘤的关系受到越来越多关注[2-6]. 研究表明在大肠癌、食管癌、乳腺癌、肺癌、胰腺癌等多种肿瘤中都存在不同程度的自噬现象[7-11]. 本研究应用免疫组织化学的方法, 在结直肠正常黏膜、低级别上皮内瘤变腺瘤(low-grade intraepithelial neoplasia, LGIN)、高级别上皮内瘤变腺瘤(high-grade intraepithelial neoplasia, HGIN)及腺瘤癌变病例中同步检测自噬关键因子beclin1、mTOR及LC3-B的表达情况, 探讨自噬及其调控因子beclin1与mTOR在结直肠腺瘤癌变发生发展中所发挥的作用.
收集2010-01/2012-08于滨州医学院附属医院病理科肠镜、手术切除的LGIN 60例, HGIN 60例, 腺瘤癌变病例80例, 正常结直肠黏膜(距肿瘤旁≥5 cm)30例. 根据2010年消化系统肿瘤WHO分类标准[1], 所选病例切片由2位资深病理专家重新阅片分类, 其中所选LGIN及HGIN病例均为管状腺瘤, 腺瘤癌变组病例为在同一肿瘤中存在浸润性结直肠癌和管状腺瘤, 或是先前存在的管状腺瘤转变为浸润性结直肠癌病例. 所有病例均为首次发现, 术前未经放疗及化疗. LGIN组、HGIN组与腺瘤癌变组的平均年龄分别为50.4、57.6和61.8岁. 全部标本均经40 g/L中性甲醛固定, 石蜡包埋, 4 μm连续切片. beclin1兔多克隆抗体购自abcam公司(ab55878), 稀释浓度为1:150. mTOR兔多克隆抗体购自abcam公司(ab2723), 稀释浓度为1:200. LC3-B鼠单克隆抗体购自Santa Cruz公司(sc-271625), 稀释浓度为1:50. 柠檬酸, 通用型二抗及DAB显色液购自北京中杉金桥生物技术有限公司. beclin1、mTOR及LC3-B的阳性对照分别为绒癌、睾丸癌及正常脑组织, 均采用PBS代替一抗作为阴性对照.
1.2.1 免疫组织化学: 采用EnVision法免疫组织化学步骤进行. 操作方法如下: 将4 μm厚石蜡切片经二甲苯, 梯度乙醇脱蜡至水后, 进行柠檬酸修复(热修复2 min), 滴加一抗, 4 ℃过夜. PBS洗涤后, 滴加通用型二抗, 37 ℃孵育30 min, DAB显色(beclin、mTOR显色时间为2 min, LC3-B显色时间为3 min), 苏木素复染后, 盐酸乙醇分化, 脱水后中性树胶封片.
1.2.2 结果判定: beclin1、mTOR和LC3-B阳性时为细胞质黄色-棕褐色颗粒. 采用染色强度与阳性细胞的百分率相结合的判定标准. 染色强度: 不着色为0分, 淡黄色1分, 棕黄色2分, 黄褐色3分. 阳性细胞所占百分比: 阳性细胞数<5%计为0分, 5%-30%计为1分, 31%-60%计为2分, ≥60%计为3分. 两者乘积为染色总分, 阴性(-): 0分, 弱阳性(+): 1-4分, 中度阳性(++): 5-8分, 强阳性(+++): 9-12分.
统计学处理 使用SPSS18.0统计软件, 不同分组间蛋白的表达差异及各蛋白与临床病理因素之间的关系采用χ2检验; 不同分组间蛋白之间的表达相关性采用Spearman相关性分析, P<0.05为差异有统计学意义.
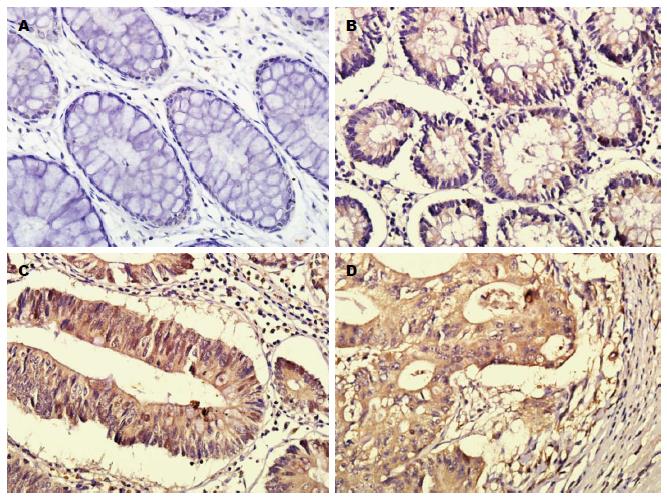
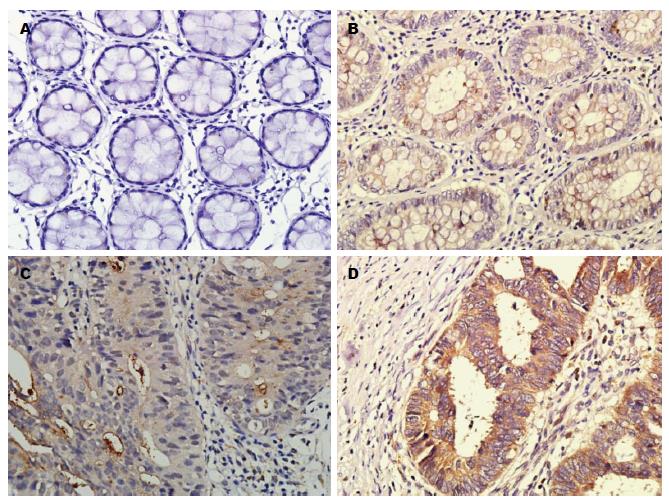
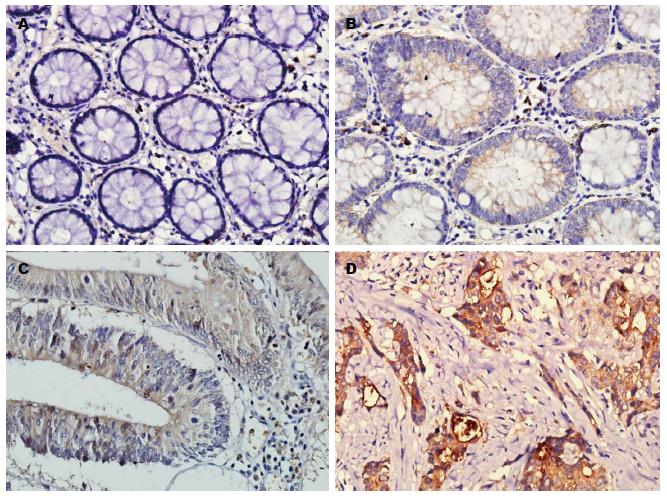
beclin1、mTOR与LC3-B在正常肠黏膜, LGIN组、HGIN组及腺瘤癌变组中呈不同程度的阳性表达(图1-3, 阳性表达率如表1). 经多组二分类资料两两卡方检验比较, beclin1与LC3-B在腺瘤癌变组、HGIN组、LGIN组中的表达高于正常肠黏膜组, 差异有统计学意义(P<0.05), 在HGIN组与腺瘤癌变组中其表达差异无统计学意义; mTOR在腺瘤癌变组中的表达高于其他3组, 差异有统计学意义(P<0.05), 在HGIN组与LGIN组, 表达差异无统计学意义(P>0.05), 但均高于正常肠黏膜组(P<0.05).
| 分组 | n | beclin1 | mTOR | LC3-B |
| 正常组 | 30 | 1(3.3) | 4(13.3) | 2(6.6) |
| LGIN组 | 60 | 27(45.0) | 19(31.7) | 21(35.0) |
| HGIN组 | 60 | 41(68.3) | 24(40.0) | 37(61.7) |
| 腺瘤癌变组 | 80 | 60(75.0) | 45(56.3) | 53(66.3) |
beclin1与LC3-B在腺瘤癌变组中的表达与肿瘤的大小有关, 其中长径≥5 cm的肿瘤中高表达, 而与性别、年龄、分化程度、TNM分期等特征无关; mTOR与肿瘤的大小及浸润深度相关, 在长径≥5 cm以及侵及外膜的腺癌中高表达, 而与性别、年龄、分化、有无淋巴转移等均无关(表2).
| 临床病理因素 | n | Beclin1(+) | P值 | mTOR(+) | P值 | LC3-B(+) | P值 |
| 年龄(岁) | 0.696 | 0.755 | 0.571 | ||||
| <60 | 35 | 27 | 19 | 22 | |||
| ≥60 | 45 | 33 | 26 | 31 | |||
| 性别 | 0.660 | 0.263 | 0.962 | ||||
| 男 | 59 | 45 | 31 | 39 | |||
| 女 | 21 | 15 | 14 | 14 | |||
| 肿瘤长径(cm) | 0.012 | 0.001 | 0.017 | ||||
| <5 | 31 | 19 | 10 | 23 | |||
| ≥5 | 49 | 42 | 35 | 45 | |||
| 肿瘤部位 | 0.897 | 0.413 | 0.817 | ||||
| 结肠 | 43 | 32 | 26 | 28 | |||
| 直肠 | 37 | 28 | 19 | 25 | |||
| 分化程度 | 0.967 | 0.171 | 0.134 | ||||
| 高分化 | 44 | 33 | 29 | 26 | |||
| 中低分化 | 36 | 27 | 20 | 27 | |||
| 浸润深度 | 0.433 | 0.015 | 0.655 | ||||
| 未达外膜 | 10 | 6 | 1 | 6 | |||
| 外膜 | 50 | 38 | 45 | 47 | |||
| 淋巴结转移 | 0.145 | 0.164 | 0.456 | ||||
| 无转移 | 49 | 34 | 32 | 34 | |||
| 转移 | 31 | 26 | 18 | 19 | |||
| TNM分期 | 0.895 | 0.553 | 0.456 | ||||
| Ⅰ+Ⅱ期 | 49 | 37 | 32 | 49 | |||
| Ⅲ+Ⅳ期 | 31 | 21 | 18 | 31 |
beclin1、mTOR和LC3-B在LGIN组与HGIN组中, 与性别、年龄、直径、部位、数目等均无关.
Beclin1与LC3-B两者在LGIN组、HGIN组及腺瘤癌变组中的表达均呈正相关(r = 0.390、r = 0.306、r = 0.443, P<0.05). mTOR与LC3-B在高级别腺瘤组及腺瘤癌变组中的表达呈正相关(r = 0.284、r = 0.223, P<0.05), 而在LGIN中无相关. beclin1与mTOR两者在LGIN组、HGIN组及腺瘤癌变组中的表达均呈正相关(r = 0.465、r = 0.503、r = 0.248, P<0.05)(表3).
| 分组 | n | beclin1与LC3-B | mTOR与LC3-B | beclin1与mTOR | |||
| r值 | P值 | r值 | P值 | r值 | P值 | ||
| LGIN组 | 60 | 0.390 | 0.002 | 0.252 | 0.052 | 0.465 | 0.001 |
| HGIN组 | 60 | 0.306 | 0.017 | 0.284 | 0.028 | 0.503 | 0.000 |
| 腺瘤癌变组 | 80 | 0.443 | 0.000 | 0.223 | 0.047 | 0.248 | 0.033 |
自噬是以胞质内出现双层膜结构包裹长寿命蛋白和细胞器的自噬体为特征的细胞"自我消化"的一系列生化过程[2,3]. 研究表明, 自噬活性异常与肿瘤的发生发展密切相关[5,12]. 一方面, 自噬能在不利生存环境中提高肿瘤细胞对应激的耐受能力, 维持其生存; 另一方面, 自噬又能在肿瘤发展的不同阶段抑制其发展和转移, 过度的自噬能诱导细胞的自噬性细胞死亡, 杀伤肿瘤细胞[3,13].
LC3-B是自噬发生过程的一种关键蛋白, 定位于前自噬泡和自噬泡膜表面, 被认为是自噬活动的特异性标志[10]. beclin1既是一种候选的抑癌基因, 在细胞的生长、凋亡、细胞自噬等方面起着桥梁作用[14-16], 又是参与自噬的特异性基因, 是自噬发生的正性调控分子. beclin1与LC3-B在绝大多数人类恶性肿瘤如卵巢癌, 肺癌, 乳腺癌, 胰腺癌[7,8]等表达缺失, 但是在食管癌、胃癌、浸润性大肠癌[9-11]等肿瘤中呈高表达. Qu等[17]发现beclinl+/-杂合缺失的鼠的自发性肿瘤的发生率升高, 且自噬活性明显下降. 目前beclin1及LC3-B在大肠腺瘤癌变过程不同病变组织中的表达及其相关性尚不清楚. 本实验发现, 在腺瘤癌变过程中, beclin1、LC3-B的表达不仅与肿瘤的进展程度呈正相关, 并且在病变的不同阶段两者均呈正相关. Beclin1与LC3-B在腺瘤癌变组中的表达明显高于LGIN及正常肠黏膜, 但与HGIN无差别, 提示在腺瘤-腺癌序列过程中存在beclin1基因的活化, 并促进了自噬的发生, 参与了肿瘤的发生发展. 其机制可能为在肿瘤发生的早期, 肿瘤由良性向恶性的转变过程中, beclin1基因活化, 诱导了肿瘤细胞自噬现象的发生, 增强了肿瘤细胞抵御不利生存因素影响的能力[11,18], 推动正常肠黏膜向LGIN-HGIN转化, 使细胞进入去分化的状态. 本实验同时发现在腺瘤癌变组中, beclin1与LC3-B在直径>5 cm的病变组中呈高表达, 但与肿瘤的分化程度, 浸润深度及淋巴转移等均无相关. 该结果提示, 在肿瘤的进展阶段, 随肿瘤的不断生长, 体积变大, 肿瘤中央区域开始出现缺血缺氧, 自噬水平被持续激活, 导致肿瘤细胞因过度自我消耗而死亡. 此时, 自噬作为一种程序性死亡方式, 杀伤肿瘤细胞[19,20], 在一定程度上抑制了肿瘤发展.
mTOR作为一种癌基因, 不仅在调节细胞增殖和凋亡方面具有重要作用, 而且在自噬诱导阶段发挥负性调控作用, 被称为自噬作用的门控分子[21]. 研究表明mTOR在肺癌、肝癌、乳腺癌、大肠癌和子宫内膜癌等中均存在mTOR的高表达和持续活化[22-24]. Narita等[25]发现, 使用mTOR抑制剂能增加LC3-B的表达. 本研究发现, mTOR不仅在腺瘤癌变组中的表达高于其他3组(P<0.05), 而且在HGIN与LGIN组中的表达均高于正常肠黏膜组(P<0.05). 同时, 相关性分析结果显示mTOR与LC3-B在HGIN与腺瘤癌变组中, 呈正相关的趋势. 本实验结果显示, 在腺瘤-腺癌序列中, 自噬调控基因mTOR对自噬现象的抑制作用效果不显著. 而mTOR在腺瘤癌变过程中表达增高, 可以提高细胞增殖活性, 抑制凋亡, 增加细胞由G1期向S期转换[21], 在正常肠黏膜向LGIN以及HGIN向腺癌的恶性转变过程中, 发挥一定的推动作用. 在腺瘤癌变组中, mTOR在侵及外膜的肿瘤中高表达, 表明mTOR不仅参与了结直肠癌的发生, 还参与了其浸润、进展.
beclin1与mTOR作为正向和负向调节细胞自噬的因子, 二者之间的关系目前尚不清楚. 本研究在结直肠腺瘤癌变过程中发现beclin1与mTOR表达同时升高, 且呈正相关关系, 而自噬发生的标记分子LC3-B表达亦升高. 表明在此过程中, beclin1发挥了对自噬的促进作用, 而mTOR对自噬的抑制作用未占主导地位. 我们认为, 自噬的调控途径中ClassⅠP13K与Class Ⅲ P13K发挥重要作用, beclin1与mTOR分属于这两条不同的途径, 两者在腺瘤癌变过程中所表现出的正相关, 可能为二者分别伴随PI3K/AKT/mTOR通路与Class Ⅲ P13K/ beclin1复合物的增高而增高[26-30]. 然而beclin1与mTOR之间是否存在某种交互作用和相互影响, 有待进一步研究. 自噬的调控机制十分复杂, 目前尚未研究清楚, 在结直肠腺瘤癌变过程中beclin1与mTOR同时增高的相关分子机制, 还需进一步深入研究.
细胞的自噬现象贯穿于细胞生长的全过程, 其对细胞的作用具有两面性, 既可以为细胞生存创造有利条件, 又能诱发自噬性细胞死亡, 促进细胞凋亡. 本研究提示, 自噬在结直肠腺瘤癌变早期促进了肿瘤的发生与恶化, 而在肿瘤晚期阶段, 持续活化的自噬则诱导自噬性细胞死亡, 杀伤肿瘤细胞. 进一步阐明自噬对结直肠腺瘤癌变过程发挥作用的分子机制, 有助于揭示肿瘤发生、发展的规律, 并能指导肿瘤的临床诊治.
目前, 自噬作为一种新的程序性死亡方式受到越来越多的关注, 而随着结直肠癌的发病率不断增高, 深入探讨自噬与结直肠癌发病机制之间的关系, 为结直肠癌的有效防治提供新的方向, 具有重要的社会意义.
李革, 副教授, 延边大学附属医院
研究表明, 自噬在肿瘤发生发展中发挥着双重作用. 一方面, 自噬能保护及促进肿瘤细胞生存扩散; 另一方面, 自噬又能抑制其发展和转移, 及杀伤肿瘤细胞. 因此, 明确自噬在不同类型肿瘤及同一肿瘤不同发展阶段中发挥的作用, 成为亟待研究的问题.
研究表明在大肠癌、食管癌、乳腺癌、肺癌、胰腺癌等多种肿瘤中都存在不同程度的自噬现象. 自噬与凋亡共存与同一细胞中, 两者相互拮抗或促进, 相互制衡, 受到一些相同因子的共同调控和影响.
本文在腺瘤-腺癌序列不同阶段中检测beclin1、mTOR及LC3-B的表达情况, 探讨自噬及其调控因子在结直肠癌发生发展中发挥的作用, 并探讨自噬过程中其调控因子beclin1及mTOR之间的关系.
本文有一定的创新性和科学性, 实验设计合理, 结果可信, 对临床研究结直肠癌的发生发展有一定的参考意义.
编辑: 田滢 电编:鲁亚静
| 1. | 周 晓军, 樊 祥山. 解读2010年消化系统肿瘤WHO分类(Ⅰ). 临床与实验病理学杂志. 2011;27:341-346. |
| 2. | Klionsky DJ. Autophagy revisited: a conversation with Christian de Duve. Autophagy. 2008;4:740-743. [PubMed] |
| 3. | Yang Z, Klionsky DJ. Eaten alive: a history of macroautophagy. Nat Cell Biol. 2010;12:814-822. [PubMed] [DOI] |
| 4. | Eskelinen EL, Saftig P. Autophagy: a lysosomal degradation pathway with a central role in health and disease. Biochim Biophys Acta. 2009;1793:664-673. [PubMed] |
| 5. | Guo JY, Xia B, White E. Autophagy-mediated tumor promotion. Cell. 2013;155:1216-1219. [PubMed] [DOI] |
| 6. | Fantin VR, Abraham RT. Self-eating limits EGFR-dependent tumor growth. Cell. 2013;154:1184-1186. [PubMed] [DOI] |
| 7. | Gong C, Bauvy C, Tonelli G, Yue W, Deloménie C, Nicolas V, Zhu Y, Domergue V, Marin-Esteban V, Tharinger H. Beclin 1 and autophagy are required for the tumorigenicity of breast cancer stem-like/progenitor cells. Oncogene. 2013;32:2261-272, 2261-272. [PubMed] [DOI] |
| 8. | Fujii S, Mitsunaga S, Yamazaki M, Hasebe T, Ishii G, Kojima M, Kinoshita T, Ueno T, Esumi H, Ochiai A. Autophagy is activated in pancreatic cancer cells and correlates with poor patient outcome. Cancer Sci. 2008;99:1813-1819. [PubMed] [DOI] |
| 9. | Műzes G, Tulassay Z, Sipos F. Interplay of autophagy and innate immunity in Crohn's disease: a key immunobiologic feature. World J Gastroenterol. 2013;19:4447-4454. [PubMed] |
| 10. | Yoshioka A, Miyata H, Doki Y, Yamasaki M, Sohma I, Gotoh K, Takiguchi S, Fujiwara Y, Uchiyama Y, Monden M. LC3, an autophagosome marker, is highly expressed in gastrointestinal cancers. Int J Oncol. 2008;33:461-468. [PubMed] [DOI] |
| 11. | Sato K, Tsuchihara K, Fujii S, Sugiyama M, Goya T, Atomi Y, Ueno T, Ochiai A, Esumi H. Autophagy is activated in colorectal cancer cells and contributes to the tolerance to nutrient deprivation. Cancer Res. 2007;67:9677-9684. [PubMed] [DOI] |
| 12. | Shoji-Kawata S, Sumpter R, Leveno M, Campbell GR, Zou Z, Kinch L, Wilkins AD, Sun Q, Pallauf K, MacDuff D. Identification of a candidate therapeutic autophagy-inducing peptide. Nature. 2013;494:201-206. [PubMed] |
| 13. | Yang SY, Winslet MC. Dual role of autophagy in colon cancer cell survival. Ann Surg Oncol. 2011;18 Suppl 3:S239. [PubMed] |
| 14. | He C, Levine B. The Beclin 1 interactome. Curr Opin Cell Biol. 2010;22:140-149. [PubMed] [DOI] |
| 15. | Wei Y, Zou Z, Becker N, Anderson M, Sumpter R, Xiao G, Kinch L, Koduru P, Christudass CS, Veltri RW. EGFR-mediated Beclin 1 phosphorylation in autophagy suppression, tumor progression, and tumor chemoresistance. Cell. 2013;154:1269-1284. [PubMed] [DOI] |
| 16. | Guo GF, Jiang WQ, Zhang B, Cai YC, Xu RH, Chen XX, Wang F, Xia LP. Autophagy-related proteins Beclin-1 and LC3 predict cetuximab efficacy in advanced colorectal cancer. World J Gastroenterol. 2011;17:4779-4786. [PubMed] |
| 17. | Qu X, Yu J, Bhagat G, Furuya N, Hibshoosh H, Troxel A, Rosen J, Eskelinen EL, Mizushima N, Ohsumi Y. Promotion of tumorigenesis by heterozygous disruption of the beclin 1 autophagy gene. J Clin Invest. 2003;112:1809-1820. [PubMed] [DOI] |
| 18. | Liang C, Feng P, Ku B, Dotan I, Canaani D, Oh BH, Jung JU. Autophagic and tumour suppressor activity of a novel Beclin1-binding protein UVRAG. Nat Cell Biol. 2006;8:688-699. [PubMed] |
| 19. | Kang R, Zeh HJ, Lotze MT, Tang D. The Beclin 1 network regulates autophagy and apoptosis. Cell Death Differ. 2011;18:571-580. [PubMed] [DOI] |
| 20. | Yu L, Alva A, Su H, Dutt P, Freundt E, Welsh S, Baehrecke EH, Lenardo MJ. Regulation of an ATG7-beclin 1 program of autophagic cell death by caspase-8. Science. 2004;304:1500-1502. [PubMed] |
| 21. | Mirzoeva OK, Hann B, Hom YK, Debnath J, Aftab D, Shokat K, Korn WM. Autophagy suppression promotes apoptotic cell death in response to inhibition of the PI3K-mTOR pathway in pancreatic adenocarcinoma. J Mol Med (Berl). 2011;89:877-889. [PubMed] [DOI] |
| 22. | Efeyan A, Zoncu R, Chang S, Gumper I, Snitkin H, Wolfson RL, Kirak O, Sabatini DD, Sabatini DM. Regulation of mTORC1 by the Rag GTPases is necessary for neonatal autophagy and survival. Nature. 2013;493:679-683. [PubMed] [DOI] |
| 23. | Bao XX, Xie BS, Li Q, Li XP, Wei LH, Wang JL. Nifedipine induced autophagy through Beclin1 and mTOR pathway in endometrial carcinoma cells. Chin Med J (Engl). 2012;125:3120-3126. [PubMed] |
| 24. | Kim DD, Eng C. The promise of mTOR inhibitors in the treatment of colorectal cancer. Expert Opin Investig Drugs. 2012;21:1775-1788. [PubMed] [DOI] |
| 25. | Narita M, Young AR, Arakawa S, Samarajiwa SA, Nakashima T, Yoshida S, Hong S, Berry LS, Reichelt S, Ferreira M. Spatial coupling of mTOR and autophagy augments secretory phenotypes. Science. 2011;332:966-970. [PubMed] [DOI] |
| 26. | Johnson SM, Gulhati P, Rampy BA, Han Y, Rychahou PG, Doan HQ, Weiss HL, Evers BM. Novel expression patterns of PI3K/Akt/mTOR signaling pathway components in colorectal cancer. J Am Coll Surg. 2010;210:767-76, 776-8. [PubMed] [DOI] |
| 27. | Pandurangan AK. Potential targets for prevention of colorectal cancer: a focus on PI3K/Akt/mTOR and Wnt pathways. Asian Pac J Cancer Prev. 2013;14:2201-2205. [PubMed] |
| 28. | Zhu BS, Yu LY, Zhao K, Wu YY, Cheng XL, Wu Y, Zhong FY, Gong W, Chen Q, Xing CG. Effects of small interfering RNA inhibit Class I phosphoinositide 3-kinase on human gastric cancer cells. World J Gastroenterol. 2013;19:1760-1769. [PubMed] |
| 29. | 高 向前, 吴 淑华, 李 扬扬, 曹 璋, 纪 洪. 结直肠癌与不同上皮内瘤变腺瘤中PI3Kp110β的表达及临床意义. 临床与实验病理学杂志. 2012;28:518-521. |