修回日期: 2014-01-22
接受日期: 2014-02-03
在线出版日期: 2014-03-08
目的: 探讨紫花牡荆素(casticin)促进肝星状细胞(hepatic stellate cell, HSC)-T6凋亡的作用机制.
方法: 用终浓度为0、0.5、1.0、2.0 μmol/L的Casticin作用于HSC-T6, 于12、24、48 h后采用MTT法检测HSC-T6增殖抑制率; 24 h后收集各组细胞, 流式细胞术检测细胞周期及凋亡率; DNA琼脂糖凝胶电泳法检测HSC-T6凋亡; RT-PCR法检测促凋亡基因FAS/FASL mRNA及抑凋亡基因Bcl-2 mRNA的表达; 免疫组织化学法检测凋亡蛋白Caspase3的表达.
结果: MTT法检测显示, Casticin对HSC-T6有增殖抑制作用, 并存在浓度和时间依赖关系; 流式细胞仪检测HSC-T6凋亡, 发现2.0 μmol/L的Casticin作用48 h后, HSC-T6凋亡率达到最大值55.70%±5.56%, 各药物组凋亡率与空白对照组比较, 差异有统计学意义(P<0.05). DNA琼脂糖凝胶电泳法检测HSC-T6凋亡, 显示有特征性的DNA梯度带形成. RT-PCR法检测促凋亡基因FAS/FASL mRNA表达明显上调, 而抑凋亡基因Bcl-2 mRNA的表达下调. 免疫组织化学法检测凋亡蛋白Caspase3的表达明显增加, 当Casticin浓度2.0 μmol/L作用48 h, 其表达率71.33%±2.68%, 与空白对照组比较, 差异有统计学意义(P<0.05).
结论: Casticin诱导HSC-T6细胞凋亡的机制可能是通过上调Fas/FasL基因表达, 下调Bcl-2, 促使线粒体通透性增加, 再激活Caspase3蛋白诱发细胞凋亡.
核心提示: 紫花牡荆素能过抑制肝星状细胞(hepatic stellate cell, HSC)的活化, 通过上调Fas/FasL基因表达, 下调Bcl-2, 促使线粒体通透性增加, 再激活Caspase3蛋白诱发细胞凋亡. 其抑制HSC活化作用与抑制肝纤维化, 进一步抑制肝癌密切相关.
引文著录: 田君湘. 紫花牡荆素诱导肝星状细胞凋亡的作用机制. 世界华人消化杂志 2014; 22(7): 907-914
Revised: January 22, 2014
Accepted: February 3, 2014
Published online: March 8, 2014
AIM: To investigate the effect of casticin on apoptosis of hepatic stellate cells (HSCs) in vitro and the possible mechanisms involved.
METHODS: Rat HSC-T6 cells were cultured in high-glucose DMEM and then treated with different concentrations of casticin (0, 0.5, 1.0, and 2.0 μmol/L) for 12, 24 and 48 h. HSC-T6 apoptosis was identified by flow cytometry (FCM) and agarose gel electrophoresis. The mRNA expression of apoptosis-related genes Fas/FasL and Bcl-2 was examined by RT-PCR. The expression of Caspase3 was studied by immunocytochemical staining assay (SABC).
RESULTS: Casticin treatment significantly increased the apoptosis of HSC-T6 in a dose- and time-dependent manner compared with the control group (P < 0.01). The highest apoptosis rate was observed in HSC-T6 cells treated with 2.0 μmol/L of casticin for 48 h (55.70% ± 5.56%). An oligonucleosomal DNA ladder was demonstrated by SABC, indicating DNA break in HSC-T6 cells. The expression of Fas/FasL mRNA was increased, while expression of Bcl-2 mRNA was reduced. After HSC-T6 cells were treated with casticin at concentrations of 0.5, 1.0, and 2.0 μmol/L for 48 h, the positive rates of Caspase3 protein expression were 12.78% ± 0.74%, 41.00% ± 1.51% and 71.33% ± 2.68%, respectively. Casticin treatment significantly increased Caspase3 protein expression in a dose- and time-dependent manner compared with the control group (P < 0.001).
CONCLUSION: Casticin induced apoptosis of HSC-T6 cells may involve mitochondrial pathways and Bcl-2 family proteins. Casticin might be a potential Chinese medical component for inhibiting liver fibrosis.
- Citation: Tian JX. Mechanisms underlying casticin induced apoptosis of hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2014; 22(7): 907-914
- URL: https://www.wjgnet.com/1009-3079/full/v22/i7/907.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i7.907
肝纤维化(hepatic fibrosis, HF)是指过多胶原纤维在肝内沉积, 是各种慢性肝病向肝硬变发展的必经阶段. HF的形成是多种细胞、细胞因子及细胞外基质(extracellular matrix, ECM)相互交错影响的动态变化网络. 肝星状细胞(hepatic stellate cell, HSC)被公认为是HF形成网络的核心. HSC正常状态下能合成与分泌少量的ECM, 各种引起肝脏慢性损伤的病因都可激活HSC. 活化的HSC可以合成大量的胶原、非胶原性糖蛋白、蛋白多糖等, 并参与胶原酶及其抑制物的合成及调节, 是ECM的主要来源细胞. 因此以HSC作为靶点治疗HF成为当前研究热点[1]. 大量研究已经证实活化HSC数量减少主要通过凋亡途径; 减少活化HSC数量有利于HF逆转; 诱导活化HSC凋亡是抗HF的有效途径; 目前尚缺乏确切有效的抗HF药物; 中药抗HF展现良好的发展前景[2,3]. 紫花牡荆素(casticin)为马鞭草科植物的干燥成熟果实-蔓荆子(vitex trifolia L1)提取物黄酮类化合物的一种[4]. 本实验采用流式细胞仪与DNA琼脂糖凝胶电泳分析, 证实Casticin对HSC增殖抑制和凋亡诱导作用, 同时检测促凋亡基因FAS、抑凋亡基因Bcl-2与凋亡蛋白酶Caspase3, 揭示Casticin对HSC-T6促凋亡作用的可能机制.
肝星状细胞株HSC-T6由上海中医药大学提供, 系SV40转染的大鼠HSC, 具有活化HSC的表型. Casticin购自成都普瑞法科技开发公司(纯度>98%); 小牛血清为杭州四季青生物制品有限公司生产; 甲氮甲唑篮(MTT)购自Sigma公司; 二甲基亚砜(DMSO)为美国Amresco公司产品; Fas、Bcl-2引物由上海生工合成; 逆转录-多聚酶链反应试剂盒试剂盒购自Promega公司; 兔抗大鼠Caspase3单克隆抗体及SABC免疫组织化学试剂盒购自武汉博士德公司.
1.2.1 细胞培养: 肝星状细胞株HSC-T6置37 ℃、50 mL/L CO2的培养箱中, 用含100 mL/L小牛血清以及青链霉素各100 kU/L的DMEM(高糖)培养液培养, 倒置显微镜观察细胞生长情况, 2.5 g/L胰蛋白酶消化传代, 取对数生长期细胞用于实验.
1.2.2 MTT比色法: 将Casticin用DMSO助溶, 用基础培养基依次对半稀释成3个梯度的母液, 调整各浓度中DMSO助溶剂质量浓度相同. 取对数生长期细胞, 以每孔0.2 mL(约0.3×104个/孔)接种于96孔板, 培养24 h待细胞贴壁后, 分别加入不同终浓度分别为0.5、1.0、2.0 μmol/L Casticin, 对照组加100 µL完全培养基, 另设空白对照组(只加培养基, 无细胞). 每个剂量组设5个复孔, 其中DMSO终浓度为2.5 g/L, 将各组细胞继续培养12、24、48 h. 在规定时间, 每孔加入20 μL MTT(5 g/L), 继续培养4 h后倾去培养液, 加入DMSO 0.2 mL/孔, 平板震荡器振荡5 min, 充分溶解蓝紫色颗粒, 空白孔调零, 用酶标仪以490 nm波长测定各组细胞吸光度(A)值, 细胞增殖抑制率 = (1-实验组平均A值/对照组平均A值)×100%. 重复上述实验5次.
1.2.3 流式细胞术分析细胞周期及检测凋亡率: 采用PI荧光染色法. 将Casticin作用24 h后的各组培养瓶内HSC收集于离心管中, 贴壁的细胞消化后与原瓶的悬浮细胞混合, 1000 r/min离心5 min, 弃上清, 冷磷酸盐缓冲液(PBS, pH 7.2-7.4)洗涤2次, 调整为1×106/mL, 预冷700 mL/L乙醇(注意边加边振荡, 以免细胞成团), 4 ℃过夜, PBS洗涤2次去除固定液, 加200 μL RNA酶, 37 ℃水浴30 min, 300目尼龙网过滤, 再加800 μL PI染色液混匀, 4 ℃避光染色30 min, 每组重复4次, 上机检测. 采用流式细胞仪对样品进行检测, 每次计细胞数6000个, 记录激发波长488 nm处红色荧光, 流式细胞仪分析不同DNA含量的细胞分布, 用分析软件CellQuest检测凋亡率, 低于G1期的细胞(亚G1期)为凋亡细胞, 其占细胞总数的比例为凋亡细胞比例. 用ModFilLT软件进行处理, 计算各周期细胞比例.
1.2.4 琼脂糖凝胶电泳法检测HSC-T6凋亡: 用TBE(1 mmol/L EDTA, pH 8.0, 45 mmol/L Tris-硼酸)缓冲液配制1.8%琼脂糖凝胶. 在微波炉内煮沸至琼脂糖溶解, 待冷却至60 ℃时, 加入溴化乙锭(10 mg/mL)使其终浓度为0.5 g/L, 混匀后灌胶, 待胶凝因后放入含TBE电泳液的电泳槽内, 使TBE液盖过凝胶, 取10-15 μL提取的各组DNA样品液与上样缓冲液(含0.25%溴酚兰, 4%蔗糖)按4:1比例混匀后点样, 60 V电泳1 h, 用紫外线透射仪观察梯形条带, 并摄影.
1.2.5 RT-PCR测定Casticin对HSC-T6基因Fas mRNA和Bcl-2 mRNA表达: Fas上游引物为5'-ATCACAAAGGACAGGCAC-3', 下游引物为5'-TAGGGTTCAGGACTTTCA-3', 大小364 bp; Bcl-2上游引物为5'-CGGGAGGAGCACATTCAGA-3', 下游引物为5'-AGTAGAAGGCAGACCAGAC-3', GAPDH上游引物为5'-ACCACAGTCCATGCCATCAC-3', 下游引物为5'-TCCACCACCCTGTTGCTG-3', 大小450 bp, 均由上海生工合成. 提取细胞总RNA, 采用Promega试剂盒逆转录为cDNA. 逆转录条件: 42 ℃ 10 min, 95 ℃ 5 min, 4 ℃ 5 min, 瞬时离心后4 ℃保存. -20 ℃保存. 取逆转录产物进行PCR, 检测Fas mRNA和Bcl-2 mRNA表达, β-actin为内参照. PCR复合扩增条件: 95 ℃预变性4.5 min, 94 ℃变性60 s, 54 ℃退火60 s, 72 ℃延伸60 s, 共35个循环, 最后72 ℃延伸10 min. 用Gel-Doc1000型紫外凝胶图像分析仪自带软件分析Fas、Bcl-2和β-actin的扩增条带, 计算Fas、Bcl-2 mRNA表达的抑制率(survivin mRNA/β-actin mRNA)为1.
1.2.6 用免疫细胞化学法检测Caspase3蛋白的表达: 蒸馏水洗细胞爬片3 min×3次, 0.3%H2O2甲醇液室温浸泡30 min, 以灭活内源性过氧化物酶, PBS洗2 min×3次, 滴加正常小牛血清, 室温下20 min, 以封闭非特异性抗原. 弃去多余血清, 滴加兔抗大鼠Caspase3单克隆抗体, 湿盒内4 ℃夜, PBS洗2 min×3次, 滴加生物素化二抗, 湿盒内37 ℃温箱30 min, PBS洗5 min×3次, 滴加链霉新合素一过氧化物酶复合物, 湿盒内室温苏木素复染, 二甲苯透明, 中性树脂封片, 光镜下观察, 阳性细胞为胞膜呈棕黄色. 以PBS代替抗大鼠Caspase3抗体作为阴性对照. 其结果判断: 以16D目镜测微网在400倍放大下计数网格中的阳性细胞数, 每例计数10个网格, 计算阳性细胞的百分率, 并根据每张盖玻片阳性细胞着色深浅计分, 无着色为0分(阴性), 浅黄色为1分(弱阳性), 棕黄色为2分(阳性), 棕褐色为3分(强阳性). 然后根据两者积分的乘积进行统计分析.
统计学处理 各组实验数据用mean±SD表示, 采用SPSS统计软件进行单因素方差分析, P<0.05为差异有统计学意义.
对照组细胞体外生长活跃, 经0.5、1.0、2.0 μmol/L Casticin作用12、24、48 h后, HepG2细胞生长均有不同程度地减慢, 与阴性对照组比较, 不同浓度的Casticin对HSC的增殖抑制率显著升高(P<0.01)(表1).
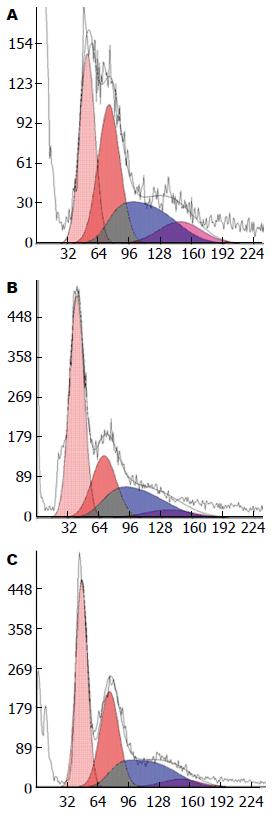
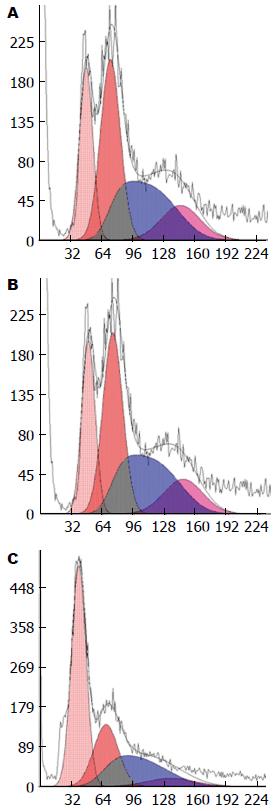
用0.5、1.0、2.0 μmol/L共3种浓度的Casticin处理生长良好的肝星状细胞株12、24、48 h, 设空白对照组, 流式细胞仪检测细胞凋亡率. 结果显示, 随Casticin作用浓度和时间的增加, 凋亡率逐渐升高, 呈现量效与时效关系, 实验组与空白对照组比较, 差异均有统计学意义(P<0.01), 实验组之间不同浓度和不同时间比较差异均有统计学意义(P<0.05); 空白对照组HSC经培养后也出现凋亡, 说明活化细胞可发生自发性凋亡. 流式细胞仪检测凋亡图表明在G0/G1期前出现亚二倍体峰即细胞凋亡率, 随着药物浓度的增加及作用时间的延长, 该峰呈上升趋势(表2, 图1, 2).
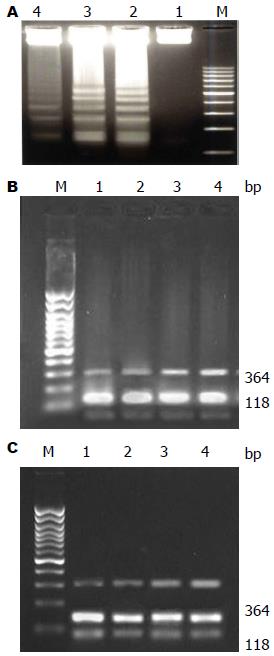
琼脂糖凝胶电泳结果显示, 在118 bp外均可见到均匀一致的β-actin基因的条带; 各组在364 bp处均可见到Fas/FasL mRNA表达, 空白组HSC弱表达, 即不同浓度Casticin处理后, 其表达呈剂量依赖性增强(图3A), 其中空白组与Casticin组0.5、1.0、2.0 μmol/L比较均有统计学意义(P<0.05); 各药物组之间比较均有差异(P<0.05).
2.4.1 不同浓度Casticin对HSC Fas/FasL mRNA表达的影响: 琼脂糖凝胶电泳结果显示, 在118 bp外均可见到均匀一致的β-actin基因的条带; 各组在364 bp处均可见到Fas/FasL mRNA表达, 空白组HSC弱表达, 即不同浓度Casticin处理后, 其表达呈剂量依赖性增强(图3B), 其中空白组与Casticin 0.5、1.0、2.0 μmol/L比较均有统计学意义(P<0.05); 各药物组之间比较均有差异(P<0.05).
2.4.2 Casticin处理不同时间对HSC Fas/FasL mRNA的表达的影响: 实验选定1.0 μmol/L Casticin作为最佳处理浓度, 观察莪术油处理HSC不同的时间(12、24、48 h)后, 其对细胞Fas/FasL mRNA水平的影响. 实验结果表明细胞Fas/FasL mRNA的表达随时间延长而增强, 呈时间依赖性(图3C). 空白组与不同时间组比较有显著差异(P<0.05). 不同时间组内进行比较有差异(P<0.05).
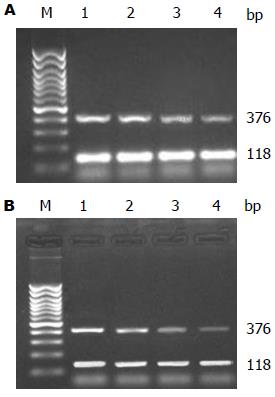
2.5.1 不同浓度Casticin对HSC Bcl-2 mRNA表达的影响: 琼脂糖胶电泳结果显示, 在118 bp处均可见到均匀一致的β-actin基因的条带; 各组在376 bp处均可见到Bcl-2 mRNA表达, 空白组HSC强表态, 不同浓度Casticin处理后, 空白组及Casticin 0.5、1.0、2.0 μmol/L之间比较均有统计学意义(均P<0.05), 药物组两两比较均有统计学意义(P<0.05)(图4A).
2.5.2 Casticin处理不同时间对HSC Bcl-2 mRNA的影响: 实验选定1.0 μmol/L Casticin作为最佳处理浓度, 观察Casticin处理HSC不同时间(12、24、48 h)后Bcl-2 mRNA表达水平的影响. 结果显示, 即随Casticin作用时间延长, 细胞Bcl-2 mRNA表达呈时间依赖性减弱(图4B). 与空白组比较有显著差异(P<0.05), 不同时间比较均有差异(P<0.05).
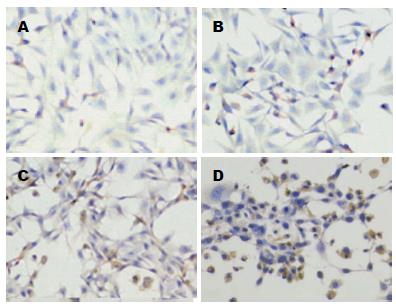
采用免疫细胞化学法检测凋亡蛋白酶Caspase3, 0.5、1.0、2.0 μmol/L Casticin处理HSC-T6细胞12、24、48 h后, 细胞爬片的Caspase3蛋白免疫组化染色结果显示: 正常对照片中仅有少量细胞在细胞核中表Caspase3蛋白, 表现为细胞核有棕黄色颗粒沉积, 细胞浆及无阳性染色; 而0.5、1.0、2.0 μmol/L Casticin处理的细胞核中着色逐渐增多(图5); 各组Caspase3阳性率如表3, Caspase3阳性率随Casticin浓度增加及时间的延长逐渐升高, 呈现量效关系. 与空白对照组比较, 均有统计学差异(P<0.05). 组间比较P<0.01.
| 分组 | 12 h | 24 h | 48 h |
| 空白对照组 | 2.19±0.51 | 4.75±0.26 | 5.75±0.34 |
| 20 μmol/L | 8.53±0.46ace | 9.98±0.55a | 12.78±0.73a |
| 40 μmol/L | 14.51±0.45acegi | 27.43±1.84agi | 41.00±1.54agi |
| 60 μmol/L | 28.93±2.37ace | 39.12±1.19a | 71.34±2.68a |
HSC作为胶原纤维和其他非胶原纤维基质蛋白的主要来源, 其活化、增殖是肝纤维化发生、发展的中心环节[5]. 当肝脏损伤使HSC活化后, 活化HSC大量增殖, 合成分泌大量ECM, 并且使组织金属蛋白酶抑制物表达增高, 胶原酶的活性降低, 造成胶原酶讲解障碍, ECM大量沉积导致肝纤维化的发生、发展[6]. 肝纤维化的损伤因素去除后常能自发逆转, HSC凋亡是此过程的关键HSC由于在肝纤维化发生、发展中的重要作用, 已成为研究肝纤维化治疗的主要靶细胞[7], 抑制HSC的活化, 促进HSC凋亡是治疗HF的理想途径[8].
大量研究已经证实, 活化HSC数量减少主要通过凋亡途径, 减少活化HSC数量有利于HF逆转, 诱导活化HSC凋亡是抗HF的有效途径, 目前尚缺乏确切有效的抗HF药物, 中药抗HF展现良好的发展前景. 迄今为止, 紫花牡荆素促进HSC株凋亡的作用机制仍不清楚. Casticin为马鞭草科植物的干燥成熟果实-蔓荆子. 提取物黄酮类化合物的一种. 各种黄酮类化合物具有广泛的抗肿瘤作用. 其相对分子质量为374.34 kDa分子式C19H18O8. Casticin具有抗急性炎症[9], 抗菌作用, 雌激素活性[10], 止痛及抑制高催乳素血症, 并且对心血管疾病、呼吸系统也显示出一定的疗效. 目前Casticin抗肿瘤方面的作用是国内外学者研究的热点和焦点[11,12]. Casticin诱导HSC凋亡的分子机制不明确, 国内外也无相关的文献报道. 本实验用不同浓度Casticin作用于体外培养的大鼠HSC-T6, 观察HSC凋亡情况. 使用流式细胞分析法结果Casticin诱导HSC凋亡呈时间剂量依赖性, 各药物组凋亡率与空白对照组比较, 均存在统计学差异(P<0.05). 当Casticin 2.0 μmol/L作用HSC-T6 48 h, HSC-T6凋亡达到最大值55.70%±5.56%. 琼脂糖凝胶电泳中检测到有特征性DNA梯度带形成, 说明Casticin能引起细胞基因组DNA断裂, 更进一步证明Casticin能诱导体外HSC发生凋亡. 流式细胞术与琼脂糖凝胶电泳法结果表明Casticin可明显促进HSC凋亡, 作用强度呈剂量-时间依赖趋势.
HSC凋亡是一个受基因调控的主动过程, 可能由若干相关基因共同完成. FasL与靶细胞膜上特异的受体Fas结合, 启动凋亡程序, 导致细胞凋亡, 是促细胞凋亡的主要途径. Bcl-2是Bcl家族中的重要成员, Bcl-2基因是重要的凋亡抑制基因, 可影响细胞的生存, 对肿瘤细胞的增生有促进作用[13]. Bcl-2基因及其表达蛋白可以抑制多种组织细胞凋亡, 延长细胞寿命, 被人称为"存活基因"[14]. 他主要通过自身二聚或与Bax等蛋白形成异二聚体来发挥其调控细胞凋亡的功能. Bcl-2确切抗凋亡机制尚未完全明了, 其可能机制: (1)抑制线粒体释放促凋亡蛋白; (2)抑制促凋亡蛋白bax的细胞毒性; (3)直接的抗氧化作用; (4)影响细胞的跨膜转运, 改变钙离子分布, 调节钙离子激活内切酶和谷氨酰转移酶; (5)Bcl-2阻止p53诱导的细胞凋亡[11,15-17]. 在多数HCC中Bcl-2高表达, 其阳性率明显高于癌前组织, 且HCC分化越低, Bcl-2表达越高[18,19]. Chang等[20]用pcDNA3-Bcl-2转染Fas表达阳性的BCL-7404肝癌细胞, 过度表达的Bcl-2抑制了Fas介导的细胞凋亡, 同时发现, 高表达的bax并不能对抗Bcl-2对Fas介导的细胞凋亡的抑制, 而bax是Bcl-2与Fas凋亡途径的一个重要调节物[9,21]. 同时人们研究紫花牡荆素的抗肿瘤作用过程中显示Bcl-2的下调是诱导肿瘤细胞的凋亡的关键, 若肿瘤细胞内过度表达Bcl-2, 则无法诱导其凋亡[10].
Fas是细胞凋亡信号受体, 当Fas与其特异性配体FasL相结合后, 进一步转导凋亡信号兵诱导细胞凋亡, 其与免疫逃逸机制密切相关, 因此Fas/FasL信号通路可能成为下一个肿瘤治疗目标[22-24]. 本实验采用RT-PCR检测了促凋亡基因Fas/FasL及抑凋亡基因Bcl-2 mRNA的表达. 结果显示药物作用组的HSC-T6细胞Fas/Fas基因表达上调, Bcl-2表达下调, 呈浓度与时间依赖性, 与对照组相比有显著的差异(P<0.05). Casticin诱导HSC发生凋亡可能是通过作用凋亡基因实现的. Caspase家族在介导细胞凋亡的过程中起着非常重要的作用, 其中Caspase3为关键的执行分子, 是细胞凋亡过程中最主要的终末剪切酶, 他在凋亡信号传导的许多途径中发挥功能[25,26]. 免疫细胞化学检测表明各药物作用组的HSC-T6细胞对Caspase3蛋白表达增加, 呈时间剂量依赖性, 与空白对照组比较, 均存在统计学差异(P<0.05), 各药物组间两两比较存在统计学差异(P<0.05). 说明Casticin诱导HSC发生凋亡最终可能是通过Caspase3执行的. 本研究结果进一步证实Casticin有诱导HSC-T6细胞凋亡作用, 其机理可能是通过上调促凋亡基因Fas/FasL表达, 下调抑凋亡基因Bcl-2, 促使线粒体通透性增加, 链锁激活Caspase3蛋白诱发细胞凋亡. 然而, HSC激活及凋亡机制复杂, 是否存在别的凋亡途径、凋亡基因与凋亡因子参与, 有待进一步研究阐明.
肝纤维化是肝硬化的必经阶段, 而肝纤维化取决于肝星状细胞(hepatic stellate cell, HSC)的活化. 同时人们在研究紫花牡荆素的药理作用时发现其对肝星状的增殖有抑制作用和诱导凋亡作用, 其抗肿瘤方面的作用亦是国内外学者研究的热点和焦点.
李华, 副教授, 中山大学器官移植研究所, 中山大学附属第三医院肝脏移植中心
目前尚缺乏确切有效的抗肝纤维化药物, 但中药抗肝纤维化展现良好的发展前景, 紫花牡荆素为马鞭草科植物的干燥成熟果实-蔓荆子提取物黄酮类化合物的一种, 有着广泛的药理作用, 关于其抗肝纤维化的作用, 国内外研究甚少.
国内研究表明紫花牡荆素可以促进肺癌细胞的凋亡, 而Caspase3的抑制剂zDEVD-FMK抵消其促凋亡作用, 并发现其能下调Bcl-xl, 下调Bax及清除Bid, 从而促进肺癌细胞的凋亡.
本文使用MTT法检测紫花牡荆素对HSC-T6增殖的抑制作用, 流式细胞仪及DNA琼脂糖凝胶电泳法检测HSC-T6凋亡. 同时使用RT-PCR法检测Fas/FasL mRNA和Bcl-2 mRNA的表达情况. 进一步使用免疫组织化学法检测凋亡蛋白Caspase3的表达, 从而证实紫花牡荆素能促进HSC-T6的凋亡, 抑制其活化.
通过研究紫花牡荆素对HSC中Fas/FasL、Bcl-2及凋亡蛋白Caspase3表达的影响, 探讨紫花牡荆素抗肝纤维化的作用机制, 为中药在临床上用于肝纤维化治疗提供理论指导和实验依据.
肝纤维化是肝硬化的必经阶段, 而肝纤维化取决于HSC的活化, 目前尚缺乏确切有效的抗肝纤维化药物, 中药抗肝纤维化展现良好的发展前景, 本文通过研究紫花牡荆素对HSC中Fas/FasL、Bcl-2及凋亡蛋白Caspase3表达的影响, 探讨紫花牡荆素抗肝纤维化的作用机制, 为紫花牡荆素在临床上用于肝纤维化治疗提供理论指导和实验依据.
编辑: 田滢 电编:鲁亚静
| 1. | Saile B, Matthes N, El Armouche H, Neubauer K, Ramadori G. The bcl, NFkappaB and p53/p21WAF1 systems are involved in spontaneous apoptosis and in the anti-apoptotic effect of TGF-beta or TNF-alpha on activated hepatic stellate cells. Eur J Cell Biol. 2001;80:554-561. [PubMed] |
| 2. | Neubauer K, Saile B, Ramadori G. Liver fibrosis and altered matrix synthesis. Can J Gastroenterol. 2001;15:187-193. [PubMed] |
| 3. | Friedman SL. Liver fibrosis -- from bench to bedside. J Hepatol. 2003;38 Suppl 1:S38-S53. [PubMed] [DOI] |
| 4. | Lin S, Zhang H, Han T, Wu JZ, Rahman K, Qin LP. In vivo effect of casticin on acute inflammation. Zhong Xi Yi Jie He Xue Bao. 2007;5:573-576. [PubMed] [DOI] |
| 5. | Iredale JP, Benyon RC, Pickering J, McCullen M, Northrop M, Pawley S, Hovell C, Arthur MJ. Mechanisms of spontaneous resolution of rat liver fibrosis. Hepatic stellate cell apoptosis and reduced hepatic expression of metalloproteinase inhibitors. J Clin Invest. 1998;102:538-549. [PubMed] [DOI] |
| 6. | Issa R, Williams E, Trim N, Kendall T, Arthur MJ, Reichen J, Benyon RC, Iredale JP. Apoptosis of hepatic stellate cells: involvement in resolution of biliary fibrosis and regulation by soluble growth factors. Gut. 2001;48:548-557. [PubMed] [DOI] |
| 7. | Gressner AM. The cell biology of liver fibrogenesis - an imbalance of proliferation, growth arrest and apoptosis of myofibroblasts. Cell Tissue Res. 1998;292:447-452. [PubMed] |
| 8. | Wu J, Zern MA. Hepatic stellate cells: a target for the treatment of liver fibrosis. J Gastroenterol. 2000;35:665-672. [PubMed] |
| 9. | Shen JK, Du HP, Yang M, Wang YG, Jin J. Casticin induces leukemic cell death through apoptosis and mitotic catastrophe. Ann Hematol. 2009;88:743-752. [PubMed] [DOI] |
| 10. | Haïdara K, Zamir L, Shi QW, Batist G. The flavonoid Casticin has multiple mechanisms of tumor cytotoxicity action. Cancer Lett. 2006;242:180-190. [PubMed] [DOI] |
| 11. | Kobayakawa J, Sato-Nishimori F, Moriyasu M, Matsukawa Y. G2-M arrest and antimitotic activity mediated by casticin, a flavonoid isolated from Viticis Fructus (Vitex rotundifolia Linne fil.). Cancer Lett. 2004;208:59-64. [PubMed] [DOI] |
| 12. | Wang HY, Cai B, Cui CB, Zhang DY, Yang BF. [Vitexicarpin, a flavonoid from Vitex trifolia L., induces apoptosis in K562 cells via mitochondria-controlled apoptotic pathway]. Yao Xue Xue Bao. 2005;40:27-31. [PubMed] |
| 13. | Shin S, Sung BJ, Cho YS, Kim HJ, Ha NC, Hwang JI, Chung CW, Jung YK, Oh BH. An anti-apoptotic protein human survivin is a direct inhibitor of caspase-3 and -7. Biochemistry. 2001;40:1117-1123. [PubMed] [DOI] |
| 14. | Iwamoto H, Sakai H, Tada S, Nakamuta M, Nawata H. Induction of apoptosis in rat hepatic stellate cells by disruption of integrin-mediated cell adhesion. J Lab Clin Med. 1999;134:83-89. [PubMed] [DOI] |
| 15. | Letsas KP, Frangou-Lazaridis M, Skyrlas A, Tsatsoulis A, Malamou-Mitsi V. Transcription factor-mediated proliferation and apoptosis in benign and malignant thyroid lesions. Pathol Int. 2005;55:694-702. [PubMed] [DOI] |
| 16. | Rossé T, Olivier R, Monney L, Rager M, Conus S, Fellay I, Jansen B, Borner C. Bcl-2 prolongs cell survival after Bax-induced release of cytochrome c. Nature. 1998;391:496-499. [PubMed] [DOI] |
| 17. | Guo XZ, Shao XD, Liu MP, Xu JH, Ren LN, Zhao JJ, Li HY, Wang D. Effect of bax, bcl-2 and bcl-xL on regulating apoptosis in tissues of normal liver and hepatocellular carcinoma. World J Gastroenterol. 2002;8:1059-1062. [PubMed] |
| 18. | Chang YC, Xu YH. Expression of Bcl-2 inhibited Fas-mediated apoptosis in human hepatocellular carcinoma BEL-7404 cells. Cell Res. 2000;10:233-242. [PubMed] [DOI] |
| 19. | George J, Banik NL, Ray SK. Bcl-2 siRNA augments taxol mediated apoptotic death in human glioblastoma U138MG and U251MG cells. Neurochem Res. 2009;34:66-78. [PubMed] [DOI] |
| 20. | Tian J, Pan F, Li J, Ma Y, Cen H, Pan HF, Pan YY, Ye DQ. Association between the FAS/FASL polymorphisms and gastric cancer risk: a meta-analysis. Asian Pac J Cancer Prev. 2012;13:945-951. [PubMed] [DOI] |
| 21. | Villa-Morales M, Fernández-Piqueras J. Targeting the Fas/FasL signaling pathway in cancer therapy. Expert Opin Ther Targets. 2012;16:85-101. [PubMed] [DOI] |
| 22. | Suzuki A, Ito T, Kawano H, Hayashida M, Hayasaki Y, Tsutomi Y, Akahane K, Nakano T, Miura M, Shiraki K. Survivin initiates procaspase 3/p21 complex formation as a result of interaction with Cdk4 to resist Fas-mediated cell death. Oncogene. 2000;19:1346-1353. [PubMed] [DOI] |
| 23. | Moreno A, Figueras A, Lloveras B, Escobedo A, Griera E, Sierra A, Fabra A. Apoptosis in ductal carcinoma in situ of the breast. Breast J. 2001;7:245-248. [PubMed] [DOI] |
| 24. | Zamzami N, Brenner C, Marzo I, Susin SA, Kroemer G. Subcellular and submitochondrial mode of action of Bcl-2-like oncoproteins. Oncogene. 1998;16:2265-2282. [PubMed] [DOI] |
| 25. | Lei XY, Zhong M, Feng LF, Zhu BY, Tang SS, Liao DF. siRNA-mediated Bcl-2 and Bcl-xl gene silencing sensitizes human hepatoblastoma cells to chemotherapeutic drugs. Clin Exp Pharmacol Physiol. 2007;34:450-456. [PubMed] [DOI] |
| 26. | Cheng SQ, Wang WL, Yan W, Li QL, Wang L, Wang WY. Knockdown of survivin gene expression by RNAi induces apoptosis in human hepatocellular carcinoma cell line SMMC-7721. World J Gastroenterol. 2005;11:756-759. [PubMed] |