修回日期: 2013-12-23
接受日期: 2014-01-10
在线出版日期: 2014-03-08
目的: 探讨鳞状细胞癌抗原SCCA1在原发性肝细胞癌(hepatocellular carcinoma, HCC)中的表达情况及其临床意义.
方法: 采用免疫组织化学、Western blot、qRT-PCR检测SCCA1在肝细胞癌、癌旁非肿瘤组织、肝硬化及正常肝组织中的表达, 并分析SCCA1 mRNA与肝癌患者临床病理特征的相关性.
结果: 免疫组织化学显示62例HCC、43例癌旁肝组织、10例肝硬化、5例正常肝脏中均未发现SCCA1的表达; Western blot显示所检测的6例肝细胞癌均有SCCA1表达, 其中5例高表达于癌旁, 1例表达与癌旁相当, 3例肝硬化中1例阳性, 3例正常肝脏中均不表达; qRT-PCR分析显示SCCA1 mRNA在HCC组阳性率为29.5%(18/61), 癌旁组、肝硬化组、正常组均未发现阳性表达(0/61、0/16、0/6). 其中肝癌组与癌旁及肝硬化组差异有统计学意义(P = 0.000、0.013). 分析扩增曲线和溶解曲线, 内参基因G3PDH的CT值为18.90±1.40, 其单一峰Tm值87.9 ℃; 目的基因SCCA1的CT值为34.37±1.74, 其Tm值为88 ℃.
结论: SCCA1蛋白在HCC中微量表达, 免疫组织化学不易检测. SCCA1 mRNA用于HCC诊断特异度高、灵敏度有限.
核心提示: 鳞状细胞癌抗原(squamous cell carcinoma antigen, SCCA)1蛋白在肝细胞癌(hepatocellular carcinoma, HCC)中微量表达, 免疫组织化学不易检测. SCCA1 mRNA用于肝癌诊断特异度高, 但灵敏度有限, 因此可与其他肿瘤标志物联合以提高HCC诊断的准确率.
引文著录: 李石磊, 高英堂, 单士岗, 梁增辉, 翟道宽, 景丽, 刘彤, 杜智, 王毅军. 鳞状细胞癌抗原SCCA1在肝细胞癌中的表达及意义. 世界华人消化杂志 2014; 22(7): 1015-1021
Revised: December 23, 2013
Accepted: January 10, 2014
Published online: March 8, 2014
AIM: To determine the expression of squamous cell carcinoma antigen 1 (SCCA1) in hepatocellular carcinoma (HCC) and to evaluate its clinical significance.
METHODS: The expression of SCCA1 was assessed in specimens of HCC, adjacent non-cancerous tissues, liver cirrhosis and normal liver tissue by immunohistochemistry, Western blot and qRT-PCR. The relationship between the expression of SCCA1 and the clinicopathological features of HCC was analyzed.
RESULTS: Immunohistochemistry showed that SCCA1 was undetectable in 62 HCCs, 43 adjacent non-cancerous tissues, 10 cirrhosis liver tissues and 5 normal liver tissues. Western blot analysis demonstrated that 5 out of 6 detected HCC tissues had higher SCCA1 expression than paired adjacent non-cancerous tissues, and that the remaining HCC tissue showed similar expression pattern to adjacent non-cancerous tissues. One out of 3 liver cirrhosis tissues was SCCA1 positive, while SCAA1 expression was not detected in normal liver tissues (0/3). Using qRT-PCR, the expression of SCCA1 was found in 29.5% of the HCC tissues (18/61), but SCAA1 expression was not detected in paired adjacent non-cancerous, liver cirrhosis and normal liver tissues (0/61, 0/16, and 0/6, respectively). There were significant differences in the positive rate of SCCA1 between HCC and paired adjacent non-cancerous, liver cirrhosis tissues (P = 0.000, 0.013). Amplification plot and melt curve plot showed that the CT and Tm values were 8.90 ± 1.40 and 87.9 ℃ for G3PDH and 34.37 ± 1.74 and 88 ℃ for SCCA1.
CONCLUSION: SCCA1 is weakly expressed in HCC and difficult to detect by immunohistochemistry. SCCA1 mRNA expression is specific in HCC, although its sensitivity is limited.
- Citation: Li SL, Gao YT, Shan SG, Liang ZH, Zhai DK, Jing L, Liu T, Du Z, Wang YJ. Expression of SCCA1 in human hepatocellular carcinoma and its clinical significance. Shijie Huaren Xiaohua Zazhi 2014; 22(7): 1015-1021
- URL: https://www.wjgnet.com/1009-3079/full/v22/i7/1015.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i7.1015
鳞状细胞癌抗原(squamous cell carcinoma antigen, SCCA)是Kato等最先在宫颈癌中分离出来的、分子量为45 kDa的糖蛋白, 属于丝氨酸蛋白酶抑制物超家族成员[1], 其基因位于染色体18q21.3, 由紧密相连的scca1和scca2基因组成, 分别编码中性SCCA1和酸性SCCA2糖蛋白[2,3]. 两蛋白氨基酸序列92%一致, 但功能有较大差异. SCCA1又被称为SerpinB3, 主要抑制木瓜蛋白酶样半胱氨酸蛋白激酶如组织蛋白酶S、K、L等[4], 体外实验表明其有促进细胞增殖、抑制细胞凋亡和通过诱导上皮间质转化促进肿瘤细胞侵袭转移的作用[5-7]. SCCA2又被称为SerpinB4, 是糜蛋白酶样蛋白激酶抑制物, 可通过影响p38 MAPK通路抑制肿瘤细胞凋亡[8].
近年来的研究显示, SCCA高表达于多种上皮起源的肿瘤, 如头颈部肿瘤[9]、食管癌[10]、肺癌[11]、乳腺癌[12], 与肿瘤的发生密切相关. 目前其在肝细胞癌中的研究尚少, Pontisso等[13]最早报道了SCCA在HCC中有表达, 其免疫组织化学结果显示SCCA(包括SCCA1、SCCA2)在85%(55/65)的肿瘤组织标本中有表达, 但在20例正常肝脏组织中不表达. Beneduce、Giannelli、Guido等[14-16]用免疫组织化学得到了类似的结果. 血清中SCCA的表达目前仍存在争议, Hussein等[17]发现血清SCCA在HCC组中高于其他肝病组, 并且在AFP阴性的HCC患者中也可持续性增高, 认为其可用于HCC诊断, 而Soyemi、Beale等[18,19]发现血清SCCA在HCC和正常对照组之间表达无差别. 鉴于以往研究方法未明确区分SCCA1和SCCA2两个亚型, 更难以准确分析哪个亚型在HCC发生演化中的作用, 因此, 本实验采用免疫组织化学、Western blot及qRT-PCR的方法对SCCA1这一亚型在原发性肝癌中的表达情况进行探讨.
选取2007-07/2011-10天津市第三中心医院肝胆外科的129例组织标本, 包括62例HCC组织、43例癌旁肝组织(距肿瘤边缘2 cm)、10例肝硬化、6例胰腺癌、3例胆管细胞癌、5例正常肝组织. 62例肝细胞癌中, 男51例, 女11例, 年龄(55.9岁±10.7岁). 4例阳性对照取自宫颈鳞状细胞癌手术标本. 上述标本中6例HCC及相邻的癌旁组织、3例肝硬化、3例正常肝脏组织用Western blot检测蛋白表达. qRT-PCR标本收集自2004-01/2009-12共144例组织标本, 包括61例肝细胞癌及配对的癌旁组织、16例肝硬化、6例正常肝组织. 患者术前均未行放疗、化疗、生物治疗等抗肿瘤治疗. 参照2002年国际抗癌联盟(Union for International Cancer Control, UICC)第六次修定的HCC的TNM临床分期标准和世界卫生组织(2000)消化系统肿瘤分类进行临床和病理学诊断. 取材的癌组织排除液化坏死区, 正常肝组织取自没有基础肝病的肝血管瘤患者, 所有标本均经病理检查确诊. 留取的组织标本分别采用-80 ℃冻存和4%甲醛固定后石蜡包埋保存. 本研究经天津市第三中心医院伦理委员批准并得到患者知情同意. 鼠抗人SCCA1单抗(8H11, Santa Cruz)、通用型免疫组织化学试剂盒、DAB显色试剂盒(北京中杉金桥). Western blot二抗(Abmart)、鼠抗人β-actin单抗(北京中杉金桥)、ECL发光试剂盒(北京艾德莱). TRIzol(invitrogen)、逆转录试剂盒(Promega)、Real time RT-PCR试剂盒(TaKaRa), SCCA1引物及内参G3PDH引物由Invitrogen公司设计和合成, SCCA1上游引物: 5'-ATTCCTGAAGGTAATATTGGCAGCA-3', 下游引物: 5'-GTTGAAGTAGGTGATGATCCGAATC-3'; G3PDH上游引物: 5'-GGGCATCCTGGGCTACACTGA-3', 下游引物: 5'-CAAATTCGTTGTCATACCAGGAAATG-3', 扩增片段大小分别为590、143 bp.
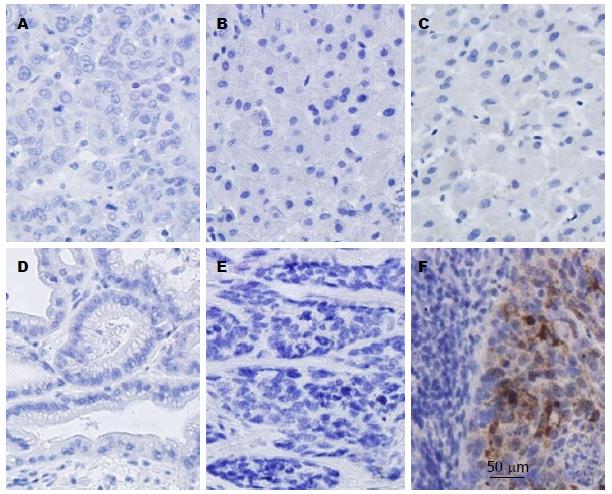
1.2.1 免疫组织化学: 采用免疫组织化学PV二步染色法. 组织标本经4%甲醛溶液固定后石蜡包埋, 切片厚约3 μm; 经64.5 ℃温箱烤片后, 二甲苯酒乙醇度脱蜡水化, 高温高压修复抗原, 3%去离子H2O2封闭内源性过氧化物酶, 滴加1:100稀释的鼠抗人单克隆SCCA1抗体, 4 ℃冰箱过夜; 滴加二抗, 光学显微镜下DAB显色, 自来水终止, 苏木素复染, 脱水透明、封片. 实验中以宫颈鳞状细胞癌标本做阳性对照, PBS代替SCCA1抗体作为阴性对照. 细胞质中出现棕黄色颗粒为阳性表达. 随机选取10个高倍镜(400×)视野, 阳性细胞<25%为阴性, 25%-75%为微弱阳性, 75%以上为强阳性.
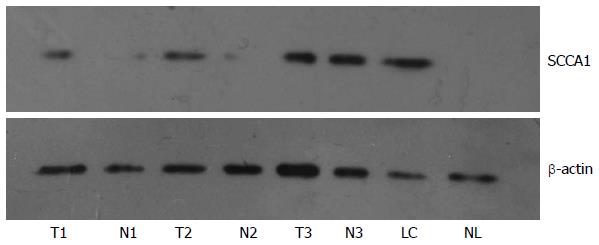
1.2.2 Western blot: 提取组织总蛋白, Bradford比色法测定蛋白浓度, 取40 μg变性蛋白质加入十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE) 80 V进行电泳, 30 min后指示剂进入分离胶, 电压调制120 V继续电泳1 h. 电转膜仪转移到PVDF膜上, 5%脱脂奶粉封闭2 h后滴加1:200稀释的鼠抗人SCCA1单克隆抗体, 4 ℃过夜孵育, TTBS洗涤后加入羊抗小鼠二抗, 室温孵育1 h, 洗涤后采用ECL化学发光显色试剂盒反应, 在暗室中压片, 然后显影、定影. 扫描仪扫描显色带.
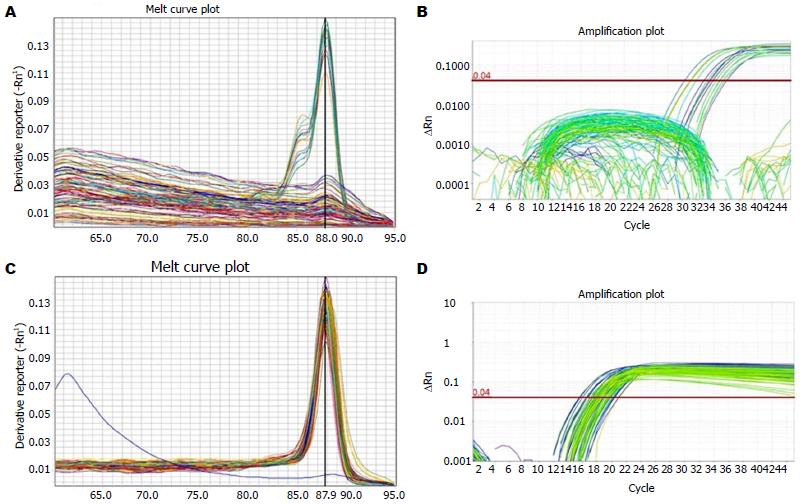
1.2.3 qRT-PCR: TRIzol法提取组织总RNA, 逆转录参照Promega公司的ImProm-ⅡTM使用说明书, 反应体系为3 µg RNA、3 µL随机引物, 补DEPC水至24 µL; 70 ℃热变性10 min, 迅速冰浴3 min; 再依次加入4.8 µL 25 mmol/L MgCl2、8 µL 5×逆转录缓冲液、2 µL 10 mmol/L dNTP Mix、1.5 µL逆转录酶, 至终体积为40 µL; 后置于PCR仪中37 ℃, 99 min. 荧光定量PCR反应在ViiATM7 384孔板上进行, 扩增体系为15 µL, 包含RT产物1.5 µL、上下游引物各0.35 µL (10 mmol/L)、Taq E (5 U/µL)0.125 µL、dNTP Mixture 0.96 µL、PCR Buffer 10×(内含Mg2+)1.5 µL, 灭菌蒸馏水补足至15 µL, 反应条件为: 94 ℃ 5 min预变性; 94 ℃ 30 s、62 ℃ 1 min, 共45个循环. 反应结束后生成溶解曲线, 记录每个标本的CT值. 随机选取5例溶解曲线有特异峰的标本由上海Invitrogen公司对PCR产物测序, 测序结果与GenBank中报道序列进行比对以确定引物对SCCA1的特异性扩增.
1.2.4 随访: 最后随访时间2012-07-01, 中位随访时间为27.3 mo, 术后每隔3 mo复查血清甲胎蛋白(alpha fetoprotein, AFP)、肝功能、CT以及腹部超声1次, 观察患者有无转移和恢复情况.
统计学处理 采用SPSS17.0软件进行数据处理, 率的比较采用χ2检验或Fisher's确切概率法, 生存分析采用Kaplan-Meier、Log-rank检验, P<0.05为差异有统计学意义.
4例宫颈鳞状细胞癌阳性对照结果显示SCCA1阳性染色为棕褐色, 主要定位于细胞浆, 而本实验在62例肝细胞HCC、6例胰腺癌、3例胆管细胞癌、43例癌旁、10例肝硬化及5例正常肝脏中均未发现SCCA1阳性表达(图1).
鉴于免疫组织化学检测结果阴性, 进一步采用Western blot的方法检测部分标本中SCCA1蛋白的表达. 在6例HCC中5例癌表达高于癌旁, 1例癌与癌旁组织表达量相当; 3例肝硬化中1例表达; 3例正常肝脏均不表达(图2).
为验证上述蛋白水平的表达, 从转录层次分析SCCA1 mRNA的表达. 首先对内参基因G3PDH的扩增曲线和溶解曲线综合分析显示, 所有标本均能够特异性扩增,其CT值为18.90±1.40, 特异峰Tm值为87.9 ℃(图3C, D), 说明总RNA的提取、逆转录和PCR过程均良好, 可用于对目的基因的扩增分析; 然后对SCCA1的扩增和溶解曲线分析发现, 18例HCC标本特异性扩增, 其CT值为34.37±1.74, 特异单峰的Tm值是88 ℃(图3A, B). 61例癌旁组织、16例肝硬化及6例正常肝组织均无扩增, 从上述阳性标本中随机挑选5例测序, 与Genbank中报道的SCCA1序列进行比对, 结果显示序列一致, 说明SCCA1被特异扩增. SCCA1 mRNA在HCC组阳性率为29.5% (18/61), 与癌旁及肝硬化组差异有统计学意义(P = 0.000、0.013). 正常肝组织例数偏少, 未进行统计学比较.
SCCA1 mRNA与HCC临床病理特征的相关性分析结果见表1, SCCA1的表达与性别、年龄、HBV感染、HCV感染、肝硬化、Child分级、血清AFP水平、γGT-Ⅱ、肿瘤大小、肿瘤数目、病理分级、TNM分期、门静脉侵犯等均无显著相关性(P>0.05).
| 临床病理因素 | n | SCCA1 | χ2 | P值 | |
| 阳性 | 阴性 | ||||
| 性别 | 1.132 | 0.287 | |||
| 男 | 52 | 14 | 38 | ||
| 女 | 9 | 4 | 5 | ||
| 年龄(岁) | 0.229 | 0.632 | |||
| ≤55 | 30 | 8 | 22 | ||
| >55 | 31 | 10 | 21 | ||
| HBV | 0.008 | 0.930 | |||
| + | 47 | 14 | 33 | ||
| - | 14 | 4 | 10 | ||
| HCV | 1.000 | ||||
| + | 3 | 1 | 2 | ||
| - | 58 | 17 | 41 | ||
| 肝硬化 | 0.411 | ||||
| 有 | 54 | 15 | 39 | ||
| 无 | 7 | 3 | 4 | ||
| Child-Pugh分级 | 0.001 | 0.970 | |||
| A | 51 | 15 | 36 | ||
| B | 10 | 3 | 7 | ||
| AFP(ng/mL) | 0.002 | 0.962 | |||
| ≤400 | 37 | 11 | 26 | ||
| >400 | 24 | 7 | 17 | ||
| γGT-II | 0.766 | 0.381 | |||
| + | 32 | 11 | 21 | ||
| - | 29 | 7 | 22 | ||
| 肿瘤大小(cm) | 0.949 | 0.622 | |||
| ≤5 | 19 | 4 | 15 | ||
| 5-10 | 24 | 8 | 16 | ||
| ≥10 | 18 | 6 | 12 | ||
| 肿瘤数目 | 0.761 | 0.383 | |||
| 1 | 39 | 13 | 26 | ||
| ≥2 | 22 | 5 | 17 | ||
| 分化程度 | 2.68 | 0.262 | |||
| 高 | 15 | 2 | 13 | ||
| 中 | 24 | 9 | 15 | ||
| 低 | 22 | 7 | 15 | ||
| TNM分期 | 0.208 | 0.649 | |||
| I -II | 38 | 12 | 26 | ||
| III-IV | 23 | 6 | 17 | ||
| 血管侵犯 | 2.497 | 0.114 | |||
| 有 | 42 | 15 | 27 | ||
| 无 | 19 | 3 | 16 | ||
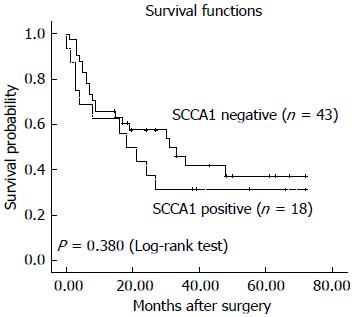
本组61例, 57例获得随访, 其中24例至2012-07仍存活(截尾资料), 33例在随访期内死亡(完整资料), 平均随访时间为25.2 mo(9 d-72 mo). SCCA1阳性组术后中位生存期为18 mo, SCCA1阴性组术后中位生存期为31 mo. SCCA1阳性组的术后中位生存时间短于阴性组, 但是Log-rank检验显示生存率差异不显著(P = 0.380, 图4).
SCCA是一种丝氨酸蛋白酶抑制剂, 因其首次在宫颈癌鳞状上皮中分离而被命名鳞状细胞癌抗原. 以往认为SCCA只表达于宫颈癌、食管癌等上皮起源的肿瘤, Pontisso最早报道了SCCA在85%的HCC中有表达, 而正常肝脏中不表达, Beneduce等[14]又指出SCCA在肝硬化及肝炎组织中也有表达, 但其各组表达量均小于HCC组. 另有学者对血清SCCA在肝癌诊断中的应用价值进行了研究, 但结果存在较大争议[17-19]. 鉴于以往研究未考虑SCCA1和SCCA2两者在HCC中的表达差异, 本实验针对SCCA1这一亚型在原发性肝癌中的表达情况从蛋白和mRNA层次分别进行了探讨.
免疫组织化学结果显示SCCA1在宫颈癌阳性对照中高表达, 而在HCC、癌旁、肝硬化及正常肝脏中均未发现阳性表达, 随后Western blot检测部分免疫组织化学阴性的标本发现癌、癌旁肝硬化中有表达, 正常肝脏中仍不表达. 免疫组织化学与前人及Western blot的结果不一致, 此结果可能有以下两种原因: (1)抗体不同: 本研究用的是Santa Cruz公司的针对SCCA1的单克隆抗体(8H11), 特异性较高, 目前仅有的4篇研究SCCA在肝癌组织中表达的报道[13-16]均使用Xeptagen公司抗体(Hepa-Ab Kit), 该抗体不能区分SCCA1、SCCA2, 因此抗体特异性的差异可能是这种结果不一致的重要原因; (2)SCCA1微量表达: qRT-PCR结果显示HCC中SCCA1 mRNA阳性组的CT值为34.37, 而内参CT值为18.90, 说明SCCA1 mRNA在HCC组织中含量极低, 转录水平低下可能造成翻译蛋白的低表达, 加之免疫组织化学仅是对单层细胞内蛋白的检测, 微量的表达超过试剂盒的检测下限可造成结果阴性, 而Western blot上样蛋白量为40 μg加之ECL发光剂可使灵敏度提高1000-10000倍以至能检测到pmol甚至fmol级的HRP, Western blot的这种放大作用可以使微量SCCA1得以检测, 所以组织中SCCA1的微量表达也可造成这种结果不一致.
实时荧光定量PCR有高的灵敏度和特异度, 可定量检测微量的靶分子. 本研究发现SCCA1 mRNA在HCC中特异表达, 而癌旁、肝硬化及正常肝中均不表达. 因此SCCA1 mRNA用于肝癌诊断特异度高, 但由于灵敏度有限(29.5%), 故可与其他肿瘤标记物联合用以提高HCC诊断的准确率. Turato等[20]在对肝母细胞瘤的研究中发现, SCCA1高表达于未成熟组织可调节未成熟肝组织的生长, 促进肝母细胞瘤的形成. Catanzaro等[12]也发现SCCA1在低分化的乳腺癌中高表达. 又有研究表明SCCA1可以通过诱导上皮间质转化增加肿瘤的侵袭性促进肿瘤的复发和转移, 因此低分化肿瘤中SCCA1的高表达可能是其易复发、预后差的原因之一. 本研究显示低分化HCC中SCCA1的表达率高于高分化HCC(31.8% vs 13.3%), 但可能受限于样本例数少, 两者差异无统计学意义.
总之, 本研究结果提示, SCCA1蛋白在HCC中微量表达, 免疫组织化学不易检测. SCCA1 mRNA用于肝癌诊断特异度高, 但灵敏度有限, 因此可与其他肿瘤标志物联合以提高HCC诊断的准确率. 目前SCCA1在部分肝癌患者中表达升高的原因及机制、其表达是否可促进肝癌的发生与发展、阻断其表达是否可治疗HCC等均需深入研究.
原发性肝细胞癌(hepatocellular carcinoma, HCC)为临床常见的恶性肿瘤, 进展快, 预后差. 早诊断早治疗是改善患者预后的关键. AFP是当前应用最广泛的肝癌血清标志物, 但其应用一直受到争议, 因此, 发现新的肝癌诊断标志物一直是研究的热点.
戴朝六, 教授, 中国医科大学第二临床学院(盛京医院)肝胆外科
近年研究表明, 原发性肝细胞癌中鳞状细胞癌抗原(squamous cell carcinoma antigen, SCCA)表达升高, 并且其表达与肿瘤有一定的临床相关性. 然而国内尚无此方面报道.
Pontisso等研究发现SCCA在85%(55/65)的HCC组织中表达, 而20例正常肝脏中无表达,Beneduce、Giannelli、Guido等用免疫组织化学得到类似结果.
SCCA有两个亚型SCCA1、SCCA2, 两者的生物学功能有明显差异. 以往研究方法未明确区分SCCA1和SCCA2, 更难以准确分析哪个亚型在HCC发生演化中的作用. 本实验主要从基因和蛋白层次对SCCA1这一亚型在原发性肝癌中的表达情况进行探讨.
分子靶向治疗是目前肿瘤治疗的研究热点. SCCA1 mRNA在部分肝细胞癌中特异表达, 研究其表达升高的原因及机制可为肝细胞癌的分子靶向治疗提供新的思路.
本文对了解SCCA1在肝细胞癌的表达情况及其临床病理意义有一定的参考意义.
编辑: 田滢 电编:鲁亚静
| 1. | Kato H. Expression and function of squamous cell carcinoma antigen. Anticancer Res. 1996;16:2149-2153. [PubMed] |
| 2. | Schneider SS, Schick C, Fish KE, Miller E, Pena JC, Treter SD, Hui SM, Silverman GA. A serine proteinase inhibitor locus at 18q21.3 contains a tandem duplication of the human squamous cell carcinoma antigen gene. Proc Natl Acad Sci U S A. 1995;92:3147-3151. [PubMed] [DOI] |
| 3. | Yasumatsu R, Nakashima T, Azuma K, Hirakawa N, Kuratomi Y, Tomita K, Cataltepe S, Silverman GA, Clayman GL, Komiyama S. SCCA1 expression in T-lymphocytes peripheral to cancer cells is associated with the elevation of serum SCC antigen in squamous cell carcinoma of the tongue. Cancer Lett. 2001;167:205-213. [PubMed] [DOI] |
| 4. | Schick C, Pemberton PA, Shi GP, Kamachi Y, Cataltepe S, Bartuski AJ, Gornstein ER, Brömme D, Chapman HA, Silverman GA. Cross-class inhibition of the cysteine proteinases cathepsins K, L, and S by the serpin squamous cell carcinoma antigen 1: a kinetic analysis. Biochemistry. 1998;37:5258-5266. [PubMed] [DOI] |
| 5. | Villano G, Quarta S, Ruvoletto MG, Turato C, Vidalino L, Biasiolo A, Tono N, Lunardi F, Calabrese F, Dall'olmo L. Role of squamous cell carcinoma antigen-1 on liver cells after partial hepatectomy in transgenic mice. Int J Mol Med. 2010;25:137-143. [PubMed] |
| 6. | Vidalino L, Doria A, Quarta S, Zen M, Gatta A, Pontisso P. SERPINB3, apoptosis and autoimmunity. Autoimmun Rev. 2009;9:108-112. [PubMed] [DOI] |
| 7. | Quarta S, Vidalino L, Turato C, Ruvoletto M, Calabrese F, Valente M, Cannito S, Fassina G, Parola M, Gatta A. SERPINB3 induces epithelial-mesenchymal transition. J Pathol. 2010;221:343-356. [PubMed] [DOI] |
| 8. | Schick C, Kamachi Y, Bartuski AJ, Cataltepe S, Schechter NM, Pemberton PA, Silverman GA. Squamous cell carcinoma antigen 2 is a novel serpin that inhibits the chymotrypsin-like proteinases cathepsin G and mast cell chymase. J Biol Chem. 1997;272:1849-1855. [PubMed] [DOI] |
| 9. | Kimura Y, Fujieda S, Takabayashi T, Tanaka T, Sugimoto C, Saito H. Conventional tumor markers are prognostic indicators in patients with head and neck squamous cell carcinoma. Cancer Lett. 2000;155:163-168. [PubMed] [DOI] |
| 10. | Shimada H, Nabeya Y, Okazumi S, Matsubara H, Shiratori T, Gunji Y, Kobayashi S, Hayashi H, Ochiai T. Prediction of survival with squamous cell carcinoma antigen in patients with resectable esophageal squamous cell carcinoma. Surgery. 2003;133:486-494. [PubMed] [DOI] |
| 11. | Kashiwabara K, Nakamura H, Yagyu H, Kishi K, Matsuoka T, Esaki T. Changes in squamous cell carcinoma-related antigen levels before and after hemodialysis in relation to the model of dialyzer employed. Intern Med. 2000;39:291-295. [PubMed] [DOI] |
| 12. | Catanzaro JM, Guerriero JL, Liu J, Ullman E, Sheshadri N, Chen JJ, Zong WX. Elevated expression of squamous cell carcinoma antigen (SCCA) is associated with human breast carcinoma. PLoS One. 2011;6:e19096. [PubMed] [DOI] |
| 13. | Pontisso P, Calabrese F, Benvegnù L, Lise M, Belluco C, Ruvoletto MG, Marino M, Valente M, Nitti D, Gatta A. Overexpression of squamous cell carcinoma antigen variants in hepatocellular carcinoma. Br J Cancer. 2004;90:833-837. [PubMed] [DOI] |
| 14. | Beneduce L, Castaldi F, Marino M, Quarta S, Ruvoletto M, Benvegnù L, Calabrese F, Gatta A, Pontisso P, Fassina G. Squamous cell carcinoma antigen-immunoglobulin M complexes as novel biomarkers for hepatocellular carcinoma. Cancer. 2005;103:2558-2565. [PubMed] [DOI] |
| 15. | Giannelli G, Marinosci F, Sgarra C, Lupo L, Dentico P, Antonaci S. Clinical role of tissue and serum levels of SCCA antigen in hepatocellular carcinoma. Int J Cancer. 2005;116:579-583. [PubMed] [DOI] |
| 16. | Guido M, Roskams T, Pontisso P, Fassan M, Thung SN, Giacomelli L, Sergio A, Farinati F, Cillo U, Rugge M. Squamous cell carcinoma antigen in human liver carcinogenesis. J Clin Pathol. 2008;61:445-447. [PubMed] [DOI] |
| 17. | Hussein MM, Ibrahim AA, Abdella HM, Montasser IF, Hassan MI. Evaluation of serum squamous cell carcinoma antigen as a novel biomarker for diagnosis of hepatocellular carcinoma in Egyptian patients. Indian J Cancer. 2008;45:167-172. [PubMed] [DOI] |
| 18. | Soyemi OM, Otegbayo JA, Ola SO, Akere A, Soyemi T. Comparative diagnostic efficacy of serum squamous cell carcinoma antigen in hepatocellular carcinoma. BMC Res Notes. 2012;5:403. [PubMed] [DOI] |
| 19. | Beale G, Chattopadhyay D, Gray J, Stewart S, Hudson M, Day C, Trerotoli P, Giannelli G, Manas D, Reeves H. AFP, PIVKAII, GP3, SCCA-1 and follisatin as surveillance biomarkers for hepatocellular cancer in non-alcoholic and alcoholic fatty liver disease. BMC Cancer. 2008;8:200. [PubMed] [DOI] |
| 20. | Turato C, Buendia MA, Fabre M, Redon MJ, Branchereau S, Quarta S, Ruvoletto M, Perilongo G, Grotzer MA, Gatta A. Over-expression of SERPINB3 in hepatoblastoma: a possible insight into the genesis of this tumour? Eur J Cancer. 2012;48:1219-1226. [PubMed] [DOI] |