修回日期: 2014-01-07
接受日期: 2014-01-16
在线出版日期: 2014-03-08
目的: 检测胃癌患者血清热休克蛋白(heat shock protein, HSP)27、90的含量, 探讨其与胃癌临床及病理指标, 以及预后的关系.
方法: 应用ELISA方法测定42例胃癌患者血清标本中HSP27、90的含量, 并与40例同期正常对照组的血清标本作对比分析. 同时采用单因素方差分析和相关分析探寻HSP27、90的浓度与胃癌病理类型、病理分期及TNM分期的关系, 并通过生存分析探寻其与胃癌预后的关系.
结果: 胃癌患者血清HSP27、90的表达显著高于正常对照者(P = 0.000). 在胃癌患者中, 血清HSP27、90在不同病理类型、病理分期及TNM分期中均无显著差异, 仅HSP27在T4组显著高于其他组(P = 0.036). Pearson相关分析显示, 血清HSP27和HSP90之间呈显著相关(r = 0.321, P = 0.038), Spearman相关分析显示, 血清HSP27、90的表达与病理类型、病理分期及TNM分期无显著相关关系. Kaplan-Meier生存分析未得出血清HSP27、90和胃癌预后的相关关系.
结论: 血清HSP27、90表达与胃癌的发病密切相关, 可作为协同判断胃癌发病的指标, 且两者表达呈正相关.
核心提示: 胃癌患者血清热休克蛋白(heat shock protein, HSP)27、90的表达显著高于正常对照者. 提示血清HSP27、90表达与胃癌的发病密切相关, 可作为协同判断胃癌发病的指标. 在胃癌患者中, 血清HSP27、90两者的表达显著相关, 提示两者存在某种内在联系.
引文著录: 袁建明, 刘涛, 沈建康, 王天翔. 胃癌患者血清热休克蛋白27、90的检测. 世界华人消化杂志 2014; 22(7): 1000-1004
Revised: January 7, 2014
Accepted: January 16, 2014
Published online: March 8, 2014
AIM: To detect the expression of heat shock protein (HSP) 27 and HSP90, and to investigate their correlations with clinical and pathological indexes of gastric carcinoma.
METHODS: HSP27 and HSP90 levels were determined by ELISA in sera from 42 patients with gastric carcinoma and 40 healthy controls. ANOVA and Pearson or Spearman correlation analysis were used to investigate the relationship between serum levels of HSP27 and HSP90 and pathological types, pathological stage and TNM stage, and survival.
RESULTS: Serum levels of HSP27 and HSP90 were significantly higher in patients with gastric carcinoma than in healthy controls. Serum levels of HSP27 differed significantly between patients with T4 disease and T1-3 disease (P = 0.036), but showed no significant correlation with pathological type, pathological stage or TNM stage. Pearson correlation analysis showed a significant relationship between serum levels of HSP27 and those of HSP90 (r = 0.321, P = 0.038). Spearman correlation analysis showed no significant relationship between serum levels of HSP27 or HSP90 and pathological type, pathological stage or TNM stage. Kaplan-Meier analysis did not show any significant relationship between serum levels of HSP27 or HSP90 and the survival rate of the patients.
CONCLUSION: Serum levels of HSP27 and HSP90 may be closely related to the development of gastric carcinoma. Serum levels of HSP27 significantly correlate with those of HSP90 in patients with gastric carcinoma.
- Citation: Yuan JM, Liu T, Shen JK, Wang TX. Detection of serum HSP27 and HSP90 in patients with gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(7): 1000-1004
- URL: https://www.wjgnet.com/1009-3079/full/v22/i7/1000.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i7.1000
胃癌是我国最常见的恶性肿瘤之一, 因其早期症状的隐匿性, 诊断多为中晚期. 热休克蛋白(heat shock protein, HSP)又称应激蛋白, 广泛存在于真核生物细胞中, 由一系列高度保守蛋白组成, 他们在机体理化环境受到侵扰时表达, 使细胞在致命条件下得以存活[1]. HSP按其相对分子质量大小和同源程度可分为不同类型, 显示特定的表达部位和生理功能. HSP家族的几个主要亚型有HSP27、HSP60、HSP70、HSP90. 本研究拟采用ELISA方法对42例胃癌患者血清中HSP27和HSP90的含量进行检测, 探讨HSP27和HSP90的表达与胃癌临床及病理指标, 以及预后的相关性, 并对其临床意义作一研究.
胃癌患者的血清标本取自2008-03/2008-07在我院手术的胃癌患者, 对照组血清取自同期健康体检人群. 所有患者术前均未进行过放化疗及抗肿瘤药物等治疗, 均有完整的临床及病理资料. 纳入的胃癌患者共42例, 女16例, 男26例, 平均年龄60.0岁±12.8岁. 病理组织学类型: 低分化腺癌24例, 中分化腺癌10例, 高分化腺癌8例. TNM分期使用2010年美国癌症联合会(American Joint Committee on Cancer, AJCC)第七版: Ⅰ期5例, Ⅱ期12例, Ⅲ期20例, Ⅳ期5例. 浸润深度(T): T1 2例, T2 4例, T3 29例, T4 7例. 淋巴结转移者26例(其中N1 16例, N2 7例, N3 3例), 无淋巴结转移者(N0)16例; 远处转移者(M1)1例. 另外, 纳入同期正常对照组血清标本40例, 女17例, 男23例, 平均年龄59.7岁±13.1岁. 病例组与对照组间在年龄和性别构成方面无统计学差异. 随访中有1例患者于术后36 mo失访, 其余患者随访47 mo以上. ELISA试剂盒为ADL公司产品, 其中包括底物、检测抗体、结合抗体、稀释液及终止剂.
采用ELISA方法, 按照试剂盒说明严格执行. 具体步骤包括: (1)加样: 分别设空白孔、标准孔、待测样品孔. 空白孔加样品稀释液100 μL, 余孔分别加标准品或待测样品100 μL, 37 ℃反应120 min; (2)弃去液体, 甩干, 每孔加检测溶液A工作液100 μL(在使用前1 h内配制), 酶标板加上覆膜, 37 ℃反应60 min; (3)温育60 min后, 弃去孔内液体, 甩干, 洗板3次, 每次浸泡1-2 min, 大约400 μL/每孔, 甩干; (4)每孔加检测溶液B工作液100 μL, 酶标板加上覆膜37 ℃反应60 min; (5)温育60 min后, 弃去孔内液体, 甩干, 洗板5次, 每次浸泡1-2 min, 350 μL/每孔, 甩干; (6)依序每孔加底物溶液90 μL, 酶标板加上覆膜37 ℃避光显色; (7)依序每孔加终止溶液50 μL, 终止反应, 此时蓝色立转黄色; (8)用酶联仪在450 nm波长依序测量各孔的吸光度(A值), 在加终止液后立即进行检测. 测得其结果, 进行比较.
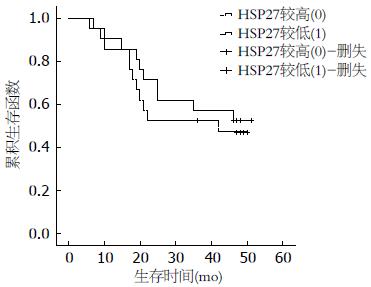
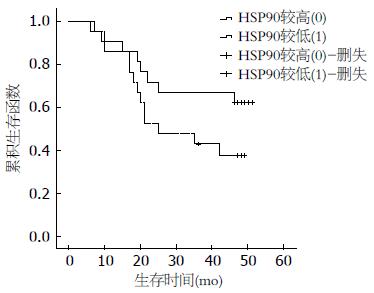
随访生存情况, 根据HSP27、90检测结果分为较高组(≥中位值)和较低组(<中位值), 比较其生存情况.
统计学处理 采用SPSS19.0软件进行统计学处理, 一般计量资料数据描述采用mean±SD表示, 满足正态和方差齐性的计量资料两组间比较采用t检验(t-test), 多组间比较采用单因素方差分析(One-way ANOVA), 否则采用非参数统计中的秩和检验, 相关性分析采用Pearson相关分析和Spearman等级相关分析方法, 采用Kaplan-Meier生存分析绘制生存曲线. P<0.05为差异有统计学意义.
胃癌患者血清HSP27的平均表达浓度为62.9 ng/mL±4.1 ng/mL, HSP90的平均表达浓度为73.0 ng/mL±4.9 ng/mL; 正常对照组血清HSP27的平均表达浓度为46.9 ng/mL±6.3 ng/mL, HSP90的平均表达浓度为59.5 ng/mL±6.8 ng/mL(表1). t检验结果表明, 胃癌患者血清HSP27和HSP90的表达均显著高于正常对照组(P = 0.000). 在胃癌患者中, 对不同病理和临床指标间采用单因素方差分析, 结果表明在不同病理组织学类型中, 血清HSP27和HSP90的表达无统计学差异. 在不同病理分期中, 血清HSP27和HSP90的表达无统计学差异. 在不同浸润深度中, 血清HSP27的表达无统计学差异, 但T4组显著高于其他组(P = 0.036); 血清HSP90的表达无统计学差异. 在不同淋巴结转移中, 血清HSP27和HSP90的表达无统计学差异. 考虑到远处转移患者只有1例, 本研究中未进行HSP27和HSP90与远处转移间的统计学分析.
| 分组 | n | HSP27 | P值 | HSP90 | P值 |
| 病例组 | 42 | 62.9±4.1 | 0.000 | 73.0±4.9 | 0.000 |
| 对照组 | 40 | 46.9±6.3 | 59.5±6.8 | ||
| 病理类型 | 0.862 | 0.934 | |||
| 低分化腺癌 | 24 | 62.3±4.5 | 72.9±5.5 | ||
| 中分化腺癌 | 10 | 62.0±4.3 | 73.8±5.4 | ||
| 高分化腺癌 | 8 | 63.7±4.2 | 72.9±7.1 | ||
| 病理分期 | 0.855 | 0.906 | |||
| I | 5 | 62.0±4.2 | 71.8±7.5 | ||
| II | 12 | 62.5±4.5 | 73.5±5.1 | ||
| III | 20 | 62.7±4.3 | 72.8±5.7 | ||
| IV | 5 | 64.4±4.3 | 74.0±5.9 | ||
| T | 0.080 | 0.866 | |||
| T1 | 2 | 61.6±0.0 | 72.5±6.2 | ||
| T2 | 4 | 62.0±4.9 | 71.0±7.9 | ||
| T3 | 29 | 62.3±3.7 | 73.1±4.9 | ||
| T4 | 7 | 65.8±5.41 | 73.6±4.4 | ||
| N | 0.951 | 0.317 | |||
| N0 | 16 | 62.3±4.1 | 73.6±5.8 | ||
| N1 | 16 | 63.0±3.8 | 71.2±3.7 | ||
| N2 | 7 | 63.2±5.6 | 74.5±5.5 | ||
| N3 | 3 | 62.2±0.1 | 75.2±5.3 |
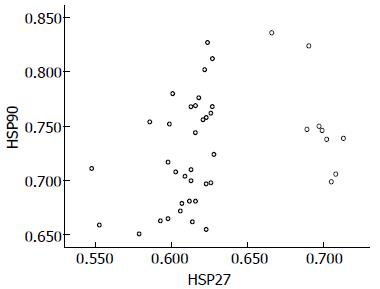
Spearman相关分析表明, 血清HSP27和HSP90分别与病理类型、病理分期及TNM分期无显著相关关系. Pearson相关分析显示, 血清HSP27和HSP90间呈正相关关系(r = 0.321, P = 0.038)(图1).
HS是20世纪70年代由美国学者Tissieres等[2]发现的一类新的蛋白质. HSP具有多种生物学功能, 起着分子伴侣的作用, 具有维持蛋白稳定, 提高细胞生存等功能, 细胞生长、发育、分化以及基因转录中发挥重要作用[3]. 当机体理化环境受到侵扰时, HSP基因被激活, 表达HSP蛋白, 使细胞免于凋亡. Binder等[4]研究发现, 在正常细胞中HSP的表达受细胞周期调控, 但在肿瘤细胞中其表达无需应激. HSP抑制剂在肺腺癌[5]、乳癌[6]及前列腺癌[7]等癌症中参与调节肿瘤细胞的增殖、生存、侵袭、转移和血管生成等多种重要过程, 并可以提高肿瘤细胞的辐射敏感性[8].
HSP27是小分子HSP亚家族中重要的一员, 参与了细胞的增殖、分化以及细胞凋亡的信号转导调节, 与肿瘤关系密切, 是一个涉及细胞生长、细胞凋亡、肿瘤的发生和转移等功能的重要蛋白, 在乳腺、肝、结肠、肺等多种肿瘤细胞中异常过表达, 并与肿瘤的恶性程度有关[9]. HSP90作为分子伴侣, 在蛋白质折叠、亚基组装以及调节细胞生长存活中具有重要作用[3]. 近年来研究发现, HSP90在多种实体肿瘤中高表达, 与肿瘤预后密切相关[10].
机体细胞在受到各种理化因素(如炎症、创伤、高温、病毒感染及肿瘤等)刺激时, 可发生应激反应, 产生分子量不同的蛋白质, 即HSP, 以维持细胞内环境稳定. 胃黏膜在受到各种刺激时, 会翻译和转录高水平HSP, 以发挥对胃黏膜细胞的保护作用[11]. 胃癌是胃黏膜长期受各种因素刺激和其他作用下逐渐发生癌变的, 此过程HSP合成不断增加. 在胃癌发展过程中, 癌细胞产生的HSP27和HSP90释放至血液, 引起外周血中含量升高, 提示检测外周血中HSP27和HSP90水平, 对发现胃癌有重要的意义.
近年来, 有学者致力于研究HSP在胃癌组织中的表达, 而对HSP在胃癌患者血清中表达的报道较少. 孟庆松等[12]研究了血清HSP60在胃癌中的表达, 发现胃癌患者血清HSP60显著升高, 其检测可提高胃癌筛查的敏感度和准确性. 任宏等[13]应用质谱分析的方法, 研究了胃癌术前、术后以及正常对照组的血清蛋白质质谱, 结果发现, HSP27在胃癌术前表达上调, 但在术后下调. 本研究应用免疫组织化学的方法, 结果表明HSP27和HSP90在胃癌患者血清中亦显著高于正常对照组, 对胃癌的筛查和诊断具有一定的临床意义.
本研究结果显示, 血清HSP27和HSP90在不同的病理类型中并无统计学差异, 提示血清HSP27和HSP90的表达与病理类型无关. 在不同病理分期中, 血清HSP27和HSP90的表达并无升高的趋势, 结合Spearman相关分析, 无法得出HSP27和HSP90与病理分期之间有显著相关关系的结论. 但在浸润深度(T)分期中, 血清HSP27的表达T4组显著高于其他组, 提示血清HSP27的表达与不同肿瘤浸润程度之间存在一定的关联, 这与Giaginis等[14]在胃癌组织中得到的结果相仿. 这可能与随着肿瘤体积的增长, HSP27被不断释放入血有关. 但T1- T3分组分析并未得出显著性结论, 仍需更大样本的试验来进一步明确目前的结果.
本研究发现, 胃癌患者血清HSP27和HSP90两项指标之间存在显著正相关, 这或许提示在胃癌的发病中, 不同家族的HSP在激活时存在某种关联. 本研究中的相关分析尚未得出血清HSP27和HSP90与病理类型、病理分期及TNM分期之间的显著相关关系.
本研究虽然在生存分析中未得出HSP27和HSP90与胃癌预后的阳性结果, 但从生存函数图, 尤其是HSP90与胃癌生存率的关系上, 已存在HSP90较高的患者预后较差的趋势, 这与Pick等[15]在乳癌中的研究相吻合. 若进一步扩大样本, 并结合免疫组织化学技术检测胃癌组织中HSP27和HSP90表达, 并在术后随访患者血清HSP27和HSP90的含量, 研究HSP27和HSP90与患者预后间的关系, 则可得出更加有意义的结论.
自1974年美国学者Tissiers等发现热休克蛋白, 其作为一种应激反应产物逐渐为人们所认识, 并发现其在多种肿瘤组织中高表达, 与肿瘤的发生、发展以及免疫逃逸存在联系.
张小晋, 主任医师, 北京积水潭医院
热休克蛋白在多种肿瘤组织中高表达, 已较为明确. 然而其在血清中的表达, 即其对于肿瘤筛查和术前诊断的意义, 是目前研究的热点.
任宏等发现, 血清热休克蛋白27在胃癌术前高表达, 但在术后明显下调, 提示其作为肿瘤标志物的潜在意义.
本研究从血清的层面分析胃癌患者和正常对照组血清热休克蛋白27、90的差异, 较组织层面的分析优势在于可以应用于临床, 对早期发现和诊断胃癌提供了新的思路. 另外本研究创新地发现了血清热休克蛋白27、90内在的相关性.
本文是一篇较实用的论文, 立题明确, 方法得当, 结论可靠: 血清热休克蛋白27、90表达与胃癌的发病密切相关, 可作为协同判断胃癌发病的指标. 临床重复性会很好, 有一定的临床意义.
编辑: 郭鹏 电编:鲁亚静
| 1. | Lanneau D, de Thonel A, Maurel S, Didelot C, Garrido C. Apoptosis versus cell differentiation: role of heat shock proteins HSP90, HSP70 and HSP27. Prion. 2007;1:53-60. [PubMed] [DOI] |
| 2. | Tissières A, Mitchell HK, Tracy UM. Protein synthesis in salivary glands of Drosophila melanogaster: relation to chromosome puffs. J Mol Biol. 1974;84:389-398. [PubMed] [DOI] |
| 3. | Jego G, Hazoumé A, Seigneuric R, Garrido C. Targeting heat shock proteins in cancer. Cancer Lett. 2013;332:275-285. [PubMed] [DOI] |
| 4. | Binder RJ, Vatner R, Srivastava P. The heat-shock protein receptors: some answers and more questions. Tissue Antigens. 2004;64:442-451. [PubMed] [DOI] |
| 5. | Sun J, Liu L, Jiang X, Chen D, Huang Y. Therapeutic effects of radiolabeled 17-allylamino-17-demethoxygeldanamycin on human H460 nonsmall-cell lung carcinoma xenografts in mice. Cancer Biother Radiopharm. 2010;25:155-164. [PubMed] [DOI] |
| 6. | Saxena V, Naguib Y, Hussain MD. Folate receptor targeted 17-allylamino-17-demethoxygeldanamycin (17-AAG) loaded polymeric nanoparticles for breast cancer. Colloids Surf B Biointerfaces. 2012;94:274-280. [PubMed] [DOI] |
| 7. | Seaton A, Maxwell PJ, Hill A, Gallagher R, Pettigrew J, Wilson RH, Waugh DJ. Inhibition of constitutive and cxc-chemokine-induced NF-kappaB activity potentiates ansamycin-based HSP90-inhibitor cytotoxicity in castrate-resistant prostate cancer cells. Br J Cancer. 2009;101:1620-1629. [PubMed] [DOI] |
| 8. | Doubrovin M, Che JT, Serganova I, Moroz E, Solit DB, Ageyeva L, Kochetkova T, Pillarsetti N, Finn R, Rosen N. Monitoring the induction of heat shock factor 1/heat shock protein 70 expression following 17-allylamino-demethoxygeldanamycin treatment by positron emission tomography and optical reporter gene imaging. Mol Imaging. 2012;11:67-76. [PubMed] |
| 9. | Calderwood SK, Khaleque MA, Sawyer DB, Ciocca DR. Heat shock proteins in cancer: chaperones of tumorigenesis. Trends Biochem Sci. 2006;31:164-172. [PubMed] |
| 10. | Mahalingam D, Swords R, Carew JS, Nawrocki ST, Bhalla K, Giles FJ. Targeting HSP90 for cancer therapy. Br J Cancer. 2009;100:1523-1529. [PubMed] [DOI] |
| 11. | Yano M, Naito Z, Tanaka S, Asano G. Expression and roles of heat shock proteins in human breast cancer. Jpn J Cancer Res. 1996;87:908-915. [PubMed] [DOI] |
| 14. | Giaginis C, Daskalopoulou SS, Vgenopoulou S, Sfiniadakis I, Kouraklis G, Theocharis SE. Heat Shock Protein-27, -60 and -90 expression in gastric cancer: association with clinicopathological variables and patient survival. BMC Gastroenterol. 2009;9:14. [PubMed] [DOI] |
| 15. | Pick E, Kluger Y, Giltnane JM, Moeder C, Camp RL, Rimm DL, Kluger HM. High HSP90 expression is associated with decreased survival in breast cancer. Cancer Res. 2007;67:2932-2937. [PubMed] [DOI] |