修回日期: 2014-01-05
接受日期: 2014-01-08
在线出版日期: 2014-02-28
目的: 检测Wnt/β-catenin信号通路中Wnt-1在化学诱发小鼠肝癌过程中的表达, 揭示Wnt/β-catenin通路与肝癌发生之间的关系.
方法: 95只C57BL/6J♂小鼠随机分为实验组(n = 50)和对照组(n = 45). 实验组联合二乙基亚硝胺(diethylnitrosamine, DEN)/四氯化碳(carbon tetrachloride, CCl4)/乙醇(ethanol)诱发小鼠肝癌. 实验组和对照组每2周各随机抽取5只小鼠定期处死并取组织标本进行病理学观察, 并通过Real-time PCR、Western blot、免疫组织化学动态监测肝组织的Wnt-1 mRNA及蛋白表达情况.
结果: (1)化学诱导20 wk后, 成功诱发小鼠肝癌; (2)Real-time PCR显示, Wnt-1 mRNA的表达在第4至12周实验组和同期对照组相比差异没有显著性, 第14至20周实验组较同期对照组表达升高, 且随着诱癌时间延长实验组第14、16、18周Wnt-1 mRNA表达逐渐升高(4.192±0.322 vs 5.630±0.579 vs 8.060±0.795, P<0.05), 第18周和第20周表达差异没有显著性(8.060±0.795 vs 8.038±0.649, P>0.05); (3)Western blot显示对照组Wnt-1蛋白微弱表达; 实验组Wnt-1蛋白第4至12周微弱表达, 第14至18周随着诱癌时间延长Wnt-1蛋白表达逐渐升高, 第18周和第20周蛋白表达差异没有显著性; (4)免疫组织化学显示, Wnt-1在实验组第8周和对照组仅见微弱表达, 实验组从16 wk开始较对照组表达增加, 至20 wk时表达最强.
结论: Wnt-1参与了小鼠肝癌的发生发展, Wnt/β-catenin信号通路在肝癌的发生过程中可能扮演重要角色.
核心提示: Wnt-1参与了小鼠肝癌发生发展的全过程, 可能是由于在化学诱导肝癌过程中Wnt通路被激活, 随着肝癌的形成相互作用的结果. 明确Wnt-1在肝癌发生过程中各时期的表达, 为今后寻找新的肝癌治疗靶点提供理论依据.
引文著录: 孔娜, 匡志鹏, 杨帆, 李韵秋, 吴继宁. Wnt-1在化学诱发肝癌过程中的表达及意义. 世界华人消化杂志 2014; 22(6): 751-758
Revised: January 5, 2014
Accepted: January 8, 2014
Published online: February 28, 2014
AIM: To detect the expression of Wnt-1 in chemically induced liver carcinogenesis in mice, and to reveal the relationship between Wnt/β-catenin signaling pathway and liver cancer.
METHODS: Ninety-five C57BL/6J mice were randomly divided into either an experimental group (n = 50) or a control group (n = 45). In the experimental group, primary hepatocellular carcinoma (HCC) was induced by using diethylnitrosamine (DEN), carbon tetrachloride (CCl4) and ethanol for twenty weeks. Five mice of each group were randomly sacrificed every two weeks to collect specimens. The expression of Wnt-1 mRNA and protein was dynamically observed by real-time PCR, Western blot and immunohistochemistry.
RESULTS: Liver cancer in C57BL/6J mice was successfully induced chemically after 20 weeks. Real-time PCR showed that the expression of Wnt-1 mRNA in the experimental group significantly increased compared to the control group at various time points during the period from weeks 14 to 20, while there was no significant difference from weeks 4 to 12. In the experimental group, Wnt-1 mRNA expression increased with time from weeks 14 to 16 and 18 (4.192 ± 0.322 vs 5.630 ± 0.579 vs 8.060 ± 0.795, P < 0.05), but there was no significant difference between weeks 18 and 20. Western blot analysis showed that Wnt-1 protein expression was weak in both groups from weeks 4 to 12, but increased with time in the experimental group, although there was also no significant difference between weeks 18 and 20. Immunohistochemistry showed that Wnt-1 was expressed weakly in both groups before week 8, but began to increase from week 16 in the experimental group, peaking at week 20.
CONCLUSION: Wnt-1 may be associated with the occurrence of HCC, and Wnt/β-catenin signaling pathway may play an important role in this process.
- Citation: Kong N, Kuang ZP, Yang F, Li YQ, Wu JN. Significance of expression of Wnt-1 in chemically induced liver carcinogenesis in mice. Shijie Huaren Xiaohua Zazhi 2014; 22(6): 751-758
- URL: https://www.wjgnet.com/1009-3079/full/v22/i6/751.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i6.751
目前, 世界范围内男性肝癌在恶性肿瘤中发病率居第5位, 在癌症死亡原因中居第2位; 女性肝癌在恶性肿瘤中的发病率居第7位, 在癌症死亡原因中居第6位[1]. 肝癌的发生机制还不完全清楚, 到目前为止, 考虑与多种细胞间信号传导通路紊乱有关. 在多种慢性损伤因素的作用下, 肝脏组织反复损伤修复, 导致肝纤维化肝硬化; 由于周围内环境的改变, 肝干细胞在肝脏的修复过程中不能向正常肝细胞分化, 在信号通路异常的情况下, 肝干细胞无限增殖形成肝细胞癌. 近年来发现, 包括肝癌在内的人类多种肿瘤都存在Wnt通路的异常激活[2-7]. Wnt通路现已成为研究肝癌发生机制的热点.
前期研究证实, 二乙基亚硝胺(diethylnitrosamine, DEN)/四氯化碳(carbon tetrachloride, CCl4)/Ethanol联合可成功诱导小鼠肝癌, 该动物模型的发生具有与人肝癌发生相似的病理过程[8], 因而对开展人肝癌的研究十分重要. 本研究基于此动物模型的构建, 通过Real-time PCR、Western blot、免疫组织化学观察Wnt通路中Wnt-1的mRNA及相应蛋白表达水平的变化, 初步明确该通路与肝癌发生发展的关系.
DEN购自Sigma公司, CCl4购自天津化学试剂研究所, 乙醇和橄榄油购自北京化学试剂公司. 总RNA提取试剂TRIzol Reagent(Invitrogen), 逆转录试剂盒(Thermo), SYBRR Premix Ex TaqTM(RR420A)购自TaKaRa公司. 引物由上海生工生物工程公司设计合成. Western blot检测用GAPDH的一抗购自美国Cell Signaling公司, Wnt-1一抗购自Abcam, 二抗购自Proteintech Group, 蛋白裂解液RIPA、蛋白酶抑制剂PMSF、BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所. 免疫组织化学检测用Wnt-1购自Abcam, 免疫组织化学检测试剂盒SP-9001、浓缩型DAB显色试剂盒购自北京中杉金桥生物技术有限公司.
1.2.1 化学诱导小鼠肝癌模型的建立: 化学诱导小鼠肝癌模型的建立参照文献[8]. C57BL/6J♂小鼠95只, 6-8周龄, 体质量20-30 g, 购自中国科学院上海实验动物中心, 符合国标GB14922-94 SPF级质量标准. 购入动物后适应环境7 d, 动物随机分为2组, 实验组50只对照组45只. 实验组小鼠首先用DEN 100 mg/kg腹腔注射, 3 d后CCl4和橄榄油(配制体积比20:80)灌胃(5 mL/kg), 2次/wk; 第3周再次腹腔注射DEN 1次(50 mg/kg), 同时开始给予含有90 mL/L乙醇的饮用水; 第4周开始加大CCl4的剂量至8 mL/kg, 共给药20 wk, 实验期间同时喂以小鼠颗粒饲料. 对照组小鼠仅喂养小鼠颗粒饲料, 并自由饮用灭菌普通水. 观察两组小鼠的生长、体质量、精神食欲等情况. 在诱癌开始后第4、6、8、10、12、14、16、18、20周, 从实验组和对照组各随机抽取5只小鼠, 摘取肝脏组织做后续试验.
1.2.2 组织病理学观察: 取新鲜实验组和对照组部分肝组织, 用3%中性多聚甲醛固定, 常规石蜡包埋, 制成5 μm厚的切片, 苏木精-伊红(HE)染色, 光镜观察病理形态学变化.
1.2.3 Real-time PCR检测Wnt-1 mRNA表达: TRIzol法提取实验组和对照组肝组织的总RNA, 分光光度计测定RNA的A值以检测RNA质量. 取总RNA 3 μg定量, 按逆转录试剂盒说明书把RNA逆转录成cDNA -20 ℃保存. 将样品cDNA稀释16倍后取样2 μL, 冰上配制PCR反应液. 反应体系20 μL: cDNA 2 μL, SYBRR Premix Ex Taq(2×)10 μL, 10 μmol/L上、下游引物各0.4 μL, RNase-free Water 7.2 μL(PCR引物序列如表1). 于BIO-RAD Real-time PCR仪中进行PCR反应, 反应条件为: 95 ℃变性30 s; 95 ℃ 5 s, 60 ℃ 30 s, 共40个循环. PCR反应结束后, 建立溶解曲线分析. 反应结束后电脑自动分析荧光信号并将其转换Ct值, 2-∆∆Ct法计算Wnt-1基因和β-actin基因之间的相对含量.
| 基因名称 | 引物 | 产物长度(bp) |
| β-actin | F: 5'-GTGACGTTGACATCCGTAAAGA-3' | 148 |
| R: 5'-GCCGGACTCATCGTACTCC-3' | ||
| Wnt-1 | F: 5'-GCTGGGTTTCTACTACGTTGCT-3' | 103 |
| R: 5'-GAGGAGGCTATGTTCACGATG-3' |
1.2.4 Western blot检测Wnt-1蛋白: 提取总蛋白放入-80 ℃冰箱保存. BCA试剂盒测定蛋白浓度. 制备10%SDS-PAGE凝胶, 以GAPDH为内参, 根据测定的浓度计算上样量; 电泳: 80 V 30 min转至 100 V 1 h; 转膜: GAPDH、Wnt-1为120 mA 1.5 h, 冰上转膜; 5%脱脂牛奶封闭1 h, TBST洗膜 2次×5 min; 加一抗4 ℃过夜(所有一抗稀释比例均为1:1000), TBST洗膜3次×5 min; 加二抗(稀释比例1:6000)摇床上1 h, TBST 4次×5 min, 显影定影. 每个诱癌阶段对照组和实验组各取一个标本进行实验, 重复3次以确保实验的准确性. Quantity One软件测定条带灰度值, 计算Wnt-1/GAPDH灰度比值.
1.2.5 免疫组织化学染色: 采用免疫组织化学SP法, 操作步骤按SP法免疫组织化学检测试剂盒说明书进行, Wnt-1一抗工作浓度为1:100, DAB染色, 苏木精复染. 以PBS代替一抗作为阴性对照, 每次试验均设阴性对照. 以胞浆出现黄色颗粒为阳性反应, 每张切片上随机观察10个高倍视野(×200), 计数阳性细胞百分比, 阳性细胞数<5%为0分, 5%-25%为1分, 26%-50%为2分, 51%-75%为3分, 76%-100%为4分; 阳性着色强度无色为0分, 淡黄色1分, 棕黄色2分, 棕褐色3分. 将两者计分相乘即为阳性等级: 0分为阴性(-), 1-4分为弱阳性(+), 5-8分为阳性(++), 9-12分为强阳性(+++).
统计学处理 使用SPSS16.0软件进行统计学分析, 计量资料以mean±SD表示, 采用完全随机设计资料的方差分析和t检验, P<0.05为差异有统计学意义.
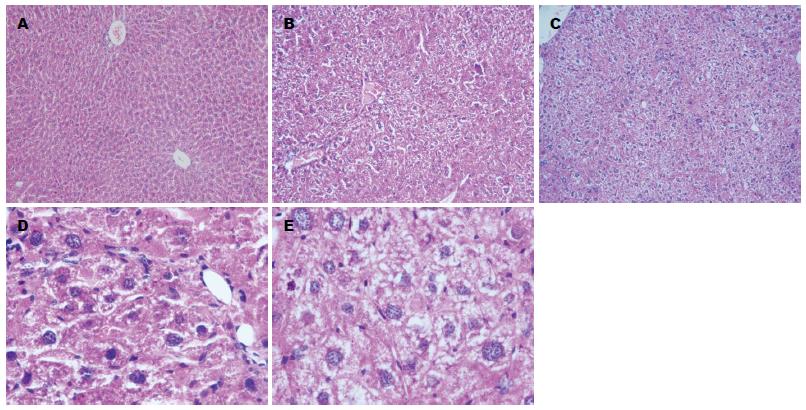
在化学诱癌过程中, 50只实验组小鼠在诱癌的第8、18、20周时分别死亡2、2、1只, 死亡率为5.26%(5/95); 对照组45只无死亡. 对照组小鼠肝组织的形态学特点为肝组织结构正常, 肝细胞以中央静脉为中心排列成索状, 呈放射状排列, 肝细胞质嗜酸性, 核嗜碱性(图1A). 实验组第8周小鼠肝组织的部分肝细胞损伤, 变性水肿, 有炎细胞浸润(图1B). 实验组第12周小鼠肝组织的肝细胞变性坏死, 炎细胞浸润, 肝内广泛纤维增生, 肝板紊乱, 部分肝细胞增生(图1C). 实验组第16周的肝细胞排列紊乱, 细胞异型性增生, 肝细胞呈多边形, 胞质丰富, 核圆形深染, 大小不等, 可见核分裂像(图1D). 诱癌第20周癌细胞呈多边形, 核大深染, 大小不等, 核分裂像明显, 核质比增大, 细胞异型性明显(图1E).
Wnt-1 mRNA的表达在第4至12周实验组和同期对照组相比差异没有显著性, 第14至20周实验组较同期对照组表达升高, 且随着诱癌时间延长实验组第14、16、18周Wnt-1 mRNA表达逐渐升高(4.192±0.322 vs 5.630±0.579 vs 8.060±0.795, P<0.05), 第18和20周表达差异没有显著性(8.060±0.795 vs 8.038±0.649, P>0.05).
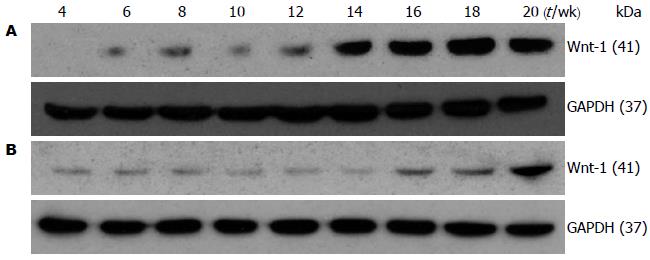
如图2, 表2所示, 对照组Wnt-1蛋白微弱表达; 实验组Wnt-1蛋白第4至12周微弱表达且差异没有统计学意义, 第14至18周随着诱癌时间延长Wnt-1蛋白表达逐渐升高, 第18和20周蛋白表达差异没有显著性.
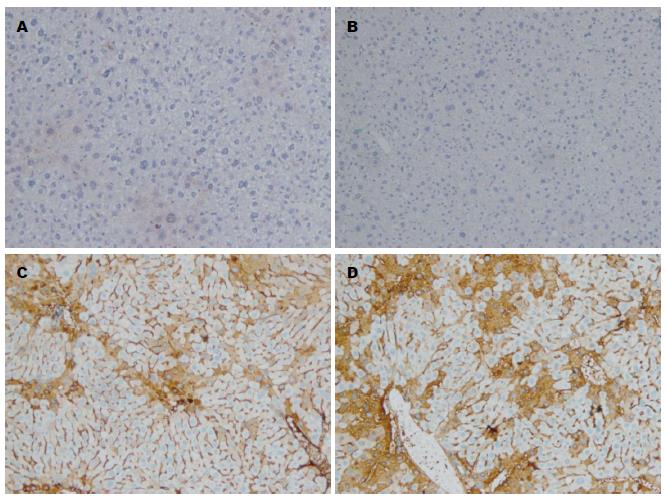
实验组第8周和对照组小鼠肝组织Wnt-1仅见微弱的胞膜淡黄色表达; 实验组第16周Wnt-1表达弱阳性3只、阳性2只, 在胞浆中呈散在或片状淡黄色表达; 实验组第20周Wnt-1均为阳性表达, 呈黄色片状或团块状表达(图3). 实验组从16 wk开始较对照组表达增加, 至20 wk时表达最强.
Wnt信号通路是一条进化上高度保守的信号转导途径, 通常与调节干细胞自我更新和肿瘤形成有关[9], 特别是经典信号通路Wnt/β-catenin信号通路, 其信号分子通过级联方式, 由细胞膜经过细胞质转导至细胞核[10]. 经典Wnt信号通路与肝癌发生的过程: Wnt蛋白在低密度脂蛋白相关蛋白(LRP-5/6)的协助下与跨膜受体蛋白Frizzeld结合, 将信号传递至胞内, 通过Dvl蛋白能将GSK-3β磷酸化, 抑制β-catenin-Axin-APC-GSK3复合物的形成, 从而抑制β-catenin磷酸化, 稳定β-catenin, 使其在胞质中聚集最后进入胞核. 核内出现β-catenin即视为Wnt通路被激活[11]. 核内β-catenin与T细胞因子/淋巴增强因子(T-cell factor/lymphoid enhancing factor, TCF/LEF)转录因子结合形成转录复合物, 共同调控下游的靶基因而影响病理生理过程[12]. 如靶基因c-myc启动子上含有β-catenin/TCF/LEF复合物的结合位点, 转录复合物作用于此处, 使其活化表达导致肿瘤的发生[13]. 有研究表明肝癌干细胞标志物上皮细胞黏附分子(epithelial cell adhesion molecule, EpCAM)是Wnt通路的靶基因, Wnt通路的激活促进EpCAM的表达[14]. 另外在肝癌组织中, OV6表达阳性的细胞在成瘤能力和耐药性上均强于OV6表达阴性的细胞, 而OV6表达阳性的肿瘤细胞产生是依赖于Wnt信号通路的激活. 所以说Wnt信号通路激活与肝癌干细胞密切相关, 能促使肝细胞向肝细胞癌(hepatocellular carcinoma, HCC)方向发展.
目前已经发现, Wnt信号通路主要通过激活下游的靶基因而导致肝癌的发生发展, 其中下游信号分子β-catenin在细胞内的累积被认为是Wnt信号通路激活的标志, 肿瘤组织中β-catenin的异常累积常与肿瘤细胞的增生活性[15]、肿瘤的分化程度[16]、血管浸润及预后[15-17]密切相关. β-catenin突变在肝癌中是频发事件, 发生率可达44.1%[18]. 有研究发现20%到90%的肝癌中均有多种机制导致β-catenin的激活, 其中包括基因突变编码β-catenin及CT NNB1、Axin-1、Axin-2、Frizzled-7的上调, 并抑制GSK-3β的激活[19]. 本课题组前期研究发现随着化学诱发肝癌的演变, 细胞浆内的β-catenin蛋白有可能向细胞核内移位, 致使细胞核内β-catenin蛋白更进一步累积, 激活一系列靶基因, 导致肝癌形成, 表明β-catenin与肝癌的发生发展有密切关系[20]. 所以为了更透彻的研究Wnt信号通路激活参与化学诱发肝癌的发生发展过程, 本实验研究了Wnt信号通路中上游信号分子Wnt-1在化学法诱发肝癌过程的动态变化.
Wnt是一种分泌型糖蛋白, 目前已经发现19种Wnt蛋白参与细胞的生长分化、胚胎形成和肿瘤形成. 已有研究发现在多种肿瘤中都存在一种或多种Wnt基因家族成员的异常表达, 这些基因的异常表达可能参与了Wnt通路的激活, 从而导致了肿瘤的发生与发展[21-23]. Kruger等[24]在检测小鼠乳腺癌4T1细胞和小鼠神经母细胞瘤NXS2细胞的SP细胞时发现, Wnt-1表达上调. Wei等[25]发现Wnt-1蛋白在肝癌组织及其细胞系中高表达, Wnt-1蛋白的抗体能降低细胞系Huh7和Hep40的增生能力, 诱导肿瘤细胞凋亡, 而对正常细胞没有影响, 同时Wnt-1蛋白抗体也能降低Wnt通路靶基因c-myc、cyclinD1的表达. Myung等[26]发现: Wnt/β-catenin通路的异常表达可激活肝星状细胞, 参与肝纤维化的形成. 在HBV和HCV相关的肝细胞肝癌中, Wnt-1基因过度表达, Wnt-1蛋白的表达水平可被看作肝癌术后复发的有用指标[27]. 此外, 在转基因小鼠c-myc/E2F1研究中发现, Wnt-1的高表达是Wnt通路中β-catenin核内累积的主要原因, 因而促进了转基因小鼠肝癌的发生[28]. 上述结果提示Wnt-1表达失调与肿瘤的发生有着密切的关系.
本研究检测了Wnt-1在诱发小鼠肝癌变过程中的表达情况, Real-time PCR、Western blot显示在诱癌的第4至12周实验组和同期对照组相比差异没有显著性, 免疫组织化学显示实验组第8周和对照组Wnt-1也仅见微弱的胞膜淡黄色表达, 此时期的病理变化主要是肝细胞变性坏死等药物性肝炎的变化和部分肝细胞增生的表现. 在第14至18周实验组较同期对照组表达升高, 且随着诱癌时间延长实验组第14、16、18周Wnt-1表达逐渐升高(蛋白水平: 0.518±0.050 vs 0.692±0.063 vs 0.815±0.071, P<0.05), 而第18和20周表达差异没有显著性变化. 免疫组织化学也显示第16周Wnt-1表达呈胞浆散在或片状淡黄色表达, 第20周Wnt-1均为阳性表达. 这段时期肝脏由轻度的肝细胞非典型增生和间质中出现纤维组织的增生的变化至第18周肝细胞出现异型性, 说明在肝癌诱发的早期阶段Wnt-1表达就发生了变化. 以上结果提示Wnt-1参与了化学诱发小鼠肝癌的发生发展过程.
另外考虑到第14周开始正常肝小叶结构破坏, 间质纤维组织增生提示开始有肝纤维化改变[29], 可在一定程度上说明肝纤维化Wnt/β-catenin通路也可能表达异常, 与Myung等[26]发现一致. 所以, 如果能在肝纤维化阶段对Wnt/β-catenin通路进行干预, 可以延缓肝纤维化、肝硬化向肝癌的进展, 为防止肝癌的形成起到了重要作用. 但Yuzugullu等[30]发现在所有肝癌细胞系中经典Wnt通路中的Wnt-1并不表达. 本研究与此结果相反, 猜测可能是经典与非经典Wnt通路共同作用的结果, 因此需要进一步的研究.
本实验存在的不足之处只是初步探索了Wnt/β-catenin信号通路中上游信号分子Wnt-1在化学法诱发肝癌过程中的变化, 其Wnt/β-catenin信号通路中上下游信号分子的相互作用及对化学法诱发肝癌发生的具体调控机制有待进一步研究.
总之, Wnt通路中的各级信号原件的结构和功能改变都可能激活Wnt通路, 参与肿瘤的发生与转移. 本实验采用DEN/CCl4/Ethanol联合成功诱导小鼠肝癌模型, 在小鼠成癌过程中动态监测Wnt-1的表达水平, 证实了Wnt-1参与了小鼠肝癌的发生发展, 我们推测可能是在化学诱导肝癌过程中Wnt通路被激活, 随着肝癌的形成相互作用的结果. 明确Wnt-1在肝癌发生过程中的表达, 为今后寻找新的肝癌治疗靶点提供理论依据.
感谢郝帅给予的帮助.
世界范围内肝癌在男、女癌症死亡原因中分别居第2、6位. 近年来发现, 包括肝癌在内的人类多种肿瘤都存在Wnt通路的异常激活. 目前, 对肝癌的研究中已有较多关于Wnt通路异常活化的报道, 但更多着眼于下游信号分子β-catenin/T细胞因子(T-cell factor, TCF)等关键环节, 因此Wnt通路对肝癌发生的调控作用尚未明确. 本文通过化学法诱导小鼠肝癌发生模型动态观察Wnt-1基因、蛋白表达水平变化, 目前相关研究报道较少.
秦建民, 主任医师, 上海中医药大学附属普陀医院普外科
Wnt是一种分泌型糖蛋白, 目前已经发现19种Wnt蛋白参与细胞的生长分化、胚胎形成和肿瘤形成. 已有研究发现在多种肿瘤中都存在一种或多种Wnt基因家族成员的异常表达, 这些基因的异常表达可能参与了Wnt通路的激活, 从而导致了肿瘤的发生与发展. 两者的关系已成为目前研究的热点.
Wei等发现Wnt-1蛋白在肝癌组织及其细胞系中高表达, Wnt-1蛋白的抗体能降低细胞系Huh7和Hep40的增生能力, 诱导肿瘤细胞凋亡, 而对正常细胞没有影响, 同时Wnt-1蛋白抗体也能降低Wnt通路靶基因c-myc、cyclinD1的表达.
既往的研究多集中在人手术标本中检测Wnt通路中Wnt-1的表达情况, 而没有从肝脏损害出现病变开始到完全形成肿瘤的全过程观察其动态性变化规律, 而本实验试图通过对化学诱发小鼠肝癌发生全过程的不同阶段对Wnt-1进行动态跟踪和系统研究, 为阐明该通路对肝癌发生发展所起的关键调控作用及相互关系打下基础.
肝癌的发病机制尚不清楚, 缺乏有效的一级预防, 因此早期诊断及治疗成为重点. 分子靶向治疗是目前肿瘤治疗的研究热点之一. 本文明确Wnt-1在肝癌发生发展过程中的表达, 为今后寻找新的肝癌治疗靶点提供理论依据.
本文采用化学法诱导小鼠肝癌发生模型, 动态观察了Wnt/β-catenin信号转导通路中信号分子Wnt-1基因、蛋白表达水平变化, 提示Wnt-1参与了肝癌发生过程, 具有一定理论参考价值.
编辑: 郭鹏 电编:鲁亚静
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Lachenmayer A, Alsinet C, Savic R, Cabellos L, Toffanin S, Hoshida Y, Villanueva A, Minguez B, Newell P, Tsai HW. Wnt-pathway activation in two molecular classes of hepatocellular carcinoma and experimental modulation by sorafenib. Clin Cancer Res. 2012;18:4997-5007. [PubMed] [DOI] |
| 3. | Moravec M. [Colorectal cancer and canonical Wnt signalling pathway]. Cas Lek Cesk. 2012;151:335-342. [PubMed] |
| 4. | Cai C, Zhu X. The Wnt/β-catenin pathway regulates self-renewal of cancer stem-like cells in human gastric cancer. Mol Med Rep. 2012;5:1191-1196. [PubMed] [DOI] |
| 5. | Zhang H, Xue Y. Wnt pathway is involved in advanced gastric carcinoma. Hepatogastroenterology. 2008;55:1126-1130. [PubMed] |
| 6. | Pan KF, Liu WG, Zhang L, You WC, Lu YY. Mutations in components of the Wnt signaling pathway in gastric cancer. World J Gastroenterol. 2008;14:1570-1574. [PubMed] |
| 7. | Zhu J, Zhang S, Gu L, Di W. Epigenetic silencing of DKK2 and Wnt signal pathway components in human ovarian carcinoma. Carcinogenesis. 2012;33:2334-2343. [PubMed] [DOI] |
| 9. | Noda T, Nagano H, Takemasa I, Yoshioka S, Murakami M, Wada H, Kobayashi S, Marubashi S, Takeda Y, Dono K. Activation of Wnt/beta-catenin signalling pathway induces chemoresistance to interferon-alpha/5-fluorouracil combination therapy for hepatocellular carcinoma. Br J Cancer. 2009;100:1647-1658. [PubMed] [DOI] |
| 10. | Nejak-Bowen KN, Monga SP. Beta-catenin signaling, liver regeneration and hepatocellular cancer: sorting the good from the bad. Semin Cancer Biol. 2011;21:44-58. [PubMed] [DOI] |
| 11. | Yang W, Yan HX, Chen L, Liu Q, He YQ, Yu LX, Zhang SH, Huang DD, Tang L, Kong XN. Wnt/beta-catenin signaling contributes to activation of normal and tumorigenic liver progenitor cells. Cancer Res. 2008;68:4287-4295. [PubMed] [DOI] |
| 12. | Zulehner G, Mikula M, Schneller D, van Zijl F, Huber H, Sieghart W, Grasl-Kraupp B, Waldhör T, Peck-Radosavljevic M, Beug H. Nuclear beta-catenin induces an early liver progenitor phenotype in hepatocellular carcinoma and promotes tumor recurrence. Am J Pathol. 2010;176:472-481. [PubMed] [DOI] |
| 13. | He TC, Sparks AB, Rago C, Hermeking H, Zawel L, da Costa LT, Morin PJ, Vogelstein B, Kinzler KW. Identification of c-MYC as a target of the APC pathway. Science. 1998;281:1509-1512. [PubMed] |
| 14. | Yamashita T, Budhu A, Forgues M, Wang XW. Activation of hepatic stem cell marker EpCAM by Wnt-beta-catenin signaling in hepatocellular carcinoma. Cancer Res. 2007;67:10831-10839. [PubMed] [DOI] |
| 15. | Inagawa S, Itabashi M, Adachi S, Kawamoto T, Hori M, Shimazaki J, Yoshimi F, Fukao K. Expression and prognostic roles of beta-catenin in hepatocellular carcinoma: correlation with tumor progression and postoperative survival. Clin Cancer Res. 2002;8:450-456. [PubMed] |
| 16. | Endo K, Ueda T, Ueyama J, Ohta T, Terada T. Immunoreactive E-cadherin, alpha-catenin, beta-catenin, and gamma-catenin proteins in hepatocellular carcinoma: relationships with tumor grade, clinicopathologic parameters, and patients' survival. Hum Pathol. 2000;31:558-565. [PubMed] |
| 17. | Wong CM, Fan ST, Ng IO. beta-Catenin mutation and overexpression in hepatocellular carcinoma: clinicopathologic and prognostic significance. Cancer. 2001;92:136-145. [PubMed] |
| 18. | Oishi N, Wang XW. Novel therapeutic strategies for targeting liver cancer stem cells. Int J Biol Sci. 2011;7:517-535. [PubMed] |
| 19. | Tycko B, Li CM, Buttyan R. The Wnt/beta-catenin pathway in Wilms tumors and prostate cancers. Curr Mol Med. 2007;7:479-489. [PubMed] |
| 21. | Cheng JH, She H, Han YP, Wang J, Xiong S, Asahina K, Tsukamoto H. Wnt antagonism inhibits hepatic stellate cell activation and liver fibrosis. Am J Physiol Gastrointest Liver Physiol. 2008;294:G39-G49. [PubMed] |
| 22. | Yan L, Della Coletta L, Powell KL, Shen J, Thames H, Aldaz CM, MacLeod MC. Activation of the canonical Wnt/β-catenin pathway in ATF3-induced mammary tumors. PLoS One. 2011;6:e16515. [PubMed] [DOI] |
| 23. | Carmon KS, Loose DS. Development of a bioassay for detection of Wnt-binding affinities for individual frizzled receptors. Anal Biochem. 2010;401:288-294. [PubMed] [DOI] |
| 24. | Kruger JA, Kaplan CD, Luo Y, Zhou H, Markowitz D, Xiang R, Reisfeld RA. Characterization of stem cell-like cancer cells in immune-competent mice. Blood. 2006;108:3906-3912. [PubMed] [DOI] |
| 25. | Wei W, Chua MS, Grepper S, So SK. Blockade of Wnt-1 signaling leads to anti-tumor effects in hepatocellular carcinoma cells. Mol Cancer. 2009;8:76. [PubMed] [DOI] |
| 26. | Myung SJ, Yoon JH, Gwak GY, Kim W, Lee JH, Kim KM, Shin CS, Jang JJ, Lee SH, Lee SM. Wnt signaling enhances the activation and survival of human hepatic stellate cells. FEBS Lett. 2007;581:2954-2958. [PubMed] |
| 27. | Lee HH, Uen YH, Tian YF, Sun CS, Sheu MJ, Kuo HT, Koay LB, Lin CY, Tzeng CC, Cheng CJ. Wnt-1 protein as a prognostic biomarker for hepatitis B-related and hepatitis C-related hepatocellular carcinoma after surgery. Cancer Epidemiol Biomarkers Prev. 2009;18:1562-1569. [PubMed] [DOI] |
| 28. | Calvisi DF, Conner EA, Ladu S, Lemmer ER, Factor VM, Thorgeirsson SS. Activation of the canonical Wnt/beta-catenin pathway confers growth advantages in c-Myc/E2F1 transgenic mouse model of liver cancer. J Hepatol. 2005;42:842-849. [PubMed] [DOI] |
| 30. | Yuzugullu H, Benhaj K, Ozturk N, Senturk S, Celik E, Toylu A, Tasdemir N, Yilmaz M, Erdal E, Akcali KC. Canonical Wnt signaling is antagonized by noncanonical Wnt5a in hepatocellular carcinoma cells. Mol Cancer. 2009;8:90. [PubMed] [DOI] |