修回日期: 2013-12-16
接受日期: 2013-12-27
在线出版日期: 2014-02-18
目的: 观察p38丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)特异性抑制剂SB203580对大鼠实验性结肠炎(ulcerative colitis, UC)外周血淋巴细胞(peripheral blood lymphocyte, PBL)凋亡及相关调控蛋白的影响, 探讨P38MAPK通路在UC中的可能作用及机制.
方法: 45只健康SD大鼠随机均分为正常对照组、结肠炎模型组、SB203580组. 模型组及SB203580组以三硝基苯磺酸(2, 4, 6-trinitrobenzene sulfonic acid, TNBS)制备大鼠溃疡性结肠炎模型, 正常对照组给予等量0.9%生理盐水灌肠, SB203580组于造模完成后给予1 mg/(kg•d) SB203580腹腔注射. 流式细胞仪技术检测PBL凋亡率及Bcl-2表达率, 免疫组织化学方法检测活化转录因子-2(phosphor-activating transcription factor 2, p-ATF2)表达; 同时观察大鼠疾病活动指数(disease activity index, DAI)、肠道大体形态及组织学评分情况; 分析p-ATF2水平与PBL凋亡率及Bcl-2达率的相关关系.
结果: 与正常组相比, 模型组大鼠肠组织磷酸化p-ATF2及PBL中Bcl-2阳性表达显著增高(43.40%±2.67% vs 7.45%±1.26%, 38.60%±3.53% vs 13.70%±2.45%, P<0.01), PBL凋亡率明显降低(27.70%±3.02% vs 58.70%±3.09%, P<0.01); SB203580组p-ATF2、Bcl-2阳性表达率较模型组明显下降(20.70%±2.79%, 20.30%±2.87%, P<0.01), PBL凋亡率较模型组明显上升(46.60%±4.14%, P<0.01). 大鼠DAI及肠道大体形态、组织学评分模型组明显高于正常组(2.42±0.30 vs 0.28±0.29, 5.42±0.30 vs 0.30±0.48, 3.29±0.26 vs 0.05±0.20, P<0.01), SB203580组较模型组明显下降(1.24±0.17, 3.30±0.22, 1.10±0.74, P<0.01).
结论: P38MAPK抑制剂SB203580通过下调p-ATF2活性及Bcl-2表达, 促进PBL的凋亡减轻UC大鼠肠道炎症损伤, 对UC具有保护作用.
核心提示: 本文通过观察p38丝裂原活化蛋白激酶超家族(mitogen-activated protein kinase)抑制剂对结肠炎大鼠外周血淋巴细胞(peripheral blood lymphocyte, PBL)凋亡及相关调控蛋白的影响, 结果发现其可下调活化转录因子-2 (phosphor-activating transcription factor 2)活性及Bcl-2表达, 促进PBL凋亡, 减轻大鼠肠道炎症损伤, 对溃疡性结肠炎具有保护作用.
引文著录: 李军华, 周薇. P38MAPK抑制剂对溃疡性结肠炎大鼠外周血淋巴细胞凋亡及相关调控蛋白的影响. 世界华人消化杂志 2014; 22(5): 668-673
Revised: December 16, 2013
Accepted: December 27, 2013
Published online: February 18, 2014
AIM: To investigate the influence of p38 mitogen-activated protein kinase inhibitor SB203580 on peripheral blood lymphocyte (PBL) apoptosis in rats with colitis and the possible mechanisms involved.
METHODS: Forty-five healthy female Sprague-Dawley (SD) rats were randomly divided into three groups: a normal group, a model group and a SB203580 group. Colitis was induced with 2, 4, 6-trinitrobenzene sulfonic acid (TNBS) in rats of the latter two groups. The normal group and the model group were treated intrarectally with saline, while the SB203580 group was given SB203580 [1 mg/(kg•d)]. The rats were sacrificed after 2 wk to assess disease activity index (DAI) and macroscopic and histological changes of the colon. PBL apoptosis and Bcl-2 expression were examined by flow cytometry. p-ATF2 protein expression in colon tissue was determined by immunohistochemistry.
RESULTS: In the model group, the percentages of cells expressing p-ATF2 and Bcl-2 were higher than those in the normal group and SB203580 group (43.40% ± 2.67% vs 7.45% ± 1.26%, 20.70% ± 2.79%; 38.60% ± 3.53% vs 13.70% ± 2.45%, 20.30% ± 2.87%, P < 0.01 for all), but the percentage of apoptotic PBLs in the model group was lower than those in the normal group and SB203580 group (27.70% ± 3.02% vs 58.70% ± 3.09%, 46.60% ± 4.14%, P < 0.01 for both). DAI and macroscopic and histological scores in the model group were significantly higher than those in the normal group and SB203580 group (2.42 ± 0.30 vs 0.28 ± 0.29, 1.24 ± 0.17; 5.42 ± 0.30 vs 0.30 ± 0.48, 3.30 ± 0.22; 3.29 ± 0.26 vs 0.05 ± 0.20, 1.10 ± 0.74, P < 0.01 for all).
CONCLUSION: P38MAPK inhibitor SB203580 reduces colonic inflammatory injury in rats with colitis by down-regulating expression of p-ATF2 and Bcl-2 and inducing PBL apoptosis. SB203580 can be considered as a novel therapeutic alternative for the treatment of UC.
- Citation: Li JH, Zhou W. P38 mitogen-activated protein kinase inhibitor SB203580 promotes peripheral blood lymphocyte apoptosis in rats with colitis. Shijie Huaren Xiaohua Zazhi 2014; 22(5): 668-673
- URL: https://www.wjgnet.com/1009-3079/full/v22/i5/668.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i5.668
溃疡性结肠炎(ulcerative colitis, UC)是炎症性肠病的一种, 以肠道持续的慢性炎症为主要病理特征, 目前其病因和发病机制尚不十分清楚. 一些研究表明, 细胞凋亡与UC发病关系密切, 免疫细胞凋亡延迟是UC炎症持续存在的主要原因之一[1-3]. p38蛋白激酶是丝裂原活化蛋白激酶超家族(mitogen-activated protein kinase, MAPK)中的重要成员, 其信号通路在炎症、细胞增殖、分化、凋亡等过程中发挥重要作用[4-7]. 本研究通过观察P38MAPK特异性抑制剂对溃疡性结肠炎大鼠肠道损伤、外周血淋巴细胞(peripheral blood lymphocyte, PBL)及相关基因的影响, 探讨P38MAPK信号通路在溃疡性结肠炎中的可能作用和机制.
SPF级健康成年♂大鼠45只, 体质量180±20 g. 由武汉大学医学院实验动物中心提供. 2, 4, 6-三硝基苯磺酸(TNBS)(Sigma公司); 兔抗大鼠磷酸化的p-ATF2、Bcl-2单抗(Santa Cruz公司); SB203580(Calbiochem公司); RPMI 1640培养基为Gibco公司产品, SP、DAB试剂盒为晶美公司产品; Ficoll淋巴细胞分离液为天津TBD产品; Annexin V-FITC细胞凋亡检测试剂盒为南京凯基生物科技发展有限公司产品; 其他试剂为进口或国产分析纯.
1.2.1 动物造模与处理: 实验大鼠适应性喂养1 wk, 随机分为正常对照组、模型组及SB203580干预组共3组, 每组15只. 模型组及SB203580组参照文献[8-10]建立大鼠溃疡性结肠炎模型. 大鼠术前24 h禁食不禁水, 实验时以乙醚吸入麻醉大鼠, 采用橡胶软管由大鼠肛门轻缓插入结肠约8 cm, 每只大鼠以100 mg/kg注入5%(w/v)的2, 4, 6-三硝基苯磺酸(TNBS)/乙醇(体积比
1:1)混合溶液. 灌肠完成后倒提鼠尾轻摇大鼠半分钟, 防止灌注液倒流, 动物平躺放置自然清醒. 正常对照组给予等量0.9%生理盐水灌肠, SB203580组于造模完成后给予1 mg/(kg•d) SB203580腹腔注射. 2 wk后所有动物全麻下取材.
1.2.2 大鼠疾病活动度及肠组织损伤观察: 每日观察大鼠精神、食欲、活动等一般情况及大便、血便等消化系症状, 并计算疾病活动指数(disease activity index, DAI)[11]. 肠组织标本取肛门至盲肠段, 沿肠管纵轴剪开, 冰生理盐水洗净, 参照文献[12]进行肠道大体形态评分. 结肠组织卷起来, 以4.0%多聚甲醛固定, 石蜡包埋, 4 μm连续切片, HE染色, 根据Fedorak积分标准进行病理组织学损伤评分[13].
1.2.3 大鼠PBL提取及凋亡检测: 肠道取材前全麻下于大鼠尾静脉取血约5 mL, 肝素抗凝, 采用密度梯度离心法分离出PBL[14,15]. 以台盼蓝染色法检测PBL活力>96%. 将提取的PBL悬于含10%胎牛血清的RPMI 1640培养液中, 调整细胞浓度为1×106/L, 置于37 ℃、体积分数5%的CO2培养箱内培养保存. 凋亡检测时以pH 7.4的PBS缓冲液洗涤2次后调整细胞浓度为1×106/L上流式细胞仪检测, 操作步骤按Annexin V-FITC细胞凋亡检测试剂盒说明书进行.
1.2.4 大鼠PBL Bcl-2表达检测: 取培养保存的PBL以pH 7.4的PBS缓冲液洗涤2次, 调整细胞浓度为1×106/L, 加入FITC标记的Bcl-2单抗, 常温孵育30 min. PBS缓冲液洗涤2次后加入碘化丙啶(propidium iodide, PI), 避光室温孵育30 min, 流式细胞仪检测, 计算Bcl-2阳性细胞表达率.
1.2.5 肠组织p-ATF2表达检测: 采用免疫组织化学SP法, 石蜡切片脱蜡水化, 经微波抗原修复, 3%H2O2孵育消除内源性过氧化物酶活性后, 以10%正常血清封闭非特异性抗原; 滴加1:100稀释的p-ATF2抗体, 4 ℃过夜; 滴加生物素化二抗, 37 ℃孵育10 min后滴加辣根过氧化物酶标记的卵白素工作液, 37 ℃孵育15 min; 滴加抗体步骤之间均需PBS缓冲液洗涤3×5 min; DAB显色, 苏木素复染, 中性树脂封片. 显微镜下计算阳性细胞所占比例.
统计学处理 采用SPSS13.0软件处理实验数据, 计量资料以mean±SD表示, 方差齐性检验采用单因素方差分析处理, 相关分析采取线性相关分析. P<0.05为差异有统计学意义.
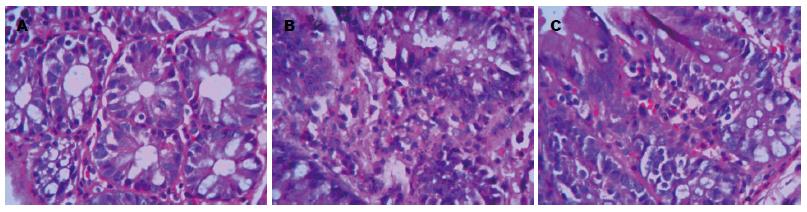
TNBS造模大鼠出现精神倦怠, 活动减退, 食欲、体质量下降, 毛发失去光泽等改变; 可观察到腹泻, 黄色稀便或肛周体毛被稀便沾染, 约30%大鼠出现黏液血便. SB203580组经干预后上述症状逐渐减轻, DAI评分明显下降(表1). 模型组结肠黏膜充血、肿胀、糜烂多见, 可见散在溃疡及出血灶; 光镜下可见结肠上皮细胞坏死、脱落, 黏膜层及黏膜下层有较多炎症细胞浸润, 可见溃疡及隐窝脓肿形成. SB203580组大鼠肉眼及镜下结肠损伤情况明显减轻, 黏膜充血水肿, 糜烂灶明显减轻或消失, 溃疡愈合, 结肠损伤大体评分及组织学评分均明显下降(P<0.01, 表1, 图1).
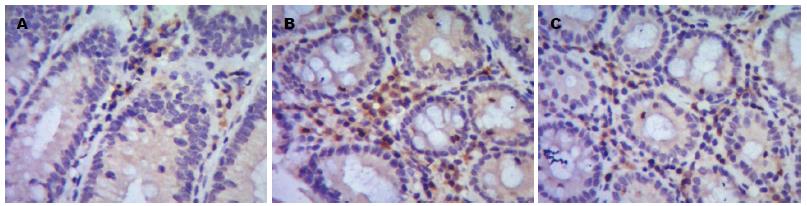
p-ATF2阳性表达细胞以胞浆着色为主, 呈棕褐色, 胞核亦有少量着色, 阳性细胞多集中在黏膜固有层内. SB203580组中p-ATF2阳性表达率较模型组明显降低(P<0.01, 表2, 图2).
模型组大鼠PBL凋亡率明显低于正常组(P<0.01); SB203580组PBL凋亡率明显高于模型组(P<0.01), 但仍低于正常组(P<0.01). 与正常组相比, 模型组大鼠Bcl-2表达率明显上升(P<0.01), SB203580组干预后, Bcl-2表达明显下降, 但其表达水平仍高于正常组(P<0.01).
采用SPSS软件对上述指标进行线性相关分析, 得相关系数分别为r = -0.991, 0.985(P<0.01); p-ATF2表达水平与PBL凋亡率呈显著负相关, 与Bcl-2表达率呈显著正相关.
UC目前病因仍未完全阐明, 可能涉及感染、遗传、免疫及环境等多个因素相互作用. 炎症因子网络失衡、免疫系统紊乱是导致UC肠道炎症损伤持续存在或反复发作的重要因素, 而细胞凋亡与之关系密切; 资料表明, 在UC中, 结肠上皮细胞凋亡明显增多, 而淋巴细胞等免疫细胞凋亡延迟或减弱[16-18]. 本实验结果发现, 在UC大鼠外周血中, 淋巴细胞的凋亡率明显低于正常组大鼠, 提示UC中不仅仅在肠道局部, 外周血中的淋巴细胞液存在凋亡延迟情况.
P38是丝裂原活化蛋白激酶家族的成员之一, 是细胞内信号传递的重要分子, 在机体生理、病理过程如细胞生长、分化、凋亡及炎症、应激反应中起重要调控作用[4-7]. SB203580是一种人工合成的吡啶咪唑类制剂, 可特异性抑制P38MAPK活性, 其可竞争性结合P38MAPK的ATP位点, 抑制p38对下游分子如ATF2的磷酸化, 但并不影响p38的磷酸化过程[19,20]. 因此, 在SB203580干预情况下, 磷酸化的ATF2水平可以反映P38MAPK的酶活性. 近年来, 随着研究的不断深入, P38MAPK信号通路在炎症性肠病发病中的作用日益受到重视[21-24], 研究表明[24], P38MAPK信号通路可通过对UC中炎症细胞因子TNF-α表达的调控参与UC的发病. 但在UC中, P38MAPK信号通路与细胞凋亡的关系目前尚未见报道. 本实验通过TNBS/乙醇灌肠复制溃疡性结肠炎模型, 采用P38MAPK选择性抑制剂SB203580进行干预, 结果发现, 模型组大鼠肠组织p-ATF2表达较正常组明显升高, 给予SB230580处理后, p-ATF2表达明显下降, 且PBL凋亡率较模型组有明显上升, 大鼠一般情况及肠道损伤情况明显改善, 提示SB203580确实阻断了P38MAPK信号通路, 并促进了UC大鼠外周血淋巴细胞的凋亡, 减轻了肠道炎症损伤.
资料表明, P38MAPK可通过增强c-myc、TNF-α表达, 激活c-jun、c-fos, 磷酸化P53, 参与Fas/FasL途径等多种方式实现细胞凋亡调控, 在细胞凋亡调控过程中作用关键[25-29]. ATF2在细胞增殖更新中亦发挥重要作用, 其可诱导Bcl-2表达, 从而引起下游效应[30]. Bcl-2是一个研究最早的细胞凋亡抑制基因, 他与其同源蛋白Bax 的比率可以调节细胞凋亡的速率[31,32]. 本实验进一步观察了p38特异性抑制剂对UC大鼠PBL中Bcl-2表达水平的影响, 结果发现SB203580干预后, UC大鼠PBL中Bcl-2的表达率明显下降. 同时, 相关分析结果显示, ATF2表达水平与Bcl-2的表达率呈显著正相关, 而与PBL凋亡率呈显著负相关. 实验结果表明p38/ATF2-Bcl-2途径参与了UC大鼠外周血PBL的凋亡调控过程, 其活化可延迟PBL的凋亡, 导致肠道过度的炎症反应和损伤, 而其特异性抑制剂SB203580可阻断这一过程. 总之, 实验结果提示, 阻断或调控p38信号通路有望成为溃疡性结肠炎防治的又一途径.
细胞凋亡在溃疡性结肠炎发生发展过程中起重要作用, p38丝裂原活化蛋白激酶超家族(mitogen-activated protein kinase, MAPK)是介导细胞生长, 发育, 分化和凋亡的重要信号通路之一, 该通路的激活与多种疾病发病密切相关, 其对细胞凋亡的调控可能参与了溃疡性结肠炎的发病.
刘杰民, 副主任医师, 贵州省人民医院消化内镜科
细胞信号通路是溃疡性结肠炎研究领域中的热点, 阻断导致肠道炎症损伤和免疫异常的信号通路的传导过程是溃疡性结肠炎治疗的又一新策略.
Feng等研究发现在炎症性肠病中存在P38MAPK信号通路的表达异常, 其可通过对炎症细胞因子TNF-α等表达的调控参与发病过程; 同时也有研究表明在哮喘、急性胰腺炎等疾病中特异性阻断P38通路能够减轻炎症反应及损伤.
有关溃疡性结肠炎中P38MAPK信号通路与细胞凋亡的关系目前鲜有研究报道, 本文发现P38MAPK信号通路活化可延迟外周血淋巴细胞凋亡, 导致肠道过度的炎症反应和损伤, 探讨了其对细胞凋亡的调控机制.
本文围绕溃疡性结肠炎防治开展研究, 结果可信. 研究结果对丰富溃疡性结肠炎发病机理, 寻求溃疡性结肠治疗新靶点方面有一定学术意义.
编辑: 田滢 电编:鲁亚静
| 1. | Araki Y, Mukaisyo K, Sugihara H, Fujiyama Y, Hattori T. Increased apoptosis and decreased proliferation of colonic epithelium in dextran sulfate sodium-induced colitis in mice. Oncol Rep. 2010;24:869-874. [PubMed] |
| 2. | Akcan A, Kucuk C, Sozuer E, Esel D, Akyildiz H, Akgun H, Muhtaroglu S, Aritas Y. Melatonin reduces bacterial translocation and apoptosis in trinitrobenzene sulphonic acid-induced colitis of rats. World J Gastroenterol. 2008;14:918-924. [PubMed] |
| 3. | Pacheco RG, Esposito CC, Müller LC, Castelo-Branco MT, Quintella LP, Chagas VL, de Souza HS, Schanaider A. Use of butyrate or glutamine in enema solution reduces inflammation and fibrosis in experimental diversion colitis. World J Gastroenterol. 2012;18:4278-4287. [PubMed] |
| 4. | de la Cruz-Morcillo MA, Valero ML, Callejas-Valera JL, Arias-González L, Melgar-Rojas P, Galán-Moya EM, García-Gil E, García-Cano J, Sánchez-Prieto R. P38MAPK is a major determinant of the balance between apoptosis and autophagy triggered by 5-fluorouracil: implication in resistance. Oncogene. 2012;31:1073-1085. [PubMed] [DOI] |
| 5. | Khan R, Khan AQ, Qamar W, Lateef A, Tahir M, Rehman MU, Ali F, Sultana S. Chrysin protects against cisplatin-induced colon. toxicity via amelioration of oxidative stress and apoptosis: probable role of p38MAPK and p53. Toxicol Appl Pharmacol. 2012;258:315-329. [PubMed] [DOI] |
| 6. | Zhang YP, Yao XX, Zhao X. Interleukin-1 beta up-regulates tissue inhibitor of matrix metalloproteinase-1 mRNA and phosphorylation of c-jun N-terminal kinase and p38 in hepatic stellate cells. World J Gastroenterol. 2006;12:1392-1396. [PubMed] |
| 7. | Ipaktchi K, Mattar A, Niederbichler AD, Hoesel LM, Hemmila MR, Su GL, Remick DG, Wang SC, Arbabi S. Topical p38MAPK inhibition reduces dermal inflammation and epithelial apoptosis in burn wounds. Shock. 2006;26:201-209. [PubMed] |
| 8. | Peterson TC, Peterson MR, Raoul JM. The effect of pentoxifylline and its metabolite-1 on inflammation and fibrosis in the TNBS model of colitis. Eur J Pharmacol. 2011;662:47-54. [PubMed] [DOI] |
| 9. | Li JH, Yu JP, Yu HG, Xu XM, Yu LL, Liu J, Luo HS. Melatonin reduces inflammatory injury through inhibiting NF-kappaB activation in rats with colitis. Mediators Inflamm. 2005;2005:185-193. [PubMed] |
| 12. | Mei Q, Yu JP, Xu JM, Wei W, Xiang L, Yue L. Melatonin reduces colon immunological injury in rats by regulating activity of macrophages. Acta Pharmacol Sin. 2002;23:882-886. [PubMed] |
| 13. | Fedorak RN, Empey LR, MacArthur C, Jewell LD. Misoprostol provides a colonic mucosal protective effect during acetic acid-induced colitis in rats. Gastroenterology. 1990;98:615-625. [PubMed] |
| 16. | Buczyński J, Spychalski M, Ławska-Wierzchniewska A, Dziki A. Higher apoptosis index and proliferation index in colonocytes of patients with ulcerative colitis in remission. Pol Przegl Chir. 2012;84:271-275. [PubMed] [DOI] |
| 17. | Karakoyun B, Uslu U, Ercan F, Aydin MS, Yuksel M, Ogunc AV, Alican I. The effect of phosphodiesterase-5 inhibition by sildenafil citrate on inflammation and apoptosis in rat experimental colitis. Life Sci. 2011;89:402-407. [PubMed] [DOI] |
| 18. | Dirisina R, Katzman RB, Goretsky T, Managlia E, Mittal N, Williams DB, Qiu W, Yu J, Chandel NS, Zhang L. p53 and PUMA independently regulate apoptosis of intestinal epithelial cells in patients and mice with colitis. Gastroenterology. 2011;141:1036-1045. [PubMed] [DOI] |
| 19. | Su J, Cui X, Li Y, Mani H, Ferreyra GA, Danner RL, Hsu LL, Fitz Y, Eichacker PQ. SB203580, a p38 inhibitor, improved cardiac function but worsened lung injury and survival during Escherichia coli pneumonia in mice. J Trauma. 2010;68:1317-1327. [PubMed] [DOI] |
| 20. | Henklova P, Vrzal R, Papouskova B, Bednar P, Jancova P, Anzenbacherova E, Ulrichova J, Maurel P, Pavek P, Dvorak Z. SB203580, a pharmacological inhibitor of p38 MAP kinase transduction pathway activates ERK and JNK MAP kinases in primary cultures of human hepatocytes. Eur J Pharmacol. 2008;593:16-23. [PubMed] [DOI] |
| 21. | Feng YJ, Li YY. The role of p38 mitogen-activated protein kinase in the pathogenesis of inflammatory bowel disease. J Dig Dis. 2011;12:327-332. [PubMed] [DOI] |
| 22. | Zhao X, Kang B, Lu C, Liu S, Wang H, Yang X, Chen Y, Jiang B, Zhang J, Lu Y. Evaluation of p38 MAPK pathway as a molecular signature in ulcerative colitis. J Proteome Res. 2011;10:2216-2225. [PubMed] [DOI] |
| 23. | Mihaescu A, Santen S, Jeppsson B, Thorlacius H. p38 Mitogen-activated protein kinase signalling regulates vascular inflammation and epithelial barrier dysfunction in an experimental model of radiation-induced colitis. Br J Surg. 2010;97:226-234. [PubMed] |
| 24. | 易 文全, 甘 华田, 黄 晓丽, 张 蒙, 欧阳 钦. p38丝裂原活化蛋白激酶抑制剂SB203580对溃疡性结肠炎肠黏膜肿瘤坏死因子α表达的影响. 中华内科杂志. 2007;46:747-750. |
| 25. | Stoneley M, Chappell SA, Jopling CL, Dickens M, MacFarlane M, Willis AE. c-Myc protein synthesis is initiated from the internal ribosome entry segment during apoptosis. Mol Cell Biol. 2000;20:1162-1169. [PubMed] |
| 26. | Waetzig GH, Seegert D, Rosenstiel P, Nikolaus S, Schreiber S. p38 mitogen-activated protein kinase is activated and linked to TNF-alpha signaling in inflammatory bowel disease. J Immunol. 2002;168:5342-5351. [PubMed] |
| 27. | Matsui Y, Watanabe J, Ding S, Nishizawa K, Kajita Y, Ichioka K, Saito R, Kobayashi T, Ogawa O, Nishiyama H. Dicoumarol enhances doxorubicin-induced cytotoxicity in p53 wild-type urothelial cancer cells through p38 activation. BJU Int. 2010;105:558-564. [PubMed] [DOI] |
| 28. | Kornmann M, Ishiwata T, Kleeff J, Beger HG, Korc M. Fas and Fas-ligand expression in human pancreatic cancer. Ann Surg. 2000;231:368-379. [PubMed] |
| 29. | Chen KC, Chiou YL, Chang LS. JNK1/c-Jun and p38 alpha MAPK/ATF-2 pathways are responsible for upregulation of Fas/FasL in human chronic myeloid leukemia K562 cells upon exposure to Taiwan cobra phospholipase A2. J Cell Biochem. 2009;108:612-620. [PubMed] |
| 30. | 马 秦, 宋 红, 程 晓兵, 张 浚睿, 陈 富林, 吴 炜, 毛 天球. 活化转录调控因子2( ATF2)在下颌骨髁突软骨细胞中调控 Bcl-2机制的研究. 实用口腔医学杂志. 2009;25:459-461. |
| 31. | Ueyama H, Kiyohara T, Sawada N, Isozaki K, Kitamura S, Kondo S, Miyagawa J, Kanayama S, Shinomura Y, Ishikawa H. High Fas ligand expression on lymphocytes in lesions of ulcerative colitis. Gut. 1998;43:48-55. [PubMed] |
| 32. | Karamanolis DG, Kyrlagkitsis I, Konstantinou K, Papatheodoridis GV, Karameris A, Mallas E, Ladas SD, Raptis S. The Bcl-2/Bax system and apoptosis in ulcerative colitis. Hepatogastroenterology. 2007;54:1085-1088. [PubMed] |