修回日期: 2013-12-19
接受日期: 2013-12-27
在线出版日期: 2014-02-18
MiRNAs是一类在转录后水平调控基因表达的微小RNA分子. 大量研究表明, MiRNAs的失调表达是肿瘤的重要特征之一. MiRNAs参与调控许多重要的癌基因或抑癌基因的表达, 从而调控肿瘤的恶性生物学表型. MiR-375最早发现在胰岛B细胞表达并调控胰岛素的分泌和胰岛的形成. 进一步的研究发现, miR-375在肿瘤组织中普遍呈现低表达特别是在消化系肿瘤中, 如肝癌、胃癌、食管癌、胰腺癌. 在这些肿瘤中过表达miR-375可抑制靶基因, 如: 星形胶质细胞升高基因1、Janus激酶2、自噬相关蛋白7、胰岛素样生长因子1受体、3-磷酸肌醇依赖性蛋白激酶1、YWHAZ以及YES相关蛋白1的表达从而抑制肿瘤的恶性表型. 此外研究还发现组织或血清中的miR-375可作为消化系肿瘤诊断和预后的生物标志物. 因此, miR-375在消化系统肿瘤的发生和发展过程中发挥了重要的作用, 是潜在的肿瘤药物开发的新靶点, 监测miR-375的表达水平可能有助于消化系肿瘤的早期诊断和预后判断.
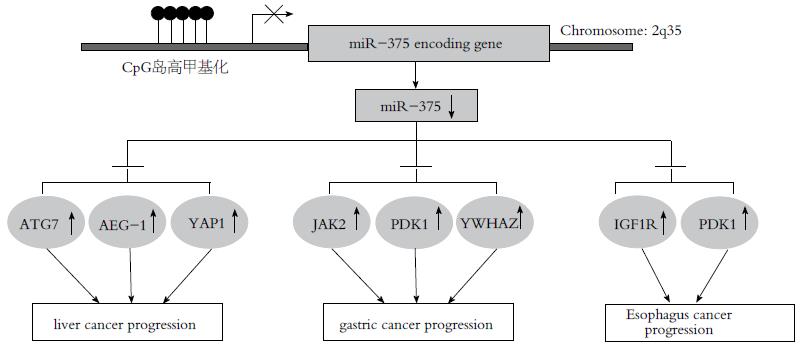
核心提示: 目前关于消化系肿瘤发生发展的分子机制仍不十分清楚. DNA高甲基化导致miR-375在众多常见的消化系肿瘤中均呈显著低表达. miR-375通过抑制星形胶质细胞升高基因1(astrocyte elevated gene-1)、Janus激酶2(janus kinase 2)、胰岛素样生长因子1受体(insulin-like growth factor 1 receptor)、3-磷酸肌醇依赖性蛋白激酶1(3-phosphoinositide-dependent protein kinase 1)、14-3-3Z以及YES相关蛋白1(Yes-associated protein 1)等重要癌基因发挥抑癌作用. 因此, 高甲基化导致抑癌基因miR-375低表达引起上述癌基因的异常激活可能是消化系肿瘤发生发展共同机制之一.
引文著录: 颜俊伟, 廖家智, 林菊生, 何星星. miR-375在消化系肿瘤中的研究进展. 世界华人消化杂志 2014; 22(5): 654-660
Revised: December 19, 2013
Accepted: December 27, 2013
Published online: February 18, 2014
MicroRNAs (miRNAs) are a group of small non-coding RNAs that regulate gene expression post-transcriptionally. A large body of evidence has indicated that dysregulation of miRNAs is an important hallmark of cancer. MiRNAs modulate malignant phenotypes of cancer by repressing many critical oncogenes or tumor suppressors. MiR-375 was firstly identified in pancreatic beta-cells and it can regulate insulin secretion and pancreatic development. Further studies found that miR-375 is significantly downregulated in multiple types of tumors, especially digestive system tumors, such as hepatocellular carcinoma, gastric cancer, esophageal cancer, and pancreatic cancer. Overexpression of miR-375 represses target genes, such as AEG-1, JAK2, ATG7, IGF1R, PDK1, 14-3-3Z and YAP1, and thereby inhibits malignant properties of cancer. It is also found that miR-375 in tissues or circulation could be used as a biomarker for diagnosis or prognosis prediction in digestive system tumors. Since miR-375 play an important role in the initiation and progression of digestive system tumors, it can become a novel therapeutic target. Monitoring the levels of miR-375 may contribute to the early diagnosis and prognosis prediction.
- Citation: Yan JW, Liao JZ, Lin JS, He XX. Roles of miR-375 in digestive tumors. Shijie Huaren Xiaohua Zazhi 2014; 22(5): 654-660
- URL: https://www.wjgnet.com/1009-3079/full/v22/i5/654.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i5.654
MicroRNA(miRNAs)是长度约为22个碱基的单链非编码RNA分子. MiRNA基因经RNA聚合酶Ⅱ转录后, 经核糖核酸酶Ⅲ(RNase Ⅲ)Drosha和Dicer酶分别在核内和核外剪切加工形成成熟的miRNA分子[1]. MiRNA与诱导沉默复合物(RNA-induced silencing complex, RISC)在胞浆中结合后, 通过与靶mRNA的3'非翻译区的互补序列结合导致翻译抑制或mRNA的降解, 从而抑制靶基因的表达[2]. 据估计miRNA基因调控多达30%的所有蛋白质编码基因[3]. MiRNA通过调控靶基因参与肿瘤细胞的分化、 增殖、存活、凋亡和转移[4-6]. MiR-375首先在胰腺中被发现并调节胰岛素的分泌以及参与胰岛细胞的发育和生长[7-10]. 随后的全基因组miRNA表达谱的研究显示, miR-375广泛存在于各种组织或器官中并在多种肿瘤特别是消化系统肿瘤如肝癌、食管癌、胃癌、胰腺癌中均显著下调[11-16]. 目前已经清楚地知道miR-375在上述这些肿瘤中发挥了重要的抑癌作用, miR-375很有可能成为未来肿瘤治疗的新型靶点以及作为重要的早期诊断和预后判断的肿瘤标志物. 以下总结了miR-375在消化系肿瘤中的抑癌机制以及其作为肿瘤治疗靶点的潜力和作为诊断和预后标志物的前景.
遗传学分析表明人miR-375基因位于2号染色体长臂2区3带, Cryba2基因和Ccdc108基因之间, 因此属于基因间型的miRNA[17]. 该染色体区域在人和小鼠之间具有较高的保守性, Avnit-Sagi等[18]通过对miR-375上游启动子中人和小鼠的保守序列分析发现了重要的转录起始和调控元件如:TATA盒和E盒. 前者是DNA聚合酶Ⅱ的结合位点, 后者是转录因子的结合位点. 这些证据表明miR-375拥有独立的启动子并受转录调控信号的调节. 进一步研究证明miR-375表达受转录因子如: PDX/NeuroD1[19]、ASH1[20]、ERα[21], CTCF[21], IL-13[22]以及糖代谢调节信号cAMP[23]的调控. 更重要的是, 研究还发现miR-375启动子区域存在高频率的CpG岛证明miR-375表达受甲基化的调控, 而miR-375启动子区域的高甲基化是miR-375在消化系肿瘤中低表达的重要原因[21,24-27]. 成熟的miR-375为长22个碱基的单链RNA分子, 碱基序列为UUUGUUCGUUCGGCUCGCGUGA. miR-375在胞浆内加工成熟后与RNA诱导沉默复合物(RNA-induced silencing complex, RISC)结合, 该复合物通过miR-375的碱基序列识别众多mRNA分子导致靶mRNA的降解或抑制翻译过程, 从而调控基因的表达. 研究发现miR-375通过靶向抑制不同的促肿瘤相关基因可抑制众多类型肿瘤特别是消化系肿瘤的生长[11,15,27-30]. 因此, 高甲基化导致的miR-375低表达是消化系肿瘤发生发展的重要原因之一.
大量证据表明miR-375在消化系肿瘤中显著下调, miR-375启动子区域高甲基化是miR-375下调的主要原因[24,25,27,28]. MiR-375通过靶向抑制许多重要的靶基因如: 星形胶质细胞升高基因(astrocyte elevated gene-1, AEG-1)、PDK1、YAP1等抑制消化系肿瘤的恶性表型(图1).
He等[11]应用miRNA芯片和TaqMan qRT-PCR技术发现miR-375在肝癌细胞和肝癌组织中的表达都是显著下调的, 并且在原发性肝癌组织中miR-375和AEG-1的表达水平呈现负相关. AEG-1是重要的癌基因在肝癌中表达上调并参与到肿瘤进展的各个方面包括转化, 逃避凋亡、侵袭、转移以及药物的耐药[31]. 研究证实AEG-1是miR-375的一个重要靶基因, 而miR-375表达下调可能是AEG-1在肝癌中表达上调的原因之一[11]. 进一步研究发现MiR-375通过靶向抑制AEG-1抑制了肝癌细胞的生长、侵袭, 诱导肝癌细胞G1期阻滞和细胞凋亡[11]. 此外, miR-375还可抑制缺氧诱导的细胞自噬从而影响肝癌细胞在缺氧条件下生存[32]. 缺氧发生时细胞激活自噬作为一种保护机制, 使细胞分解细胞器和蛋白质以维持生存所必需的能量和物质供应. MiR-375可抑制LC3I转化为LC3II, 从而抑制自噬体的形成, 后者可与溶酶体融合后被降解和回收利用因此是自噬的关键步骤. 自噬相关蛋白7(autophagy-related protein 7, ATG7)被发现是miR-375的直接靶基因. ATG7介导其他ATGs分子的连接从而促进自噬的激活[33]. 在肝癌细胞中过表达miR-375或者抑制ATG7的表达均可抑制肿瘤细胞在低氧状态下对损伤线粒体的清除, 增加线粒体凋亡相关蛋白如细胞色素C的释放, 从而抑制肝癌细胞的活性[32]. 这些发现阐述了miR-375新的抑癌机制: miR-375通过抑制在缺氧等应激条件下保护性自噬的发生影响肝癌细胞的生存. 研究发现自噬是肿瘤耐药的重要机制之一[34], 而恶性肿瘤特别是肝癌长期处于缺氧的微环境中, 这提示我们miR-375的替代治疗或联合用药可能具有高效的治疗潜能. Liu等[35]的研究还发现miR-375通过靶向YES相关蛋白1(Yes-associated protein 1, YAP1)抑制了肝癌细胞的侵袭和扩散.
MiR-375在胃癌组织中呈低表达并发挥了重要的抑癌作用. Ding等[12]发现miR-375在胃癌中显著下调, 并通过靶向抑制Janus激酶2(janus kinase 2, JAK2)抑制胃癌细胞的增殖. JAK2是Janus非受体酪氨酸激酶家族成员其表达水平与miR-375在胃癌组织中呈负相关. 利用酪氨酸磷酸化抑制剂AG490或RNA干扰抑制JAK2后胃癌细胞的生长受到抑制而过表达JAK2则抵消了miR-375的生长抑制作用. Tsukamoto等[28]进一步证实了miR-375在胃癌中的抑癌作用并发现两个新的靶基因: 一是3-磷酸肌醇依赖性蛋白激酶1(3-phosphoinositide-dependent protein kinase 1, PDK1或PDPK1), 可激活蛋白激酶Akt及其下游的信号通路[36,37]; 另一个是YWHAZ(也称14-3-3Z), 属于高度保守的14-3-3家族的结合蛋白参与有丝分裂、细胞周期和细胞凋亡的调控[38]. 干扰YWHAZ和PDK1均可诱导胃癌细胞Caspase的激活, 从而启动凋亡信号[28].
针对食管癌和癌旁组织的miRNA芯片结果发现: 在众多下调的miRNA中miR-375下调最为明显, 特别是在食管鳞状细胞癌中[39]. Kong等[27]发现miR-375靶向胰岛素样生长因子1受体(insulin-like growth factor 1 receptor, IGF1R)抑制食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)的细胞的增殖, 克隆形成及转移能力. 胰岛素样生长因子1(Insulin-like growth factor 1, IGF-1)可与IGF1R结合激活PI3K/Akt信号通路. 此外, Li等[25]也证实PDK1是miR-375的直接靶基因. 因此, 可以推测miR-375是PI3K/Akt信号通路的一个重要调节因子. 在肿瘤发生过程中miR-375下调导致PI3K/Akt信号通路的异常激活, 从而导致肿瘤的发生发展.
Bloomston等[13]发现miR-375在正常胰腺组织、慢性胰腺炎、胰腺癌中呈逐渐下降的趋势. Bhatti等[40]检测了胰腺导管细胞癌(pancreatic ductal adenocarcinoma, PDAC)与癌旁组织中miR-375的表达水平发现miR-375在PDAC中明显下调. Zhou等[29]进一步证实上调miR-375可抑制胰腺癌细胞的增殖, 促进癌细胞阻滞在G0期并诱导细胞凋亡. 此外, Faltejskova等[41]发现结肠癌组织中miR-375的表达明显低于癌旁组织, 上调miR-375可抑制结肠细胞的生长并抑制细胞从G1期向S期转换. 虽然研究发现miR-375在胰腺癌和结肠癌具有抑癌作用, 但具体的分子机制还需进一步阐明.
MiR-375不仅在消化系肿瘤中显著低表达而且是消化系肿瘤的重要抑癌基因之一, 因此进一步探索miR-375在临床方面的应用潜力具有重要的现实意义. MiRNA在肿瘤中的表达谱差异, 使我们可以将miRNA作为诊断肿瘤和预后判断的标志物[42,43]. MiR-375在消化系肿瘤中显著低表达表明miR-375可能作为重要的分子标志物区分消化系肿瘤. Wang等[44]发现联合miR-375、miR-424和miR-92a 3个miRNA可准确的区分大肠标本中的腺瘤和高级别上皮内瘤变. 研究发现血清miRNA可在循环中稳定存在是理想分子标志物[45,46]. Li等[47]发现血清miR-25、miR-375和let-7f可用于区分HBV阳性肝癌和健康对照人群. 许多研究还发现miR-375在消化系肿瘤的预后判断方面也具有很大的潜力(表1). 值得注意的是, miR-375在众多的消化系统肿瘤中表达均下调这可能暗示miR-375的低表达不是某一肿瘤特异性而是一个广谱的分子标志物, 因此联合miR-375与其他的特异性的miRNA分子标志物可能具有更高的特异性和灵敏度.
| 肿瘤类型 | miRNA | 来源 | miR-375水平 | 预后 | 参考文献 |
| 食管鳞状细胞癌 | miR-21, miR-375 | 血浆 | 下调 | 差 | [51] |
| 食管鳞状细胞癌 | miR-375 | 组织 | 下调 | 差 | [52] |
| 食管腺癌 | miR-21, miR-375 | 组织 | 下调 | 差 | [39] |
| 胃癌 | miR-375/miR-142-5p | 组织 | 下调 | 差 | [53] |
未来miRNA的替代或拮抗疗法可能成为疾病治疗特别是抗肿瘤治疗重要方法之一[48,49]. 大量的证据表明miR-375在消化系肿瘤中显著下调, 体内和体外实验均证明miR-375可显著抑制肿瘤的生长, 这表明miR-375可作为肿瘤治疗的分子靶点, 具有重要的治疗价值. 实验证明胆固醇修饰的miR-375具有良好的稳定性可不依靠其他载体高效率的进入细胞内发挥作用. 将胆固醇修饰的miR-375注入到裸鼠移植瘤内明显抑制了肿瘤的生长[11]. 此外, 通过慢病毒介导miR-375过表达能抑制肝癌细胞自噬, 影响肝癌细胞的生存从而减缓小鼠肝癌移植瘤的生长[32]. miR-375的过表达真核表达质粒在转染试剂的协助下, 导入胃癌移植瘤内显著抑制了胃癌细胞的生长[12]. 稳定转染miR-375前体食管癌细胞的裸鼠成瘤能力明显低于空白对照组[27]. 这些证据表明miR-375在体内和体外都具有良好的抑癌作用, miR-375替代治疗肿瘤具有广阔的应用前景. 未来针对miR-375的治疗探索, 我们应该着眼于开发出新型的miRNA携带载体. 新型的miRNA携带载体必须保证合成RNA在体内稳定性高, 肿瘤靶向特异性强, 药物作用时间持久, 药物不良反应低. 而纳米技术很可能成为这类新型miRNA携带载体中的一员[50]. 通过纳米材料携带miRNA分子并偶联肝脏组织或肝癌细胞特异性的靶向分子如叶酸或转铁蛋白等可高效的将miRNA分子导向靶器官并被胞吞进入细胞内部发挥抗肿瘤作用.
MiRNAs为癌症研究开辟了一个新的领域. 到目前为止, miR-375已被证实在消化系肿瘤中下调并作为一个重要的抑癌基因. 虽然已经鉴别出许多重要的靶基因但miR-375参与的信号通路仍未完全阐明, 利用生物信息学的方法分析miR-375靶基因的调控网络有助于全面解析miR-375的功能. MiR-375在癌症的诊断和治疗方面具有很大的潜力, 未来我们的研究工作应探索miR-375的临床应用潜力, 更好的实现基础医学向临床医疗的转化.
肿瘤的早期诊断和治疗均缺乏有效的手段和方法, 所以肿瘤学研究的重心也是难点就是寻找合适生物分子标志物和有效分子治疗靶点. MicroRNA是一类内源性的具有调控基因表达功能的微小RNA分子其异常表达与肿瘤的发生发展密切相关. MicroRNA是较为理想的分子标志物, 其替代或拮抗治疗很可能成为未来肿瘤治疗的新方法.
莫发荣, 副教授, 广西医科大学组织学与胚胎学教研室
每年都有大量肿瘤相关的microRNA被发现和证实, 研究microRNA调控网络、血清microRNA作为肿瘤分子标志物的应用前景以及microRNA相关药物的开发是microRNA研究的热点. MicroRNA携带载体的开发是microRNA药物走向临床治疗的瓶颈.
Poy等证实miR-375基因敲除小鼠导致高血糖和胰岛素抵抗; Biton报道miR-375参与肠道免疫; Wang等发现miR-375参与肺泡上皮分化以及表面活性物质的分泌.
miR-375与多种肿瘤密切相关但与消化系肿瘤的关系尤为突出, 几乎参与所有常见消化系器官恶性肿瘤的进展并在这些肿瘤中显著低表达. 本文重点概括总结了miR-375与消化系肿瘤的密切联系认为miR-375不管是在消化系肿瘤诊断还是治疗方面都具有很高的潜力.
未来可利用miR-375的类似物与具有靶向功能的新型携带载体偶联后通过局部注射或全身应用的方法治疗消化系肿瘤.
本文综述miR-375的抑癌机制以及其作为肿瘤治疗靶点的潜力和作为诊断和预后标志物的前景, 具有一定的可读性, 可为以后的研究提供思路.
编辑: 田滢 电编:鲁亚静
| 1. | Winter J, Jung S, Keller S, Gregory RI, Diederichs S. Many roads to maturity: microRNA biogenesis pathways and their regulation. Nat Cell Biol. 2009;11:228-234. [PubMed] [DOI] |
| 2. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] [DOI] |
| 3. | Lewis BP, Burge CB, Bartel DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets. Cell. 2005;120:15-20. [PubMed] [DOI] |
| 4. | Baranwal S, Alahari SK. miRNA control of tumor cell invasion and metastasis. Int J Cancer. 2010;126:1283-1290. [PubMed] [DOI] |
| 5. | Lynam-Lennon N, Maher SG, Reynolds JV. The roles of microRNA in cancer and apoptosis. Biol Rev Camb Philos Soc. 2009;84:55-71. [PubMed] [DOI] |
| 6. | Garzon R, Fabbri M, Cimmino A, Calin GA, Croce CM. MicroRNA expression and function in cancer. Trends Mol Med. 2006;12:580-587. [PubMed] [DOI] |
| 7. | Poy MN, Eliasson L, Krutzfeldt J, Kuwajima S, Ma X, Macdonald PE, Pfeffer S, Tuschl T, Rajewsky N, Rorsman P. A pancreatic islet-specific microRNA regulates insulin secretion. Nature. 2004;432:226-230. [PubMed] [DOI] |
| 8. | El Ouaamari A, Baroukh N, Martens GA, Lebrun P, Pipeleers D, van Obberghen E. miR-375 targets 3'-phosphoinositide-dependent protein kinase-1 and regulates glucose-induced biological responses in pancreatic beta-cells. Diabetes. 2008;57:2708-2717. [PubMed] [DOI] |
| 9. | Poy MN, Hausser J, Trajkovski M, Braun M, Collins S, Rorsman P, Zavolan M, Stoffel M. miR-375 maintains normal pancreatic alpha- and beta-cell mass. Proc Natl Acad Sci U S A. 2009;106:5813-5818. [PubMed] [DOI] |
| 10. | Kloosterman WP, Lagendijk AK, Ketting RF, Moulton JD, Plasterk RH. Targeted inhibition of miRNA maturation with morpholinos reveals a role for miR-375 in pancreatic islet development. PLoS Biol. 2007;5:e203. [PubMed] [DOI] |
| 11. | He XX, Chang Y, Meng FY, Wang MY, Xie QH, Tang F, Li PY, Song YH, Lin JS. MicroRNA-375 targets AEG-1 in hepatocellular carcinoma and suppresses liver cancer cell growth in vitro and in vivo. Oncogene. 2012;31:3357-3369. [PubMed] [DOI] |
| 12. | Ding L, Xu Y, Zhang W, Deng Y, Si M, Du Y, Yao H, Liu X, Ke Y, Si J. MiR-375 frequently downregulated in gastric cancer inhibits cell proliferation by targeting JAK2. Cell Res. 2010;20:784-793. [PubMed] [DOI] |
| 13. | Bloomston M, Frankel WL, Petrocca F, Volinia S, Alder H, Hagan JP, Liu CG, Bhatt D, Taccioli C, Croce CM. MicroRNA expression patterns to differentiate pancreatic adenocarcinoma from normal pancreas and chronic pancreatitis. JAMA. 2007;297:1901-1908. [PubMed] [DOI] |
| 14. | Hui AB, Lenarduzzi M, Krushel T, Waldron L, Pintilie M, Shi W, Perez-Ordonez B, Jurisica I, O'Sullivan B, Waldron J. Comprehensive MicroRNA profiling for head and neck squamous cell carcinomas. Clin Cancer Res. 2010;16:1129-1139. [PubMed] [DOI] |
| 15. | Wang F, Li Y, Zhou J, Xu J, Peng C, Ye F, Shen Y, Lu W, Wan X, Xie X. miR-375 is down-regulated in squamous cervical cancer and inhibits cell migration and invasion via targeting transcription factor SP1. Am J Pathol. 2011;179:2580-2588. [PubMed] [DOI] |
| 16. | Chang C, Shi H, Wang C, Wang J, Geng N, Jiang X, Wang X. Correlation of microRNA-375 downregulation with unfavorable clinical outcome of patients with glioma. Neurosci Lett. 2012;531:204-208. [PubMed] [DOI] |
| 17. | Baroukh NN, Van Obberghen E. Function of microRNA-375 and microRNA-124a in pancreas and brain. FEBS J. 2009;276:6509-6521. [PubMed] [DOI] |
| 18. | Avnit-Sagi T, Kantorovich L, Kredo-Russo S, Hornstein E, Walker MD. The promoter of the pri-miR-375 gene directs expression selectively to the endocrine pancreas. PLoS One. 2009;4:e5033. [PubMed] [DOI] |
| 19. | Keller DM, McWeeney S, Arsenlis A, Drouin J, Wright CV, Wang H, Wollheim CB, White P, Kaestner KH, Goodman RH. Characterization of pancreatic transcription factor Pdx-1 binding sites using promoter microarray and serial analysis of chromatin occupancy. J Biol Chem. 2007;282:32084-32092. [PubMed] [DOI] |
| 20. | Nishikawa E, Osada H, Okazaki Y, Arima C, Tomida S, Tatematsu Y, Taguchi A, Shimada Y, Yanagisawa K, Yatabe Y. miR-375 is activated by ASH1 and inhibits YAP1 in a lineage-dependent manner in lung cancer. Cancer Res. 2011;71:6165-6173. [PubMed] [DOI] |
| 21. | de Souza Rocha Simonini P, Breiling A, Gupta N, Malekpour M, Youns M, Omranipour R, Malekpour F, Volinia S, Croce CM, Najmabadi H. Epigenetically deregulated microRNA-375 is involved in a positive feedback loop with estrogen receptor alpha in breast cancer cells. Cancer Res. 2010;70:9175-9184. [PubMed] [DOI] |
| 22. | Lu TX, Lim EJ, Wen T, Plassard AJ, Hogan SP, Martin LJ, Aronow BJ, Rothenberg ME. MiR-375 is downregulated in epithelial cells after IL-13 stimulation and regulates an IL-13-induced epithelial transcriptome. Mucosal Immunol. 2012;5:388-396. [PubMed] [DOI] |
| 23. | Keller DM, Clark EA, Goodman RH. Regulation of microRNA-375 by cAMP in pancreatic β-cells. Mol Endocrinol. 2012;26:989-999. [PubMed] [DOI] |
| 24. | Furuta M, Kozaki KI, Tanaka S, Arii S, Imoto I, Inazawa J. miR-124 and miR-203 are epigenetically silenced tumor-suppressive microRNAs in hepatocellular carcinoma. Carcinogenesis. 2010;31:766-776. [PubMed] [DOI] |
| 25. | Li X, Lin R, Li J. Epigenetic silencing of microRNA-375 regulates PDK1 expression in esophageal cancer. Dig Dis Sci. 2011;56:2849-2856. [PubMed] [DOI] |
| 26. | Mazar J, DeBlasio D, Govindarajan SS, Zhang S, Perera RJ. Epigenetic regulation of microRNA-375 and its role in melanoma development in humans. FEBS Lett. 2011;585:2467-2476. [PubMed] [DOI] |
| 27. | Kong KL, Kwong DL, Chan TH, Law SY, Chen L, Li Y, Qin YR, Guan XY. MicroRNA-375 inhibits tumour growth and metastasis in oesophageal squamous cell carcinoma through repressing insulin-like growth factor 1 receptor. Gut. 2012;61:33-42. [PubMed] [DOI] |
| 28. | Tsukamoto Y, Nakada C, Noguchi T, Tanigawa M, Nguyen LT, Uchida T, Hijiya N, Matsuura K, Fujioka T, Seto M. MicroRNA-375 is downregulated in gastric carcinomas and regulates cell survival by targeting PDK1 and 14-3-3zeta. Cancer Res. 2010;70:2339-2349. [PubMed] [DOI] |
| 29. | Zhou J, Song S, Cen J, Zhu D, Li D, Zhang Z. MicroRNA-375 is downregulated in pancreatic cancer and inhibits cell proliferation in vitro. Oncol Res. 2012;20:197-203. [PubMed] |
| 30. | Nohata N, Hanazawa T, Kikkawa N, Mutallip M, Sakurai D, Fujimura L, Kawakami K, Chiyomaru T, Yoshino H, Enokida H. Tumor suppressive microRNA-375 regulates oncogene AEG-1/MTDH in head and neck squamous cell carcinoma (HNSCC). J Hum Genet. 2011;56:595-601. [PubMed] [DOI] |
| 31. | Hu G, Wei Y, Kang Y. The multifaceted role of MTDH/AEG-1 in cancer progression. Clin Cancer Res. 2009;15:5615-5620. [PubMed] [DOI] |
| 32. | Chang Y, Yan W, He X, Zhang L, Li C, Huang H, Nace G, Geller DA, Lin J, Tsung A. miR-375 inhibits autophagy and reduces viability of hepatocellular carcinoma cells under hypoxic conditions. Gastroenterology. 2012;143:177-87.e8. [PubMed] [DOI] |
| 33. | Komatsu M, Waguri S, Ueno T, Iwata J, Murata S, Tanida I, Ezaki J, Mizushima N, Ohsumi Y, Uchiyama Y. Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice. J Cell Biol. 2005;169:425-434. [PubMed] [DOI] |
| 34. | Kondo Y, Kanzawa T, Sawaya R, Kondo S. The role of autophagy in cancer development and response to therapy. Nat Rev Cancer. 2005;5:726-734. [PubMed] [DOI] |
| 35. | Liu AM, Poon RT, Luk JM. MicroRNA-375 targets Hippo-signaling effector YAP in liver cancer and inhibits tumor properties. Biochem Biophys Res Commun. 2010;394:623-627. [PubMed] [DOI] |
| 36. | Alessi DR, James SR, Downes CP, Holmes AB, Gaffney PR, Reese CB, Cohen P. Characterization of a 3-phosphoinositide-dependent protein kinase which phosphorylates and activates protein kinase Balpha. Curr Biol. 1997;7:261-269. [PubMed] |
| 37. | Raimondi C, Falasca M. Targeting PDK1 in cancer. Curr Med Chem. 2011;18:2763-2769. [PubMed] |
| 38. | Nishimura Y, Komatsu S, Ichikawa D, Nagata H, Hirajima S, Takeshita H, Kawaguchi T, Arita T, Konishi H, Kashimoto K. Overexpression of YWHAZ relates to tumor cell proliferation and malignant outcome of gastric carcinoma. Br J Cancer. 2013;108:1324-1331. [PubMed] [DOI] |
| 39. | Mathé EA, Nguyen GH, Bowman ED, Zhao Y, Budhu A, Schetter AJ, Braun R, Reimers M, Kumamoto K, Hughes D. MicroRNA expression in squamous cell carcinoma and adenocarcinoma of the esophagus: associations with survival. Clin Cancer Res. 2009;15:6192-6200. [PubMed] [DOI] |
| 40. | Bhatti I, Lee A, James V, Hall RI, Lund JN, Tufarelli C, Lobo DN, Larvin M. Knockdown of microRNA-21 inhibits proliferation and increases cell death by targeting programmed cell death 4 (PDCD4) in pancreatic ductal adenocarcinoma. J Gastrointest Surg. 2011;15:199-208. [PubMed] [DOI] |
| 41. | Faltejskova P, Svoboda M, Srutova K, Mlcochova J, Besse A, Nekvindova J, Radova L, Fabian P, Slaba K, Kiss I. Identification and functional screening of microRNAs highly deregulated in colorectal cancer. J Cell Mol Med. 2012;16:2655-2666. [PubMed] [DOI] |
| 42. | Calin GA, Croce CM. MicroRNA signatures in human cancers. Nat Rev Cancer. 2006;6:857-866. [PubMed] [DOI] |
| 43. | Cho WC. MicroRNAs: potential biomarkers for cancer diagnosis, prognosis and targets for therapy. Int J Biochem Cell Biol. 2010;42:1273-1281. [PubMed] [DOI] |
| 44. | Wang S, Wang L, Bayaxi N, Li J, Verhaegh W, Janevski A, Varadan V, Ren Y, Merkle D, Meng X. A microRNA panel to discriminate carcinomas from high-grade intraepithelial neoplasms in colonoscopy biopsy tissue. Gut. 2013;62:280-289. [PubMed] [DOI] |
| 45. | Turchinovich A, Weiz L, Langheinz A, Burwinkel B. Characterization of extracellular circulating microRNA. Nucleic Acids Res. 2011;39:7223-7233. [PubMed] [DOI] |
| 46. | Arroyo JD, Chevillet JR, Kroh EM, Ruf IK, Pritchard CC, Gibson DF, Mitchell PS, Bennett CF, Pogosova-Agadjanyan EL, Stirewalt DL. Argonaute2 complexes carry a population of circulating microRNAs independent of vesicles in human plasma. Proc Natl Acad Sci U S A. 2011;108:5003-5008. [PubMed] [DOI] |
| 47. | Li LM, Hu ZB, Zhou ZX, Chen X, Liu FY, Zhang JF, Shen HB, Zhang CY, Zen K. Serum microRNA profiles serve as novel biomarkers for HBV infection and diagnosis of HBV-positive hepatocarcinoma. Cancer Res. 2010;70:9798-9807. [PubMed] [DOI] |
| 48. | Kong YW, Ferland-McCollough D, Jackson TJ, Bushell M. microRNAs in cancer management. Lancet Oncol. 2012;13:e249-e258. [PubMed] [DOI] |
| 49. | Bader AG, Brown D, Winkler M. The promise of microRNA replacement therapy. Cancer Res. 2010;70:7027-7030. [PubMed] [DOI] |
| 50. | Hao L, Patel PC, Alhasan AH, Giljohann DA, Mirkin CA. Nucleic acid-gold nanoparticle conjugates as mimics of microRNA. Small. 2011;7:3158-3162. [PubMed] [DOI] |
| 51. | Komatsu S, Ichikawa D, Takeshita H, Konishi H, Nagata H, Hirajima S, Kawaguchi T, Arita T, Shiozaki A, Fujiwara H. Prognostic impact of circulating miR-21 and miR-375 in plasma of patients with esophageal squamous cell carcinoma. Expert Opin Biol Ther. 2012;12 Suppl 1:S53-S59. [PubMed] [DOI] |