修回日期: 2013-12-05
接受日期: 2013-12-12
在线出版日期: 2014-02-08
目的: 观察肝内型门脉高压大鼠门静脉超微结构及生物力学特性, 为进一步探索门脉高压病理机制提供实验依据.
方法: 四氯化碳皮下注射诱导肝内型门静脉高压大鼠模型, 生物力学技术测定门脉高压形成中门静脉在体直径、纵向拉伸应力-应变曲线及残余应力大小, 透视电镜下观察门静脉超微结构.
结果: 与正常组大鼠相比, 门脉高压组大鼠门静脉体外直径显著增粗(1.53 mm±0.28 mm vs 1.14 mm±0.17 mm, P<0.01); 门静脉超微结构发生显著改变; 纵向拉伸应力-应变曲线较陡峭, 整个拉伸应变过程耗时短, 50%应变时应力是1.04 N±0.13 N, 显著大于正常组(0.51 N±0.08 N, P<0.01); 门静脉张开角的弧度及组内波动幅度较正常组显著增大(110.34度±8.09度 vs 79.93度±2.44度, P<0.01).
结论: 肝内型门脉高压大鼠门静脉管壁存在异常重构, 其顺应性下降, 门静脉呈周向和轴向高应力的生物力学特性改变.
核心提示: 肝内型门脉高压时, 门静脉超微结构存在异常重构, 如门静脉管壁内皮细胞基底膜不完整, 细胞间隙连接疏松; 平滑肌细胞减少, 周围胶原纤维增多, 胞质肌丝少而紊乱, 部分线粒体嵴断裂、空泡化; 外膜可见大量胶原纤维及疏松结缔组织增生, 管壁顺应性下降, 门静脉轴向及周向处于高应力状态.
引文著录: 文彬, 邓鑫, 陈然, 彭佩纯. 肝内型门脉高压大鼠门静脉超微结构及生物力学特性的改变. 世界华人消化杂志 2014; 22(4): 541-545
Revised: December 5, 2013
Accepted: December 12, 2013
Published online: February 8, 2014
AIM: To observe the ultrastructure and biomechanical properties of the portal vein in rats with intrahepatic portal hypertension to provide an experimental basis for further exploring the pathogenesis of portal hypertension.
METHODS: Subcutaneous injection of carbon tetrachloride was performed to induce intrahepatic portal hypertension in rats. Biomechanical methods were used to determine portal vein diameter, longitudinal tensile stress-strain curve and the size of the residual stress during portal hypertension formation. Portal vein ultrastructure was observed by electron microscopy.
RESULTS: Compared with normal rats, the portal vein diameter was significantly greater in rats with portal hypertension (1.53 ± 0.28 mm vs 1.14 ± 0.17 mm, P < 0.01); portal vein ultrastructure changed significantly; longitudinal tensile stress - strain curve was steeper; the time consumed for the whole process of tensile strain was shorter; the stress at 50% strain was significantly larger (1.04 ± 0.13 N vs 0.51 ± 0.08 N, P < 0.01); the opening angle of the portal vein and arc fluctuations increased significantly (110.34碍 ± 8.09碍 vs 79.93碍 ± 2.44碍, P < 0.01).
CONCLUSION: Rats with intrahepatic portal hypertension have abnormal portal vein wall remodeling, decreased portal vein compliance, and changes in circumferential and axial biomechanical characteristics.
- Citation: Wen B, Deng X, Chen R, Peng PC. Changes in ultrastructure and biomechanical properties of the portal vein in rats with intrahepatic portal hypertension. Shijie Huaren Xiaohua Zazhi 2014; 22(4): 541-545
- URL: https://www.wjgnet.com/1009-3079/full/v22/i4/541.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i4.541
目前, 国内外对门脉系统的血流动力学已作了广泛研究[1,2], 发现门脉高压时最突出的病理生理特征为门脉系统的高阻力、高压力、高流量及低外周阻力的全身高动力循环状态. 由于原有力学平衡遭打破, 门脉系统的生物力学发生了结构和功能改变已得到初步证实[3,4]. 但门静脉管壁重构、生物力学特性的改变与门脉高压相关性的研究尚未深入, 本实验拟对大鼠门静脉超微结构、纵向拉伸应力-应变及无载荷状态下残余应力的探讨, 对门静脉超微结构和顺应性进行测试评估, 旨在进一步从生物力学角度阐述门脉高压的病理机制.
♂SD大鼠, SPF级, 6-7周龄, 体质量160 g±20 g, 购自广西医科大学动物实验中心, 动物合格证: scxk桂2009-0002. 四氯化碳(CCl4), 购自天津富宇精细化工试剂厂产品. TY8000系列(50-5000 N)伺服控制拉力试验机. Image-Pro Plus6.0图像分析软件(Media Cybernetics公司). 纯丙酮(EPON812), H-7650型透射电子显微镜(日本日立公司).
1.2.1 分组和模型制备: 大鼠在适应性饲养1 wk后, 随机分为对照组(30只)和模型组(40只), 采用复合因素法造模[5], 造模组大鼠首次按0.5 mL/100 g腹部皮下注射(贝蒂斯橄榄油60%+ 40%CCl4)混合液, 以后每隔3日按0.3 mL/100 g体质量皮下注射, 每周2次, 150 mL/L乙醇为唯一饮料, 同时辅以20%猪油、0.5%胆固醇、79.5%玉米面混合饲料, 共计12 wk; 正常组则以普通饲料和纯净水喂养.
1.2.2 大鼠门静脉在体直径的测量: 造模成功后(正常组n = 30, 模型组n = 35), 水合氯醛以0.3 mL/100 g腹腔注射麻醉, 剖开腹腔, 逐层分离出门静脉, 将分离出的门静脉以记号笔标记两端, 平行置上刻度尺, 数码相机拍照, 所得数值输入计算机, Image-Pro Plus6.0图像分析软件测量门静脉段(胃冠状静脉分支点下游2 cm)在体的直径. 门静脉纵向拉伸试验、残余应力、超微结构的测定均在测量门静脉体外直径后随机抽取进行实验.
1.2.3 大鼠门静脉纵向拉伸试验: 逐层剥离出门静脉(正常组n = 12, 模型组n = 12), 沿其轴向主干两端剪下长度25 mm, 将门静脉两端夹在伺服控制拉力试验机的夹具上, 夹具间距为20 mm, 以5%/min应变率增加(5 mm/min)进行拉伸测试, 记录应变为50%及试样断裂时的应力, UTM107 WIN-XP测试软件描绘出应力-应变曲线. 实验前需要对每个试样反复加载卸载进行预调处理.
1.2.4 大鼠门静脉残余应力的测定: 所有操作均在25 ℃下进行, 取新鲜门静脉主干(正常组n = 12, 模型组n = 12), 移入剩有生理盐水的培养皿中, 沿其长轴连续横切, 得到厚度约为1 mm的血管环, 沿门静脉血管环径向剪开, 静置20 min左右, 数码相机拍照零应力状态血管环横切面图像(以门静脉环内壁中点为顶点, 沿两个断端的内壁作一连线, 所形成的夹角即为张开角), 计算机图文系统测量门静脉张开角, 以此代表门静脉零应力状态的变化.
1.2.5 大鼠门静脉超微结构测定: 取相同部位新鲜门静脉主干(正常组n = 6, 模型组n = 11), 切成大小约1 mm×1 mm×1 mm, 投入4 ℃预冷的4%戊二醛, 固定24 h, 再经1%四氧化锇固定2 h, 常规乙醇和丙酮脱水, 加丙酮-EPON812环氧树脂包埋, 修块及切片, 铀-铅染色, 透视电镜下观察门静脉管壁超微结构.
统计学处理 实验数据以mean±SD表示, 采用SPSS11.5统计软件行t检验和方差分析, 比较组间差异有无统计学意义, P<0.05为差异有统计学意义.
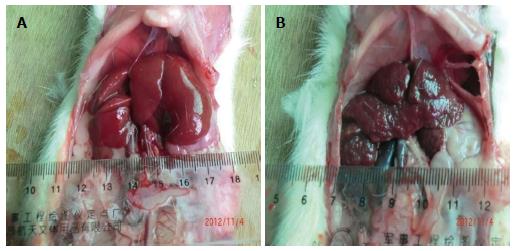
正常组大鼠实验期间无死亡, 模型组大鼠死亡5只, 模型成功率达87.5%. 与正常组大鼠相比, 门脉高压组大鼠门静脉管腔充盈, 体外直径显著增粗(1.53 mm±0.28 mm vs 1.14 mm±0.17 mm, P<0.01, 图1).
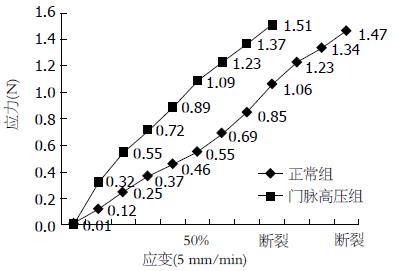
正常组大鼠门静脉以每分钟5%应变率增加(5 mm/min)进行拉伸过程中, 应变达50%时应力为0.51 N±0.08 N, 此时应力-应变曲线较平坦, 门静脉拉伸应变从50%到试样断裂过程中, 应力-应变曲线较前陡峭, 应力达1.47 N, 应变为96.46%时试样断裂. 门脉高压组大鼠门静脉以同样速率拉伸过程中, 应力-应变曲线始终陡峭, 门静脉拉伸应变达50%时应力为1.04 N±0.13 N, 当应力达到1.51 N、应变为95.67%时门静脉断裂, 试样拉伸应变耗时较正常组短, 在同等应变条件下, 门脉高压组的应力显著高于正常组(P<0.01)(图2).
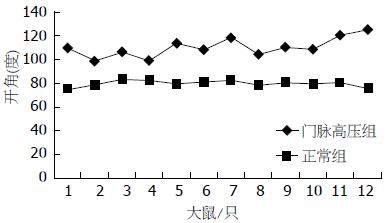
正常大鼠门静脉沿径向剪开后展开角呈小"c"形, 角度约75.4度至83.2度左右, 组内波动范围小; 门脉高压组试样切开后展开角呈大"C"形, 角度在98.7度至124.9度之间, 组内波动幅度较大. 对两组门静脉张开角均值行方差分析与t检验, 显示两组门静脉开角大小之间有统计学差异(P<0.01); 正常大鼠门静脉组内差异小, 门脉高压组组内差异大(P<0.01), 以均值为基数绘制门静脉张开角曲线, 正常组大鼠门静脉张开角图像基本呈一直线, 门脉高压组门静脉张开角图像较正常组大(图3).
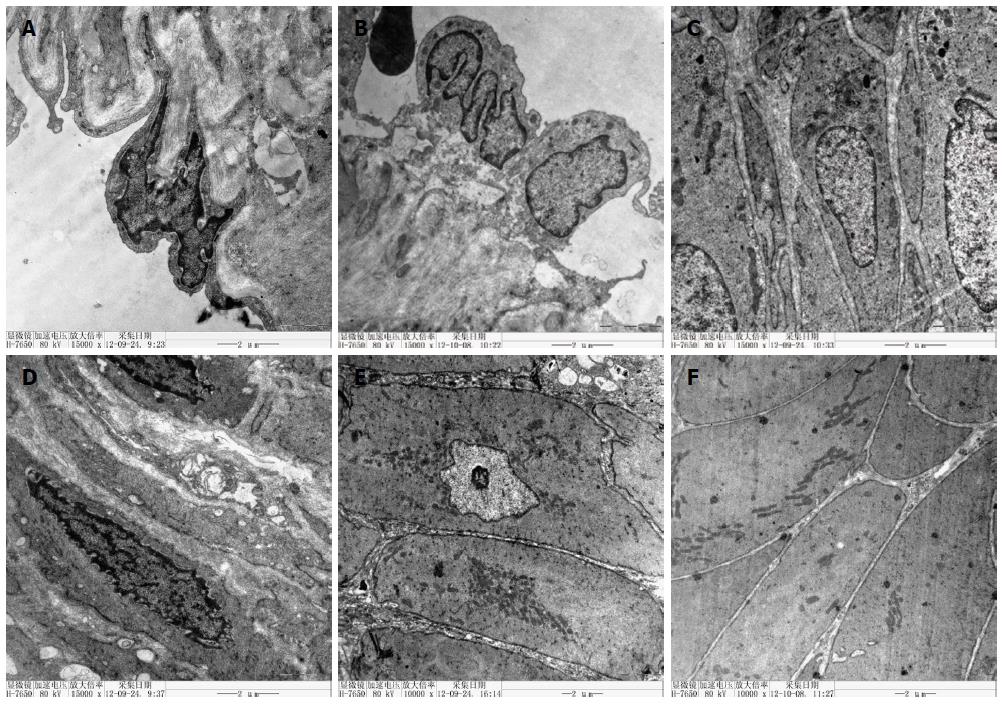
正常组大鼠门静脉内膜内皮细胞表面光滑, 基底膜完整, 细胞间隙连接紧密; 中膜层平滑肌细胞呈梭形, 排列成束, 胞质中可见肌丝; 外膜可见弹性纤维、胶原纤维及疏松结缔组织排列规则. 门脉高压组门静脉内皮细胞基底膜不完整, 细胞间隙连接疏松; 中膜层平滑肌细胞减少, 周围胶原纤维增多, 胞质中肌丝少而紊乱, 部分线粒体嵴断裂、空泡化; 外膜未见平滑肌细胞、弹性纤维, 可见大量胶原纤维及疏松结缔组织增生(图4).
肝硬化门脉高压症病理机制复杂, 其中一个显著特点就是全身高动力循环状态. 这种特殊的血流动力学改变势必影响门静脉的应力状态[6]. 顺应性是反应血管应力状态的重要指标之一, 血管管壁超微结构与之密切相关, 目前与管壁顺应性密切相关的组织学成分主要包含内皮细胞、平滑肌细胞、弹力纤维及胶原纤维. 研究发现血管在低应力时, 主要由管壁内皮细胞及平滑肌细胞承载[7,8], 高应力时则胶原纤维的拉伸起主要作用. 平滑肌细胞主要分为收缩和合成型两种, 收缩型平滑肌细胞胞质内肌丝丰富而细胞器较少, 合成型平滑肌细胞则是胞质内肌丝少, 细胞器丰富, 生理条件下两者处于动态平衡, 合成型占绝对优势时会影响血管的收缩功能, 使管壁趋于扩张. 但持续的管壁扩张, 血管力学会重新分布, 胶原纤维被拉伸, 由于胶原纤维比弹性纤维具备一定的强度和刚度, 因此门静脉管壁相对会变硬, 顺应性下降. 目前常用胶原纤维与弹性纤维含量比值来代表血管刚度, 比值越大则刚度越大, 反之血管弹性及顺应性越差[9]. 实验中通过透视电镜观察门静脉超微结构, 发现门脉高压时门静脉超微结构发生显著改变, 中膜平滑肌细胞及胞质肌丝减少, 胶原纤维相应增多, 平滑肌细胞处于合成型状态, 有利于门静脉管壁持续扩张; 另一方面门静脉管壁外膜中胶原纤维与弹性纤维比值增大, 无疑促进血管硬度增加、弹性下降. 因此我们推测门静脉平滑肌细胞转型及外膜胶原纤维与弹性纤维等微观结构成分失衡是门脉高压时门静脉持续扩张及管壁顺应性下降等生物力学改变的重要原因之一.
血管轴向拉伸是研究生物材料力学特性的重要方法, 可以反映生物材料的轴向力学特性, 与血管的顺应性显著相关. 顺应性是单位压力下血管容积改变, 涵盖周向应力和轴向应力, 是检测血管弹性功能重要指标[10]. 本研究显示正常组大鼠门静脉纵向拉伸应变达到50%时只需很小的力, 试样应力-应变曲线平坦, 试样拉伸应变可塑性强, 说明门静脉组织具有极好的弹性拉伸性能, 顺应性好; 门脉高压组门静脉拉伸应变为50%时应力较正常组大(P<0.01), 整个拉伸应变耗时较短, 血管组织容易达到自身弹性极限(断裂), 在相同应变下, 门脉高压组门静脉拉伸应力显著高于正常组. 结合门静脉超微结构改变, 我们认为门静脉异常重构及高轴向应力共同作用下, 门静脉管壁相对固有成分被破坏, 硬度增加, 顺应性下降. Cahill等[11]与Menon等[12]进一步研究发现应力在门静脉顺应性下降、硬度增加时对管壁的直接破坏力增强. 这与本实验结果中门静脉超微结构异常重构相符合, 血管壁的破坏则有助于门静脉血栓形成, 进一步加重肝脏的损害及门脉高压的维持.
血管的零应力状态并不是无载荷状态下的血管, 而是指血管环被径向切开, 将残余应力释放后的状态, 此时血管环会自动张开呈一定弧度, 我们称之为张开角[13]. 门静脉张开角代表门静脉的残余应力大小, 其意义在于可从力学角度反映血管组织重建程度、应力分布情况及周向力学特性[14]. 本实验基于此原理, 通过测量两组大鼠门静脉张开角来量化残余应力大小. 实验中正常组门静脉零应力状态下张开角较小, 组内波动幅度不大; 而门脉高压组门静脉张开角大, 组内波动范围差异大, 表明门脉高压组大鼠门静脉处于高周向应力状态下. 也有研究发现门脉高压时, 门脉高应力状态使门静脉内外壁应力分布不一致, 导致内外壁生长不均匀, 内壁细胞的生长速度大于外壁细胞的生长速度, 造成内壁周向应变大于外壁, 内壁的残余应力增大, 张开角相应增大[15]. 由此可知血管内部微观结构重排可引起残余应力的改变, 残余应力一旦改变势必影响承载对象-管壁组织细胞学的活性, 引起管壁结构成分和功能发生变化, 最终导致周向应力在血管壁的分布异常. 这种正反馈调节可能是门脉高压症并发恶性循环的原因之一.
总之, 本实验通过对门静脉超微结构及生物力学特性的研究, 结果表明肝内型门脉高压时, 门静脉超微结构存在异常重构、管壁顺应性下降, 门静脉轴向及周向处于高应力状态. 门静脉管壁这种重构及力学异常分布, 为我们从生物力学角度揭示门脉高压病理机制提供新思路; 同时对门静脉微观成分及顺应性的研究可以为人工血管移植提供力学依据, 提高血管移植成功率, 减少远期不良并发症.
门脉高压时门脉系统生物力学发生了显著改变, 据应力-生长法则, 应力环境的改变将导致应力-生长失衡, 门静脉管壁形态结构也随之发生改变, 因此研究门静脉管壁超微结构、力学特性与门脉高压症的相关性至关重要.
杨家和, 教授, 中国人民解放军第二军医大学附属东方肝胆外科医院综合治疗三科
生物力学是国内外研究新热点, 目前门脉系统的力学研究多集中于"血流动力学"研究, 对门静脉管壁超微结构、力学分布与门脉高压相关性研究尚未深入.
张宗棨, 汤松伟等在门脉高压兔的模型中, 认为门脉系统的低剪切应力与高周向应力状态参与了门脉高压症并发症发生的力学基础(肝前型门静脉高压兔门脉系统血管应力的研究). 贺细菊, 张兴华等对门静脉高压症猪离体状态的生物力学特性改变和几何性状的进行研究, 发现门脉高压时门静脉弹性模量随压力变大而增大, 顺应性随压力增大而下降(门静脉高压症猪门静脉的生物力学特性及其临床意义), 为临床血管移植提供了一定力学数据. 施斌, 朱樑等观察了大鼠肝内型门脉高压症形成中门静脉零应力状态及轴向拉伸时应力-伸长比的动态变化, 认为门脉高压时高压力、高流量的特殊血液动力学状态可引起门静脉力学特性(轴向和周向)的力学改变, 这些变化又可进一步加重门脉高压血液动力学异常及病理生理改变, 造成恶性循环.
本文从门静脉微观结构及力学异常分布等方面探讨门脉高压病理机制, 与传统侧重研究门脉系统"血流动力学"相比具有一定创新性.
探讨门静脉管壁超微结构及力学异常分布, 为我们从生物力学角度揭示门脉高压病理机制提供新思路; 同时为人工血管移植提供力学参考价值, 提高血管移植远期不良并发症.
本文进一步探讨了肝内型门脉高压大鼠门静脉生物力学特性及力学特点, 为后续治疗及血管移值创造条件, 证据充分, 引用合理, 研究具有一定新颖性.
编辑: 郭鹏 电编:闫晋利
| 1. | Zekanovic D, Ljubicic N, Boban M, Nikolic M, Delic-Brkljacic D, Gacina P, Klarin I, Turcinov J. Doppler ultrasound of hepatic and system hemodynamics in patients with alcoholic liver cirrhosis. Dig Dis Sci. 2010;55:458-466. [PubMed] [DOI] |
| 2. | 张 潭, 宇 雪豹, 秦 艳娟, 吴 小微, 范 文涛. 肝硬化患者门静脉血流动力学彩色多普勒超声检测分析. 中国中西医结合消化杂志. 2013;23:257-259. |
| 7. | Reneman RS, Arts T, Hoeks AP. Wall shear stress--an important determinant of endothelial cell function and structure--in the arterial system in vivo. Discrepancies with theory. J Vasc Res. 2006;43:251-269. [PubMed] [DOI] |
| 8. | Cunningham KS, Gotlieb AI. The role of shear stress in the pathogenesis of atherosclerosis. Lab Invest. 2005;85:9-23. [PubMed] [DOI] |
| 10. | Kong X, Han B, Wang H, Li H, Xu W, Liu W. Mechanical properties of biodegradable small-diameter chitosan artificial vascular prosthesis. J Biomed Mater Res A. 2012;100:1938-1945. [PubMed] [DOI] |
| 11. | Cahill PA, Redmond EM, Sitzmann JV. Endothelial dysfunction in cirrhosis and portal hypertension. Pharmacol Ther. 2001;89:273-293. [PubMed] [DOI] |
| 12. | Menon KV, Kamath PS. Regional and systemic hemodynamic disturbances in cirrhosis. Clin Liver Dis. 2001;5:617-27, viii. [PubMed] [DOI] |
| 13. | Fung YC, Liu SQ. Strain distribution in small blood vessels with zero-stress state taken into consideration. Am J Physiol. 1992;262:H544-H552. [PubMed] |
| 14. | 宋 玉祥, 陈 峰, 熊 江, 郭 伟, 潘 秀颉, 贾 森皓, 刘 杰. 氢气饱和生理盐水对腹主动脉瘤大鼠主动脉残余应力的影响. 中国修复重建外科杂志. 2013;27:881-884. |
| 15. | Liu SQ. Focal expression of angiotensin II type 1 receptor and smooth muscle cell proliferation in the neointima of experimental vein grafts: relation to eddy blood flow. Arterioscler Thromb Vasc Biol. 1999;19:2630-2639. [PubMed] [DOI] |