修回日期: 2013-12-03
接受日期: 2013-12-04
在线出版日期: 2014-02-08
目的: 研究藤黄对人结肠癌HCT116细胞建立的裸鼠外科原位移植瘤生长及转移的抑制作用.
方法: 通过外科原位移植能表达绿色荧光蛋白人结肠癌HCT116细胞的方法建立裸鼠结肠癌模型. 40只模型裸鼠随机分为对照组(G1), 5-氟尿嘧啶(5-fluorouracil, 5-FU)组(G2), 10、20 mg/kg藤黄组(G3、G4), 每组10只. G1组采用生理盐水灌胃, 1次/d; G2组用25 mg/kg的5-FU进行腹腔灌注, 3次/wk; G3、G4组分别予相应剂量的藤黄提取物灌胃, 1次/d. 每天观察受试裸鼠的并发症及死亡情况, 2次/wk在体外荧光影像系统下观察移植肿瘤大小并测量裸鼠体质量, 实验终点处死所有受试裸鼠在开放荧光系统下观察肿瘤生长及转移情况, 切除移植肿瘤进行称体质量.
结果: 药物干预后, 20 mg/kg藤黄组各观察点的平均肿瘤体积(mm3)均小于对照组(d4: 104.5±35.5 vs 164.1±66.1; d7: 102.6±53.8 vs 286.2±132.0; d11: 137.6±70.5 vs 324.4±115.8; d14: 207.2±101.7 vs 434.2±169.3; d21: 229.8±99.8 vs 480.4±165.5), 差异有统计学意义(P<0.05). 实验终点20 mg/kg藤黄组的平均肿瘤质量轻于对照组(0.58 g±0.26 g vs 0.92 g±0.26 g), 差异有统计学意义(P<0.05). 20 mg/kg藤黄组与5-FU组之间比较, 10 mg/kg藤黄组与对照组比较, 无论是各观察点平均肿瘤体积还是实验终点肿瘤重量差异无统计学意义(P>0.05). 实验终点开放体内荧光成像显示各组均出现了不同程度的胰腺及淋巴结转移, 比较组间淋巴结及胰腺转移率的差异无统计学意义(P>0.05). 实验过程中各组实验动物均未出现药物相关的不良反应, 各组荷瘤裸鼠的平均体质量未出现明显波动.
结论: 藤黄在达到一定干预剂量(20 mg/kg)后能安全有效地抑制人结肠癌HCT116细胞裸鼠原位移植瘤的生长, 可能具有潜在的临床抗结直肠癌作用.
核心提示: 藤黄在达到一定干预剂量(20 mg/kg)后能有效地抑制人结肠癌HCT116细胞裸鼠原位移植瘤的生长, 该作用和5-氟尿嘧啶相似, 同时不会增加受试动物的不良反应, 提示藤黄可能具有潜在的临床抗结直肠癌作用.
引文著录: 竺平, 谷云飞, 杨柏霖, 林秋, 丁义江. 藤黄对人结肠癌HCT116细胞裸鼠原位移植模型的作用. 世界华人消化杂志 2014; 22(4): 476-482
Revised: December 3, 2013
Accepted: December 4, 2013
Published online: February 8, 2014
AIM: To study the antitumor and anti-metastatic effects of gamboge in an orthotopic mouse model developed with human colon cancer cell line HCT116.
METHODS: A colon cancer model was developed by surgical orthotopic implantation of green fluorescent protein (GFP)-expressing HCT 116 tumor in nude mice. Forty mice were equally randomized into four groups. Group 1 served as a negative control and received intragastric infusion of normal saline once daily. Group 2 received intraperitoneal injection of 5-fluorouracil at a dose of 25 mg/kg three times per week. Groups 3 and 4 received intragastric infusion of gamboge extract at a dose of 10 and 20 mg/kg, respectively, once daily. Each animal was checked for mortality and signs of morbidity every day. Primary tumor volume and metastasis for each animal were observed under a fluorescence imaging system twice a week, and body weights were measured as well. At the end of the experiment, all mice were sacrificed and open fluorescent images of tumors and metastases expressing GFP were acquired, and the tumor was removed from each mouse and weighed.
RESULTS: After initiation of different treatment regimens, the average tumor volume (mm3) was significantly smaller in the gamboge (20 mg/kg) group than the control group at each observation point (d4: 104.5 ± 35.5 vs 164.1 ± 66.1; d7: 102.6 ± 53.8 vs 286.2 ± 132.0; d11: 137.6 ± 70.5 vs 324.4 ± 115.8; d14: 207.2 ± 101.7 vs 434.2 ± 169.3; d21: 229.8 ± 99.8 vs 480.4 ± 165.5; P < 0.05 for all). At the end of the study, the average tumor weight was significantly smaller in the gamboge group (20 mg/kg) than in the control group (0.58 ± 0.26 vs 0.92 ± 0.26, P < 0.05). There were no statistical differences between the gamboge (20 mg/kg) group and 5-fluorouracil group, as well as between the gamboge (10 mg/kg) group and control group, in term of average tumor volume and weight (P > 0.05 for all). At the end of the experiment, open GFP imaging demonstrated that all groups presented metastasis of lymph nodes or the pancreas, although there were no significant differences between the four groups with regard to the metastasis rate (P > 0.05 for all). No significant morbidity or weight loss was found in all tumor-bearing mice.
CONCLUSION: Gamboge at a dose of 20 mg/kg was able to suppress HCT 116 tumor growth in an orthotopic mouse model of colon cancer safely and effectively, and may possess clinical therapeutic potential for colorectal cancer.
- Citation: Zhu P, Gu YF, Yang BL, Lin Q, Ding YJ. Effects of gamboge in an orthotopic mouse model of colon cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(4): 476-482
- URL: https://www.wjgnet.com/1009-3079/full/v22/i4/476.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i4.476
结直肠癌是世界范围内发病率仅次于肺癌和乳腺癌的第三大恶性肿瘤, 每年约有120万的新增病例和60万死亡病例[1]. 近年来随着生活水平的提高和膳食结构的改变, 我国结直肠癌发病率和死亡率均呈上升趋势[2]. 以手术及放化疗为主的综合治疗目前仍然是结直肠癌的主要治疗方法[3]. 尽管近年来随着新型化疗药物如奥沙利铂, 伊立替康以及生物靶向制剂的应用将晚期结直肠癌的总生存期平均延长至2年左右[4-6], 但5年生存率仍不能让人满意[7], 且手术的风险以及放化疗带来的并发症常让医生和患者陷入两难困局. 因此迫切需要发现能够有效治疗结直肠癌的新方法. 近年来以紫杉醇、喜树碱衍生物为代表的诸多植物药显示出巨大抗肿瘤潜力, 因而得到越来越多的关注. 研究证实中药藤黄及其主要成分藤黄酸可通过多种途径起到抑制肿瘤细胞的作用[8-13]. 我们的前期研究证明藤黄提取物可有效抑制人结肠癌HCT116细胞的生长[14]. 进一步研究发现这种抑制作用可能是通过调节Bax、Bcl-2、MLH-1、MSH2及p53等基因蛋白表达, 产生G2/M期阻滞, 诱导细胞凋亡等途径实现的. 为了明确藤黄对动物在体结肠肿瘤是否具有同样的作用, 我们在本研究中运用经过绿色荧光转染的HCT116细胞建立了裸鼠结肠癌原位移植模型, 通过观察不同剂量藤黄干预后肿瘤的生长、转移情况, 进一步确定藤黄的抗结直肠癌作用.
人结肠癌细胞株HCT116购自中国科学院上海细胞生物研究所; 绿色荧光蛋白(green fluorescent protein, GFP)的表达质粒pEGFP-N3(-)购自美国BD Biosciences公司; 逆转录病毒pLPCX购自日本Clontech Laboratories公司; RPMI 1640培养基、胎牛血清均购自美国Gibco公司; 氯化钠注射液购自南京小营药业, 浓度为250 mL: 2.25 g, 批号为H32023209; 5-氟尿嘧啶(5-fluorouracil, 5-FU)购自天津金耀氨基酸有限公司, 浓度为10 mL: 0.25 g, 批号为H12020959; 藤黄购自南京中医药大学附属医院药剂科. ♀Balb/c裸鼠, 鼠龄7 wk, 体质量18-22 g购自扬州大学比较医学中心, 实验动物许可证号为SCXK(苏)2007-0011, 动物合格证号为0001868, 在无特定病原体(specific-pathogen free, SPF)级屏障系统中进行饲养, 饲料为钴60辐射灭菌过的大小鼠专用颗粒饲料购自江苏省协同医药生物工程有限公司.
1.2.1 HCT116-GFP细胞株的构建和筛选: (1)人结肠癌细胞株HCT116在含10%胎牛血清, 100 IU/mL青霉素, 100 IU/mL链霉素的DMEM培养液中, 37 ℃、5%CO2条件下培养, 传代; (2)绿色荧光蛋白逆转录病毒转染载体PT67-Plpcx-EGFP由南京源端生物科技公司参照文献[15]的方法构建. 培养PT67-pLPCX-EGFP包装细胞, 收集包装细胞培养上清, 将上清分别加入培养的人结肠癌HCT116细胞中进行转染, 48 h后用含有浓度为800 μg/mL的新霉素(G418)进行筛选, 建立稳定表达GFP的细胞株, 配制成1.5×107/mL的绿色荧光蛋白转染的人结肠癌细胞(HCT116-GFP).
1.2.2 藤黄的制备: 参照文献[14]的方法, 取藤黄200 g, 依次用8倍量、6倍量的950 mL/L乙醇回流提取两次, 每次1 h, 合并滤液, 浓缩至无醇味, 用蒸馏水稀释至200 mL, 得醇提取物. 取醇提取物100 mL, 加蒸馏水稀释至500 mL, 氢氧化钠调pH至8, 离心(转速3000 r/min, 离心10 min), 取上清液得浓度为0.1 g/mL药液, 避光储存在4 ℃环境下, 使用前用生理盐水分别配置成1和2 mg/mL的实验浓度.
1.2.3 裸鼠结肠癌原位荧光移植模型的建立: 所有动物实验均在东南大学实验物中心完成, 实验室使用许可证号为SYXK(苏)2007-0011. 参照文献[16]的方法, 将浓度为5×107/mL HCT116-GFP细胞悬液分别皮下接种于2只Balb/c裸鼠背部, 每只0.1 mL. 稳定传代2次, 当肿瘤达10 mm×10 mm时从皮下移植处取出, 在RPMI 1640培养液中将瘤块修剪成1 mm×1 mm大小, 准备进行原位移植. 选取40只♀Balb/c裸鼠, 对受体裸鼠采用肌肉注射麻醉, 在裸鼠左下腹部做一1 cm的纵切口, 剪开皮肤和腹膜, 暴露回盲部并将其提出腹膜外, ×8外科手术显微(ZOOM645S, 江南禹成光学仪器有限公司)切开结肠浆膜, 用8-0外科缝线(上海浦东金环医疗用品有限公司)将1个瘤块贯穿后缝入结肠浆膜内以形成原位移植瘤, 将结肠放回腹腔并固定在腹膜上, 5-0外科缝线(上海浦东金环医疗用品有限公司)关闭腹腔. 所有手术操作均在超净工作台中完成.
1.2.4 实验动物分组及药物干预: 在原位移植后18 d, 肿瘤体积达80 mm3, 将40只原位移植模型裸鼠, 随机分成4组, 每组10只, 分别进行药物干预(表1).
| 分组 | 试验药物 | 实验剂量(mg/kg) | 给药剂量(μL) | 给药频率 | 给药途径 |
| G1 | 0.9%氯化钠 | - | 200 | 1次/d | 灌胃 |
| G2 | 5-氟尿嘧啶 | 25 | 200 | 3次/wk | 腹腔灌注 |
| G3 | 藤黄 | 10 | 200 | 1次/d | 灌胃 |
| G4 | 藤黄 | 20 | 200 | 1次/d | 灌胃 |
1.2.5 临床观察及肿瘤测量: 开始药物干预后, 每天观察实验动物的日常行为、全身性表现、皮肤毛发及死亡情况. 每周2次测量实验动物的体质量. 药物干预后3 wk, 当对照组平均肿瘤体积达到480 mm3或动物状态不佳为实验终点, 遵照动物福利原则处死所有存活的荷瘤鼠, 打开腹腔进行尸检, 检查原发肿瘤及转移情况. 切除原发肿瘤进行称质量并计算抑瘤率, 抑瘤率 = (对照组平均瘤质量-实验组平均瘤质量)/对照组平均瘤质量×100%.
1.2.6 肿瘤生长荧光成像: 每周2次运用IFLUOR-100小动物活体荧光影像系统(南京东图数码科技有限公司)对实验动物进行体外整体荧光成像, 观察体内原发肿瘤生长情况. 实验终点将裸鼠解剖并进行开放式荧光成像, 根据绿色荧光的表达来判断原位移植瘤的生长及转移情况. 每个时间位点选取典型的原发灶在荧光影像系统下拍摄分辨率为1392×1040的照片, 用Image-Pro 5.1(美国Media Cybernetics公司)测量裸鼠原位肿瘤的长径(L)和短径(W), 并根据公式(L×W2)×1/2计算肿瘤体积(V).
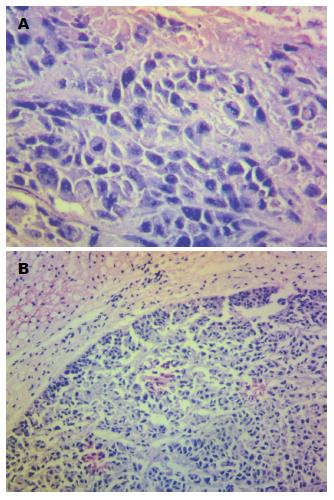
1.2.7 组织学分析: 开放式荧光成像后, 切除实验裸鼠全部原发肿瘤和转移灶, 用电子天平(TANITA® KO-160)对原发肿瘤称质量, 并立即将所取标本置于-196 ℃液氮中, 2-3 h后转入-80 ℃低温冰箱中保存. 另取部分原发肿瘤和转移灶置于4%甲醛中固定, 石蜡包埋并切片, 切片用H&E染色后通过显微镜观察病理性质.
统计学处理 采用SPSS17.0软件进行数据分析. 计量资料用mean±SD表示, 采用t检验进行比较; 计数资料用%表示, 多组间比较采用χ2检验或Fisher精确概率法, P<0.05为差异有统计学意义.
药物干预后, 每周2次采用整体荧光影像技术测量肿瘤体积, 计算各组模型动物原发肿瘤的平均体积, 药物干预3 wk为实验终点, 处死存活的实验动物, 切除原发肿瘤称质量. 结果显示20 mg/kg藤黄组各观察点的平均肿瘤体积及实验终点的肿瘤重量与对照组比较差异有统计学意义(P<0.05)(表2, 3), 与5-FU组比较差异无统计学意义(P>0.05)(表2, 3); 10 mg/kg藤黄组无论是各观察点平均肿瘤体积还是实验终点肿瘤重量与对照组比较无明显差异(P>0.05)(表2, 3). 根据瘤质量计算抑瘤率, 20 mg/kg藤黄组和5-FU组的抑瘤率分别为37%和45%, 10 mg/kg藤黄组的抑瘤率为23%(表3).
| 分组 | 治疗方法 | 药物干预前 | 第4天 | 第7天 | 第11天 | 第14天 | 第21天 |
| G1 | 对照组 | 82.8±23.9 | 164.1±66.1 | 286.2±132.0 | 324.4±115.8 | 434.2±169.3 | 480.4±165.5 |
| G2 | 5-氟尿嘧啶 | 82.1±17.1 | 61.7±26.0a | 89.6±57.0a | 132.8±90.9a | 172.0±115.1a | 196.9±123.8a |
| G3 | 藤黄(10 mg/kg) | 84.5±29.4 | 138.3±45.1 | 267.2±150.4 | 312.6±167.2 | 374.8±250.4 | 423.3±289.1 |
| G4 | 藤黄(20 mg/kg) | 83.4±29.9 | 104.5±35.5a | 102.6±53.8a | 137.6±70.5a | 207.2±101.7a | 229.8±99.8a |
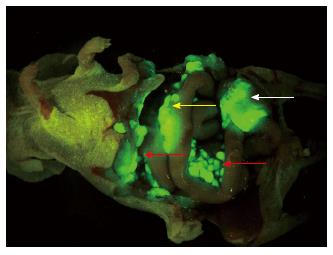
药物干预3 wk为实验终点. 处死所有存活的实验动物, 开放体内荧光成像检查肿瘤生长及转移情况, 荧光系统发现了肠系膜淋巴结、腰淋巴结及胰腺转移灶(图1). 用χ2检验对4组间淋巴转移情况进行比较, 差异无统计学意义(χ2 = 5.6000, P>0.05, 表4), 采用fisher精确概率法对胰腺转移情况进行分析, 差异无统计学意义(P>0.05, 表4). 对切除标本进行H&E染色显示移植肿瘤及转移淋巴结均为低分化腺癌(图2).
| 分组 | 治疗方法 | 淋巴结转移率 | 胰腺转移率 |
| G1 | 对照组 | 7/10 | 1/10 |
| G2 | 5-氟尿嘧啶 | 2/10 | 2/10 |
| G3 | 藤黄(10 mg/kg) | 6/10 | 5/10 |
| G4 | 藤黄(20 mg/kg) | 5/10 | 2/10 |
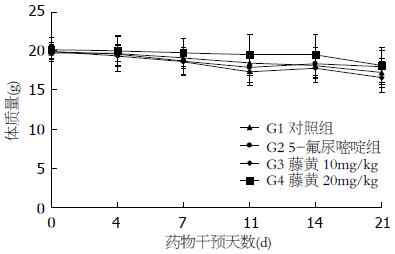
考虑到藤黄毒性较强, 为了明确实验剂量的藤黄对受试动物的影响, 我们每日观察并记录了裸鼠的日常行为、全身性表现、皮肤毛发及死亡情况, 两个不同剂量藤黄组内的实验动物均未出现药物相关的不良反应, 唯一的1只死亡系因肿瘤恶病质导致. 每周测量裸鼠体质量2次, 各组荷瘤裸鼠的平均体质量随着时间的推移逐渐减轻, 但未出现明显波动(图3), 4组裸鼠的最大体质量丢失量出现在药物干预后第21天(表5), 均未超过基线体质量的20%. 和对照组相比, 20 mg/kg藤黄组和5-FU组的体质量丢失较少, 而10 mg/kg藤黄组的体质量丢失较多(表5).
| 分组 | 治疗方法 | 裸鼠体质量(g)(d0) | 裸鼠体质量(g)(d21) | 最大体质量丢失量(%) |
| G1 | 对照组 | 19.8±0.9 | 17.2±1.8 | 13 |
| G2 | 5-氟尿嘧啶 | 19.9±1.2 | 18.0±2.1 | 9.5 |
| G3 | 藤黄(10 mg/kg) | 19.9±0.9 | 16.6±2.0 | 17 |
| G4 | 藤黄(20 mg/kg) | 20.2±1.5 | 18.1±2.4 | 10 |
藤黄系藤黄科植物藤黄树所分泌出的干燥树脂, 主要产于东南亚地区, 其性寒, 味酸、辛、涩, 有毒, 具破血散结、解毒、止血、杀虫之功效, 用于治疗瘰疬、痈疽、疖肿等顽疾[17]. 现代研究证明藤黄可通过多种机制起到抗肿瘤效果, 是一种多靶点的抗肿瘤天然药物. 藤黄抗癌研究协作组发现藤黄对小鼠腹水型肝癌ECA、S180、S37、ARA4、W256有抑制作用, 对体外培养的人肝癌细胞BEL-7402与宫颈癌HeLa细胞株也有程度不等的抑制作用[8]. 刘若庸等[9]证实合用藤黄能提高小鼠肿瘤MA737的放疗效果. 我们的体外研究证实藤黄可以有效抑制人结肠癌细胞HCT116的增殖, 可能是潜在的抗结肠癌中药[14]. 为了能更客观地评价藤黄的临床抗肿瘤作用, 还需要对能模拟人类结直肠癌特性的模型动物进行在体研究, 否则无法提供有说服力的结果.
裸鼠皮下异种移植瘤模型虽然成瘤性高[18], 但由于生长环境的密闭性, 导致该模型无法模拟人类结肠癌常见的局部和远处转移[19]. 基因工程鼠可表现出类似于人类结直肠癌的基因学特点, 但在肿瘤生物学及肿瘤谱方面存在不小差距, 如自发性成瘤时间较长、无远处转移、容易发生淋巴瘤而非结肠癌等, 因此在合适的基因小鼠模型出现前, 异种移植小鼠模型仍是进行抗结直肠癌药物疗效评价的最佳载体[20]. 我们利用绿色荧光转染的HCT116细胞建立了人结肠癌裸鼠外科原位移植模型(surgical orthotopic implantation, SOI), 该模型是利用手术的方法将能稳定表达绿色荧光的结肠癌肿瘤组织原位移植到实验动物的结肠浆膜下, 该模型可以为移植瘤提供最适宜的生长环境, 具有和人类结直肠癌相似的生长和转移模式[16,21]. 通过选择性肿瘤荧光成像, 观察者无需借助麻醉、造影剂及侵入性手术等方式即可在体外对活体肿瘤的生长和转移进行实时追踪观察, 从而减少实验动物的死亡和实验偏差, 是评估抗肿瘤药物作用的理想载体[22].
本研究结果显示, 20 mg/kg藤黄有具有显著抑制人结肠癌HCT116细胞裸鼠原位移植瘤生长的作用, 该作用与5-FU相似. 10 mg/kg藤黄则对移植肿瘤的生长无明显抑制作用, 提示藤黄抗结肠癌的作用可能呈浓度依赖性, 这和我们之前应用藤黄对HCT116细胞进行体外干预的结果类似[14]. 藤黄中的藤黄酸、新藤黄酸为抗肿瘤作用的有效成分, 具有抗瘤谱广, 毒性较低的特点[23,24]. 杨平等研究发现藤黄酸能够明显抑制人结肠癌细胞株SW480的增殖, 诱导SW480细胞发生G2/M期阻滞, 其作用机制可能与抑制VEGFR2表达有关[25]. 周兰贞等[26]研究发现新藤黄酸通过下调细胞周期蛋白cyclin D1、cyclin E的表达和上调P21、P27的表达, 使HCT116细胞阻滞在G0/G1期, 进而显著抑制HCT116细胞的增殖, 并诱导其凋亡. 我们进一步的研究结果提示藤黄对HCT116的抑制作用可能是通过调节Bax、Bcl-2、MLH-1、MSH2及p53等基因蛋白表达, 产生G2/M期阻滞, 诱导细胞凋亡等途径实现的. 侵袭和转移是恶性肿瘤患者死亡的主要原因[27], 转移的发生是一个多步骤的复杂过程, 包括细胞启动、细胞外基质蛋白水解、细胞外渗以及维持在远处脏器生长的能力等[28]. 本实验终点各组均出现了不同程度的淋巴结及胰腺转移, 但未出现人结直肠癌常见的肝脏转移, 这和我们之前的实验结果有所区别[16,29], 可能和本研究观察时间较短以及裸鼠原位移植模型和人结肠癌的转移模式仍存在一定的差异有关. 通过对转移情况的比较发现, 各组间的淋巴结及胰腺转移无显著差异, 提示干预期间各组药物并未表现出显著地抑制肿瘤转移作用. 藤黄具有一定的毒性, 大剂量的藤黄可导致恶心、呕吐及峻泻[30], 为了明确藤黄对实验动物的影响, 我们对受试裸鼠的日常行为、全身性表现、皮肤毛发、死亡情况以及体质量变化情况进行观察, 不同剂量藤黄组的裸鼠未出现药物相关的不良反应. 各组受试裸鼠的体质量随着肿瘤的生长而逐渐减轻, 但未出现明显波动, 20 mg/kg藤黄组和5-FU组的体质量丢失量少于对照组和10 mg/kg藤黄组. 以上结果提示裸鼠体质量的减轻可能和肿瘤消耗而非药物毒性有关, 通过对肿瘤生长的有效抑制可减少裸鼠因肿瘤消耗而引起的体质量减轻, 较大剂量的藤黄在提高抑瘤作用的同时不会增加实验动物的不良反应.
本研究中利用可稳定表达绿色荧光的裸鼠原位移植结肠癌模型对藤黄抗结肠癌作用进行了探索研究, 目前国内外尚未见相似报道. 研究结果提示较高剂量的藤黄显示出了和5-FU相似的肿瘤抑制效果, 同时不会增加受试动物的毒性反应, 提示藤黄是一种非常有潜力的结肠癌治疗药物. 其作用机制如何? 增加干预剂量是否能提高藤黄抑制肿瘤生长及转移的作用? 这些问题仍需进一步深入研究.
结直肠癌是世界范围内发病率仅次于肺癌和乳腺癌的第三大恶性肿瘤, 近年来我国结直肠癌发病率和死亡率均呈上升趋势. 以手术及放化疗为主的综合治疗目前仍然是结直肠癌的主要治疗方法, 手术的风险以及放化疗带来的并发症常让医生和患者陷入两难困局. 因此迫切需要发现能够有效治疗结直肠癌的新方法.
白雪, 副主任医师, 中国人民解放军北京军区总医院普通外科
近年来许多植物药显示出巨大抗肿瘤潜力, 因而得到越来越多的关注. 现代研究证实中药藤黄及其主要成分藤黄酸可通过抑制肿瘤细胞增殖、促进肿瘤细胞凋亡、抑制肿瘤血管形成等多个途径起到抗恶性肿瘤的作用, 是一种多靶点的抗肿瘤天然药物.
藤黄中的主要抗肿瘤活性成分为藤黄酸和新藤黄酸. 藤黄酸能够明显抑制人结肠癌细胞株SW480的增殖, 诱导SW480细胞发生G2/M期阻滞, 其作用机制可能与抑制VEGFR2表达有关. 新藤黄酸通过下调细胞周期蛋白cyclin D1、cyclin E的表达和上调P21、P27的表达, 使HCT116细胞阻滞在G0/G1期, 进而显著抑制HCT116细胞的增殖, 并诱导其凋亡.
本研究发现藤黄只有在较高剂量时才能有效抑制受试动物结肠原位移植瘤的生长, 提示藤黄的抗结肠肿瘤作用可能是剂量依赖性的. 有效剂量的藤黄并不会增加实验动物的不良反应.
本研究通过外科原位移植能表达绿色荧光蛋白HCT116肿瘤的方法建立了裸鼠结肠癌模型, 使观察者无需借助麻醉、造影剂及侵入性手术等方式即可在体外对活体肿瘤的生长和转移进行实时追踪观察, 从而减少实验动物的死亡和实验偏差, 是评估抗肿瘤药物作用的理想载体.
本文内容新颖, 结构层次清晰, 条理分明, 提供了充足的有意义的信息, 具有较高的学术价值.
编辑: 田滢 电编:闫晋利
| 1. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 3. | Minsky BD. Adjuvant therapy of resectable rectal cancer. Cancer Treat Rev. 2002;28:181-188. [PubMed] [DOI] |
| 4. | Douillard JY, Siena S, Cassidy J, Tabernero J, Burkes R, Barugel M, Humblet Y, Bodoky G, Cunningham D, Jassem J. Randomized, phase III trial of panitumumab with infusional fluorouracil, leucovorin, and oxaliplatin (FOLFOX4) versus FOLFOX4 alone as first-line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME study. J Clin Oncol. 2010;28:4697-4705. [PubMed] [DOI] |
| 5. | Sobrero A, Ackland S, Clarke S, Perez-Carrión R, Chiara S, Gapski J, Mainwaring P, Langer B, Young S. Phase IV study of bevacizumab in combination with infusional fluorouracil, leucovorin and irinotecan (FOLFIRI) in first-line metastatic colorectal cancer. Oncology. 2009;77:113-119. [PubMed] [DOI] |
| 6. | Welch S, Spithoff K, Rumble RB, Maroun J. Bevacizumab combined with chemotherapy for patients with advanced colorectal cancer: a systematic review. Ann Oncol. 2010;21:1152-1162. [PubMed] |
| 7. | Meyerhardt JA, Mayer RJ. Systemic therapy for colorectal cancer. N Engl J Med. 2005;352:476-487. [PubMed] [DOI] |
| 10. | Lu N, Yang Y, You QD, Ling Y, Gao Y, Gu HY, Zhao L, Wang XT, Guo QL. Gambogic acid inhibits angiogenesis through suppressing vascular endothelial growth factor-induced tyrosine phosphorylation of KDR/Flk-1. Cancer Lett. 2007;258:80-89. [PubMed] [DOI] |
| 11. | Yang Y, Yang L, You QD, Nie FF, Gu HY, Zhao L, Wang XT, Guo QL. Differential apoptotic induction of gambogic acid, a novel anticancer natural product, on hepatoma cells and normal hepatocytes. Cancer Lett. 2007;256:259-266. [PubMed] [DOI] |
| 12. | Yu J, Guo QL, You QD, Zhao L, Gu HY, Yang Y, Zhang HW, Tan Z, Wang X. Gambogic acid-induced G2/M phase cell-cycle arrest via disturbing CDK7-mediated phosphorylation of CDC2/p34 in human gastric carcinoma BGC-823 cells. Carcinogenesis. 2007;28:632-638. [PubMed] [DOI] |
| 13. | Huang H, Chen D, Li S, Li X, Liu N, Lu X, Liu S, Zhao K, Zhao C, Guo H. Gambogic acid enhances proteasome inhibitor-induced anticancer activity. Cancer Lett. 2011;301:221-228. [PubMed] [DOI] |
| 14. | 竺 平, 谷 云飞, 杨 柏霖, 林 秋, 陈 红锦, 孙 桂东, 丁 义江. 有毒中药对人结肠癌HCT116和SW480细胞的生长抑制作用. 南京中医药大学学报. 2013;29:351-354. |
| 15. | Yang M, Jiang P, Sun FX, Hasegawa S, Baranov E, Chishima T, Shimada H, Moossa AR, Hoffman RM. A fluorescent orthotopic bone metastasis model of human prostate cancer. Cancer Res. 1999;59:781-786. [PubMed] |
| 16. | Chen HJ, Yang BL, Chen YG, Lin Q, Zhang SP, Gu YF. A GFP-labeled human colon cancer metastasis model featuring surgical orthotopic implantation. Asian Pac J Cancer Prev. 2012;13:4263-4266. [PubMed] [DOI] |
| 18. | Wang J, Sun L, Myeroff L, Wang X, Gentry LE, Yang J, Liang J, Zborowska E, Markowitz S, Willson JK. Demonstration that mutation of the type II transforming growth factor beta receptor inactivates its tumor suppressor activity in replication error-positive colon carcinoma cells. J Biol Chem. 1995;270:22044-22049. [PubMed] [DOI] |
| 19. | Fu XY, Besterman JM, Monosov A, Hoffman RM. Models of human metastatic colon cancer in nude mice orthotopically constructed by using histologically intact patient specimens. Proc Natl Acad Sci U S A. 1991;88:9345-9349. [PubMed] [DOI] |
| 20. | Taketo MM, Edelmann W. Mouse models of colon cancer. Gastroenterology. 2009;136:780-798. [PubMed] |
| 21. | Rajput A, Dominguez San Martin I, Rose R, Beko A, Levea C, Sharratt E, Mazurchuk R, Hoffman RM, Brattain MG, Wang J. Characterization of HCT116 human colon cancer cells in an orthotopic model. J Surg Res. 2008;147:276-281. [PubMed] [DOI] |
| 22. | Katz MH, Takimoto S, Spivack D, Moossa AR, Hoffman RM, Bouvet M. A novel red fluorescent protein orthotopic pancreatic cancer model for the preclinical evaluation of chemotherapeutics. J Surg Res. 2003;113:151-160. [PubMed] [DOI] |
| 25. | 杨 平, 曹 杰, 张 通, 王 强, 孙 政, 张 伟健, 曾 山崎. 藤黄酸对人结肠癌SW480细胞增殖及VEGFR2表达的影响. 中国中医基础医学杂志. 2012;18:520-522. |
| 27. | Bates RC, Mercurio AM. The epithelial-mesenchymal transition (EMT) and colorectal cancer progression. Cancer Biol Ther. 2005;4:365-370. [PubMed] |
| 28. | Steeg PS. Metastasis suppressors alter the signal transduction of cancer cells. Nat Rev Cancer. 2003;3:55-63. [PubMed] [DOI] |
| 29. | Yang BL, Chen HJ, Chen YG, Gu YF, Zhang SP, Lin Q, Sun Y. Inhibitory effects of baicalin on orthotopic xenografts of colorectal cancer cells that are deficient in a mismatch repair gene in nude mice. Int J Colorectal Dis. 2013;28:547-553. [PubMed] [DOI] |
| 30. | Panthong A, Norkaew P, Kanjanapothi D, Taesotikul T, Anantachoke N, Reutrakul V. Anti-inflammatory, analgesic and antipyretic activities of the extract of gamboge from Garcinia hanburyi Hook f. J Ethnopharmacol. 2007;111:335-340. [PubMed] |