修回日期: 2014-11-06
接受日期: 2014-11-18
在线出版日期: 2014-12-28
目的: 探讨大肠癌原发灶和淋巴结内转移癌中p85a与nm23、基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)的表达及其临床意义.
方法: 收集有完整随访资料的243例大肠癌病例, 根据有无淋巴结转移进行分组, 分为无淋巴结转移组51例、有淋巴结转移的原发灶组192例、淋巴结内转移癌组(简称转移癌组)192例, 设大肠癌癌旁正常黏膜组织为对照组243例, 免疫组织化学方法检测对照组、无转移组、原发灶组、转移癌组中p85a、nm23、MMP-2的表达情况, 分析其相关性以及与临床病理因素、患者生存的关系.
结果: p85a和MMP-2在大肠癌原发灶组和转移癌组中的阳性表达率明显高于无转移组和对照组, nm23在无转移组中的阳性表达率明显高于转移癌组和原发灶组, 差异有统计学意义. 转移癌组中p85a与nm23的表达呈负相关(P<0.05), p85a与MMP-2的表达呈正相关(P<0.05). 生存分析结果显示, p85a、nm23、MMP-2是大肠癌预后的独立影响因素. 高表达p85a并低表达nm23或者同时高表达p85a和MMP-2的患者预后差.
结论: 在大肠癌转移过程中, p85a协同增强MMP-2并抑制nm23, 三者在大肠癌转移中均发挥重要作用且与患者预后密切相关.
核心提示: p85a、基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)在转移灶中的表达率高于原发灶, 在转移灶中p85a与MMP-2的表达呈正相关; nm23在转移灶中的表达率低于原发灶, 在转移灶中p85a与nm23的表达率呈负相关. p85a、nm23、MMP-2蛋白的异常表达是影响大肠癌患者预后的独立危险因素, 存在p85a和MMP-2同时高表达或者高表达p85a且低表达nm23的患者术后生存期明显缩短.
引文著录: 思蓉, 吴淑华, 何双, 温菲菲. p85a与nm23、MMP-2在大肠癌原发灶和淋巴结内转移癌中的表达及临床意义. 世界华人消化杂志 2014; 22(36): 5623-5630
Revised: November 6, 2014
Accepted: November 18, 2014
Published online: December 28, 2014
AIM: To detect the expression of p85a, nm23 and matrix metalloproteinase-2 (MMP-2) in primary colorectal cancer and lymph node metastasis, and to discuss the role and significance of p85a, nm23 and MMP-2 in colorectal cancer metastasis.
METHODS: Two hundred and forty-three colorectal cancer patients were divided into two groups: patients with cervical lymph node metastasis and those without. Primary tumor samples from patients without cervical lymph node metastasis (n = 51) and those with lymph node metastasis (n = 192), cervical lymph node metastasis samples (n = 192), and normal colorectal tissue samples from normal controls (n = 243) were collected. Immunohistochemistry was used to detect the expression of p85a, nm23 and MMP-2 in the above samples. The correlations between expression of p85a, nm23 and MMP-2 and clinicopathological and prognostic factors of colorectal cancer were analyzed.
RESULTS: The positive expression rates of p85a and MMP-2 in primary tumor and lymph node metastasis samples from patients with lymph node metastasis were significantly higher than those in primary tumors from patients without cervical lymph node metastasis and normal colorectal tissue samples. The expression of nm23 in the metastasis was significantly lower than those in the other groups. In metastatic cancer, the expression of p85a and nm23 had a negative correlation (P < 0.05), and p85a and MMP-2 had a positive correlation (P < 0.05). According to survival analysis, p85a, nm23 and MMP-2 were independent factors for the prognosis of colorectal cancer. The cases with higher p85a and lower nm23 or with both higher p85a and MMP-2 had shorter lifetime.
CONCLUSION: In the process of colorectal cancer metastasis, p85a can enhance the expression of MMP-2 and restrain the expression of nm23. They all play an important role in colorectal metastasis, and all of them are prognostic factors for colorectal cancer.
- Citation: Si R, Wu SH, He S, Wen FF. Clinical significance of expression of p85a, nm23 and MMP-2 in primary colorectal cancer and lymph node metastasis. Shijie Huaren Xiaohua Zazhi 2014; 22(36): 5623-5630
- URL: https://www.wjgnet.com/1009-3079/full/v22/i36/5623.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i36.5623
我国大肠癌的患病率逐年升高, 居全部恶性肿瘤的第4位, 消化系肿瘤的第3位[1]. 大肠癌的发生是一个多环节、复杂的过程, 其中细胞转导通路的异常发挥了重要作用[2]. 磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/Akt, PI3K/Akt)信号转导通路[3]作为重要的细胞生存通路之一, 在促进细胞生长、增殖, 促进细胞运动、侵袭, 抑制细胞凋亡, 促进血管生成, 抵抗化疗和放疗等方面起作用[4-7]. PI3K/Akt通路中的IA型PI3K分子的调节亚基p85a在介导PI3K和胞膜受体激酶的相互作用中起了关键作用, 并且与肿瘤的生物学活性密切相关[8-10]. 本研究通过检测大肠癌原发灶和淋巴结内转移癌中p85a、nm23、基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)的表达情况, 对三者在大肠癌转移过程中的相关性及临床意义进行初步探讨.
收集滨州医学院附属医院2006-01/2009-01大肠癌手术标本300例, 所选病例均为首次发现, 术前未经任何治疗, 并对其进行随访, 剔除失访及因其他原因死亡的病例. 最后获得完整随访资料243例, 其中女111例, 男132例, 年龄27-87岁, 平均年龄64.23岁±1.21岁. 入选病例病理切片经两位病理专家重新阅片, 根据有无淋巴结转移进行分组, 分为无淋巴结转移组51例, 有淋巴结转移的原发灶组192例, 淋巴结内转移癌组192例, 并设大肠癌癌旁正常黏膜组织为对照组243例. p85a兔多克隆抗体、nm23鼠多克隆抗体、MMP-2人单克隆抗体均购自ImmunoWay公司, 稀释浓度分别为1:100、1:200、1:150. 柠檬酸, 通用型二抗及DAB显色液购自北京中杉金桥生物技术有限公司. 分别采用已知阳性表达的子宫内膜癌组织、胃癌组织、乳腺癌组织做阳性对照, 采用PBS代替一抗做阴性对照.
1.2.1 随访: 对大肠癌术后患者以电话、书信等方式进行回访, 对死亡病例以医院出具的死亡诊断书为准, 除去非肿瘤原因死亡的病例, 最终获得有完整随访资料的病例243例.
1.2.2 免疫组织化学检测p85a、nm23、MMP-2: 按照EnVision法步骤进行, 3 μm石蜡切片经二甲苯、梯度乙醇脱蜡至水后, 进行柠檬酸修复(热修复2 min), 滴加一抗, 4 ℃过夜. PBS洗涤后, 滴加通用型二抗, 37 ℃孵育30 min, DAB显色(p85a, nm23显色时间为2 min, MMP-2显色时间为3 min), 苏木素复染, 盐酸酒精分化, 脱水后中性树胶封片.
1.2.3 结果判读: p85a以上皮细胞胞浆内出现棕黄色颗粒为阳性标志, nm23、MMP-2均以上皮细胞胞浆均质黄染为阳性标志, 结果判定采用半定量积分法, 根据每张切片上的阳性细胞比例和染色深浅积分. 着色深度: 无色0分, 浅黄色1分, 棕黄色2分, 棕褐色3分. 同倍数物镜单个视野下阳性细胞数面积: ≤1/4为1分, 1/4-1/2为2分, 1/2-3/4为3分, ≥3/4为4分. 2项积分相乘所得的总分进行结果判定, 0-6分为阴性, 8-12分为阳性.
统计学处理 使用SPSS19.0统计软件, 不同分组间三种蛋白的表达差异及与临床病理因素之间的关系采用χ2检验. p85a和nm23、MMP-2之间的相关性采用Spearman相关分析. 用Kaplan-Meier法进行单因素生存分析, 对有统计学差异的变量应用Cox模型进行多因素生存分析, 所有统计学分析均以α≤0.05为检验水准. P<0.05为差异具有统计学意义.
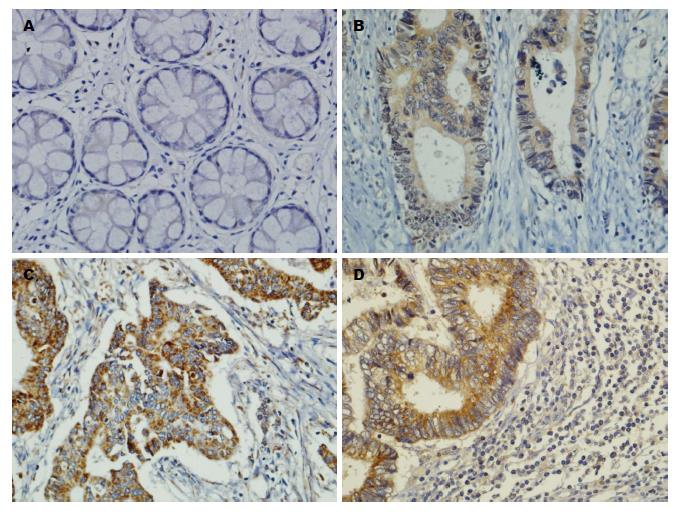
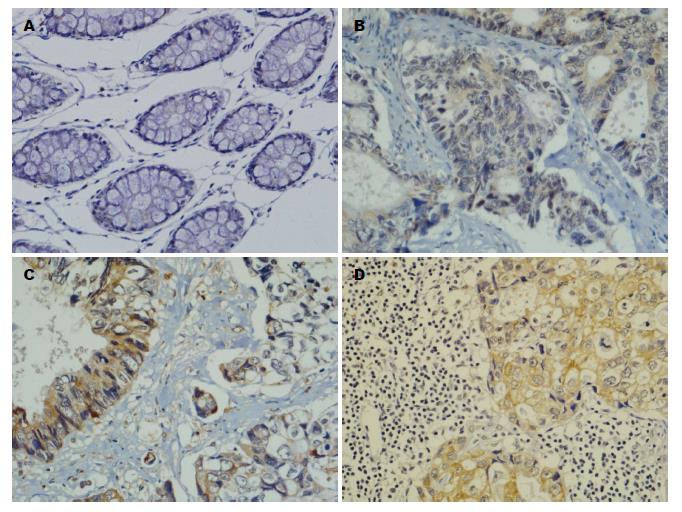
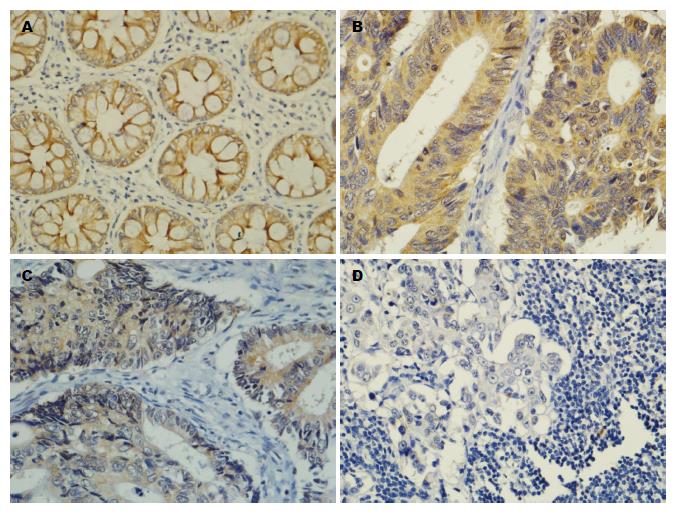
p85a、MMP-2在转移癌组的表达明显高于无转移组和对照组(P<0.05), 与原发灶组无显著性差异(P>0.05); nm23在无转移组的表达明显高于原发灶组和转移癌组(P<0.05), 但与对照组之间无显著性差异(P>0.05)(表1, 图1, 图2和图3).
| 分组 | n | p85a | MMP-2 | nm23 |
| 对照组 | 243 | 72(29.6) | 69(28.4) | 129(78.4) |
| 无转移组 | 51 | 10(18.8) | 33(64.7) | 42(82.4) |
| 原发灶组 | 192 | 135(70.3) | 159(82.8) | 41(29.4) |
| 转移癌组 | 192 | 156(81.3) | 162(84.3) | 32(19.3) |
统计学分析结果显示, 在转移癌组中p85a与MMP-2的表达呈正相关, p85a与nm23的表达呈负相关(P<0.05), 而在对照组、无转移组、原发灶组中的表达无相关性(P>0.05)(表2).
| 分组 | n | MMP-2 | nm23 | ||
| Spearman(r) | P值 | Spearman(r) | P值 | ||
| 对照组 | 243 | 0.717 | 0.276 | 0.735 | 0.346 |
| 无转移组 | 51 | 0.145 | 0.764 | 0.231 | 0.582 |
| 原发灶组 | 192 | 0.251 | 0.297 | 0.243 | 0.315 |
| 转移癌组 | 192 | 0.417 | 0.004 | -0.382 | 0.040 |
在各种临床病理因素中, p85a、nm23、MMP-2蛋白的表达与肿瘤的分化程度及淋巴结是否转移相关(P<0.05), 而与性别、年龄、肿瘤直径、部位及TNM分期无相关性(表3).
| 临床病理因素 | n | p85a+ | P值 | nm23+ | P值 | MMP-2+ | P值 |
| 性别 | 0.854 | 0.584 | 0.442 | ||||
| 男 | 132 | 102(41.9) | 99(40.8) | 117(48.1) | |||
| 女 | 111 | 69(28.4) | 84(34.6) | 84(34.6) | |||
| 年龄(岁) | 0.753 | 0.717 | 0.504 | ||||
| ≤65 | 117 | 84(34.5) | 87(35.8) | 96(39.5) | |||
| >65 | 126 | 87(35.8) | 96(39.5) | 105(43.2) | |||
| 肿瘤直径(cm) | 0.809 | 0.347 | 0.369 | ||||
| ≤3 | 128 | 116(47.7) | 114(46.9) | 52(21.4) | |||
| >3 | 115 | 110(45.3) | 98(40.3) | 94(38.7) | |||
| 肿瘤部位 | 0.401 | 0.066 | 0.888 | ||||
| 结肠 | 108 | 78(32.1) | 78(32.1) | 90(37.3) | |||
| 直肠 | 135 | 93(38.3) | 105(43.2) | 111(45.7) | |||
| 分化程度 | 0.049 | 0.037 | 0.010 | ||||
| 高分化 | 72 | 48(19.8) | 54(22.2) | 54(22.2) | |||
| 中分化 | 126 | 87(35.8) | 93(38.3) | 102(41.9) | |||
| 低分化 | 45 | 36(14.8) | 36(14.8) | 45(18.5) | |||
| TNM分期 | 0.406 | 0.175 | 0.069 | ||||
| Ⅰ+Ⅱ | 54 | 39(16.5) | 18(7.4) | 30(12.3) | |||
| Ⅲ+Ⅳ | 189 | 132(54.3) | 165(67.9) | 171(70.4) | |||
| 淋巴结转移 | 0.023 | 0.017 | 0.011 | ||||
| 无 | 54 | 42(17.3) | 45(18.5) | 45(18.5) | |||
| 有 | 189 | 129(53.1) | 138(56.8) | 156(64.2) |
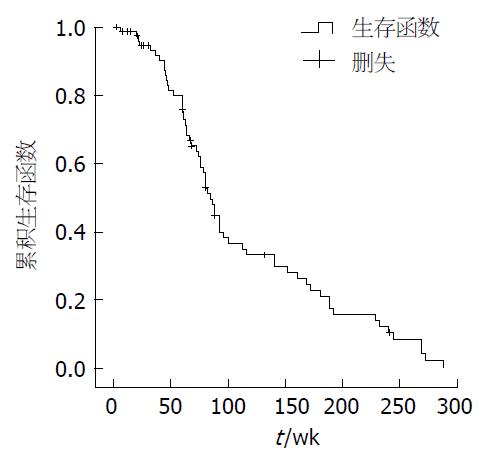
对300例大肠癌患者进行随访, 获得完整随访资料243例. 其中57例死亡, 186例生存, 总生存期1-60 mo, 平均生存28.5 mo, 中位生存期为21 mo(95%CI: 18.6-23.4), 5年生存率为50.2%(图4).
p85a是PI3K中表达量最高的一种调节亚基, p85a的异常可导致PI3K/Akt细胞信号传导通路异常, 与多种肿瘤的发生发展密切相关[11-13]. Catasus等[14]学者发现p85a蛋白的表达水平与卵巢癌的临床分期和组织学分级成正相关. 王彦云[15]发现p85a蛋白在大肠正常黏膜、大肠腺瘤、大肠癌中的表达呈上升趋势. 本研究结果表明p85a在对照组、无转移组、原发灶组和转移癌组中的阳性表达率呈逐渐上升的趋势, 提示p85a蛋白不但与大肠癌的发生发展有关, 并且与其转移密切相关.
MMP-2是基质金属蛋白酶家族的重要成员, 可降解基膜Ⅳ型胶原, 在肿瘤的转移中发挥重要作用[16-18]. 本实验发现, MMP-2在对照组、无转移组、原发灶组和转移癌组中的表达呈上升趋势, 印证了其促进肿瘤细胞转移的作用. 并且, 我们发现在转移癌组中MMP-2的表达与p85a的表达呈正相关, 由此我们推测, p85a高表达可激活PI3K/Akt细胞信号传导通路, 影响其下游的效应因子Rho、Racl和cdc42等细胞生物学活性的关键分子, 使细胞骨架重排、调节细胞膜褶皱运动、细胞运动和细胞蔓延. 并可通过多种途径, 促进肿瘤细胞产生过多的MMP-2, 促进其发挥水解细胞外基质的作用, 从而促进肿瘤细胞的侵袭与转移.
nm23基因是第一个被发现的转移抑制基因[19], 在肿瘤细胞增殖分化侵袭及转移中起重要作用[20-22]. 他与乳腺癌、肝癌、恶性黑色素细胞瘤等多种肿瘤的转移有关[23-26]. Kanat等[27]研究发现高表达nm23的胃肠道间质瘤患者中位生存期明显延长. 本实验发现, nm23在无转移组中的表达明显高于原发灶组和转移癌组, 并且在转移癌组中与p85a的表达呈负相关. 我们认为, p85a蛋白高表达以及nm23基因的失活与大肠癌的转移具有相关性, 其机制可能是p85a蛋白高表达活化PI3K/Akt细胞信号传导通路, 由于该通路具有较高的生物学效应, 能够通过多种途径抑制nm23基因的活性, 从而降低或失去抑制大肠癌细胞转移和浸润的作用.
研究[28-30]表明, 大肠癌的5年生存率约为40%-65%. 本研究对243例大肠癌患者进行随访, 同时对p85a、nm23、MMP-2蛋白的表达与临床病理因素的相关性进行分析. 结果显示, 5年生存率为50.2%. 并且, 高表达p85a和低表达nm23或者p85a和MMP-2同时高表达的患者术后生存期明显缩短. 多因素回归分析表明, 在影响患者预后的各种临床病理因素中, p85a、nm23、MMP-2蛋白的异常表达是独立影响因子.
本实验研究结果表明, 在大肠癌组织中同时存在p85a、nm23、MMP-2的异常表达, 并与患者的预后密切相关. 检测大肠癌组织中p85a、nm23、MMP-2的表达对于判断大肠癌的进展及预后有重要的意义. 然而, 肿瘤的发生发展是多种因素共同参与作用的结果, 对于p85a与nm23、p85a与MMP-2在大肠癌发生中的相互影响和调控的关系以及机制还有待于进一步研究.
大肠癌的发病率逐年上升, 早期症状隐匿, 发现时多为中晚期, 仍有半数患者在手术治疗后发生转移, 临床预后不良. 发现大肠癌转移过程中的关键因素, 研究其与大肠癌患者生存之间的关系, 对于大肠癌的诊断、治疗和提高大肠癌患者的生存率, 具有十分重要的意义.
白雪, 副主任医师, 中国人民解放军北京军区总医院普通外科
近年来有关大肠癌与PI3K/AKT通路、nm23、MMP-2之间关系的研究多集中于基础研究领域, 然而, 关于这些因素与大肠癌患者淋巴结转移及预后之间的相关性研究鲜见报道.
p85a的表达与大肠癌Dukes'分期相关, 随分期增高而增高, 明显降低细胞的侵袭能力. nm23具有二磷酸核苷酶的活性, 通过影响微管聚合及G蛋白信号通路来抑制转移. MMP-2属明胶酶类, 通过影响Ⅳ型胶原促进转移.
本研究通过对所选病例进行随访, 并对随访的资料做生存分析, 找寻可以与患者不良预后密切相关的临床病理指标. 在大肠癌原发灶和转移灶中利用免疫组织化学的方法同时测定p85a、nm23、MMP-2的表达, 并分析其表达的相关性, 探讨了p85a和nm23、MMP-2与大肠癌的转移及影响预后的机制.
为进一步完善大肠癌发病机制的研究, 改善患者预后, 开发新的靶向治疗药物提供新的方向和思路.
本文选题新颖, 内容重要, 符合伦理学要求, 具有一定理论及实用价值.
编辑: 郭鹏 电编:闫晋利
| 1. | Kerr D. Clinical development of gene therapy for colorectal cancer. Nat Rev Cancer. 2003;3:615-622. [PubMed] [DOI] |
| 2. | Griffin Lengyel JN, Park EY, Brunson AR, Pinali D, Lane MA. Phosphatidylinositol 3-kinase mediates the ability of retinol to decrease colorectal cancer cell invasion. Nutr Cancer. 2014;66:1352-1361. [PubMed] |
| 3. | Carnero A. The PKB/AKT pathway in cancer. Curr Pharm Des. 2010;16:34-44. [PubMed] |
| 4. | Liu P, Cheng H, Roberts TM, Zhao JJ. Targeting the phosphoinositide 3-kinase pathway in cancer. Nat Rev Drug Discov. 2009;8:627-644. [PubMed] [DOI] |
| 5. | Liu S, Knapp S, Ahmed AA. The structural basis of PI3K cancer mutations: from mechanism to therapy. Cancer Res. 2014;74:641-646. [PubMed] |
| 6. | Kolasa IK, Rembiszewska A, Felisiak A, Ziolkowska-Seta I, Murawska M, Moes J, Timorek A, Dansonka-Mieszkowska A, Kupryjanczyk J. PIK3CA amplification associates with resistance to chemotherapy in ovarian cancer patients. Cancer Biol Ther. 2009;8:21-26. [PubMed] [DOI] |
| 7. | Samuels Y, Ericson K. Oncogenic PI3K and its role in cancer. Curr Opin Oncol. 2006;18:77-82. [PubMed] [DOI] |
| 8. | Mamali I, Tatari MN, Micheva I, Lampropoulou M, Marmaras VJ. Apoptosis in medfly hemocytes is regulated during pupariation through FAK, Src, ERK, PI-3K p85a, and Akt survival signaling. J Cell Biochem. 2007;101:331-347. [PubMed] |
| 9. | De Gregorio G, Coppa A, Cosentino C, Ucci S, Messina S, Nicolussi A, D'Inzeo S, Di Pardo A, Avvedimento EV, Porcellini A. The p85 regulatory subunit of PI3K mediates TSH-cAMP-PKA growth and survival signals. Oncogene. 2007;26:2039-2047. [PubMed] |
| 10. | Cosentino C, Di Domenico M, Porcellini A, Cuozzo C, De Gregorio G, Santillo MR, Agnese S, Di Stasio R, Feliciello A, Migliaccio A. p85 regulatory subunit of PI3K mediates cAMP-PKA and estrogens biological effects on growth and survival. Oncogene. 2007;26:2095-2103. [PubMed] |
| 11. | Huang J, Zhang L, Greshock J, Colligon TA, Wang Y, Ward R, Katsaros D, Lassus H, Butzow R, Godwin AK. Frequent genetic abnormalities of the PI3K/AKT pathway in primary ovarian cancer predict patient outcome. Genes Chromosomes Cancer. 2011;50:606-618. [PubMed] |
| 12. | Donini CF, Di Zazzo E, Zuchegna C, Di Domenico M, D'Inzeo S, Nicolussi A, Avvedimento EV, Coppa A, Porcellini A. The p85α regulatory subunit of PI3K mediates cAMP-PKA and retinoic acid biological effects on MCF7 cell growth and migration. Int J Oncol. 2012;40:1627-1635. [PubMed] |
| 13. | Fruman DA, Rommel C. PI3K and cancer: lessons, challenges and opportunities. Nat Rev Drug Discov. 2014;13:140-156. [PubMed] |
| 14. | Catasus L, Gallardo A, Cuatrecasas M, Prat J. PIK3CA mutations in the kinase domain (exon 20) of uterine endometrial adenocarcinomas are associated with adverse prognostic parameters. Mod Pathol. 2008;21:131-139. [PubMed] |
| 15. | 王 彦云. RNA干扰靶向抑制PI3K p85a表达对大肠癌细胞侵袭转移的影响. 广州: 南方医科大学 2010; . |
| 16. | Raffetto JD, Khalil RA. Matrix metalloproteinases and their inhibitors in vascular remodeling and vascular disease. Biochem Pharmacol. 2008;75:346-359. [PubMed] |
| 17. | Xu YP, Zhao XQ, Sommer K, Moubayed P. Correlation of matrix metalloproteinase-2, -9, tissue inhibitor-1 of matrix metalloproteinase and CD44 variant 6 in head and neck cancer metastasis. J Zhejiang Univ Sci. 2003;4:491-501. [PubMed] |
| 18. | Wang LB, Jiang ZN, Fan MY, Xu CY, Chen WJ, Shen JG. Changes of histology and expression of MMP-2 and nm23-H1 in primary and metastatic gastric cancer. World J Gastroenterol. 2008;14:1612-1616. [PubMed] |
| 19. | Lombardi D, Lacombe ML, Paggi MG. nm23: unraveling its biological function in cell differentiation. J Cell Physiol. 2000;182:144-149. [PubMed] |
| 20. | Lovato A, Marioni G, Manzato E, Staffieri C, Giacomelli L, Ralli G, Staffieri A, Blandamura S. Elderly patients at higher risk of laryngeal carcinoma recurrence could be identified by a panel of two biomarkers (nm23-H1 and CD105) and pN+ status. Eur Arch Otorhinolaryngol. 2014; Oct 4. [Epub ahead of print]. [PubMed] |
| 21. | He F, York JP, Burroughs SG, Qin L, Xia J, Chen D, Quigley EM, Webb P, LeSage GD, Xia X. Recruited metastasis suppressor NM23-H2 attenuates expression and activity of peroxisome proliferator-activated receptor δ (PPARδ) in human cholangiocarcinoma. Dig Liver Dis. 2014; Sep 29. [Epub ahead of print]. [PubMed] |
| 22. | Wang YF, Chang CJ, Chiu JH, Lin CP, Li WY, Chang SY, Chu PY, Tai SK, Chen YJ. NM23-H1 expression of head and neck squamous cell carcinoma in association with the response to cisplatin treatment. Oncotarget. 2014;5:7392-7405. [PubMed] |
| 23. | 杨 育生, 刘 斌, 邢 传平, 高 自芳, 顾 立萍, 钱 震, 董 亮, 苏 勤军. 胃癌组织中Caveolin-1,nm23及MMP-2的表达及其意义. 世界华人消化杂志. 2007;15:1725-1730. [DOI] |
| 24. | Marqués M, Kumar A, Poveda AM, Zuluaga S, Hernández C, Jackson S, Pasero P, Carrera AC. Specific function of phosphoinositide 3-kinase beta in the control of DNA replication. Proc Natl Acad Sci U S A. 2009;106:7525-7530. [PubMed] |
| 25. | 于 观贞, 王 杰军, 陈 颖, 倪 灿荣, 朱 明华. 转移相关基因nm23和P53及S100A4在晚期胃癌中的表达及与侵袭转移的相关性研究. 中华胃肠外科杂志. 2006;9:165-169. |
| 26. | Dbouk HA, Backer JM. A beta version of life: p110β takes center stage. Oncotarget. 2010;1:729-733. [PubMed] |
| 27. | Kanat O, Adim S, Evrensel T, Yerci O, Ediz B, Kurt E, Demiray M, Gonullu G, Arslan M, Manavoglu O. Prognostic value of nm23 in gastrointestinal stromal tumors. Med Oncol. 2004;21:53-58. [PubMed] |
| 28. | Qi JK, Huang XL, Meng ZM, Gan HT, Fu DG. [The relationship between PTEN expression and PI3K/AKT signal pathway in colon carcinoma]. Sichuan Daxue Xuebao Yixueban. 2009;40:644-646, 654. [PubMed] |
| 29. | 胡 金龙, 何 双, 孙 晨博, 吴 淑华. 自噬相关基因Beclinl、LC3与大肠癌多药耐药性的相关性. 临床与实验病理学杂志. 2014;30:135-139. |
| 30. | 燕 炜, 吴 淑华, 李 扬扬, 高 向前, 孟 晓. 大肠癌组织中PIK3CA和PIK3CB的表达及意义. 临床与实验病理学杂志. 2013;29; 18-22. |