修回日期: 2014-08-20
接受日期: 2014-11-18
在线出版日期: 2014-12-28
目的: 从多药耐药相关蛋白1(multidrug resistance-associated protein 1, MRP1)基因转录调控入手, 初步探讨血管内皮生长因子(vascular endothelial growth factor, VEGF)上调MRP1表达的机制.
方法: (1)以人胃癌BGC-823细胞为模型, 一组常规培养24 h, 另一组VEGF作用24 h, 最后一组PI3K/Akt抑制剂LY294002预处理1 h后再加VEGF作用24 h, Western blot法分别检测各实验组MRP1、Akt、p-Akt及SP1蛋白表达水平, EMSA方法检测各实验组转录因子SP1与DNA的结合活性; (2)构建分别含MRP1基因启动子序列及SP1结合位点突变的MRP1基因启动子序列的重组荧光素酶报告基因载体(PGL3-Basic-MRP1w、PGL3-Basic-MRP1m), 荧光素酶活性分析突变后的MRP1基因启动子在BGC-823细胞中活性的改变及VEGF对其转录活性的影响.
结果: (1)VEGF 32 ng/mL作用24 h组与未处理组相比, MRP1、p-Akt、SP1在蛋白水平均上调, 且SP1的DNA结合活性明显增强; LY294002 50 μmol/mL预处理1 h再联合VEGF 32 ng/mL作用24 h后, 与VEGF 32 ng/mL单独作用组相比, MRP1、p-Akt、SP1在蛋白水平均下调, SP1的DNA结合活性明显减弱; (2)在BGC-823细胞中, PGL3-Basic-MRP1m具有启动子活性(110.000±2.603), 其转录活性为空载体PGL3-Basic的1.8倍(t = -8.936, P<0.01), 但与SP1结合位点突变之前的MRP1启动子(PGL3-Basic-MRP1w)活性(144.000±6.888)相比, 其转录活性下降23.6%(t = 4.617, P<0.05); VEGF作用12 h后, 其活性增强, 且呈剂量依赖关系(r = 0.911, P<0.01), VEGF作用浓度为32 ng/mL时达最大值(191.000±14.799), 与无VEGF作用组(112.000±11.358)相比, 活性增高0.7倍(t = -7.335, P<0.01); VEGF作用24 h后, 也能以剂量依赖的方式上调SP1结合位点突变后MRP1启动子区的转录活性(r = 0.945, P<0.01), 与无VEGF作用组(133.000±6.083)相比, 最大活性(426.000±7.000)增高2.2倍(t = -56.032, P<0.01).
结论: VEGF对MRP1启动子活性的上调作用与激活PI3K/Akt信号通路及增强转录因子SP1的表达及活性相关; MRP1基因启动子区SP1结合位点突变后其启动子活性减弱, VEGF对其活性的上调作用不如突变之前明显.
核心提示: 血管内皮生长因子(vascular endothelial growth factor, VEGF)对多药耐药相关蛋白1(multi-drug resistance-associated protein 1, MRP1)启动子活性的上调作用与激活PI3K/Akt信号通路及增强转录因子SP1的表达及活性相关; MRP1基因启动子区SP1结合位点突变后其启动子活性减弱, VEGF对其活性的上调作用不如突变之前明显.
引文著录: 李娟, 许文林, 冷加燕. PI3K/Akt信号通路及SP1在VEGF上调胃癌细胞MRP1中的作用. 世界华人消化杂志 2014; 22(36): 5587-5593
Revised: August 20, 2014
Accepted: November 18, 2014
Published online: December 28, 2014
AIM: To explore the mechanism by which vascular endothelial growth factor (VEGF) up-regulates multidrug resistance-associated protein 1 (MRP1) in gastric cancer cell line BGC-823.
METHODS: BGC-823 cells cultured in the absence or presence of VEGF for 24 h were pretreated with phosphatidylinositol 3 kinase, PI-3K/protein kinase B, and PKB (PI3K/Akt) inhibitor LY294002 for 1 h before stimulation with VEGF. Western blot assay was applied to assess the expression of MRP1, Akt, p-Akt and specificity protein 1 (SP1) proteins in the three groups of cells described above, and electrophoretic mobility shift assay (EMSA) was adopted to detect the DNA binding activity of transcriptional factor SP1. The sequences of MRP1 promoter and MRP1 promoter with SP1 binding site mutants were synthesized and cloned into the luciferase reporter gene vector PGL3-Basic to result in recombinant plasmids PGL3-Basic-MRP1w and PGL3-Basic-MRP1m, respectively. The recombinant plasmid was transiently co-transfected into BGC-823 cells using lipofectamine 2000 reagent, and the alteration of the mutant MRP1 promoter activity and the effect of VEGF on MRP1 promoter activity were then investigated.
RESULTS: Compared with the control group, the MRP1, p-Akt and SP1 proteins were all up-regulated, and the DNA binding activity of SP1 was significantly enhanced in BGC-823 cells treated with 32 ng/mL VEGF for 24 h. Contrarily, the protein levels of MRP1, p-Akt and SP1 were down-regulated, and the DNA binding activity of SP1 was remarkably decreased in the LY294002 pretreated group when compared with the VEGF 32 ng/mL group. The analysis of the luciferase reporter gene activity indicated that the recombinant plasmid PGL3-Basic-MRP1m possessed its promoter activity (110.000 ± 2.603) in BGC-823 cells, and compared with the control vector PGL3-Basic, its transcriptional activity was increased by 1.8-fold (t = -8.936, P < 0.01). On the contrary, the transcriptional activity of PGL3-Basic-MRP1m was reduced by 23.6% compared with PGL3-Basic-MRP1w (t = 4.617, P < 0.05), and this was dose-dependently enhanced at the 12-h time point after the transfected cells were treated with VEGF (r = 0.911, P < 0.01). When the concentration of VEGF was increased to 32 ng/mL to continuously stimulate the cells for 12 h, the transcriptional activity of PGL3-Basic-MRP1m (191.000 ± 14.799) was 0.7-fold increased than the control group (112.000 ± 11.358, t = -7.335, P < 0.01). Similarly, 24 h after the transfected cells were treated with VEGF, the mutant MRP1 promoter activity was also up-regulated in a dose-dependent manner (r = 0.945, P < 0.01). Compared with untreated cells (133.000 ± 6.083), the greatest activity (426.000 ± 7.000) of about 2.2-fold was observed (t = -56.032, P < 0.01).
CONCLUSION: The PI3K/Akt signaling pathway and transcriptional factor SP1 are two critical factors involved in VEGF-mediated augmentation of the activity of the MRP1 promoter; the transcriptional activity of the MRP1 promoter is decreased by SP1 binding site mutation, and the enhancing effect of VEGF on the promoter activity is weakened when compared with the wild type MRP1 promoter.
- Citation: Li J, Xu WL, Leng JY. Role of PI3K/Akt and SP1 in VEGF induced up-regulation of MRP1 in gastric cancer cell line BGC-823. Shijie Huaren Xiaohua Zazhi 2014; 22(36): 5587-5593
- URL: https://www.wjgnet.com/1009-3079/full/v22/i36/5587.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i36.5587
人类血管内皮生长因子(vascular endothelial growth factor, VEGF), 1989年由Ferrara等[1]发现具有促血管内皮细胞有丝分裂的活性. VEGF对于肿瘤新生血管的生成及肿瘤的发展、转移、预后判断具有十分重要的意义[2]. 现已经研究证实, 大多数肿瘤细胞存在VEGF自分泌机制, 通过某种机制调节自身的分裂增殖和其他生物学行为[3-5]. 在病理条件下, 特别是肿瘤细胞, VEGF无论是在mRNA水平还是在蛋白水平均有过量表达, VEGF的表达水平和肿瘤组织的血管化程度及恶性程度呈明显正相关[6-8]. 目前已有研究[9,10]发现恶性肿瘤中VEGF的高表达与肿瘤细胞多药耐药(multidrug resistance, MDR)密切相关, 肿瘤患者血清中VEGF含量的高低与疾病的预后密切相关[11]. 我们的前期工作发现VEGF可以上调肿瘤细胞中多药耐药相关蛋白1(multidrug resistance-associated protein 1, MRP1)mRNA和蛋白的表达, 之后我们又构建了含MRP1启动子区-91/+103序列的重组荧光素酶报告基因载体(命名为PGL3-Basic-MRP1w)[12], 发现这段序列在人胃癌BGC-823细胞中具有启动子活性, VEGF能以剂量依赖的方式增强MRP1启动子区的活性, PI3K/Akt信号通路抑制剂可以有效地抑制VEGF对MRP1启动子区的转录激活. 但是MRP1基因的转录调控机制非常复杂, 在启动子近侧区的正负调控结构域有多个公认的调节位点如TATA及CAT盒, 进一步对序列检测后显示这些位点包含转录因子specificity protein 1(SP1)、activator protein 1(AP1)、activator protein 2(AP2)等结合序列. 因此, 本研究采用Western blot、EMSA方法分析了PI3K/Akt信号通路及转录因子SP1在VEGF上调MRP1启动子活性中的作用, 并构建了含SP1结合位点突变的MRP1启动子区序列的重组荧光素酶报告基因载体(命名为PGL3-Basic-MRP1m), 探讨了SP1结合位点突变后对MRP1启动子区活性及VEGF上调MRP1转录调控作用的影响, 从而进一步阐述VEGF参与肿瘤细胞MDR发生、发展的作用机制.
人胃癌细胞株BGC-823由本实验室保存, 37 ℃、50 mL/L CO2饱和湿度条件下于含10%小牛血清的DMEM培养基中培养. 重组人VEGF购自Peprotech公司, LY294002购自Cell Signaling公司, Lightshift EMSA Kit购自PIERCE公司, 重组PGL3-Basic-MRP1w及PGL3-Basic-MRP1m报告基因质粒及空载体PGL3-Basic由上海捷瑞生物工程有限公司提供, 内参质粒β-半乳糖苷酶(β-galactosidase, β-gal)由江苏大学医学院陈永昌教授惠赠, 转染试剂Lipofectamine 2000购自Invitrogen公司, 荧光素酶报告基因检测试剂盒及β-半乳糖苷酶报告基因检测试剂盒购自碧云天生物技术研究所.
1.2.1 细胞培养: 取BGC-823细胞, 按2.5×105/孔接种于6孔板中, 37 ℃、50 mL/L CO2培养箱内培养. 实验分3组(每组设3个复孔): 一组常规培养24 h; 另一组加入32 ng/mL VEGF培养24 h; 最后一组加50 μmol/mL LY294002预处理1 h后, 再加入32 ng/mL VEGF继续培养24 h.
1.2.2 Western blot法检测MRP1、Akt、p-Akt及SP1蛋白的表达: 取上述3组细胞各2×106, PBS洗涤2次, 按Nuclear/cytosol Fractionation Kit说明书提取胞浆及胞核蛋白, 行BCA蛋白制作标准曲线后定量, 取50 μg总蛋白加适量上样缓冲液100 ℃煮沸5 min变性, 12%SDS-PAGE电泳, 1 mA/cm2恒流半干转膜, 5%的脱脂奶粉室温摇床封闭1 h, 以GAPDH(1:500)作内参照, 兔抗人MRP1抗体(1:200)、Akt抗体(1:500)、p-Akt抗体(1:500)和SP1抗体(1:500), 4 ℃过夜, 1×TBST液洗膜3次, 10 min/次, 山羊抗兔二抗(1:2000)室温摇床40 min, 洗膜同上, DAB显色试剂盒显色后拍摄.
1.2.3 EMSA法检测SP1的DNA结合活性: 取上述3组细胞各1×106, PBS洗涤2次, 参照PIERCE公司试剂盒实验方法进行, 等量细胞核抽提物(10 μg)与生物素标记的凝胶寡核苷酸探针(50 ng)在20 ℃下反应30 min; 反应混合物经非变性聚丙烯酰胺凝胶(PAGE)在0.5×TBE电泳缓冲液中于4 ℃、120 V电泳3 h, 用半干电转移法转移于尼龙膜上; 用GAE封闭液Q室温下封闭尼龙膜1 h; 加入碱性磷酸偶联的链亲和素(用1×缓冲液F 1:7500稀释), 室温震摇15 min, 加1.0 mL化学发光底物室温震荡孵育5 min, X线下显影.
1.2.4 重组PGL3-Basic-MRP1w及PGL3-Basic-MRP1m报告基因质粒的合成: 对人MRP1基因5'端-2008-+103侧翼序列进行分析后, 发现此区域-91-+103序列具有启动子活性[12], 合成这段DNA序列, 经KpnⅠ、NcoⅠ双酶切后, 连于PGL3-Basic荧光素酶报告基因载体上, 其中MRP1基因启动子位于报告基因的上游(命名为PGL3-Basic-MRP1w). 这段序列包含3个SP1结合位点, 分别为-28/-22、-24/-18、-14/-8, 结合位点序列为5'-GGGCGGG-3'. 有研究[13]发现将质膜-细胞骨架连接蛋白Ezrin基因启动子区-75/-69经典的SP1结合位点序列GGGCGGG突变为AATATTT后, 荧光素酶活性降低约50%. 因此, 本研究中将MRP1启动子区3个SP1结合位点突变为AATATTT, 合成突变之后的MRP1 5'端-91到+103序列, 构建重组荧光素酶报告基因质粒PGL3-Basic-MRP1m.
1.2.5 质粒瞬时共同转染人胃癌BGC-823细胞: 取指数生长期人胃癌BGC-823细胞株按2.5×105/孔接种于6孔板中, 37 ℃、50 mL/L CO2培养箱内过夜培养, 直到细胞80%融合. 参照Lipofectamine 2000 Reagent说明书, 在EP管中配制重组质粒或空载体PGL3-Basic、内参质粒β-gal及转染脂质体Lipofectamine 2000复合物. A液: 将重组质粒或空载体PGL3-Basic、内参质粒β-gal各1 μg/孔稀释至100 μL/孔不含血清的DMEM培养液中, 用加样枪混合均匀, 室温静置5 min ; B液: 将Lipofectamine 2000 6 μL/孔溶于100 μL/孔不含血清的DMEM培养液中, 用加样枪混合均匀, 室温静置5 min; 将A、B两液混合, 室温下静置30 min后加入用无菌PBS洗涤2次的待转染细胞中. 37 ℃、50 mL/L CO2培养箱常规培养4-6 h, 弃去培养液, 换含10%小牛血清的DMEM培养液继续培养.
1.2.6 SP1结合位点突变前后MRP1启动子区活性的测定: 收集上述转染之后的细胞, 参照试剂盒说明分别测定荧光素酶和β-gal活性. 其中β-gal活性用于校正细胞转染效率, 启动子活性为细胞转染效率校正后的荧光素酶活性, 即启动子活性 = 荧光素酶/β-gal活性.
1.2.7 SP1结合位点突变后VEGF对MRP1启动子区活性的影响: VEGF设5个浓度, 即0、0.5、2.0、8.0、32.0 ng/mL. 每孔细胞中共同转染1 μg重组质粒PGL3-Basic-MRP1m和1 μg内参质粒β-gal, 转染4-6 h后换含10%小牛血清的DMEM培养液, 加入不同浓度的VEGF分别继续培养6、12、24 h, 测定荧光素酶和β-gal活性, 计算启动子活性, 方法同上.
统计学处理 计量资料以mean±SD表示, 应用SPSS17.0软件对实验数据进行统计分析, 采用两组资料t检验及直线相关分析, P<0.05为差异具有统计学意义.
结果如图1所示, 3组Akt蛋白总量无明显差异, 与对照组(未处理组)相比较, VEGF单独作用组MRP1、p-Akt及SP1蛋白表达出现上调, 蛋白条带变粗; 而LY294002+VEGF处理组与VEGF单独作用组相比, MRP1、p-Akt及SP1蛋白表达出现下调, 蛋白条带明显变细. 提示在VEGF上调MRP1蛋白表达的过程中, Akt、SP1蛋白发生了磷酸化激活.
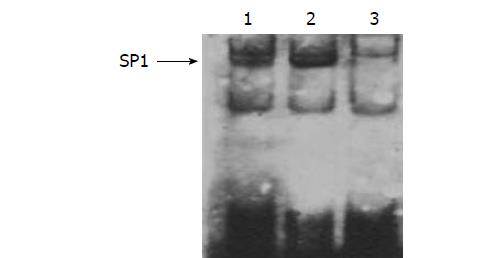
结果发现(图2), 未处理组、VEGF组、LY294002+VEGF组SP1与DNA结合的荧光强度分别为: 3753.27、4898.64、1296.22, 可见SP1与其探针结合的荧光强度在VEGF单独作用组明显增强, 而此增强作用可被PI3K/Akt信号通路抑制剂LY294002有效抑制.
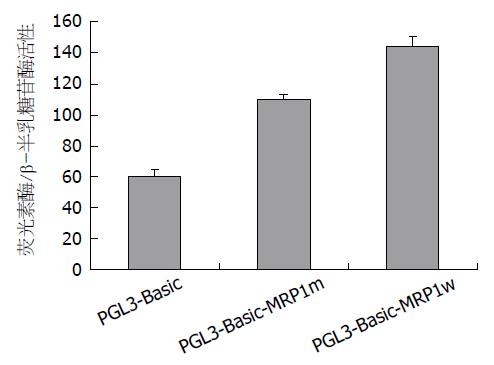
荧光素酶活性分析显示(图3), 重组质粒PGL3-Basic-MRP1m组转录活性(110.000±2.603)是空载体PGL3-Basic组(60.000±4.910)的1.8倍, 差异具有统计学意义(t = -8.936, P<0.01), 但与重组质粒PGL3-Basic-MRP1w组(144.000±6.888)相比, 重组质粒PGL3-Basic-MRP1m组转录活性下降23.6%(t = 4.617, P<0.05), 提示MRP1启动子区SP1结合位点突变后其转录活性减弱.
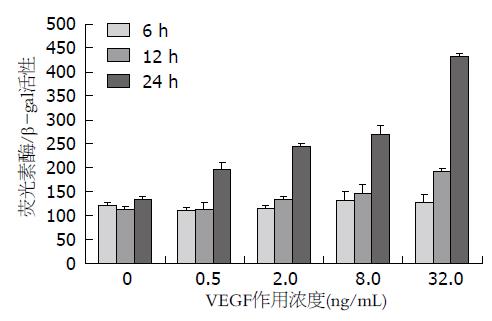
结果如图4. VEGF作用6 h后, 与无VEGF作用组相比, SP1结合位点突变后的MRP1启动子活性无明显变化(P>0.05); 作用12 h后, 活性逐渐增强, 呈剂量依赖关系(r = 0.911, P<0.01), VEGF作用浓度为32 ng/mL时达最大值, 与无VEGF作用组相比, 活性增高0.7倍(t = -7.335, P<0.01); VEGF作用24 h后, 也能以剂量依赖的方式上调SP1结合位点突变后MRP1启动子区的转录活性(r = 0.945, P<0.01), 与无VEGF作用组相比, 最大活性增高2.2倍(t = -56.032, P<0.01).
众所周知, 血管新生是肿瘤生长、进展和转移进程中必需的一个病理生理过程, 可导致原发肿瘤细胞呈指数性增长[14], 而VEGF是肿瘤血管生成过程中作用最强、特异性最高的调控因子, 其调控肿瘤血管生成的作用机制已经证实, 在肿瘤生长的各个环节中起重要作用[15]. 目前, 越来越多的研究认为VEGF与肿瘤细胞MDR关系密切, 外周血VEGF水平已成为肿瘤治疗和预后判断的重要因素, 也是肿瘤治疗的靶标[16]. Volm等[17]通过研究31种细胞因子对多柔比星与非小细胞肺肉瘤敏感性的影响, 发现耐多柔比星的非小细胞肺癌中VEGF及其受体Flt-1表达明显高于对多柔比星敏感的细胞, 这提示我们VEGF可能与耐药形成有关. Klement等[18]在治疗耐药的乳腺癌时, 同时应用小剂量化疗药物和抗VEGFR抗体, 发现能明显增强化疗效果, 逆转肿瘤细胞P-gp介导的耐药性, 治疗3 wk, 耐药乳腺癌细胞开始死亡, 瘤体明显缩小. Zhang等[19]发现VEGF165介导的HDMEC多药耐药表型对多种药物耐受, 如顺铂、丝裂霉素、VP-16、泰素等, 而这种保护性作用部分归因于MRP和LRP的上调. 且我们前期的工作发现VEGF可以上调白血病细胞K562、胃癌细胞BGC-823中MRP1 mRNA和蛋白的表达, 同时能以剂量依赖的方式增强MRP1启动子区的活性. 研究表明, VEGF与其特异性受体VEGFR结合之后, 引发受体酪氨酸激酶活化, 可以激活其下游的PI3K/Akt信号通路, 从而发挥生物学行为. PI3K/Akt信号通路是体内重要的信号转导通路之一, 在维持细胞的正常生理功能, 如生长、分化、代谢等方面起着关键作用[20-22]. Akt在PI3K调节作用下发生磷酸化而激活, Akt的异常表达与肿瘤的发生、发展以及对放化疗产生的耐受密切相关[23-25]. Tazzari等[26]研究发现, PI3K/Akt信号转导网络系统在调控MRP1水平中起着很重要的作用, 可以通过上调MRP1的表达水平而导致白血病细胞耐药, MRP1水平与PI3K/Akt表达在AML细胞中呈正相关性. 我们用PI3K/Akt信号通路抑制剂LY294002预处理细胞后, 发现VEGF上调MRP1蛋白作用明显减弱, 进一步证实了PI3K/Akt信号通路在VEGF激活MRP1转录过程中的积极作用.
同时, 在对MRP1表达调控的研究过程中, 寻找关键的转录因子及其结合部位, 并明确其在转录调控过程中发挥怎样的作用对于靶向MRP1的肿瘤治疗意义重大. MRP1基因的转录调控机制非常复杂, 其启动子区中含有多个正负调控元件, 包括SP1结合位点、GC丰富区、NE-1结合域等. SP1是一种基本的参与真核生物转录起始的转录因子, 以细胞和启动子特异性方式通过调控富含GC启动子的基因表达, 参与调节细胞功能如细胞增殖、凋亡、分化和肿瘤形成[27]. SP1自身表达水平、磷酸化、糖基化等翻译后修饰、其他蛋白质的结合以及染色质结构与修饰等方面均能影响SP1蛋白的转录活性[28,29]. 有研究[30]发现, 激活PI3K/Akt信号通路可有效刺激转录因子SP1磷酸化, 使其DNA结合力增加, 转录活性增强, 进而启动下游基因的转录. 我们在实验过程中也发现VEGF不仅能上调转录因子SP1的蛋白表达水平, 同时还能使其DNA结合活性增强, 而这一作用可被PI3K/Akt信号通路抑制剂LY294002有效抑制. 因此, 我们进一步合成MRP1基因启动子区SP1结合位点突变序列的重组荧光素酶报告基因载体, 并将其转染入人胃癌BGC-823细胞, 发现MRP1基因启动子区SP1结合位点突变后其启动子活性减弱, VEGF作用12 h和24 h后虽然也能以剂量依赖的方式上调突变后的MRP1启动子的活性, 与未处理组相比, 最大活性分别上调0.7倍、2.2倍, 但对其活性的上调作用均不如突变之前明显(前期工作发现SP1结合位点突变之前VEGF作用12 h和24 h后最大活性分别上调4.4倍、2.5倍), 提示转录因子SP1在MRP1的转录调控过程中发挥了关键作用.
总之, PI3K/Akt信号通路及转录因子SP1在VEGF调控MRP1转录表达过程中作用重大, 是否能通过阻断此途径下调MRP1的表达从而达到抑制肿瘤细胞生长、促进肿瘤细胞凋亡、逆转或预防肿瘤细胞多药耐药的目的值得研究, 进而为靶向MRP1的肿瘤治疗提供实验依据.
目前已研究发现恶性肿瘤中血管内皮生长因子(vascular endothelial growth factor, VEGF)的高表达与肿瘤细胞多药耐药(multidrug resistance, MDR)密切相关, 肿瘤患者血清中VEGF含量的高低与疾病的预后密切相关, 肿瘤细胞的MDR已成为国内外研究的热点.
蒋敬庭, 教授, 常州市第一人民医院(苏州大学附属第三医院)肿瘤生物诊疗中心
本文初步探讨VEGF引起肿瘤细胞MDR的机制, 为靶向多药耐药相关蛋白1(multidrug resistance-associated protein 1, MRP1)的肿瘤治疗提供了理论依据.
越来越多的研究认为VEGF与肿瘤细胞MDR关系密切, 外周血VEGF水平已成为肿瘤治疗和预后判断的重要因素, 也是肿瘤治疗的靶标.
肿瘤细胞MDR已成为国内外研究的热点, 但大量的工作主要集中于MRP1基因及其编码的P-gp、MRP1则相对研究较少. 目前国内外学者对于VEGF的研究主要着眼于其与肿瘤增殖、侵袭凋亡及转移的关系, VEGF与肿瘤耐药的研究则相对较少.
PI3K/Akt信号通路及转录因子SP1在VEGF调控MRP1转录表达过程中作用重大, 是否能通过阻断此途径下调MRP1的表达从而达到抑制肿瘤细胞生长、促进肿瘤细胞凋亡、逆转或预防肿瘤细胞多药耐药的目的, 值得研究, 进而为靶向MRP1的肿瘤治疗提供实验依据.
多药耐药(MDR): 指肿瘤细胞接触一种抗肿瘤药物并产生耐药以后, 同时对结构和作用机制不同的多种天然来源的抗肿瘤药物具有交叉耐药性.
课题组成员在前期研究工作中发现VEGF可以上调肿瘤细胞中MRP1的表达, 并发现含MRP1启动子区-91/+103序列在人胃癌BGC-823细胞中具有启动子活性. 此文在此基础上探讨对MRP1启动子区的调控作用, 并从信号机制入手, 进一步探讨PI3K/Akt信号通路及转录因子SP1对MRP1的转录调控作用, 研究工作具有一定的延续性和创新性.
编辑: 郭鹏 电编:闫晋利
| 1. | Ferrara N, Henzel WJ. Pituitary follicular cells secrete a novel heparin-binding growth factor specific for vascular endothelial cells. 1989. Biochem Biophys Res Commun. 2012;425:540-547. [PubMed] [DOI] |
| 2. | Inda AM, Andrini LB, García MN, García AL, Fernández Blanco A, Furnus CC, Galletti SM, Prat GD, Errecalde AL. Evaluation of angiogenesis with the expression of VEGF and CD34 in human non-small cell lung cancer. J Exp Clin Cancer Res. 2007;26:375-378. [PubMed] |
| 3. | Byeon SH, Lee SC, Choi SH, Lee HK, Lee JH, Chu YK, Kwon OW. Vascular endothelial growth factor as an autocrine survival factor for retinal pigment epithelial cells under oxidative stress via the VEGF-R2/PI3K/Akt. Invest Ophthalmol Vis Sci. 2010;51:1190-1197. [PubMed] [DOI] |
| 4. | Issaka RB, Oommen S, Gupta SK, Liu G, Myers JL, Ryu JH, Vlahakis NE. Vascular endothelial growth factors C and D induces proliferation of lymphangioleiomyomatosis cells through autocrine crosstalk with endothelium. Am J Pathol. 2009;175:1410-1420. [PubMed] [DOI] |
| 5. | Arbiser JL. Unexpected autocrine role of vascular endothelial growth factor in squamous cell carcinoma. J Invest Dermatol. 2009;129:538-540. [PubMed] [DOI] |
| 6. | Ghanem MA, van Steenbrugge GJ, Sudaryo MK, Mathoera RB, Nijman JM, van der Kwast TH. Expression and prognostic relevance of vascular endothelial growth factor (VEGF) and its receptor (FLT-1) in nephroblastoma. J Clin Pathol. 2003;56:107-113. [PubMed] |
| 7. | Imura S, Miyake H, Izumi K, Tashiro S, Uehara H. Correlation of vascular endothelial cell proliferation with microvessel density and expression of vascular endothelial growth factor and basic fibroblast growth factor in hepatocellular carcinoma. J Med Invest. 2004;51:202-209. [PubMed] |
| 8. | Kim KJ, Li B, Winer J, Armanini M, Gillett N, Phillips HS, Ferrara N. Inhibition of vascular endothelial growth factor-induced angiogenesis suppresses tumour growth in vivo. Nature. 1993;362:841-844. [PubMed] [DOI] |
| 9. | Avramis IA, Kwock R, Avramis VI. Taxotere and vincristine inhibit the secretion of the angiogenesis inducing vascular endothelial growth factor (VEGF) by wild-type and drug-resistant human leukemia T-cell lines. Anticancer Res. 2001;21:2281-2286. [PubMed] |
| 10. | Katoh O, Takahashi T, Oguri T, Kuramoto K, Mihara K, Kobayashi M, Hirata S, Watanabe H. Vascular endothelial growth factor inhibits apoptotic death in hematopoietic cells after exposure to chemotherapeutic drugs by inducing MCL1 acting as an antiapoptotic factor. Cancer Res. 1998;58:5565-5569. [PubMed] |
| 11. | Lieto E, Ferraraccio F, Orditura M, Castellano P, Mura AL, Pinto M, Zamboli A, De Vita F, Galizia G. Expression of vascular endothelial growth factor (VEGF) and epidermal growth factor receptor (EGFR) is an independent prognostic indicator of worse outcome in gastric cancer patients. Ann Surg Oncol. 2008;15:69-79. [PubMed] [DOI] |
| 12. | Zhu Q, Center MS. Cloning and sequence analysis of the promoter region of the MRP gene of HL60 cells isolated for resistance to adriamycin. Cancer Res. 1994;54:4488-4492. [PubMed] |
| 13. | 高 书颖, 李 恩民, 孟 令英, 崔 磊, 袁 华敏, 杜 泽澎, 许 丽艳. 肺癌细胞中调控ezrin基因基本转录活性的顺式作用元件及转录因子的鉴定. 生物化学与生物物理进展. 2009;36:288-296. |
| 14. | Meric JB. [Angiogenesis targeting in gastro-intestinal cancers]. Bull Cancer. 2007;94:F207-F215. [PubMed] |
| 15. | Calvo A, Catena R, Noble MS, Carbott D, Gil-Bazo I, Gonzalez-Moreno O, Huh JI, Sharp R, Qiu TH, Anver MR. Identification of VEGF-regulated genes associated with increased lung metastatic potential: functional involvement of tenascin-C in tumor growth and lung metastasis. Oncogene. 2008;27:5373-5384. [PubMed] [DOI] |
| 16. | Podar K, Anderson KC. The pathophysiologic role of VEGF in hematologic malignancies: therapeutic implications. Blood. 2005;105:1383-1395. [PubMed] [DOI] |
| 17. | Volm M, Rittgen W. Cellular predictive factors for the drug response of lung cancer. Anticancer Res. 2000;20:3449-3458. [PubMed] |
| 18. | Klement G, Huang P, Mayer B, Green SK, Man S, Bohlen P, Hicklin D, Kerbel RS. Differences in therapeutic indexes of combination metronomic chemotherapy and an anti-VEGFR-2 antibody in multidrug-resistant human breast cancer xenografts. Clin Cancer Res. 2002;8:221-232. [PubMed] |
| 19. | Zhang XS, Zhu XF, Gao JS, Qian CN, Kuang ZJ, Liu ZC, Zeng YX. Multiple drug resistance phenotype of human endothelial cells induced by vascular endothelial growth factor 165. Acta Pharmacol Sin. 2001;22:731-735. [PubMed] |
| 20. | Xu Q, Simpson SE, Scialla TJ, Bagg A, Carroll M. Survival of acute myeloid leukemia cells requires PI3 kinase activation. Blood. 2003;102:972-980. [PubMed] [DOI] |
| 21. | Kubota Y, Ohnishi H, Kitanaka A, Ishida T, Tanaka T. Constitutive activation of PI3K is involved in the spontaneous proliferation of primary acute myeloid leukemia cells: direct evidence of PI3K activation. Leukemia. 2004;18:1438-1440. [PubMed] [DOI] |
| 22. | Min YH, Eom JI, Cheong JW, Maeng HO, Kim JY, Jeung HK, Lee ST, Lee MH, Hahn JS, Ko YW. Constitutive phosphorylation of Akt/PKB protein in acute myeloid leukemia: its significance as a prognostic variable. Leukemia. 2003;17:995-997. [PubMed] [DOI] |
| 23. | Testa JR, Bellacosa A. AKT plays a central role in tumorigenesis. Proc Natl Acad Sci U S A. 2001;98:10983-10985. [PubMed] |
| 24. | Nicholson KM, Anderson NG. The protein kinase B/Akt signalling pathway in human malignancy. Cell Signal. 2002;14:381-395. [PubMed] |
| 25. | Neri LM, Borgatti P, Tazzari PL, Bortul R, Cappellini A, Tabellini G, Bellacosa A, Capitani S, Martelli AM. The phosphoinositide 3-kinase/AKT1 pathway involvement in drug and all-trans-retinoic acid resistance of leukemia cells. Mol Cancer Res. 2003;1:234-246. [PubMed] |
| 26. | Tazzari PL, Cappellini A, Ricci F, Evangelisti C, Papa V, Grafone T, Martinelli G, Conte R, Cocco L, McCubrey JA. Multidrug resistance-associated protein 1 expression is under the control of the phosphoinositide 3 kinase/Akt signal transduction network in human acute myelogenous leukemia blasts. Leukemia. 2007;21:427-438. [PubMed] [DOI] |
| 27. | Rieber M, Strasberg Rieber M. Unequal nuclear Sp1/GC box DNA binding activity distinguishes proliferating from differentiated senescent or apoptotic cells. Int J Cancer. 1999;83:359-364. [PubMed] |
| 28. | French SW, Malone CS, Shen RR, Renard M, Henson SE, Miner MD, Wall R, Teitell MA. Sp1 transactivation of the TCL1 oncogene. J Biol Chem. 2003;278:948-955. [PubMed] [DOI] |
| 29. | Li L, He S, Sun JM, Davie JR. Gene regulation by Sp1 and Sp3. Biochem Cell Biol. 2004;82:460-471. [PubMed] |
| 30. | Pore N, Liu S, Shu HK, Li B, Haas-Kogan D, Stokoe D, Milanini-Mongiat J, Pages G, O'Rourke DM, Bernhard E. Sp1 is involved in Akt-mediated induction of VEGF expression through an HIF-1-independent mechanism. Mol Biol Cell. 2004;15:4841-4853. [PubMed] [DOI] |