修回日期: 2014-10-28
接受日期: 2014-11-18
在线出版日期: 2014-12-18
目的: 研究赖氨酰氧化酶样蛋白-2(lysyl oxidase-like 2 protein, LOXL2)及黏附蛋白E-cadherin在胆管癌的表达, 探讨其表达情况与胆管癌生物学行为的关系.
方法: 应用SP法及RT-PCR技术分别检测47例胆管癌、47例配对的癌旁组织、20例正常胆管组织中LOXL2和E-cadherin的表达情况, 对结果应用SPSS17.0统计软件进行. 数据进行统计学分析.
结果: (1)在47例胆管癌组织、癌旁组织、正常胆管组织中LOXL2蛋白的阳性表达率分别为68.1%、10.6%、10.0%(P<0.05); E-cadherin蛋白阳性表达率分别为21.3%、74.5%、95.0%, 差异均具有统计学意义(P<0.05); (2)胆管癌组织、癌旁组织、正常胆管组织中LOXL2 mRNA的表达分别为154.63±128.96、5.35±11.85、4.52±10.79(P<0.05); E-cadherin mRNA的表达分别为0.18±0.25、0.95±0.62、1.08±0.33(P<0.05); (3)胆管癌组织中E-cadherin的表达减弱和LOXL2的表达增强均与患者肿瘤的分化程度、分期、淋巴结转移和组织器官转移相关(P<0.05); (4)胆管癌中E-cadherin和LOXL2的表达呈负相关.
结论: 在胆管癌组织中E-cadherin的表达低于癌旁组织减弱, 而LOXL2表达高于癌旁组织; 二者的表达呈负相关且与肿瘤的分化程度有明显相关性.
核心提示: 赖氨酰氧化酶样蛋白-2(lysyl oxidase-like 2 protein, LOXL2)表达增高, 通过调节作用抑制E-cadherin的表达诱导上皮-间叶样表型转化(epithelial-mesenchymal transitions), 从而促进胆管癌的浸润转移. E-cadherin的表达减弱及LOXL2的表达增强共同促进胆管癌的浸润转移.
引文著录: 刘鹏, 王建华, 蒋海滨, 彭娅. LOXL2和E-cadherin在胆管癌浸润转移中的表达及相关性. 世界华人消化杂志 2014; 22(35): 5542-5549
Revised: October 28, 2014
Accepted: November 18, 2014
Published online: December 18, 2014
AIM: To examine the expression of lysyl oxidase-like 2 (LOXL2) and E-cadherin in cholangiocarcinoma, and to analyze their relationship with clinicopathological features of cholangiocarcinoma.
METHODS: Streptavidin-peroxidase (SP) immunohistochemical method and SYBR green real-time polymerase chain reaction (RT-PCR) were used to detect the protein and mRNA expression of LOXL2 and E-cadherin in 47 cases of cholangiocarcinoma, 47 matched tumor adjacent tissues, and 20 normal bile duct tissues.
RESULTS: Expression of LOXL2 protein was significantly higher in cholangiocarcinoma than in matched tumor adjacent tissues and normal bile duct tissues (68.1% vs 10.6%, 10.0%, P < 0.05). Expression of E-cadherin protein was significantly lower in cholangiocarcinoma than in paired tumor adjacent tissues and normal bile duct tissue (21.3% vs 74.5%, 95.0%, P < 0.05). Expression of LOXL2 mRNA was significantly higher in cholangiocarcinoma than in paired tumor adjacent tissues and normal bile duct tissues (154.63 ± 128.96 vs 5.35 ± 11.85, 4.52 ± 10.79, P < 0.05). Expression of E-cadherin mRNA was significantly lower in cholangiocarcinoma than in paired tumor adjacent tissues and normal bile duct tissues (0.18 ± 0.25 vs 0.95 ± 0.62, 1.08 ± 0.33, P < 0.05). Down-regulation of E-cadherin and up-regulation of LOXL2 were related with tumor differentiation, stage, lymph node metastasis and distant organ metastasis (P < 0.05). The expression of E-cadherin was negatively related to that of LOXL2.
CONCLUSION: Expression of E-cadherin is significantly lower and that of LOXL2 is significantly higher in cholangiocarcinoma. Expression of E-cadherin and LOXL2 is associated with tumor differentiation, stage, lymph node metastasis and distant organ metastasis in cholangiocarcinoma.
- Citation: Liu P, Wang JH, Jiang HB, Peng Y. Expression of E-cadherin and lysyl oxidase-like 2 in cholangiocarcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(35): 5542-5549
- URL: https://www.wjgnet.com/1009-3079/full/v22/i35/5542.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i35.5542
胆管癌是来源于肝内或肝外胆管上皮的恶性肿瘤, 恶性程度很高. 起病隐匿, 临床早期诊断困难, 预后较差. 而影响胆管癌治疗和患者远期生存率的主要因素是肿瘤的浸润和转移. 现代分子生物学研究[1]表明, 黏附蛋白调节紊乱及细胞外基质环境破坏是恶性肿瘤侵润转移的重要机制之一. E-cadnerin为一类主要介导细胞间同质黏附的钙依赖性跨膜糖蛋白, 与许多肿瘤的发生、发展、预后都有相关性[1]. 赖氨酰氧化酶样蛋白-2(lysyl oxidase-like 2 protein, LOXL2)是一类细胞外基质修饰酶, 肿瘤细胞的生长和行为强烈依赖他们的微环境, LOXL2主要通过SnaiL/E-cadherin或Src/FAK这两条通路促进肿瘤浸润转移[2]. 目前尚未见关于E-cadnerin和LOXL2在胆管癌中的定量表达水平和两者在胆管癌中的联合检测的报道. 本实验收集47例手术切除胆管癌标本, 应用免疫组织化学法及RT-PCR发检测二者在其中的表达情况, 探讨二者在胆管癌浸润转移过程中的作用及意义.
收集湖南省人民医院2011-01/2012-11外科手术治疗的47例胆管癌患者的癌组织标本、47例相匹配的胆管癌旁组织标本(距癌组织>1 cm). 所有患者术前均未接受过放疗和化疗, 标本均经病理检查证实. 其中男性26例, 女性21例, 年龄35-79岁, 平均年龄60岁, 以60岁为界, ≥60岁26例, <60岁21例. 根据世界卫生组织(World Health Organization, WHO)病理分类标准, 高分化腺癌者8例, 中、低分化腺癌39例. 肿瘤部位: 肝内胆管癌11例, 肝门部胆管癌24例, 胆总管中下段癌12例. 经肉眼或病理所见有淋巴结转移者33例, 无淋巴结转移者14例, 有远处转移者16例, 无远处转移者31例, 主要转移在淋巴结、神经、胰腺、肝脏、胆囊等部位. 取同期就诊于该院的良性胆管疾病患者胆管标本20例作为对照, 来源于肝内胆管结石患者行肝叶切除后的胆管组织, 经病理证实无其他病变. SP免疫组织化学染色试剂盒、DAB显色试剂购自由北京中杉生物技术公司, LOXL2鼠抗人单克隆抗体购自美国Abnova公司, E-cadherin鼠抗人单克隆抗体购自福州迈新生物技术公司, SYBRGreen PCR试剂盒购自广州达晖生物公司, 逆转录cDNA合成试剂盒购自MBI公司, 引物设计合成购自上海捷瑞生物公司, 其他: 焦碳酸二乙酯(DEPC)、DEPC处理水、PBS缓冲液、氯仿、异丙醇、无水乙醇切片机烤片机; 电热恒温干燥箱; 冰箱; 微量移液器和离心机; OLYMPUS光学显微镜.
1.2.1 分组: 共分3组: 胆管癌组织组47例; 与胆管癌组织相匹配的癌旁组织组47例; 正常胆管组20例. 行免疫组织化学SP法检测E-cadherin、LOXL2表达, RT-PCR检测E-cadherin、LOXL2表达.
1.2.2 E-cadherin染色结果的判断标准: E-cadherin染色结果的判断标准: 细胞膜出现黄色或棕黄色的细小颗粒着色为阳性信号. 参照Liu等[3]和Szauter等[4]的判断标准, 每张切片选择10个高倍视野, 每个视野记数50个细胞, 按切片中染色反应强度和阳性细胞率分为4级: 无着色为(-); 细胞内出现浅棕色颗粒和/或阳性细胞率<25%为(+); 细胞内出现棕黄色颗粒和/或阳性细胞率为25%-75%为(++); 细胞内出现深棕黄色颗粒和/或阳性细胞率>75%为 (+++). (+++)为表达正常, (++)-(-)为表达减弱或缺失, 鉴于此, 我们把(+++)统计为阳性表达, (++)-(-)统计为阴性表达. 采用PBS液代替一抗作为阴性对照, 用已知胆管癌阳性病理切片作为阳性对照.
1.2.3 LOXL2染色结果的判断标准: LOXL2染色结果的判断标准: 细胞核或细胞浆出现棕黄色细小颗粒状染色为阳性信号, 结果判断参照Akiri等[5]的方法, 每张切片选择10个高倍视野, 每个视野记数50个细胞, 按切片中阳性细胞率及染色反应强度分为4级: 无着色为(-); 细胞核或胞浆内出现浅棕色颗粒和/或阳性细胞率<20%为(+); 细胞内出现棕黄色颗粒和/或阳性细胞率为20%-60%为(++); 细胞内出现深棕黄色颗粒和/或阳性细胞率60%为(+++). 以>20%的胆管癌细胞的胞核/胞浆染色为阳性表达, 否则为阴性表达. 采用PBS液代替一抗作为阴性对照, 用已知胆管癌阳性病理切片作为阳性对照.
1.2.4 RT-PCR结果的判断: RT-PCR结果的判断: E-cadherin mRNA和LOXL2 mRNA的阳性标本荧光定量扩增曲线呈现典型的S型, 融解曲线为单峰, 排除非特异性扩增及引物二聚体的出现(引物序列如表1). △Ct = 样本Ct均值-内参照Ct均值, △△Ct = △Ct-(随机阴性对照样品Ct均值-该样品内参照Ct均值), 以2-△△Ct表示样品中目的基因mRNA相对表达量. 样品中Ct均值<30表示为目的基因阳性表达, 样品中Ct均值>30表示为目的基因阴性表达.
| 引物名称 | 引物序列 | 扩增片段长度(bp) |
| E-cadherin上游 | 5'-ACAGGATGGCTGAAGGTGAC-3' | 141 |
| E-cadherin下游 | 5'-GGATGACACAGCGTGAGAGA-3' | |
| LOXL2上游 | 5'-CTTCTCCTCCCAGATCCACA-3' | 147 |
| LOXL2下游 | 5'-CTGTGACAGTCGTGCCAGAT-3' |
统计学处理 全部资料经Excel建立数据库, 采用SPSS17.0统计软件对数据资料进行分析. 计数资料采用χ2检验, 方差不齐者采用Wilcoxon秩和检验, 相关分析采用Pearson相关分析和Spearman等级相关分析, 检验水准α = 0.05, 以P<0.05为差异有统计学意义.
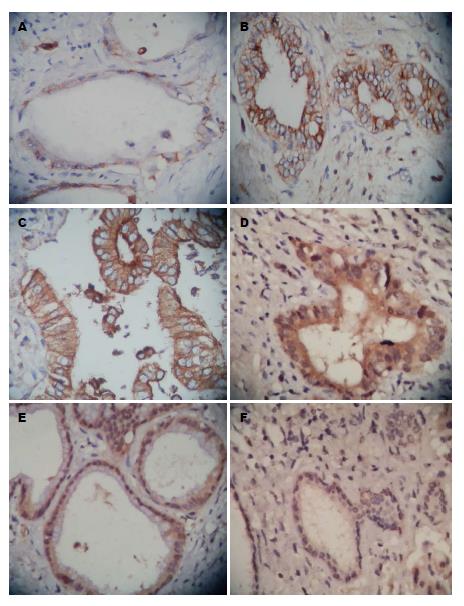
47例胆管癌组织中LOXL2蛋白的表达阳性率为68.1%(32/47), LOXL2 mRNA的表达为154.63±128.96, 癌旁组织组LOXL2蛋白的阳性表达率分别为10.6%(5/47), LOXL2 mRNA的表达为5.35±11.85, 正常胆管组中LOXL2蛋白的表达阳性率为10.0%(2/20), LOXL2 mRNA的表达为5.35±11.85(图1D-F, 2A, 3A). LOXL2蛋白及mRNA的表达在胆管癌组与癌旁组织组和正常胆管组分别比较差异有统计学意义(P<0.05), 癌旁组织组和正常胆管组比较差异无统计学意义(P>0.05), LOXL2蛋白及mRNA在中-低分化组较高分化组表达增强, Ⅲ-Ⅳ期组较Ⅰ-Ⅱ期组表达增强, 有淋巴结转移组较无淋巴结转移组表达增强, 有组织器官转移组较无组织器官转移组表达增强; 另外, LOXL2蛋白及mRNA表达与患者性别、年龄、肿瘤发生部位差异无统计学意义(P>0.05)(表2).
| 临床参数 | n | E-cadherin蛋白 | E-cadherin mRNA | LOXL2蛋白 | LOXL2 mRNA | ||||||||
| +(%) | χ2值 | P值 | +(%) | χ2值 | P值 | +(%) | χ2值 | P值 | +(%) | χ2值 | P值 | ||
| 性别 | 3.295 | 0.070 | 0.022 | 0.881 | 2.092 | 0.148 | 2.066 | 0.151 | |||||
| 男 | 26 | 3(11.5) | 5(19.2) | 20(76.9) | 21(80.8) | ||||||||
| 女 | 21 | 7(33.3) | 4(19.0) | 12(57.1) | 13(61.9) | ||||||||
| 年龄(岁) | 0.113 | 0.737 | 2.177 | 0.140 | 1.148 | 0.284 | 1.407 | 0.236 | |||||
| ≥60 | 26 | 6(23.1) | 3(11.5) | 16(61.5) | 17(65.4) | ||||||||
| <60 | 21 | 4(19.0) | 6(28.6) | 16(76.2) | 17(81.0) | ||||||||
| 肿瘤部位 | 1.635 | 0.442 | 0.098 | 0.952 | 0.142 | 0.931 | 1.168 | 0.558 | |||||
| 肝内胆管 | 11 | 3(27.3) | 2(18.2) | 8(72.7) | 7(63.6) | ||||||||
| 肝门胆管 | 24 | 6(25.0) | 5(20.8) | 16(66.7) | 17(70.8) | ||||||||
| 胆总管中下段 | 12 | 1(8.3) | 2(16.7) | 8(66.7) | 10(83.3) | ||||||||
| 分化程度 | 9.781 | 0.002 | 5.927 | 0.015 | 8.236 | 0.004 | 10.798 | 0.001 | |||||
| 高分化 | 8 | 5(62.5) | 4(50.0) | 2(25.0) | 2(25.0) | ||||||||
| 中-低分化 | 39 | 5(12.8) | 5(12.8) | 30(76.9) | 32(82.1) | ||||||||
| 肿瘤分期 | 5.012 | 0.025 | 6.419 | 0.011 | 6.650 | 0.010 | 5.188 | 0.023 | |||||
| Ⅰ-Ⅱ期 | 11 | 5(45.5) | 5(45.5) | 4(36.4) | 5(45.5) | ||||||||
| Ⅲ-Ⅳ期 | 36 | 5(12.8) | 4(11.1) | 28(77.8) | 29(80.6) | ||||||||
| 淋巴结转移 | 5.544 | 0.019 | 7.239 | 0.007 | 9.616 | 0.002 | 8.662 | 0.003 | |||||
| 有 | 33 | 4(12.1) | 3(9.1) | 27(81.8) | 28(84.8) | ||||||||
| 无 | 14 | 6(42.9) | 6(42.9) | 5(35.7) | 6(42.8) | ||||||||
| 组织器官转移 | 7.315 | 0.007 | 9.483 | 0.002 | 10.443 | 0.001 | 9.910 | 0.002 | |||||
| 有 | 31 | 3(9.7) | 2(6.5) | 26(83.9) | 27(87.1) | ||||||||
| 无 | 16 | 7(43.6) | 7(43.6) | 6(37.5) | 7(43.8) | ||||||||
47例胆管癌组织中E-cadherin蛋白的阳性表达率为21.3%(10/47), E-cadherin mRNA的表达为0.18±0.25; 癌旁组织组E-cadherin蛋白的阳性表达率为74.5%(35/47), E-cadherin mRNA的表达为0.95±0.62; 正常胆管组中E-cadherin的阳性表达率为95.0%(19/20), E-cadherin mRNA的表达为1.08±0.33(图1A-C, 2B, 3B). E-cadherin蛋白及mRNA的表达在胆管癌组与癌旁组织组和正常胆管组分别比较差异有统计学意义(P<0.05), 癌旁组织组与正常胆管组比较差异无统计学意义(P>0.05). E-cadherin蛋白及mRNA在中-低分化组较高分化组表达减弱, Ⅲ-Ⅳ期组较Ⅰ-Ⅱ期组表达减弱, 有淋巴结转移组较无淋巴结转移组表达减弱, 有组织器官转移组较无组织器官转移组表达减弱; E-cadherin蛋白及mRNA的表达与患者性别、年龄、肿瘤部位无明显相关性(P>0.05)(表2).
Spearman等级相关分析结果表明, 在胆管癌组织中E-cadherin蛋白的表达与LOXL2蛋白的表达呈负相关(r = -0.358, P = 0.013)(表3). 胆管癌中E-cadherin和LOXL2蛋白的表达与肿瘤分化程度、肿瘤分期、有无淋巴结转移和有无远处转移差异有统计学意义.
| E-cadherin表达 | LOXL2表达 | ||||
| - | + | ++ | +++ | 合计 | |
| - | 3 | 2 | 3 | 7 | 15 |
| + | 3 | 2 | 3 | 5 | 13 |
| ++ | 4 | 1 | 1 | 3 | 9 |
| +++ | 5 | 3 | 2 | 0 | 10 |
| 合计 | 15 | 8 | 9 | 15 | 47 |
Pearson相关分析结果表明, 在胆管癌组织中E-cadherin mRNA表达与LOXL2 mRNA表达呈负相关(r = -0.464, P = 0.001).
高浸润转移是胆管癌最重要的生物学特性, 胆管癌存在多种转移方式, 胆管癌细胞除直接浸润、种植转移和沿淋巴系统转移外, 血管和神经周围间隙均是重要的转移途径, 但很少发生远处转移, 经淋巴转移是胆管癌的主要转移方式之一. 肿瘤的浸润转移是多基因参与、多步骤完成的复杂过程, 其中肿瘤细胞黏附、运动能力的改变, 与细胞外基质间的相互作用是肿瘤发生浸润转移的基础, 也是肿瘤浸润转移的关键环节[6]. 上皮-间叶样表型转化(epithelial-mesenchymal transitions, EMT)是一个复杂的分化程序, 包括上皮细胞失去极性和他们的表面标志物, 诱导间充质标志物的表达, 导致形成成纤维细胞样和运动型表型的细胞, 是肿瘤浸润转移的关键因素[7].
E-cadherin为钙依赖性黏附蛋白超家族成员之一, 是一类主要介导细胞间同质黏附的钙依赖性跨膜糖蛋白, 主要由细胞外区、跨膜区和细胞内区三部分构成[8]. E-cadherin是以嗜同性方式(同种分子间拉链式结合)介导同型细胞-细胞间黏附的细胞黏附分子, 主要参与形成紧密连接、黏附连接等[9]. 在本文的研究中, 我们采用了免疫组织化学SP法和SYBR green RT-PCR分别从蛋白水平和基因水平检测了人胆管癌中E-cadherin的表达, 结果显示47例胆管癌组织中E-cadherin蛋白和基因的表达较胆管癌旁组织和正常胆管组织明显降低(P<0.05), 且胆管癌组织中E-cadherin蛋白和基因的表达与患者肿瘤分化程度、分期、有无淋巴结转移和组织器官转移差异有统计学意义(P<0.05), 肿瘤分化程度越低、分期越高、发生淋巴结转移和组织器官浸润转移者E-cadherin蛋白和基因表达越低. 由于E-cadherin是正常分化细胞所具有的成分, 而肿瘤在转化过程中容易失去某些正常细胞所具有的表型. 因此, 我们认为E-cadherin在分化差的癌组织中表达下调是肿瘤异常分化所致, 参与了胆管癌的发生、发展, 机制可能是E-cadherin减少或缺失, 导致细胞间的黏附减弱, 原有的细胞外基质降解、形成新的细胞-基质黏附, 细胞运动能力大大增强, 从而促进肿瘤的浸润转移.
LOXL2基因定位于8p21.2-p21.3, 是赖氨酰氧化酶(lysyl oxidase, LOX)家族的5个成员之一, 赖氨酰氧化酶是一类细胞外基质修饰酶, 是一类从氧化初级胺到反应性醛酶家族的铜依赖性胺氧化酶[10,11]. 肿瘤细胞的生长和行为强烈依赖他们的微环境. 文献[12]报道LOXL2主要通过SnaiL/E-cadherin或Src/FAK这两条通路促进肿瘤浸润转移, 参与上皮间质转化[13,14], 可以促进细胞外基质(extracellular matrixc, ECM)重构, 参与肿瘤的发生、发展. 我们研究结果显示, 47例胆管癌组织中LOXL2蛋白和基因的表达阳性率分别为68.1%, 154.6332±128.9566, 胆管癌旁组织分别为10.6%, 5.3451±11.8545, 正常胆管组织分别为10.0%, 5.3451±11.8545. LOXL2蛋白和基因的表达在胆管癌组与癌旁组织组和正常胆管组比较差异有统计学意义(P<0.05), 胆管癌中LOXL2蛋白和基因的表达明显增高并且与患者肿瘤分化程度、肿瘤分期、有无淋巴结转移和有无组织器官转移差异有统计学意义(P<0.05), 肿瘤分化程度越低、分期越高、发生淋巴结转移和组织器官浸润转移者LOXL2蛋白和基因的表达越高, 而与年龄、性别、肿瘤部位无关. LOXL2在胆管癌组织中有较高阳性表达提示可能通过阻断该环节而对胆管癌的发生、发展起抑制作用, 故有望成为胆管癌侵润转移过程中重要的肿瘤标志物, 有利于胆管癌恶性程度的判断, 为预后估计提供帮助.
E-cadherin表达缺失是EMT发生的标志之一, 而LOXL2基因在上皮细胞的过度表达可诱导EMT. Rodriguez等[15]的体内研究结果表明LOXL2以酶的形式参与Snail介导的E-cadherin沉默. E-cadherin和LOXL2在肿瘤浸润转移中的作用机制都与EMT密切相关. 本实验在胆管癌组织中对E-cadherin和LOXL2进行相关性检验, 无论是蛋白水平还是基因水平方面检测都证实, E-cadherin和LOXL2在胆管癌浸润转移中的表达呈负相关, E-cadherin和LOXL2的相关性机制可能在于: LOXL2表达增高, 通过调节作用抑制E-cadherin的表达诱导EMT, 从而促进胆管癌的浸润转移. E-cadherin的表达减弱及LOXL2的表达增强共同促进胆管癌的浸润转移.
胆管癌恶性程度很高, 治愈率很低. 近年来发病率有升高的趋势, 而影响胆管癌患者治疗和远期生存率的主要因素是肿瘤的浸润和转移. 许多研究认为上皮-间叶样表型转化(epithelial-mesenchymal transitions, EMT)是促进肿瘤浸润转移的关键因素, E-cadherin表达缺失是EMT发生的标志之一, 而赖氨酰氧化酶样蛋白-2(lysyl oxidase-like 2 protein, LOXL2)基因在上皮细胞的过度表达可诱导EMT.
王铮, 副研究员, 西安交通大学医学院第一附属医院肝胆病院肝胆外科; 康春博, 副主任医师, 北京大学航天临床医院普通外科
E-cadherin基因被认为是肿瘤抑制基因之一, 近年来已成为肿瘤细胞浸润转移研究的热点之一. LOXL2在胆管癌组织中有较高阳性表达提示可能通过阻断该环节而对胆管癌的发生、发展起抑制作用. 在此基础上研究两者对胆管癌浸润转移的作用及其相关性, 从分子水平探寻胆管癌浸润转移机制.
近年文献报道E-cadherin在人类正常上皮组织总是均匀稳定地在细胞边缘区呈强阳性表达, 在大多数肿瘤组织中低表达, 且随着肿瘤分化程度下降而下降; LOXL2有缺氧调节作用, 参与上皮间质转化, 可以促进细胞外基质(extracellular matrixc, ECM)重构.
E-cadherin和LOXL2在肿瘤浸润转移中的作用机制都与EMT密切相关, EMT是促进肿瘤浸润转移的关键因素. 已有文献报道, E-cadherin与胆管癌的浸润转移相关, 但目前国内外关于LOXL2在胆管癌方面的研究极为少见, 且目前尚未见关于E-cadnerin和LOXL2在胆管癌中的定量表达水平和两者在胆管癌中的联合检测的报道.
LOXL2在胆管癌组织中高表达E-cadherin低表达, 提示可能通过阻断该环节而对胆管癌的发生、发展起抑制作用, 故有望成为胆管癌侵润转移过程中重要的肿瘤标志物, 有利于胆管癌恶性程度的判断, 为预后估计提供帮助.
该论文创新性强, 论点新颖, 首次同时研究LOXL2和E-cadherin对胆管癌浸润转移的作用及其相关性, 在分子水平探寻胆管癌浸润转移机制, 对临床具有一定的指导意义和实用价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Pećina-Slaus N, Nikuseva Martić T, Deak AJ, Zeljko M, Hrasćan R, Tomas D, Musani V. Genetic and protein changes of E-cadherin in meningiomas. J Cancer Res Clin Oncol. 2010;136:695-702. [PubMed] [DOI] |
| 2. | Barry-Hamilton V, Spangler R, Marshall D, McCauley S, Rodriguez HM, Oyasu M, Mikels A, Vaysberg M, Ghermazien H, Wai C. Allosteric inhibition of lysyl oxidase-like-2 impedes the development of a pathologic microenvironment. Nat Med. 2010;16:1009-1017. [PubMed] [DOI] |
| 3. | Liu X, Zhao Y, Gao J, Pawlyk B, Starcher B, Spencer JA, Yanagisawa H, Zuo J, Li T. Elastic fiber homeostasis requires lysyl oxidase-like 1 protein. Nat Genet. 2004;36:178-182. [PubMed] |
| 4. | Szauter KM, Cao T, Boyd CD, Csiszar K. Lysyl oxidase in development, aging and pathologies of the skin. Pathol Biol (Paris). 2005;53:448-456. [PubMed] |
| 5. | Akiri G, Sabo E, Dafni H, Vadasz Z, Kartvelishvily Y, Gan N, Kessler O, Cohen T, Resnick M, Neeman M. Lysyl oxidase-related protein-1 promotes tumor fibrosis and tumor progression in vivo. Cancer Res. 2003;63:1657-1666. [PubMed] |
| 7. | Ungefroren H, Sebens S, Seidl D, Lehnert H, Hass R. Interaction of tumor cells with the microenvironment. Cell Commun Signal. 2011;9:18. [PubMed] [DOI] |
| 8. | Gu MJ, Choi JH. Clinicopathological significance of E-cadherin, β-catenin and epidermal growth factor receptor expression in intrahepatic cholangiocarcinoma. Hepatogastroenterology. 2012;59:1241-1244. [PubMed] [DOI] |
| 9. | ElMoneim HM, Zaghloul NM. Expression of E-cadherin, N-cadherin and snail and their correlation with clinicopathological variants: an immunohistochemical study of 132 invasive ductal breast carcinomas in Egypt. Clinics (Sao Paulo). 2011;66:1765-1771. [PubMed] |
| 10. | Csiszar K. Lysyl oxidases: a novel multifunctional amine oxidase family. Prog Nucleic Acid Res Mol Biol. 2001;70:1-32. [PubMed] |
| 11. | Borel A, Eichenberger D, Farjanel J, Kessler E, Gleyzal C, Hulmes DJ, Sommer P, Font B. Lysyl oxidase-like protein from bovine aorta. Isolation and maturation to an active form by bone morphogenetic protein-1. J Biol Chem. 2001;276:48944-48949. [PubMed] |
| 12. | Schietke R, Warnecke C, Wacker I, Schödel J, Mole DR, Campean V, Amann K, Goppelt-Struebe M, Behrens J, Eckardt KU. The lysyl oxidases LOX and LOXL2 are necessary and sufficient to repress E-cadherin in hypoxia: insights into cellular transformation processes mediated by HIF-1. J Biol Chem. 2010;285:6658-6669. [PubMed] [DOI] |
| 13. | Moreno-Bueno G, Salvador F, Martín A, Floristán A, Cuevas EP, Santos V, Montes A, Morales S, Castilla MA, Rojo-Sebastián A. Lysyl oxidase-like 2 (LOXL2), a new regulator of cell polarity required for metastatic dissemination of basal-like breast carcinomas. EMBO Mol Med. 2011;3:528-544. [PubMed] [DOI] |
| 14. | Grützmann R, Foerder M, Alldinger I, Staub E, Brümmendorf T, Röpcke S, Li X, Kristiansen G, Jesenofsky R, Sipos B. Gene expression profiles of microdissected pancreatic ductal adenocarcinoma. Virchows Arch. 2003;443:508-517. [PubMed] |
| 15. | Rodriguez HM, Vaysberg M, Mikels A, McCauley S, Velayo AC, Garcia C, Smith V. Modulation of lysyl oxidase-like 2 enzymatic activity by an allosteric antibody inhibitor. J Biol Chem. 2010;285:20964-20974. [PubMed] [DOI] |