修回日期: 2014-10-10
接受日期: 2014-11-04
在线出版日期: 2014-12-18
目的: 观察贝前列素钠(beraprost sodium)对急性重症胰腺炎(severe acute pancreatitis, SAP)大鼠c-Jun氨基末端激酶(c-Jun N-terminal kinase, c-JNK)信号通路的影响.
方法: 48只♂SD大鼠, 随机分为假手术组(正常对照组, NC组)、SAP组(S组)和贝前列腺素钠组(BS组). S组和BS组大鼠腹腔注射盐酸氯胺酮麻醉下逆行胰胆管内加压注射5%牛磺胆酸钠建立SAP模型. S组大鼠给予腹腔注射生理盐水, BS组大鼠腹腔注射贝前列素钠20 µg/kg干预组. 最终纳入实验各组分别为13、12及11只. 在实验进行的第1、3、6、12 h时间点分别处死相应大鼠并采集胰腺标本, 运用酶联免疫吸附实验(ELISA)法测定胰腺组织的肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、白介素-6(interleukin-6, IL-6)的含量; 反转录聚合酶链式反应(reverse transcription-polymerase chain reaction, RT-PCR)法检测胰腺组织中c-JNK mRNA的变化; 免疫印迹(Western blot)法检测各组大鼠胰腺组织中c-JNK蛋白及磷酸化c-JNK(p-c-JNK)蛋白活性. 采用定量资料3×4析因设计的方差分析, 运用SPSS17.0统计软件包进行统计分析.
结果: 与NC组比较, S组胰腺组织TNF-α(458.7 pg/mL±36.9 pg/mL vs 197.1 pg/mL±5.3 pg/mL)、IL-6(525.6 pg/mL±12.6 pg/mL vs 211.4 pg/mL±3.5 pg/mL)、c-JNK mRNA(2.60±0.09 vs 0.91±0.59)水平增高; c-JNK蛋白(1.52±0.41 vs 0.98±0.11)及p-c-JNK蛋白(1.53±0.45 vs 0.98±0.08)活性增强. 与S组相比, BS组TNF-α(211.7 pg/mL±3.4 pg/mL vs 458.7 pg/mL±36.9 pg/mL)、IL-6(468.7 pg/mL±34.9 pg/mL vs 525.6 pg/mL±12.6 pg/mL)、c-JNK mRNA(1.93±0.14 vs 2.60±0.09)、c-JNK蛋白(1.32±0.35 vs 1.52±0.41)及p-c-JNK蛋白(1.22±0.37 vs 1.53±0.45)水平下降, 差异均有统计学意义(P<0.05).
结论: c-JNK通路在SAP大鼠胰腺组织损伤中起一定作用; 贝前列腺素钠治疗SAP可能是通过c-JNK通路实现的, 为贝前列腺素钠用于治疗SAP提供一定的理论依据.
核心提示: 重症急性胰腺炎(severe acute pan-creatitis, SAP)死亡率高、治疗效果差. 贝前列素钠具有抑制炎症反应等作用. 其在糖尿病外周血管病的治疗中取得良好疗效. 他对SAP是否具有治疗作用以及通过什么样的机制起作用值得研究. 我们发现贝前列腺素钠通过抑制c-Jun氨基末端激酶(c-Jun N-terminal kinase)信号通路的激活, 抑制胰腺组织炎症因子的生成, 从而阻断SAP的发展.
引文著录: 王珣, 王明林, 鲁新耀, 张鹏, 于红刚, 胡义奎. 贝前列素钠对急性重症胰腺炎大鼠c-JNK信号通路的影响. 世界华人消化杂志 2014; 22(35): 5486-5491
Revised: October 10, 2014
Accepted: November 4, 2014
Published online: December 18, 2014
AIM: To investigate the effect of beraprost sodium (BS) on the c-Jun N-terminal kinase (c-JNK) signal pathway in rats with severe acute pancreatitis (SAP).
METHODS: Forty-eight SD rats were randomly divided into a sham operation group (normal control), an SAP group and a BS group. SAP was induced by retrograde injection of 5% sodium tauroeholate. BS was given at a dose of 20 µg/kg at the time of pancreatitis induction in the BS group. At 1, 3, 6, and 12 h after SAP was successfully induced, the animals were killed. Levels of tumor necrosis factor α (TNF-α) and interleukin-6 (IL-6) in pancreatic tissue were detected by ELISA, c-JNK mRNA expression was detected by RT-PCR, and c-JNK and phosporylated c-JNK (p-c-JNK) protein in pancreatic tissue was examined by Western blot.
RESULTS: Compared with the normal control group, the levels of TNF-α, IL-6, c-JNK mRNA, c-JNK protein and p-c-JNK protein in pancreatic tissues were significantly enhanced in the SAP group (TNF-α: 458.7 pg/mL ± 36.9 pg/mL vs 197.1 pg/mL ± 5.3 pg/mL; IL-6: 525.6 pg/mL ± 12.6 pg/mL vs 211.4 pg/mL ± 3.5 pg/mL; c-JNK mRNA: 2.60 ± 0.09 vs 0.91 ± 0.59; c-JNK protein: 1.52 ± 0.41 vs 0.98 ± 0.11; p-c-JNK protein: 1.53 ± 0.45 vs 0.98 ± 0.08, P < 0.05 for all). Compared with the SAP group, the levels of TNF-α, IL-6, c-JNK mRNA, c-JNK protein and p-c-JNK protein were significantly decreased in the BS group (TNF-α: 211.7 pg/mL ± 3.4 pg/mL vs 458.7 pg/m L ± 36.9 pg/mL; IL-6: 468.7 pg/mL ± 34.9 pg/mL vs 525.6 pg/mL± 12.6 pg/mL; c-JNK mRNA: 1.93 ± 0.14 vs 2.60 ± 0.09; c-JNK protein: 1.32 ± 0.35 vs 1.52 ± 0.41; p-c-JNK protein: 1.22 ± 0.37 vs 1.53 ± 0.45, P < 0.05 for all).
CONCLUSION: BS can alleviate the inflammatory response in SAP rats by down-regulating c-JNK signaling.
- Citation: Wang X, Wang ML, Lu XY, Zhang P, Yu HG, Hu YK. Effect of beraprost sodium on c-JNK signal pathway in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2014; 22(35): 5486-5491
- URL: https://www.wjgnet.com/1009-3079/full/v22/i35/5486.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i35.5486
重症急性胰腺炎(severe acute pancreatitis, SAP)死亡率高达20%-25%, 目前有效的治疗药物较少. SAP的发生、发展与多种炎症介质如肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、白介素6(interleukin-6, IL-6)等相关. 目前SAP药物研究的热点集中在抗炎症介质. 贝前列素钠(beraprost sodium)为前列环素(prostacyclin, PGI2)的衍生物, 具有扩张血管、抑制炎症反应等作用. 其在糖尿病外周血管病的治疗中取得良好疗效, 治疗机制可能系通过c-Jun氨基末端激酶(c-Jun N-terminal kinase, c-JNK)这一炎症相关通路实现[1]. 研究[2]表明, SAP和糖尿病周围神经病的发病机制均和炎症介质相关. 本研究旨在初步探讨贝前列素钠对SAP大鼠的治疗作用及可能机制, 为临床治疗SAP的药物应用提供一定理论基础.
48只♂SD大鼠, 体质量200-250 g, 由武汉大学动物实验中心提供. 按参考文献介绍的方法造SAP模型[2]. 动物实验前12 h禁食, 不禁饮. SD大鼠腹腔注射盐酸氯胺酮麻醉下逆行胰胆管内加压注射5%牛磺胆酸钠(淀粉酶试剂盒, 南京建成生物工程有限公司, 0.1 mL/100 g)建立SAP模型. 贝前列素钠: 德纳, 20 µg/片, 安斯泰来制药公司馈赠.
1.2.1 实验分组: 随机分为3组, 分别为NC组、S组和BS组, 每组16只. NC组是正常SD大鼠(正常对照组即假手术组), 仅翻动十二指肠、胰腺后关闭腹腔, 并腹腔注射生理盐水; S组为SAP造模后SD大鼠, 腹腔注射生理盐水干预组; BS组为造模后大鼠, 腹腔注射贝前列素钠 20 µg/kg干预组. 最终NC组13只, S组12只, BS组11只. 3组SD大鼠均于术后第1、3、6、12 h分两批麻醉后予腹主动脉放血法处死, 分别取各个时间段SD大鼠的胰腺病理标本.
1.2.2 胰腺病理学检查: 取大鼠胰腺组织置于40 g/L中性甲醛固定24 h, 常规石蜡包埋、切片及HE染色、显微镜下观察.
1.2.3 TNF-α、IL-6含量测定: 取不法胰腺组织制成5%匀浆液, -20 ℃保存. ELISA法测定匀浆液的TNF-α、IL-6含量, 严格按照试剂盒(美国Santa公司)说明书操作.
1.2.4 c-JNK mRNA检测: 采用RT-PCR方法进行检测. 具体步骤: 以TRIzol试剂盒(北京中杉生物公司)提取胰腺组织总RNA, 分光光度计检测总RNA的纯度及浓度. 运用逆转录试剂盒(北京中杉生物公司)逆转录合成cDNA. c-JNK上游引物: 5'-ATTTGGAGGAGCGAACTAAG-3'; 下游引物: 5'-ATTGACAGACGGCGAAGA-3', 扩增片段为112 bp; 内参β-actin上游引物: 5'-TCGTGCGTGACATTAAAGAG-3', 下游引物: 5'-ATTGCCGATAGTGATGACCT-3', 扩增片段为134 bp. 以上引物由上海Invitrogen公司合成. 在PCR仪上进行扩增反应. PCR反应条件为: 95 ℃ 10 s, 95 ℃ 5 s, 60 ℃ 34 s, 35个循环; 溶解曲线分析: 95 ℃ 15 s, 60 ℃ 60 s, 95 ℃ 15 s.
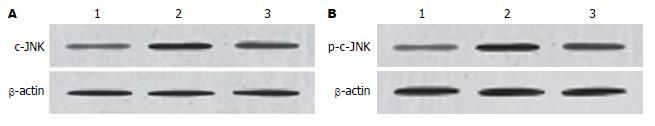
1.2.5 c-JNK和磷酸化(p-c-JNK)蛋白检测: 采用免疫印迹(Western blot)法检测. 胰腺组织100 mg剪碎后研磨, 按照试剂盒(深圳晶美生物公司)操作说明抽提胞质蛋白, 蛋白定量采用BCA法. 取50 µg样品常规进行SDS-PAGE电泳后, 转移至PVDF膜, 5%BSA溶液中室温封闭. 加入一抗(c-JNK单克隆抗体, p-c-JNK单克隆抗体及内参β-actin单克隆抗体)4 ℃过夜后加入HRP标记的二抗(山羊抗小鼠IgG HRPC)孵育. ECL显色, X线片曝光、显影、定影、扫描. 并用Quantity One分析软件将图片上每个特异条带密度进行测量. 测得的c-JNK及p-c-JNK阳性条带的密度与相应的β-actin条带密度的比值作为其蛋白的相对表达量.
统计学处理 采用定量资料3×4析因设计的方差分析, 运用SPSS17.0统计软件包进行统计分析. P<0.05为差异具有统计学意义.
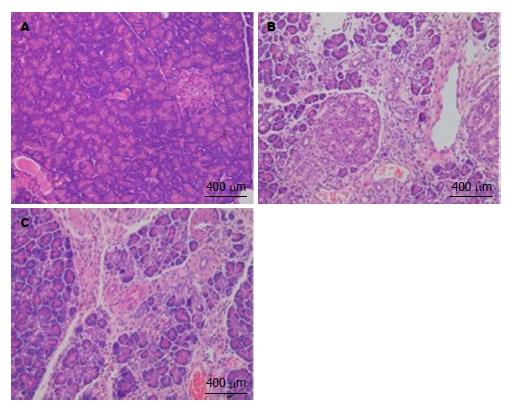
假手术组大鼠胰腺组织结构正常. SAP组6 h时胰腺腺泡间隙明显扩大, 胰腺内出现片状坏死, 中性粒细胞浸润, 12 h时胰腺坏死区域进一步扩大. BS组6 h时胰腺内片状坏死较少, 可见少量的中性粒细胞浸润(图1).
大鼠胰腺组织中TNF-α及IL-6随时间的延长而增加, 均在12 h达到高峰(表1).
| 分组 | 时间 | TNF-α(pg/mL) | IL-6(pg/mL) | c-JNK mRNA | c-JNK蛋白 | p-c-JNK蛋白 |
| NC组 | 1 h | 184.6±18.6 | 519.7±44.0 | 0.87±0.25 | 0.99±0.23 | 0.89±0.25 |
| 3 h | 192.9±12.7 | 517.8±40.2 | 0.91±0.12 | 1.01±0.17 | 0.92±0.16 | |
| 6 h | 187.2±15.6 | 508.1±13.6 | 1.11±0.21 | 1.21±0.22 | 1.07±0.23 | |
| 12 h | 197.1±5.3 | 525.6±12.6 | 0.91±0.59 | 0.98±0.11 | 0.98±0.08 | |
| SAP组 | 1 h | 303.2±7.9 | 302.2±7.6 | 1.30±0.04 | 1.89±0.16 | 1.82±0.18 |
| 3 h | 326.9±22.6 | 342.9±22.6 | 1.90±0.39 | 1.60±0.67 | 1.59±0.68 | |
| 6 h | 411.1±11.6 | 411.1±11.6 | 2.01±0.15 | 1.57±0.14 | 1.62±0.16 | |
| 12 h | 458.7±36.9 | 468.7±34.9 | 2.60±0.09 | 1.52±0.41 | 1.53±0.45 | |
| BS组 | 1 h | 227.8±10.8 | 223.8±10.4 | 1.01±0.02 | 0.96±0.10 | 1.01±0.12 |
| 3 h | 244.9±7.4 | 254.1±7.8 | 1.18±0.21 | 1.55±0.10 | 1.48±0.17 | |
| 6 h | 230.1±6.3 | 222.1±7.2 | 1.38±0.34 | 1.66±0.29 | 1.59±0.31 | |
| 12 h | 211.7±3.4 | 211.4±3.5 | 1.93±0.14 | 1.32±0.35 | 1.22±0.37 |
大鼠胰腺组织中c-JNK mRNA、c-JNK、p-c-JNK蛋白含量随时间的延长而增加, 12 h达高峰(表1).
SAP的发病机制至今尚未完全明了. Rinder-knecht首先提出SAP发病机制的"白细胞过度激活学说", 认为急性胰腺炎早期异常激活的胰酶在引起胰腺细胞自身损伤的同时, 激活单核或巨噬细胞、成纤维细胞、内皮细胞、淋巴细胞及胰腺腺泡细胞等产生、释放多种细胞因子及其他炎性介质, 其中最为重要的是TNF-α及IL-6, 并通过扳机样作用, 触发炎症介质瀑布样级联反应, 即信号传导系统, 引起全身炎症反应综合征而造成组织细胞损伤[2]. 本实验结果显示SAP大鼠胰腺组织中可见大量中性粒细胞浸润, 而且TNF-α及IL-6含量增加, 进一步证实严重介质在SAP大鼠胰腺组织损伤的重要作用.
有研究表明: 核因子κB(nuclear factor-κB, NF-κB)和环氧合酶2(cyclooxygenase-2, COX-2)对这些细胞介质有调控作用, 在SAP发生、发展中发挥重要作用[3-7]. 但是人们应用相应的拮抗剂治疗SAP时发现只能部分缓解SAP病理损伤程度, 并不能完全缓解. 这就说明在SAP发病过程中还存在其他机制[8,9], 需进一步研究.
丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)是介导细胞外信号引起细胞内反应的信号传导系统, 是调节产生细胞介质(如TNF-α、IL-6等)、趋化因子黏附分子的主要信号传导通路[10]. 而c-JNK是MAPKs家族的最重要成员[11], 本研究结果显示SAP大鼠胰腺组织c-JNK mRNA和蛋白表达增加, p-c-JNK蛋白表达也增加, 提示在SAP过程中c-JNK信号传导通路被激活. SAP大鼠胰腺组织中炎症介质的级联反应可能受c-JNK信号通路的调节.
糖尿病和SAP一样也一种炎症性疾病[2,12-16], 炎性因子生成增多参与了整个糖尿病的发病过程. 贝前列腺素钠可通过抑制炎症介质的生成而减轻糖尿病周围血管损害. 目前贝前列腺素钠主要运用于糖尿病周围血管壁的治疗, 其治疗机制可能系通过c-JNK通路起作用[17-20]. 我们发现: 贝前列素钠干预后, 降低了急性SAP大鼠胰腺损害程度指标, 贝前列腺素钠通过抑制c-JNK信号通路的激活, 抑制胰腺组织炎症因子的生成, 从而阻断SAP的发展. 为贝前列素钠运用于临床治疗SAP提供一定实验依据.
重症急性胰腺炎(severe acute pancreatitis, SAP)死亡率高、治疗效果差. 目前SAP药物研究的热点集中在抗炎症介质. 贝前列素钠具有扩张血管、抑制炎症反应等作用. 其在糖尿病外周血管病的治疗中取得良好疗效. 研究表明, SAP和糖尿病周围神经病的发病机制均和炎症介质相关. 贝前列素钠对SAP 是否具有治疗作用以及通过什么样的机制起作用值得研究.
夏时海, 副教授, 副主任医师, 武警后勤学院附属医院肝胆胰脾科(中心)
贝前列素钠为前列环素(prostacyclin, PGI2)的衍生物, 治疗糖尿病周围神经病的机制可能系通过c-Jun氨基末端激酶(c-Jun N-terminal kinase, c-JNK)这一炎症相关通路实现. 目前SAP病情进展和治疗效果极差和胰腺细胞凋亡密切相关; 而c-JNK是凋亡系统的主要通路. 贝前列素钠极有可能通过影响c-JNK通路对SAP起到治疗作用.
JNK信号通路参与细胞因子、应激、药物等诱导的细胞凋亡. 目前大多JNK信号通路研究集中在神经系统退行性疾病及糖尿病中. JNK信号通路在SAP中的研究鲜有报道; 贝前列素钠其在糖尿病外周血管病的治疗中取得良好疗效. 本文从SAP和JNK通路的关系入手来探讨贝前列素钠对SAP的治疗作用及可能机制.
贝前列腺素钠通过抑制c-JNK信号通路的激活, 抑制胰腺组织炎症因子的生成, 从而阻断SAP的发展. 为贝前列素钠运用于临床治疗SAP提供一定的实验依据.
本研究有一定的参考价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Wu SD, Zhang ZH, Li DY, Jin JZ, Kong J, Tian Z, Wang W, Wang MF. Nitroester drug's effects and their antagonistic effects against morphine on human sphincter of Oddi motility. World J Gastroenterol. 2005;11:2319-2323. [PubMed] |
| 2. | Vanderstocken G, Van de Paar E, Robaye B, di Pietrantonio L, Bondue B, Boeynaems JM, Desmecht D, Communi D. Protective role of P2Y2 receptor against lung infection induced by pneumonia virus of mice. PLoS One. 2012;7:e50385. [PubMed] [DOI] |
| 3. | Sudhindran S, Bromwich E, Edwards PR. Prospective randomized double-blind placebo-controlled trial of glyceryl trinitrate in endoscopic retrograde cholangiopancreatography-induced pancreatitis. Br J Surg. 2001;88:1178-1182. [PubMed] |
| 4. | Doctor N, Agarwal P, Gandhi V. Management of severe acute pancreatitis. Indian J Surg. 2012;74:40-46. [PubMed] [DOI] |
| 5. | Bai Y, Xu C, Yang X, Gao J, Zou DW, Li ZS. Glyceryl trinitrate for prevention of pancreatitis after endoscopic retrograde cholangiopancreatography: a meta-analysis of randomized, double-blind, placebo-controlled trials. Endoscopy. 2009;41:690-695. [PubMed] [DOI] |
| 6. | Watanabe H, Ueda T, Miura M. [Thromboxane A2 (TXA2), thromboxane B2(TXB2)]. Nihon Rinsho. 2010;68 Suppl 7:33-37. [PubMed] |
| 7. | Xavier FE, Blanco-Rivero J, Sastre E, Badimón L, Balfagón G. Simultaneous inhibition of TXA(2) and PGI(2) synthesis increases NO release in mesenteric resistance arteries from cirrhotic rats. Clin Sci (Lond). 2010;119:283-292. [PubMed] [DOI] |
| 8. | Yao HX, Huang L, Lin LE, Wu CM, Wang H, Chen WT, Fu XJ, Ding YP. [The study of relationship between platelet function and thrombus in patients with essential thrombocythaemia]. Zhonghua Yixue Zazhi. 2010;90:253-255. [PubMed] |
| 9. | Takahashi M, Shiba T, Hirano K, Hitsumoto T, Shirai K. Acute decrease of cardio-ankle vascular index with the administration of beraprost sodium. J Atheroscler Thromb. 2012;19:479-484. [PubMed] |
| 10. | Spormann H, Sokolowski A, Letko G. Effect of temporary ischemia upon development and histological patterns of acute pancreatitis in the rat. Pathol Res Pract. 1989;184:507-513. [PubMed] |
| 13. | Fang BJ, Gao PY, He SH, Chen H, Shen P, Zhang YY, Zhang JZ. [Clinical early intervention of Tongxia Huayu Decoction on pancreatic microcirculatory disturbance in severe acute pancreatitis]. Zhongxiyi Jiehe Xuebao. 2007;5:134-136. [PubMed] |
| 14. | Kotan R, Nemeth N, Kiss F, Posan J, Miszti-Blasius K, Toth L, Furka I, Miko I, Sapy P, Szentkereszty Z. Micro-rheological changes during experimental acute pancreatitis in the rat. Clin Hemorheol Microcirc. 2012;51:255-264. [PubMed] [DOI] |
| 15. | Strate T, Mann O, Kleinhans H, Rusani S, Schneider C, Yekebas E, Freitag M, Standl T, Bloechle C, Izbicki JR. Microcirculatory function and tissue damage is improved after therapeutic injection of bovine hemoglobin in severe acute rodent pancreatitis. Pancreas. 2005;30:254-259. [PubMed] |
| 17. | 王 晓, 张 照兰, 杨 国红, 谢 进, 费 景兰. 血必净注射液治疗重症急性胰腺炎25例临床观察. 中国中西医结合急救杂志. 2010;17:169-17. |
| 18. | Meng H, Gong J, Fang L, Song Z, Wu F, Zhou B, Qian M. Effect of interferon-γ on NF-κB and cytokine IL-18 and IL-27 in acute pancreatitis. Bosn J Basic Med Sci. 2013;13:114-118. [PubMed] |
| 19. | Trumbeckaite S, Kuliaviene I, Deduchovas O, Kincius M, Baniene R, Virketyte S, Bukauskas D, Jansen E, Kupčinskas L, Borutaite V. Experimental acute pancreatitis induces mitochondrial dysfunction in rat pancreas, kidney and lungs but not in liver. Pancreatology. 2013;13:216-224. [PubMed] [DOI] |
| 20. | Howard TJ. The role of antimicrobial therapy in severe acute pancreatitis. Surg Clin North Am. 2013;93:585-593. [PubMed] [DOI] |