修回日期: 2014-09-14
接受日期: 2014-09-17
在线出版日期: 2014-12-18
目的: 检测chromodomain helicase/ATPase DNA binding protein 1-like gene (CHD1L)在结直肠组织中的表达情况及探讨CHD1L基因对结直肠癌(colorectal cancer, CRC)细胞增殖和凋亡的影响.
方法: 通过荧光定量PCR、免疫组织化学检测80例CRC患者癌组织和对应癌旁组织中CHD1L基因的表达情况; 采用噻唑蓝(methyl thiazolyl tetrazolium, MTT)、克隆形成实验及动物实验等观察CHD1L基因在CRC细胞增殖中的作用; 利用流式细胞技术检测细胞凋亡.
结果: 76.25%(61/80)的CRC癌组织CHD1L基因的表达明显高于对应的癌旁组织; 转染shRNA-CHD1L至CRC细胞可以明显降低CHD1L基因的mRNA和蛋白的表达, 同时MTT实验和克隆形成实验发现干扰CHD1L组细胞的增殖明显低于对照组. 另外, 流式细胞仪检测发现干扰CHD1L组较对照组细胞凋亡指数明显增加. 裸鼠成瘤实验发现稳定低表达CHD1L组肿瘤体积和重量明显小于对照组.
结论: CHD1L在结直肠组织呈现高表达, 降低结直肠细胞中CHD1L的表达可明显抑制细胞增殖及肿瘤生长. CHD1L可能成为治疗CRC的新靶点.
核心提示: Chromodomain helicase/ATPase DNA binding protein 1-like gene (CHD1L)在结直肠癌癌组织中mRNA水平及蛋白水平都呈现过表达, 选用2种结肠癌细胞株CHD1L水平都呈现过表达. 利用噻唑蓝(methyl thiazolyl tetrazolium)检测、克隆形成实验、流式细胞技术检测到干扰CHD1L的SW620、SW480细胞存活增殖能力下降, 凋亡增强, 观察到裸鼠成瘤实验干扰CHD1L组肿瘤较对照组缩小. 在结直肠癌患者的癌细胞增殖凋亡中CHD1L发挥了重要的作用.
引文著录: 邓云刚, 黄文峰, 赖剑, 刘晓平, 邓龙颖, 章新华. CHD1L在结直肠癌中的表达及其对细胞增殖的影响. 世界华人消化杂志 2014; 22(35): 5432-5440
Revised: September 14, 2014
Accepted: September 17, 2014
Published online: December 18, 2014
AIM: To investigate the expression of chromodomain helicase/ATPase DNA binding protein 1-like (CHD1L) in colorectal cancer (CRC) tissues, and to assess the effect of CHD1L on CRC cell proliferation and apoptosis.
METHODS: Real-time fluorescence quantitative PCR (qRT-PCR) and immunohistochemistry were used to detect the expression of CHD1L mRNA and protein in CRC and pericarcinomatous intestine tissues (PCIT). MTT assay, colony formation assay and animal experiments were used to observe the effect of CHD1L on CRC cell proliferation. Flow cytometric assay was used to detect cell apoptosis.
RESULTS: CHD1L protein was overexpressed in 76.25% (61/80) of the CRC tissue samples. Transfection of CRC cells with an shRNA targeting CHD1L significantly reduced the expression of CHD1L mRNA and protein. MTT assay and colony formation assay showed that cell proliferation in the CHD1L knockdown group was significantly lower than that in the control group. Flow cytometry assay showed that apoptosis index in the CHD1L knockdown group was significantly increased compared with the control group. Tumor formation assay showed that tumor volume and weight in the CHD1L knockdown group were significantly less than those in the control group.
CONCLUSION: CHD1L is overexpressed in CRC tissues. Knockdown of CHD1L inhibits CRC cell proliferation and tumor growth. CHD1L may become a new target for the treatment of CRC.
- Citation: Deng YG, Huang WF, Lai J, Liu XP, Deng LY, Zhang XH. Expression of CHD1L in colorectal cancer and its effect on colorectal cancer cell proliferation. Shijie Huaren Xiaohua Zazhi 2014; 22(35): 5432-5440
- URL: https://www.wjgnet.com/1009-3079/full/v22/i35/5432.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i35.5432
结直肠癌(colorectal cancer, CRC)是较常见的恶性肿瘤之一, 每年新发病例高达约103万, 死亡病例约53万, CRC的死亡率位居恶性肿瘤的第2位, 且呈逐年上升的趋势[1-3]. 研究[4-7]表明结肠癌是多因素导致的恶性肿瘤, 与个人遗传、环境等因素有关, 结肠癌恶性肿瘤的发生与分子异常表达有关, 目前对结肠癌发病分子机理研究报道的还不深入, 因此探索CRC的发病机制可以为临床寻找有效的抗肿瘤药物提供理论基础.
Chromodomain helicase/ATPase DNA binding protein 1-like gene (CHD1L)是从人体癌细胞的染色体1q21区分离并克隆的一个新基因[8,9]. 最近研究[10-12]报道, CHD1L在转录调控、染色质重构、调节蛋白-DNA结合等方面起十分重要的作用. 因此, CHD1L蛋白可能在肿瘤的增殖和凋亡中发挥了重要的作用. 研究[13-15]报道CHD1L与鼻咽癌发病的遗传易感性及患者发生淋巴结转移密切相关. 此外, Tian等[16]研究报道在乳腺癌组织中CHD1L的高表达与乳腺癌复发存在正相关性. 然而CHD1L在CRC中的作用还不清楚, 因此, 探讨CHD1L在CRC发生发展中的作用十分必要, 本实验主要探讨CRC中CHD1L的表达情况, 以及CHD1L对CRC细胞增殖和凋亡的影响.
收集CRC及对应癌旁组织手术标本(n = 80). 所有标本均经病理学检查确诊, 其中男性54例, 女性26例, 年龄50-69岁. 所有患者术前均未接受放化疗. 上标本采集均由患者本人知情同意并通过医院伦理委员会审核通过. SW480、SW620细胞(中国科学院细胞库), DMEM高糖培养基(Gibco公司), 胎牛血清(Gibco), shRNA-CHD1L质粒(上海吉玛公司), 脂质体Lipfectamine 2000(Invitrogen), TRIzol (Invitrogen), Annexin V-FITC凋亡检测试剂盒(南京凯基公司), 总蛋白提取试剂盒(碧云天), CHD1L单克隆抗体(Santa Cruz), 实时荧光定量PCR分析仪9700(美国ABI公司), 流式细胞仪(美国BD公司).
1.2.1 荧光定量PCR检测CRC组织中CHD1L mRNA的表达: 采用TRIzol试剂提取肿瘤组织及对照组织中总RNA, 采用紫外分光光度计测定浓度, -80 ℃保存, 首先取将TRIzol法获得的RNA进行逆转录成cDNA, 逆转录的反应条件为: 16 ℃ 30 min, 42 ℃ 30 min, 85 ℃ 5 min. 将cDNA其稀释100倍, 参用20 μL反应体系: SYBR 10 μL、CHD1L上下游引物各1 μL、cDNA 6 μL及H2O 2 μL, 反应条件: 95 ℃ 10 min, 随后95 ℃ 15 s, 59 ℃ 60 s, 40个循环. 根据获得的Ct值按统计学分析CHD1L在CRC和对应癌旁组织中CHD1L mRNA的表达情况.
1.2.2 免疫组织化学检测CRC组织中CHD1L蛋白的表达: 将收集的CRC患者的癌组织和癌旁组织制成石蜡切片后置于67 ℃烘箱中, 烘片2 h, 用pH 7.4的PBS冲洗3次, 取一定量柠檬酸盐缓冲液(pH 6.0), 加热至沸腾, 将脱蜡水化后的组织切片置于耐高温塑料切片架上, 放入已沸腾的缓冲液中, 微波处理10 min, 取出微波盒流水自然泠却, 从缓冲液中取出玻片, 先用蒸馏水冲洗2次, PBS冲洗. 每张切片加1滴3%H2O2, 室温下孵育10 min, PBS冲洗3次. 去PBS液, 每张切片加1滴相应的第一抗体, 室温下孵育2 h. PBS冲洗, 每张切片加1滴聚合物增强剂, 室温下孵育20 min. 每张切片加1滴酶标抗鼠/兔聚合物, 室温下孵育30 min. 去PBS液, 每张切片加1滴新鲜配制的二氨基联苯胺(diaminobenzidine, DAB)液, 显微镜下观察5 min. 苏木素复染, 0.1%HCl分化, 自来水冲洗, 蓝化, 切片经梯度酒精脱水干燥, 二甲苯透明, 中性树胶封固, 晾干后观察.
1.2.3 细胞培养及转染: 将SW480、SW620接种于DMEM培养基(含10%胎牛血清), 5%CO2、37 ℃条件下培养. 待细胞数量达到70%-90%, 严格遵照新型脂质体Lipofectamine™ 2000转染试剂说明用不含10%胎牛血清的DMEM培养液进行转染, 于转染4-6 h后更换含有10%胎牛血清的培养液中继续培养24-36 h.
1.2.4 MTT实验检测SW480、SW620细胞增殖情况: 收集SW480、SW620细胞, 将各组细胞悬液在离心管内反复充分打匀, 接种于96孔培养板(6×103/孔), 24 h后换液. 每组设有6个复孔. 转染后1-4 d每孔加入噻唑蓝(methyl thiazolyl tetrazolium, MTT)试剂(浓度为5 mg/mL)20 μL, 在5%CO2、37 ℃条件下继续孵育4 h. 用移液器吸取各孔上清, 加入DMSO 150 μL/孔, 在室温条件下摇10 min(置水平摇床)以充分完全溶解MTT结晶. 测定各孔吸光值(波长490 nm). 每组重复3次. 按下列公式计算细胞生长抑制率(%): 细胞生长抑制率 = (实验组平均A490-对照组平均A490)/对照组平均A490×100%, 上述操作重复3次.
1.2.5 克隆形成实验检测SW480、SW620细胞的增殖: SW480、SW620细胞经转染后, 取对数生长期的细胞, 接种于6孔培养板中, 大约500-600个细胞/孔, 置37 ℃、5%CO2, 饱和湿度的条件下, 培养2-3 wk. 观察细胞生长情况, 当培养皿中出现肉眼可见的克隆细胞团时, 终止培养. 移去上清液, 运用PBS漂洗2次. 加甲醇固定20 min, 去除固定液, 加适量Giemsa应用染色液染30 min, 清洗染色液, 经干燥后在显微镜下计数细胞的克隆数, 克隆形成率 = 克隆数/接种细胞数×100%. 上述操作重复3次.
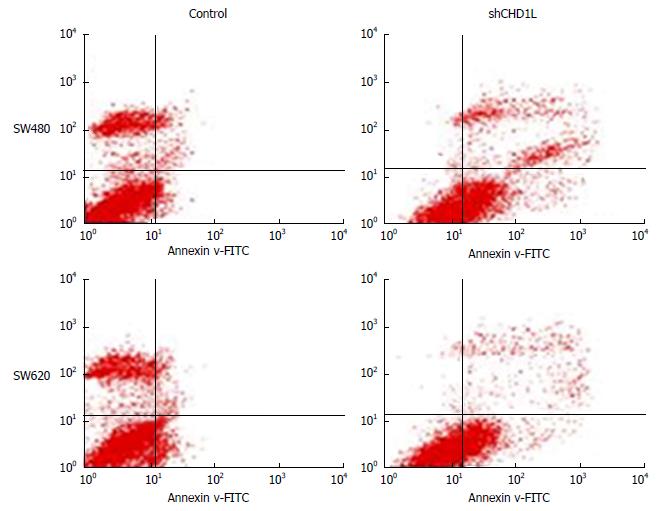
1.2.6 流式细胞术分析SW480、SW620细胞凋亡: 将细胞接种于6孔板中, 转染干扰CHD1L质粒, 经48 h后收集细胞并制备为单细胞悬液, 采用PBS漂洗2次, 离心、弃上清, 最后运用Annexin V-FITC早期凋亡试剂盒和流式细胞仪检测各组细胞的早期凋亡情况. 上述操作重复3次.
1.2.7 构建稳定低表达CHD1L的SW620细胞: 将shCHD1L质粒转染至SW620细胞中(转染方法同上), 次日加入不同剂量的G418抗生素, 筛选出最合适的G418抗生素浓度为800 μg/mL, 至到挑出单克隆细胞株, 维持G418浓度筛选出稳定低表达CHD1L的细胞株.
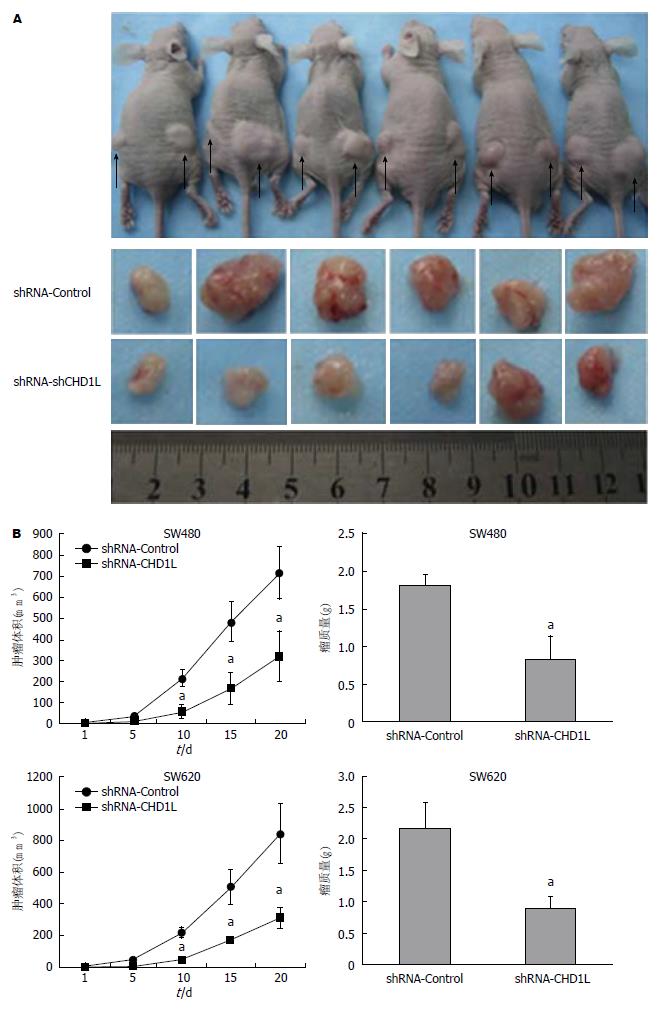
1.2.8 裸鼠皮下成瘤实验: 将6只(4-5周龄)裸鼠饲养于无菌环境下. 取对数期生长的稳定低表达CHD1L及对照组的SW620细胞(约1×106个)制成150 μL细胞悬液, 运用微量注射器接种于裸鼠左侧及右侧大腿背部皮下. 成瘤后定期测量肿瘤的大小, 绘制肿瘤生长曲线. 饲养20 d后处死裸鼠, 取瘤称重. 经甲醛固定、石蜡包埋、HE染色后, 在光镜下观察肿瘤组织的病理学特征.
统计学处理 采用SPSS13.0统计软件, 计量资料以mean±SD表示, 癌及癌旁组织采用配对样本t检验, 其他两组间均数的比较采用两独立样本t检验, P<0.05为差异有统计学意义.
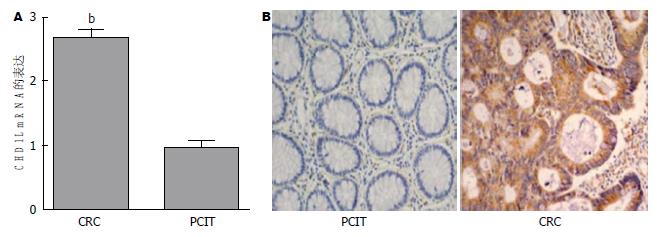
利用实时荧光定量PCR和免疫组织化学检测80例CRC患者癌及癌旁组织中CHD1L的表达, 荧光定量PCR结果发现76.25%(61/80)的结肠癌组织的CDHIL mRNA表达明显高于癌旁组织(P<0.01), 而其余23.75%(19/80)的结肠癌组织中CHD1L的表达与对应的癌旁组织中的表达差异无统计学意义(P>0.05). 免疫组织化学结果发现CHD1L蛋白主要分布在结肠癌细胞的胞浆, 其在结肠癌组织中的表达明显高于癌旁组织, 结果与荧光定量PCR结果一致(图1).
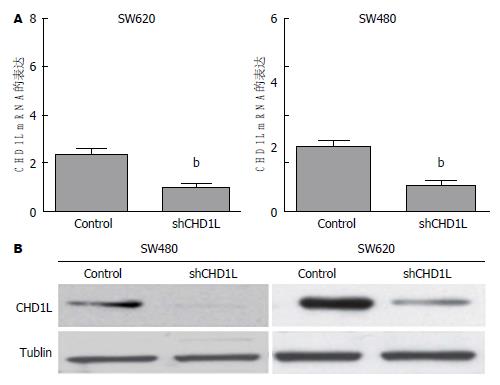
荧光定量PCR结果发现SW480、SW620细胞转染shRNA-CHD1L后CHD1L mRNA的表达比对照组明显降低(P<0.01), 同时Western blot结果同样发现shRNA-CHD1L组CHD1L蛋白的表达比对照组降低(图2).
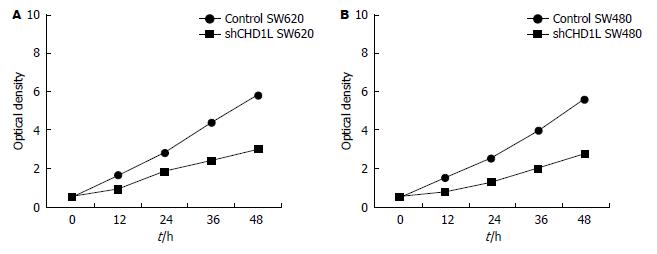
MTT检查结果发现: SW480、SW620细胞转染shRNA-CHD1L后的细胞生长较对照组均明显降低(P<0.05)(图3).
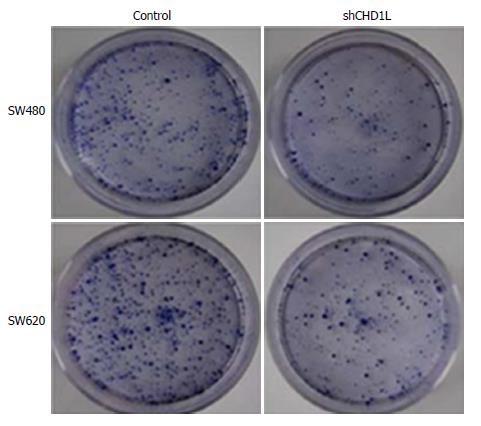
克隆形成实验结果提示: 转染shRNA-CHD1L组SW480和SW620细胞克隆形成率较对照组明显降低(P<0.05)(图4).
流式细胞仪检测细胞凋亡的结果显示: SW480、SW620细胞在转染干扰CHD1L后, 凋亡指数增加明显(P<0.05)(图5).
本实验所有的裸鼠皮下肿瘤成瘤率为100%, 实验结果发现shRNA-CHD1L组的肿瘤生长较对照组肿瘤明显要慢, 差异有统计学意义(P<0.05); 同时, shRNA-CHD1L组的肿瘤的重量明显低于对照组(P<0.05)(图6).
CRC是西欧、北美等发达国家最常见的恶性肿瘤, 也是我国九大常见恶性肿瘤之一, 发病率居恶性肿瘤的第4-6位, 占消化系恶性肿瘤的第2-3位[2-4]. 近年CRC的发病率呈逐年上升和年轻化趋势, 虽然其根治术后的5年生存率有所提高, 但病死率仍然居高不下[4-9]. 从流行病学的观点看, 结肠癌的发病与社会环境、生活方式(尤其是饮食习惯、缺乏体力活动)、遗传因素有关. 年龄、结直肠息肉史、溃疡性结肠炎及胆囊切除史也是结肠癌的高危因素. 但总体而言, 结肠癌的病因及发病机制仍不十分清楚[9-11].
CHD1L又被称为ALC1(amplified in liver cancer 1), 基因全长2980 bp, 编码89 kDa分子蛋白, CHD1L属于SNF2类家族, 其编码的蛋白含有保守的. 作为SNF2家族蛋白一员, CHD1L蛋白可能具有类似的调控基因转录的功能. 近年来, CHD1L在恶性肿瘤中的作用受到研究者们的日愈重视[12-15]. 如Tian等[16]及研究[17-22]在胆囊癌中证实CHD1L呈过表达且与患者的预后相关. 另外, 研究报道CHD1L在肝癌组织中的表达明显增高, 其与患者的临床病理特征如肿瘤的微卫星灶形成、肿瘤的分期、血管浸润和生存时间显著相关, 体外和体内功能实验发现CHD1L通过ARHGEF9介导的Cdc42的活化可以促进肝癌细胞的侵袭和转移[23-26]. 另外研究[27-30]发现CHD1L在卵巢癌以及前列腺癌中的表达也失调, 但CHD1L在CRC中的表达及其作用目前还不清楚.
本次实验通过荧光定量和免疫组织化学检测临床CRC标本和对应的正常癌旁组织, 结果发现CHD1L在肿瘤组织中呈明显高表达, 两者差异具有统计学意义. 为了深入了解CHD1L在结肠癌发病过程中的具体作用及其对结肠癌细胞生物学行为的影响, 本次实验通过MTT、克隆形成实验以及动物实验等探讨CHD1L对CRC细胞增殖的影响, 结果发现干扰CHD1L的表达可以明显抑制CRC细胞的的增殖及生长, 同时可以明显促进肿瘤细胞发生凋亡. 说明CHD1L在CRC发生及凋亡过程中发挥重要的作用, 其很可能成为一个CRC新的癌前标志物, 为临床基因治疗提供新的靶点. 然而, CHD1L在CRC中的作用机制还不清楚, 我们将在下一步的实验中探讨CHD1L的上游调控基因、下游调控基因及可能参与调控的信号通路.
结直肠癌是世界上常见的恶性肿瘤之一, 而转移性结直肠癌患者的生存率明显下降. CHD1L(Chromo-domain helicase/ATPase DNA binding protein1-tike gene)是香港大学关新元教授用染色体显微切割技术结合比较基因组杂交技术, 首次从人体肝癌细胞的染色体1q21区分离并克隆的一个新基因. 该基因又被称为ALC1(amplifled iIl liver cancer 1, 基因库登记号: AF537213), 基因全长2980 bp, 编码89 kDa分子蛋白. CHD1L是最近发现与多种肿瘤的起始、恶性进展治疗及化疗耐药等有着密切的关系, 因此, 研究在结直肠癌中CHD1L的作用机制十分重要.
李革, 副教授, 延边大学附属医院
近年来, 结直肠癌(colorectal cancer, CRC)发病率呈逐年上升和年轻化趋势, 病死率居高不下, 其死亡的主要原因是局部侵袭和远处转移, 研究CRC的靶向治疗疗效具有重要意义, 但仅部分患者获益, 因此, 寻找新的合适的标志物对治疗结直肠癌至关重要.
He等报道在卵巢癌转移组织中CHD1L的阳性表达可以明显缩短患者的生存期. 另外, 研究报道在肝癌患者中CHD1L的表达情况与临床病理特征如肿瘤的微卫星灶形成、肿瘤的分期、血管浸润和生存时间存在显著相关.
本文较全面的研究了CHD1L在CRC患者中的表达情况, 通过体外和体内证实CHD1L增强结直肠癌癌细胞增殖.
CHD1L在结直肠癌患者的癌细胞增殖凋亡中发挥了重要的作用, CHD1L可能成为治疗结直肠癌的一个新的靶点.
CHD1L: 是从人体肝癌细胞的染色体1q21区分离并克隆的一个新基因, 该基因又被称为ALC1(amplified in liver cancer 1). CHD1L属于SNF2类家族, SNF2蛋白家族在转录调控、染色质重构、调节蛋白-DNA结合等方面起十分重要的作用.
在肝癌、食管癌、胃癌等肿瘤中对CHD1L的研究已有文献报道, 乳腺癌中也稍有报道, 目前对CHD1L在结直肠癌中的研究寥寥无几. 本文就CHD1L在结肠癌中的表达以及其对癌细胞增殖凋亡的影响进行了相关的研究, 有一定的创新性, 实验设计合理, 结论有指导意义.
编辑: 韦元涛 电编:都珍珍
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 2. | Naishadham D, Lansdorp-Vogelaar I, Siegel R, Cokkinides V, Jemal A. State disparities in colorectal cancer mortality patterns in the United States. Cancer Epidemiol Biomarkers Prev. 2011;20:1296-1302. [PubMed] [DOI] |
| 3. | Wan DS. [Epidemiologic trend of and strategies for colorectal cancer]. Ai Zheng. 2009;28:897-902. [PubMed] [DOI] |
| 5. | Woodage T, Basrai MA, Baxevanis AD, Hieter P, Collins FS. Characterization of the CHD family of proteins. Proc Natl Acad Sci U S A. 1997;94:11472-11477. [PubMed] [DOI] |
| 7. | Su Z, Zhao J, Xian G, Geng W, Rong Z, Wu Y, Qin C. CHD1L is a novel independent prognostic factor for gastric cancer. Clin Transl Oncol. 2014;16:702-707. [PubMed] [DOI] |
| 8. | He WP, Zhou J, Cai MY, Xiao XS, Liao YJ, Kung HF, Guan XY, Xie D, Yang GF. CHD1L protein is overexpressed in human ovarian carcinomas and is a novel predictive biomarker for patients survival. BMC Cancer. 2012;12:437. [PubMed] [DOI] |
| 9. | Duffy MJ, Lamerz R, Haglund C, Nicolini A, Kalousová M, Holubec L, Sturgeon C. Tumor markers in colorectal cancer, gastric cancer and gastrointestinal stromal cancers: European group on tumor markers 2014 guidelines update. Int J Cancer. 2014;134:2513-2522. [PubMed] [DOI] |
| 10. | Chen L, Yuan YF, Li Y, Chan TH, Zheng BJ, Huang J, Guan XY. Clinical significance of CHD1L in hepatocellular carcinoma and therapeutic potentials of virus-mediated CHD1L depletion. Gut. 2011;60:534-543. [PubMed] [DOI] |
| 11. | Hyeon J, Ahn S, Park CK. CHD1L Is a Marker for Poor Prognosis of Hepatocellular Carcinoma after Surgical Resection. Korean J Pathol. 2013;47:9-15. [PubMed] [DOI] |
| 12. | Ji X, Li J, Zhu L, Cai J, Zhang J, Qu Y, Zhang H, Liu B, Zhao R, Zhu Z. CHD1L promotes tumor progression and predicts survival in colorectal carcinoma. J Surg Res. 2013;185:84-91. [PubMed] [DOI] |
| 13. | Du X, An Y, Yu L, Liu R, Qin Y, Guo X, Sun D, Zhou S, Wu B, Jiang YH. A genomic copy number variant analysis implicates the MBD5 and HNRNPU genes in Chinese children with infantile spasms and expands the clinical spectrum of 2q23.1 deletion. BMC Med Genet. 2014;15:62. [PubMed] [DOI] |
| 14. | Li N, Chen J. ADP-ribosylation: activation, recognition, and removal. Mol Cells. 2014;37:9-16. [PubMed] [DOI] |
| 16. | Tian F, Xu F, Zhang ZY, Ge JP, Wei ZF, Xu XF, Cheng W. Expression of CHD1L in bladder cancer and its influence on prognosis and survival. Tumour Biol. 2013;34:3687-3690. [PubMed] [DOI] |
| 17. | Bignell GR, Greenman CD, Davies H, Butler AP, Edkins S, Andrews JM, Buck G, Chen L, Beare D, Latimer C. Signatures of mutation and selection in the cancer genome. Nature. 2010;463:893-898. [PubMed] [DOI] |
| 18. | Chen L, Chan TH, Yuan YF, Hu L, Huang J, Ma S, Wang J, Dong SS, Tang KH, Xie D. CHD1L promotes hepatocellular carcinoma progression and metastasis in mice and is associated with these processes in human patients. J Clin Invest. 2010;120:1178-1191. [PubMed] [DOI] |
| 19. | Chen M, Huang JD, Hu L, Zheng BJ, Chen L, Tsang SL, Guan XY. Transgenic CHD1L expression in mouse induces spontaneous tumors. PLoS One. 2009;4:e6727. [PubMed] |
| 20. | Chen L, Hu L, Chan TH, Tsao GS, Xie D, Huo KK, Fu L, Ma S, Zheng BJ, Guan XY. Chromodomain helicase/adenosine triphosphatase DNA binding protein 1-like (CHD1l) gene suppresses the nucleus-to-mitochondria translocation of nur77 to sustain hepatocellular carcinoma cell survival. Hepatology. 2009;50:122-129. [PubMed] [DOI] |
| 21. | Li Y, Chen L, Chan TH, Liu M, Kong KL, Qiu JL, Li Y, Yuan YF, Guan XY. SPOCK1 is regulated by CHD1L and blocks apoptosis and promotes HCC cell invasiveness and metastasis in mice. Gastroenterology. 2013;144:179-191.e4. [PubMed] [DOI] |
| 22. | Hudson TJ, Anderson W, Artez A, Barker AD, Bell C, Bernabé RR, Bhan MK, Calvo F, Eerola I, Gerhard DS. International network of cancer genome projects. Nature. 2010;464:993-998. [PubMed] [DOI] |
| 23. | Stratton MR, Campbell PJ, Futreal PA. The cancer genome. Nature. 2009;458:719-724. [PubMed] [DOI] |
| 24. | Lemos TA, Passos DO, Nery FC, Kobarg J. Characterization of a new family of proteins that interact with the C-terminal region of the chromatin-remodeling factor CHD-3. FEBS Lett. 2003;533:14-20. [PubMed] |
| 25. | Hall JA, Georgel PT. CHD proteins: a diverse family with strong ties. Biochem Cell Biol. 2007;85:463-476. [PubMed] [DOI] |
| 26. | Liu W, Lindberg J, Sui G, Luo J, Egevad L, Li T, Xie C, Wan M, Kim ST, Wang Z. Identification of novel CHD1-associated collaborative alterations of genomic structure and functional assessment of CHD1 in prostate cancer. Oncogene. 2012;31:3939-3948. [PubMed] [DOI] |
| 27. | Huang S, Gulzar ZG, Salari K, Lapointe J, Brooks JD, Pollack JR. Recurrent deletion of CHD1 in prostate cancer with relevance to cell invasiveness. Oncogene. 2012;31:4164-4170. [PubMed] [DOI] |
| 28. | Larsen DH, Poinsignon C, Gudjonsson T, Dinant C, Payne MR, Hari FJ, Rendtlew Danielsen JM, Menard P, Sand JC, Stucki M. The chromatin-remodeling factor CHD4 coordinates signaling and repair after DNA damage. J Cell Biol. 2010;190:731-740. [PubMed] [DOI] |
| 29. | Marom R, Shur I, Hager GL, Benayahu D. Expression and regulation of CReMM, a chromodomain helicase-DNA-binding (CHD), in marrow stroma derived osteoprogenitors. J Cell Physiol. 2006;207:628-635. [PubMed] [DOI] |
| 30. | Brockschmidt A, Chung B, Weber S, Fischer DC, Kolatsi-Joannou M, Christ L, Heimbach A, Shtiza D, Klaus G, Simonetti GD. CHD1L: a new candidate gene for congenital anomalies of the kidneys and urinary tract (CAKUT). Nephrol Dial Transplant. 2012;27:2355-2364. [PubMed] [DOI] |