修回日期: 2014-10-27
接受日期: 2014-11-05
在线出版日期: 2014-12-18
目的: 通过观察正常结肠组织及各类型结肠腺瘤息肉和结肠癌组织类型中瞬时受体阳离子通道亚家族V成员5(transient receptor potential cation channel, subfamily V, member 5, TRPV5)、TRPV6表达情况, 研究TRPV5、TRPV6的表达变化是否与结肠腺瘤-腺癌的演变过程相关, 探讨其在人类结肠腺瘤-腺癌形成过程中的作用.
方法: 取肠镜活检或手术切除的增生性息肉、结肠腺瘤(免疫组织化学40例)、结肠癌标本各20例及正常对照肠黏膜20例. 采用实时荧光定量PCR技术、Western blot技术及免疫组织化学技术检测并比较正常结肠组织、结肠腺瘤及结肠癌组织中TRPV5、TRPV6 mRNA及其相应的蛋白含量的表达, 同时通过免疫组织化学测定组织细胞Ki-67来观察TRPV5、TRPV6表达与上述组织细胞增殖的关系.
结果: (1)TRPV5、TRPV6在正常结肠组织、结肠息肉组织及结肠癌组织中均有表达, 且主要表达部位均在细胞胞浆; Ki-67表达在TRPV5或TRPV6表达增高时亦增高(P<0.05); (2)TRPV5、TRPV6的蛋白及mRNA在正常肠黏膜及非腺瘤息肉中呈弱阳性表达或不表达(P>0.05), 在结肠腺瘤及结肠腺癌中高表达(P<0.05), 且与组织类型具有直线相关性(P<0.05); (3)在结肠黏膜组织内, TRPV5表达量低于TRPV6(P<0.05).
结论: 在结肠黏膜组织内, TRPV5、TRPV6均有不同程度表达, 特别在结肠腺瘤及结肠腺癌中呈高表达状态, 同时Ki-67表达亦相应增高. 提示在结肠黏膜组织内, TRPV5、TRPV6表达程度与组织增殖程度以及息肉恶变的危险性之间具有相关关系, TRPV5、TRPV6可能在结肠腺癌发生、发展过程中扮演着重要的角色.
核心提示: 瞬时受体阳离子通道亚家族V成员5(transient receptor potential cation channel, subfamily V, member 5, TRPV5)、TRPV6在正常结肠黏膜、腺瘤到腺癌的序列转变中可能扮演着重要的角色, 甚至可能是正常结肠组织向结肠腺癌转换过程中的重要调控靶点.
引文著录: 刘微, 刘模荣, 张慧. TRPV5、TRPV6在结肠腺癌发生发展过程中的表达及意义. 世界华人消化杂志 2014; 22(35): 5422-5431
Revised: October 27, 2014
Accepted: November 5, 2014
Published online: December 18, 2014
AIM: To investigate the expression of transient receptor potential cation channel, subfamily V, member 5 (TRPV5) and TRPV6 in the development of colon adenocarcinoma and to discuss the role of TRPV5 and TRPV6 in the carcinogenesis of this malignancy.
METHODS: TRPV5, TRPV6 and Ki-67 expression was examined by immunohistochemical staining, RT-PCR, and Western blot in 20 colonic hyperplastic polyp, 20 colonic adenoma (40 for immunohistochemical staining), 20 colonic adenocarcinoma, and 20 normal colonic mucosal tissues obtained by endoscopic biopsy, surgical resection or endoscopic polypectomy. The relationship between the expression of TRPV6 and TRPV5 and the carcinogenesis of colon adenocarcinoma was then assessed.
RESULTS: TRPV5 and TRPV6 expression was detectable in the normal colon, colonic polyp and colonic cancer tissues, mainly localized in the cytoplasm. The expression of Ki-67 increased with the increase in TRPV5 and TRPV6 expression (P < 0.05). TRPV5 and TRPV6 proteins and mRNAs were weakly or not expressed in normal intestinal mucosa and non-adenoma polyps (P > 0.05), but were highly expressed in colon adenoma and colon adenocarcinoma (P < 0.05). TRPV5 and TRPV6 expression had a significant correlation with histological type (P < 0.05). In the colonic mucosa, TRPV5 expression was lower than TRPV6 expression (P < 0.05).
CONCLUSION: TRPV5 and TRPV6 show high expression in colon adenoma and adenocarcinoma, and Ki-67 expression is correlated with TRPV5 and TRPV6 expression. TRPV5 and TRPV6 might be related with the extent of tissue proliferation and the risk of malignant transformation of polyps. TRPV5 and TRPV6 may play an important role in the carcinogenesis and development of colonic adenocarcinoma.
- Citation: Liu W, Liu MR, Zhang H. Expression of TRPV5 and TRPV6 in development of colonic adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(35): 5422-5431
- URL: https://www.wjgnet.com/1009-3079/full/v22/i35/5422.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i35.5422
结肠癌是消化系主要的恶性肿瘤之一, 在发达国家高居癌症发病率第1位、死亡率第2位. 近年来, 随着我国人民生活水平的提高、饮食结构的改变、人口老龄化以及结肠癌普查的开展, 结肠癌在我国的发病率呈逐年上升的趋势, 严重威胁着人们的健康[1]. 因此, 为了提高结肠癌患者的生存率, 我们应着手于早期结肠癌的防治.
胃肠平滑肌细胞的离子通道有3种类型, 即电压门控的钠通道、钾通道、钙通道等; 配体门控通道; 机械门控通道的牵张敏感通道和容积敏感通道等[2]. 平滑肌收缩活动与胞内Ca2+浓度变化密切相关, 高浓度Ca2+引起平滑肌收缩, 低浓度Ca2+引起平滑肌舒张, 因而近几年电压门控钙通道的研究在结肠疾病中备受关注. 一些流行病学研究也提示, 钙摄入可防止结肠癌的发生起保护作用. 作为人体内重要的阳离子, 钙离子具有极其重要的生理功能, 如维持神经肌肉正常兴奋性、调节腺体分泌等. 同时, 钙离子作为第二信使, 在信号传导中起着极其重要的作用, 是各条信号传导途径的枢纽, 可直接或间接地影响细胞的某些DNA复制和RNA表达, 完成生物信号的跨膜传递, 将细胞外刺激传递至细胞内, 激活不同的转录因子, 调节细胞的生长、分化和功能活性. 钙通道存在于机体的各种类型组织细胞中, 是一种与钙离子转运有关的存在于细胞膜上的特定蛋白质, 是钙离子从细胞外进入细胞内的主要通道, 通过构象变化成开放或关闭状态, 从而控制钙离子的流动, 发挥钙离子对细胞生物功能的调节作用[3].
瞬时受体阳离子通道亚家族V成员5(transient receptor potential cation channel, subfamily V, member 5, TRPV5)、TRPV6是TRP基因超家族中的成员, TRP是一种非电压依赖性阳离子通道, 广泛存在于多种哺乳动物组织中, 并参与调节多种重要的生理功能, 包括肌肉收缩、递质释放、细胞增殖、细胞分化、基因转录、细胞凋亡及细胞死亡等[4]. TRPV5和TRPV6是已知的钙离子高选择性通道. 在促进跨细胞钙离子转运的三步过程中, 已有研究[5]证明TRPV6是其一部分, 钙离子通过TRPV6进入细胞后, 结合到钙结合蛋白D28K上和/或钙结合蛋白D9K上弥散到基底外侧膜然后钙离子经钠钙交换蛋白(Na/Ca exchanger 1, NCX1)和三磷酸腺苷(adenosine triphosphate, ATP)依赖性质膜钙离子-碱性磷酸酶1b排出[6]. TRPV5、TRPV6除了在维持机体钙平衡中起着重要作用外, 在肿瘤的发生和进展中也有非常重要的影响. 有研究[7]表明TRPV5、TRPV6在前列腺、乳腺、甲状腺、卵巢和胰腺等恶性肿瘤中呈高表达. 对于TRPV6基因在结肠疾病中的研究, 其首先发现于大鼠十二指肠, 仅表达于上皮细胞, 与钙离子的摄入密切相关, 但TRPV6并不表达于胰腺癌及其他肿瘤组织与细胞, 因此他并不是在肿瘤中普遍表达的通道蛋白[8]. 目前有关TRPV5、TRPV6在人类结肠细胞中的表达以及功能仍旧知之甚少, 虽有研究[9]表明TRPV6在结肠癌中的表达显著增加, 但对于其在正常结肠组织、结肠腺瘤和结肠癌中表达的相互关系, 以及其对肿瘤发生的影响仍旧缺乏进一步的认识. 本文旨在探索TRPV5、TRPV6在结肠腺瘤-腺癌发生发展过程中的关系, 拟为进一步研究TRPV5、TRPV6在结肠腺癌早期诊断和治疗中的作用提供理论依据.
结肠癌组织来源于遵义医学院附属医院胃肠外科手术切除的组织及遵义医学院附属医院病理科收集的结肠癌组织石蜡标本, 各种类型大肠腺瘤性息肉(增生性息肉、增生腺瘤性息肉、绒毛状腺瘤)来源于遵义医学院附属医院内镜中心肠镜活检及遵义医学院附属医院病理科收集的组织标本. 正常结肠黏膜组织取材于外科肠外伤后切除肠管或内镜检查正常的肠壁活检. 取材患者年龄>18岁, 且所选的所有病例均无严重的肾脏疾病、甲状旁腺功能亢进及其他肿瘤病史, 术前未接受过放、化疗等抗癌治疗. TRPV5、TRPV6多克隆抗体购自Abcam公司; 内参抗体购自Boster公司; Ki-67多克隆抗体购自Bioss公司; 二抗、蛋白定量试剂盒购自上海碧云天生物技术有限公司; 引物(TRPV5-forward: 5'-ACTCATTCTCGAGACATCACCATCC-3', TRPV5-reverse: 5'-GCACCAACCCTGAAGATGTCTG-3'; TRPV6-forward: 5'-ATGGGTTTGTCACTGCCAAG-3', TRPV6-reverse: 5'-TTCAGGGCCTGGACATCATTATC-3'; GAPDH-forward: 5'-GCACCGTCAAGGCTGAGAAC-3', GAPDH-reverse: 5'-TGGTGAAGACGCCAGTGGA-3')由TakaRa公司合成; 逆转录试剂盒、RT-PCR扩增试剂盒购自TakaRa公司; GTVision™Ⅲ抗鼠/兔通用型免疫组织化学检测试剂盒购自上海基因科技有限公司.
1.2.1 免疫组织化学检测: 组织经4%甲醛溶液固定; 石蜡包埋后按照10 μm厚度常规切片; 切片经二甲苯脱蜡、梯度乙醇水化; 后进行封闭内源性过氧化物酶、抗原修复; 依据试剂说明滴加稀释后TRPV5、TRPV6及Ki-67多克隆抗体4 ℃冰箱过夜; 湿盒室温复温45 min后滴加生物素标记二抗, 室温孵育30 min; PBS冲洗干净后DAB显色; 苏木素复染; 重新梯度乙醇脱水透明; 中性树胶封片后显微镜下观察.
1.2.2 实时荧光定量PCR: 将所取得的人结肠组织标本放入1.5 mL离心管加入500-1000 μL TRIzol后充分捣碎组织, 静置5 min. 按照与TRIzol 5:1的比例加入三氯甲烷, 震荡摇匀后静置5 min后12000 g, 4 ℃, 离心15 min. 离心结束后, 将无色上清液转移至新的去酶EP管中, 加入与上清液等体积的异丙醇轻混匀后12000 g, 4 ℃, 离心10 min. 弃去上清液, 向沉淀中加入1 mL 750 mL/L乙醇(DEPC水+无水乙醇配制)清洗沉淀, 后12000 g, 4 ℃, 离心5 min. 然后滤纸上倒置3-5 min, 尽量除尽乙醇, 然后再重复1次加乙醇清洗操作. 溶解于适量的0.1%DEPC水中(30-100 μL), 运用SkanIt RE for MSS.2.4.4系统, 检测RNA的纯度和含量, 选取A260/280比值为1.8-2.0的RNA, 完成20 μL逆转录体系. 将逆转录产物置于-20 ℃冰箱保存用于扩增20 μL体系, 同时扩增目的基因及内参.
1.2.3 蛋白印迹实验: 将所取得的人结肠组织放入含有蛋白提取液RIPA 300-500 μL的EP管中后剪碎组织, 加入蛋白酶抑制剂PMSF 3-5 μL(终浓度为1 mmol), 用匀浆机充分捣碎组织后, 离心条件为12000 g, 4 ℃, 30 min, 离心完成后将上清液吸出进行BCA法蛋白定量, 后加入配制好的BCA试剂盒中的A:B液(50:1)每孔各200 μL, 置于37 ℃恒温孵育30 min后取出, 放入酶标仪检测蛋白浓度. 计算好样本浓度后, 按50 μg/(10 μL•支)统一蛋白质总量, 用于蛋白印迹实验. 根据TRPV5、TRPV6的蛋白分子量选择配制SDS-PAGE凝胶. 取分装好的样品各20 μL加入2×上样缓冲液1:1混匀, 煮沸6 min. 上样, 80 V、120 V进行电泳. 取出电泳完成的胶块, 切取目的蛋白TRPV5、TRPV6、β-actin条带所在胶上的胶带, 制作三明治, 用电转夹夹好后插入电转槽内, 将电压调至40 V, 电转槽置于冰水中, 电转4 h. 配封闭液即为含封闭蛋白干粉, 计算封闭液量, 分别加TRPV5、TRPV6一抗于封闭液中4 ℃封闭过夜. 取出一抗封闭过的PVDF膜, TBST室温清洗, 加入含TBST的孵育膜中混匀, 轻摇封闭1 h, 封闭完成后继续洗涤二抗, 后显色曝光, 用扫描仪扫描胶片, 采用IPP软件测出灰度值.
1.2.4 免疫组织化学结果判定标准: 采用光镜下观察组织切片的显色反应. TRPV5和TRPV6均以腺体细胞胞浆染色为主, 细胞膜可有少量染色. Ki-67阳性反应着色结果为细胞核呈黄色或棕褐色. 每张切片随机共选择5个视野, 每个视野共计数100个细胞, 根据染色的浓度及阳性细胞的数量来记分, 标准为: 不着色: 0分, 浅黄色: 1分, 黄色: 2分, 棕黄色: 3分. 阳性细胞数≤10%: 0分, 11%-30%: 1分, 31%-70%: 2分, 71%以上: 3分. 最后根据上述染色深度与阳性细胞数的得分相加后分为4级, 即阴性(-): 0分, 弱阳性(+): 1-2分, 阳性(++): 3-4分, 强阳性(+++): 5-6分.
统计学处理 数据统一用SPSS19.0软件进行统计分析, 采用单因素方差分析(One-way ANOVA), 组间差异采用LDS-t检验计算, 用mean±SD对计量资料进行统计描述, 采用Kruskal-Wallis(One-way ANOVA)秩和检验和Spearman等级相关分析; P<0.05为差异有统计学意义.
2.1.1 半定量评分比较TRPV5、TRPV6及Ki-67在正常结肠组织、各类型结肠息肉组织及结肠腺癌组织中的表达: TRPV5、TRPV6在各类型结肠组织中均有表达, 且在正常结肠组织、结肠增生性息肉、结肠腺瘤性息肉、结肠绒毛状腺瘤及结肠腺癌中TRPV5、TRPV6的表达呈逐渐递增趋势. Ki-67阳性表达与相应组织中TRPV5、TRPV6表达类似(表1).
2.1.2 TRPV5、TRPV6和Ki-67之间的相关性: 根据表1数据, 采用Spearman等级相关分析显示, TRPV5、TRPV6表达水平分别与Ki-67表达呈正相关关系(r = 0.323, P<0.05; r = 0.437, P<0.05).
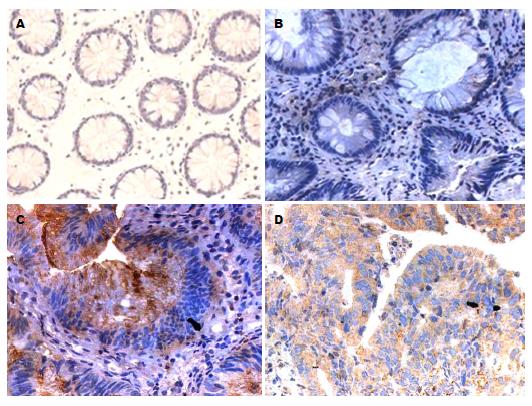
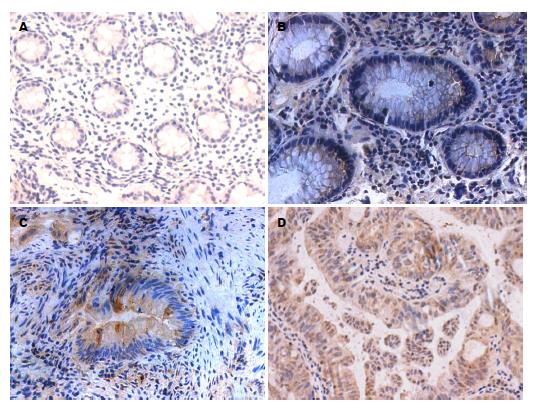
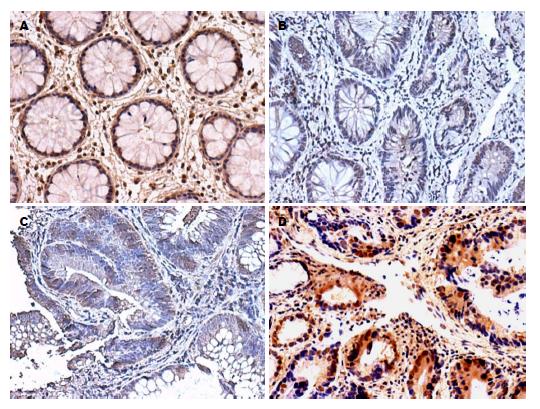
2.1.3 TRPV5、TRPV6在各类型结肠组织中的表达: TRPV5、TRPV6在各类型结肠组织中均有表达, 且在正常结肠组织、结肠增生性息肉、结肠腺瘤性息肉、结肠绒毛状腺瘤及结肠腺癌中TRPV5、TRPV6的表达呈逐渐递增趋势, 并主要定位于细胞胞浆, 少量表达在细胞膜. Ki-67阳性表达与相应组织中TRPV5、TRPV6表达类似, 主要定位于细胞核(图1, 图2和图3).
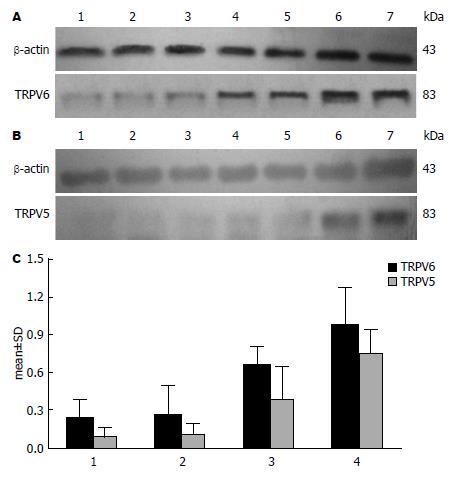
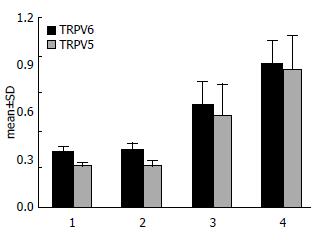
Western blot结果显示结肠癌、各类结肠息肉及正常结肠组织上均有TRPV5、TRPV6蛋白的表达, TRPV5、TRPV6及内参在83、43 kDa处有条带表达(图4). TRPV5、TRPV6蛋白在正常结肠黏膜、增生性息肉、结肠腺瘤性息肉及结肠腺癌中从弱表达或不表达呈逐渐增加趋势, 且TRPV5表达量略低于TRPV6(表2).
用Real-time PCR的方法检测后比较正常结肠组织与各类结肠息肉及结肠癌组织之间TRPV5、TRPV6 mRNA水平表达的差异. 结果显示: TRPV5、TRPV6 mRNA在正常结肠黏膜、增生性息肉、结肠腺瘤性息肉及结肠腺癌中从低表达呈逐渐增加, 在腺癌组织中表达最高, 且TRPV5表达量略低于TRPV6(表3, 图5).
Ca2+通道在调控肿瘤细胞生物学行为中的作用已成为当今研究的热点问题之一. 1999年以前, 对钙离子的跨膜转运的研究主要集中在Ca2+ ATP酶和钠-钙交换这两种形式上, 也就是钙离子从细胞中转运到细胞外的过程, 但对细胞外钙离子如何进入小肠、肾和骨细胞的机制并不了解. 自从1999年Hoenderop等[10]首次报道TRPV5和TRPV6, 并证实其和钙离子细胞转运有关后, 近十年间, 相继发现了多种钙离子的跨膜转运通道, 且主要集中在瞬时性受体电位通道TRP超家族这一类新型钙离子转运蛋白通道. 目前, 大约三十种TRP通道已被明确, TRPV5和TRPV6是TRP超家族中V亚家族中已知的两种钙离子高选择性通道. 因为首先发现其存在于上皮组织, 曾分别被命名为上皮性钙通道1和2(ECaC1和ECaC2)[11], 在维持机体钙平衡中起着重要作用, 同时其在肿瘤的发生、发展过程中也有着非常重要的影响. 与正常组织或细胞相比, TRPV5、TRPV6 mRNA或蛋白的表达在前列腺癌、结肠癌、乳腺癌、甲状腺癌和卵巢癌组织中均有大幅度的增加[7,12].
免疫组织化学数据表明, TRPV5、TRPV6在各类型结肠组织中均有表达, 且在结肠腺癌中呈高表达, 并主要定位于细胞胞浆, 少量表达在细胞膜. 在正常结肠组织、结肠增生性息肉中TRPV5、TRPV6呈低浓度表达, 而在结肠腺瘤性息肉、结肠绒毛状腺瘤及结肠腺癌中TRPV5、TRPV6的表达较高, 且呈逐渐递增趋势, 与正常结肠组织比较差异具有统计学意义(P<0.05). 进一步Western blot、RT-PCR的实验结果也表明, TRPV5、TRPV6蛋白及TRPV5 mRNA、TRPV6 mRNA在结肠增生性息肉、结肠腺瘤性息肉及结肠腺癌中的表达量也呈逐渐递增趋势, 与正常结肠组织比较差异具有统计学意义(P<0.05). 尽管部分学者发现, TRPV6在Ⅰ期结肠肿瘤中66%过表达, 在Ⅱ期结肠肿瘤中17%过表达, 在Ⅲ、Ⅳ期结肠肿瘤中却几乎检测不到, 提示结肠TRPV6表达水平的增加与早期结肠癌相关[13]. 但多数研究[9]表明, TRPV6在结肠癌中表达呈显著增加.
Ki-67是一种细胞核抗原, 仅在增殖的细胞核中有表达, 在一定程度上能够反映出细胞的增殖活性, 是当今应用最广泛的细胞增殖的标记物, 与肿瘤的发生密切相关. Ki-67能可靠地反映出正常和病变组织甚至肿瘤细胞的增殖活性. Muto等[14]认为结肠腺瘤属于癌前期病变, 大多数结肠癌发生于先前存在的腺瘤, 即所谓的"腺瘤-癌"序列, 并且强调了在不同的阶段这一过程有着不同的基因变化参与, 其中结肠黏膜细胞的增殖活性渐增直到转为质变是它的主要特征. 本实验发现, Ki-67阳性表达在正常结肠组织、结肠增生性息肉、结肠腺瘤及结肠腺癌中呈逐渐增高, 特别是在结肠腺瘤和结肠腺癌中Ki-67阳性率显著高于正常组织及增生性息肉(P<0.05). 同时, 相应组织中TRPV5、TRPV6表达亦呈类似变化, 经过相关统计学分析表明TRPV5、TRPV6在正常结肠组织、结肠增生性息肉、结肠腺瘤及结肠腺癌中的表达与Ki-67之间成正相关关系(r = 0.323, P<0.05; r = 0.437, P<0.05). 在高水平表达的TRPV6 mRNA结肠癌细胞株Caco-2的实验中, 经用TRPV6特异性siRNA来处理后, TRPV6 mRNA水平显著降低了约50%, 同时减少了40%细胞增殖. 在结肠隐窝增生模型实验中也显示出, TRPV6 mRNA表达发生了显著性的增强, 且广泛分布于结肠隐窝的增殖区, 而当动物被喂以高钙饮食时, 增生模型中TRPV6的过表达可被逆转, 相应组织细胞增殖过程减慢[13]. 这些实验均表明TRPV5、TRPV6表达阳性率高低与组织细胞的增殖活性密切相关. 提示TRPV5、TRPV6在结肠腺瘤-腺癌序列的发展过程中可能扮演关键角色. TRPV5、TRPV6及相应钙离子转运可能是早期结肠癌发生发展的一个重要致病因素, 至于TRPV5和TRPV6究竟是通过何种机制来控制结肠细胞的增殖, 这还需要进一步的实验来证实.
既往研究[15]发现, TRPV5和TRPV6蛋白序列是具有高度同源性的, 他们的某些功能区结构完全相同, 而且两者似乎是TRPV家族中唯一形成异四倍体的通道. 更有实验证明[16,17], TRPV5和TRPV6的功能是相互连接的, TRPV5基因敲除的小鼠, 由于TRPV5介导的Ca2+在肾脏重吸收的损失, 而立即上调肠道TRPV6的表达来补偿以致达到负钙平衡, 两者的表达和功能还共同受饮食中钙量及多种钙调激素的调节[18,19]. TRPV5主要表达在肾脏, 在大鼠表达胆囊收缩素CCK1受体的迷走神经节状神经元也发现TRPV5表达[20], 在结肠组织中仅有少量表达[21]; 而TRPV6则主要发生在肠上皮细胞, 同时发现人结肠癌细胞(Caco-2及SW480细胞株)中也存在表达[19,22,23]. 在本实验中尽管TRPV5和TRPV6在各类结肠组织中呈共表达, 但无论在正常结肠组织及结肠增生性息肉, 或是结肠腺瘤和结肠腺癌, TRPV5蛋白和TRPV5 mRNA表达均低于和TRPV6蛋白和TRPV6 mRNA, 两者相比较, 差异具有统计学意义(P<0.05). 这一结果可能与TRPV5和TRPV6蛋白结构的区别有关, 研究表明, 尽管TRPV5和TRPV6结构相似, 但仍然存在着区别. TRPV6的羧基末端没有蛋白激酶C磷酸化位点, 而TRPV5羧基末端存在3个蛋白激酶C磷酸化位点. TRPV6的TM6羧基端存在组氨酸残基(H587)突变体, 而TRPV5则未发现该突变体. 两通道在化学结构差别的基础上引起电生理学的差异, 表现为: (1)TRPV6的失活首先是一个快速的过程, 随后是一个缓慢的过程, 而TRPV5在整个失活过程中都是一个缓慢的过程; (2)TRPV5中Ba2+/Ca2+电流比值明显高于TRPV6; (3)通道阻滞剂钌红对TRPV6的阻断作用要比TRPV5弱100倍. 因此决定了TRPV5和TRPV6表达部位及生理功能的差异[24-31]. 因此, 在TRPV5和TRPV6共表达的结肠组织中, 由于两者相对表达量不同, 更能精细地调节机体钙转运动力学, 甚至在"结肠腺瘤-腺癌序列"发生、发展过程中对组织细胞增殖进行精细调控.
总之, TRPV5、TRPV6在正常结肠黏膜、腺瘤到腺癌的序列转变中可能扮演着重要的角色, 甚至可能是正常结肠组织向结肠腺癌转换过程中的重要调控靶点. 但TRPV5、TRPV6在"结肠腺瘤-腺癌序列"发生、发展过程中对组织细胞增殖所起作用的大小及其机制, 还有待进一步实验研究来证明. 这可能会为未来结肠癌的研究提供一个新的方向, 或将为结肠癌的防治提供一个新的切入点.
结肠癌的发生率目前呈现升高趋势, 钙及维生素D能显著降低结肠癌的发生率. 瞬时受体阳离子通道亚家族V成员5(transient receptor potential cation channel, subfamily V, member 5, TRPV5)和TRPV6是新发现的高选择性的Ca2+跨膜转运通道, 与结肠癌形成过程相关. 本文作者主要从TRPV5和TRPV6与结肠腺癌发生发展关系等方面进行实验研究探讨.
王道荣, 主任医师, 江苏省苏北人民医院胃肠外科; 甘华田, 教授, 四川大学华西医院老年消化内科; 陈洪, 主任医师, 副教授, 东南大学附属中大医院消化科
近十年间, 相继发现了多种钙离子的跨膜转运通道, 且主要集中在TRP超家族这一类新型钙离子转运蛋白通道. 而TRPV5和TRPV6是该家族中V亚家族中唯一已知的两种钙离子高选择性通道, 目前研究发现TRPV5和TRPV6与结肠癌形成过程相关.
研究表明TRPV5、TRPV6通过调控细胞内钙离子的浓度影响细胞生物学行为, 在人乳腺癌、前列腺癌及结肠癌等多种肿瘤中呈高表达.
本文观察了正常结肠组织及各类型结肠腺瘤息肉和结肠癌组织类型中TRPV5、TRPV6表达情况. 结果发现TRPV5与TRPV6在结肠组织中共表达, 但TRPV5表达量略低于TRPV6; TRPV5、TRPV6在结肠组织中表达程度与组织细胞增殖程度呈正相关.
该研究观察了正常结肠组织及各类型结肠腺瘤息肉和结肠癌组织类型中TRPV5、TRPV6表达情况, 提示在结肠黏膜组织内, TRPV5、TRPV6表达程度与组织增殖程度以及息肉恶变的危险性之间具有相关关系, 将为结肠癌的防治研究提供新的方向.
TRPV5和TRPV6: 是TRP超家族中V亚家族中唯一已知的两种钙离子高选择性通道. 因为首先发现其存在于上皮组织, 曾分别被命名为上皮性钙通道1和2. 研究表明, TRPV5和TRPV6同源性高达75%, 具有高度的钙离子选择性, 其存在于具有钙离子跨细胞转运功能的器官.
本文选题新颖, 对探索结肠癌的发生发展机理有一定意义. 对同行在TRPV5和TRPV6钙离子通道方面的研究有一定的参考价值.
编辑: 韦元涛 电编:都珍珍
| 1. | Shike M, Winawer SJ, Greenwald PH, Bloch A, Hill MJ, Swaroop SV. Primary prevention of colorectal cancer. The WHO Collaborating Centre for the Prevention of Colorectal Cancer. Bull World Health Organ. 1990;68:377-385. [PubMed] |
| 3. | Benham CD, Davis JB, Randall AD. Vanilloid and TRP channels: a family of lipid-gated cation channels. Neuropharmacology. 2002;42:873-888. [PubMed] [DOI] |
| 5. | Yamauchi D, Nakaya K, Raveendran NN, Harbidge DG, Singh R, Wangemann P, Marcus DC. Expression of epithelial calcium transport system in rat cochlea and vestibular labyrinth. BMC Physiol. 2010;10:1. [PubMed] [DOI] |
| 6. | Schwaller B. Cytosolic Ca2+ buffers. Cold Spring Harb Perspect Biol. 2010;2:a004051. [PubMed] [DOI] |
| 7. | Zhuang L, Peng JB, Tou L, Takanaga H, Adam RM, Hediger MA, Freeman MR. Calcium-selective ion channel, CaT1, is apically localized in gastrointestinal tract epithelia and is aberrantly expressed in human malignancies. Lab Invest. 2002;82:1755-1764. [PubMed] [DOI] |
| 8. | Peng JB, Brown EM, Hediger MA. Apical entry channels in calcium-transporting epithelia. News Physiol Sci. 2003;18:158-163. [PubMed] [DOI] |
| 9. | Lehen'kyi V, Raphaël M, Prevarskaya N. The role of the TRPV6 channel in cancer. J Physiol. 2012;590:1369-1376. [PubMed] [DOI] |
| 10. | Hoenderop JG, van der Kemp AW, Hartog A, van de Graaf SF, van Os CH, Willems PH, Bindels RJ. Molecular identification of the apical Ca2+ channel in 1, 25-dihydroxyvitamin D3-responsive epithelia. J Biol Chem. 1999;274:8375-8378. [PubMed] [DOI] |
| 11. | Weber K, Erben RG, Rump A, Adamski J. Gene structure and regulation of the murine epithelial calcium channels ECaC1 and 2. Biochem Biophys Res Commun. 2001;289:1287-1294. [PubMed] [DOI] |
| 12. | Wissenbach U, Niemeyer BA, Fixemer T, Schneidewind A, Trost C, Cavalie A, Reus K, Meese E, Bonkhoff H, Flockerzi V. Expression of CaT-like, a novel calcium-selective channel, correlates with the malignancy of prostate cancer. J Biol Chem. 2001;276:19461-19468. [PubMed] [DOI] |
| 13. | Peleg S, Sellin JH, Wang Y, Freeman MR, Umar S. Suppression of aberrant transient receptor potential cation channel, subfamily V, member 6 expression in hyperproliferative colonic crypts by dietary calcium. Am J Physiol Gastrointest Liver Physiol. 2010;299:G593-G601. [PubMed] [DOI] |
| 14. | Muto T, Bussey HJ, Morson BC. The evolution of cancer of the colon and rectum. Cancer. 1975;36:2251-2270. [PubMed] |
| 15. | Hellwig N, Albrecht N, Harteneck C, Schultz G, Schaefer M. Homo- and heteromeric assembly of TRPV channel subunits. J Cell Sci. 2005;118:917-928. [PubMed] [DOI] |
| 16. | Suzuki Y, Landowski CP, Hediger MA. Mechanisms and regulation of epithelial Ca2+ absorption in health and disease. Annu Rev Physiol. 2008;70:257-271. [PubMed] [DOI] |
| 17. | Benn BS, Ajibade D, Porta A, Dhawan P, Hediger M, Peng JB, Jiang Y, Oh GT, Jeung EB, Lieben L. Active intestinal calcium transport in the absence of transient receptor potential vanilloid type 6 and calbindin-D9k. Endocrinology. 2008;149:3196-3205. [PubMed] [DOI] |
| 18. | Nijenhuis T, Hoenderop JG, Bindels RJ. TRPV5 and TRPV6 in Ca(2+) (re)absorption: regulating Ca(2+) entry at the gate. Pflugers Arch. 2005;451:181-192. [PubMed] [DOI] |
| 19. | Schoeber JP, Hoenderop JG, Bindels RJ. Concerted action of associated proteins in the regulation of TRPV5 and TRPV6. Biochem Soc Trans. 2007;35:115-119. [PubMed] [DOI] |
| 20. | Zhao H, Simasko SM. Role of transient receptor potential channels in cholecystokinin-induced activation of cultured vagal afferent neurons. Endocrinology. 2010;151:5237-5246. [PubMed] [DOI] |
| 21. | Santoni G, Farfariello V, Amantini C. TRPV channels in tumor growth and progression. Adv Exp Med Biol. 2011;704:947-967. [PubMed] [DOI] |
| 22. | Fukushima A, Aizaki Y, Sakuma K. Short-chain fatty acids induce intestinal transient receptor potential vanilloid type 6 expression in rats and Caco-2 cells. J Nutr. 2009;139:20-25. [PubMed] [DOI] |
| 23. | Bartik L, Whitfield GK, Kaczmarska M, Lowmiller CL, Moffet EW, Furmick JK, Hernandez Z, Haussler CA, Haussler MR, Jurutka PW. Curcumin: a novel nutritionally derived ligand of the vitamin D receptor with implications for colon cancer chemoprevention. J Nutr Biochem. 2010;21:1153-1161. [PubMed] [DOI] |
| 24. | Lee KP, Nair AV, Grimm C, van Zeeland F, Heller S, Bindels RJ, Hoenderop JG. A helix-breaking mutation in the epithelial Ca(2+) channel TRPV5 leads to reduced Ca(2+)-dependent inactivation. Cell Calcium. 2010;48:275-287. [PubMed] [DOI] |
| 25. | Hoenderop JG, van der Kemp AW, Hartog A, van Os CH, Willems PH, Bindels RJ. The epithelial calcium channel, ECaC, is activated by hyperpolarization and regulated by cytosolic calcium. Biochem Biophys Res Commun. 1999;261:488-492. [PubMed] [DOI] |
| 26. | Fudge NJ, Kovacs CS. Pregnancy up-regulates intestinal calcium absorption and skeletal mineralization independently of the vitamin D receptor. Endocrinology. 2010;151:886-895. [PubMed] [DOI] |
| 27. | Thyagarajan B, Benn BS, Christakos S, Rohacs T. Phospholipase C-mediated regulation of transient receptor potential vanilloid 6 channels: implications in active intestinal Ca2+ transport. Mol Pharmacol. 2009;75:608-616. [PubMed] [DOI] |
| 28. | Cha SK, Wu T, Huang CL. Protein kinase C inhibits caveolae-mediated endocytosis of TRPV5. Am J Physiol Renal Physiol. 2008;294:F1212-F1221. [PubMed] [DOI] |
| 29. | Jiang Y, Ferguson WB, Peng JB. WNK4 enhances TRPV5-mediated calcium transport: potential role in hypercalciuria of familial hyperkalemic hypertension caused by gene mutation of WNK4. Am J Physiol Renal Physiol. 2007;292:F545-F554. [PubMed] [DOI] |
| 30. | Vasil'eva IO, Neguliaev IuA, Marakhova II, Semenova SB. [TRPV5 and TRPV6 calcium channels in human T cells]. Tsitologiia. 2008;50:953-957. [PubMed] |
| 31. | Ajibade DV, Dhawan P, Fechner AJ, Meyer MB, Pike JW, Christakos S. Evidence for a role of prolactin in calcium homeostasis: regulation of intestinal transient receptor potential vanilloid type 6, intestinal calcium absorption, and the 25-hydroxyvitamin D(3) 1alpha hydroxylase gene by prolactin. Endocrinology. 2010;151:2974-2984. [PubMed] [DOI] |