修回日期: 2014-10-13
接受日期: 2014-10-16
在线出版日期: 2014-12-08
目的: 探讨血清sCD25水平在肝细胞癌(hepatocellular carcinoma, HCC)诊断中的意义.
方法: 本实验包括160例研究对象: 40例HCC患者; 40例肝硬化患者; 40例慢性乙型病毒性肝炎(chronic hepatitis B, CHB)患者, 40例健康志愿者. 通过酶联免疫吸附方法(ELISA)测定每一受检者血清中sCD25水平.
结果: HCC组血清sCD25水平(平均值 = 9641.23 pg/mL)显著高于肝硬化组、CHB组及健康对照组(P<0.05). 在HCC的诊断中, sCD25比甲胎蛋白(alpha fetal protein, AFP)显示出更好的敏感性.
结论: 本实验表明, 在早期HCC的检测中sCD25(95%CI: 7584.47-11697.99 pg/mL)比AFP敏感性更高. 有望作为HCC发生的一个新的预测指标并有可能用来区分早期HCC与晚期肝硬化. 这正是国际社会目前研究的热点.
核心提示: 肝细胞癌(hepatocellular carcinoma, HCC)患者血清sCD25水平明显升高, 且在早期HCC的检测中sCD25显示出较高的敏感性, 提示其有望作为早期HCC检测的标志物, 但其具体机制有待进一步研究.
引文著录: 郭慧敏, 李建生, 张金平, 李东颖, 李会芬. 血清sCD25测定在肝细胞癌诊断中的意义. 世界华人消化杂志 2014; 22(34): 5344-5349
Revised: October 13, 2014
Accepted: October 16, 2014
Published online: December 8, 2014
AIM: To explore the significance of serum sCD25 level in the diagnosis of hepatocellular carcinoma (HCC).
METHODS: A total of 160 subjects, including 40 patients with HCC, 40 patients with liver cirrhosis, 40 patients with chronic hepatitis B, and 40 healthy controls, were measured for serum sCD25 levels by enzyme-linked immuno sorbent assay (ELISA).
RESULTS: Serum sCD25 level in the HCC group (mean, 9641.23 pg/mL) was significantly higher than those in the cirrhosis group, chronic hepatitis B group and healthy control group (P < 0.05). Serum sCD25 level demonstrated a better sensitivity than alpha fetal protein (AFP) in the diagnosis of HCC.
CONCLUSION: Serum sCD25 level is effective in the detection of early HCC, and it may serve as a novel predictive marker of HCC to distinguish advanced cirrhosis from early HCC.
- Citation: Guo HM, Li JS, Zhang JP, Li DY, Li HF. Significance of serum sCD25 level in diagnosis of hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(34): 5344-5349
- URL: https://www.wjgnet.com/1009-3079/full/v22/i34/5344.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i34.5344
肝细胞癌(hepatocellular carcinoma, HCC)是世界范围内肿瘤相关死亡的主要原因之一, 因此导致的经济、社会负担日益加重. 原发性肝细胞癌通常作为慢性肝脏疾病, 尤其是肝硬化的并发症出现. HCC的主要危险因素有: 乙型肝炎、丙型肝炎病毒感染, 酒精性肝病、非酒精性脂肪性肝病、自身免疫性肝病等. 世界范围内, 乙型肝炎病毒(hepatitis B virus, HBV)感染占到HCC发病原因的50%, 尤其是在发展中国家[1]. 肝硬化患者最常见的结局是发展为HCC[2]. 早期发现HCC能明显改善预后[3]. 然而, 高危患者发展成HCC的危险因素是多种多样的, 因此HCC的早期检测依旧是医学界的一个具有挑战性的难题. 目前, HCC的筛查主要包括血清学和放射学两个方面[4]. 在血清学检查中甲胎蛋白(alpha fetal protein, AFP)应用最为广泛, 然而因其敏感性较差[5], 以其作为HCC筛查指标结果并不令人满意. 这也解释了美国肝病研究学会(American Association for the Study of Liver Diseases, AASLD)的指南中尝试不再将AFP作为HCC筛查内容[6]. 因此寻找早期HCC检测的血清学指标意义重大[7].
免疫系统拥有多种防御机制来抵制肿瘤的发生. 但是, 肿瘤的一个重要特征是破坏这些防御机制, 最终逃脱肿瘤免疫机制[8]. 研究[9]表明sCD25作为一种免疫因子, 是HCC免疫抑制系统的一部分, 有望作为HCC的标志物. sCD25产生于白介素-2(interleukin-2, IL-2)受体的膜相关α亚基的水解释放. 当sCD25与β、γ链共同表达于T细胞膜表面时, 就组成了具有高亲和力的IL-2受体, 与相应配体结合后引起T细胞的活化和增殖. 有研究[10]表明, 在血液系统恶性肿瘤、头颈部肿瘤、肺癌及食管癌中血清sCD25水平明显升高, 且与肿瘤负荷具有明显的相关性. 但国内目前尚无关于HCC患者血清sCD25水平的研究.
本研究包含160例研究对象, 分为4组: 第1组为HCC组, 包含40例研究对象(平均年龄: 56.2岁±10.99岁, 男:女 = 2.6:1.0); 第2组为肝硬化组, 包含40例研究对象(平均年龄: 51.98岁±9.01岁, 男:女 = 2.3:1.0); 第3组为慢性乙型病毒性肝炎(chronic hepatitis B, CHB)组, 包含40例研究对象(平均年龄: 33.55岁±10.70岁, 男:女 = 5.7:1.0), 不包括丙型肝炎病毒及人类免疫缺陷病毒的混合感染; 第4组包含40例健康对照(平均年龄: 53.63岁±14.04岁, 男:女 = 0.9:1.0), 此组不包括类风湿关节炎患者、酗酒、自免肝及急性感染或其他恶性肿瘤. 本实验经郑州大学伦理委员会审核通过. 所有研究对象均于实验前给以知情同意并签署同意书.
1.2.1 诊断: HCC的诊断基于AFP水平升高、组织学证实或经两种以上影像学证实[(彩超、计算机断层扫描(computed tomography, CT)或核磁共振成像(magnetic resonance imaging, MRI)]; 肝硬化的诊断依据临床、生化、彩超或组织学标准.
1.2.2 sCD25水平检测: 血浆标本经收集并离心后储存于-80 ℃, 实验时给以解冻. 根据使用说明书, 使用ELISA板[卡迈舒(上海)生物科技有限公司]测定每一个受试者血清中sCD25水平.
统计学处理 本实验采用SPSS17.0进行统计学分析. 依据具体情况使用中位数、全距、均数、标准差、标准误来描述. 分类数据用Fisher's exact test或χ2检验来检测. 连续数据用ANOVA检验. 3组之间sCD25水平与临床特征之间的比较用K-W检验和非参数t检验. 通过ROC曲线找到AFP及sCD25的最佳工作点进而比较两者的诊断价值. P<0.05为差异有统计学意义.
本研究中大多数的HCC患者为男性, HBV感染占HCC及肝硬化病原学的绝大多数. 各组在体质量指数、糖尿病患病率、吸烟习惯之间无明显差异(P>0.05). HCC组与肝硬化组在年龄、性别、体质量指数、居住地、感染类型、吸烟习惯及腹水有无之间差异无统计学意义(P>0.05). 各组之间在肝功能及肿瘤标志物之间差异有统计学意义(P<0.05). HCC组与CHB组在年龄上差异有统计学意义(P<0.05), 但这种差异是符合逻辑的, 因为HCC大多是慢性肝炎及肝硬化的长期并发症[11](表1).
| 变量 | HCC组 | LC组 | CHB组 | HC组 | P1值 | P2值 |
| 年龄(岁) | 56.2±10.99 | 51.98±9.01 | 33.55±10.70 | 53.63±14.04 | 0.000 | 0.097 |
| 性别n(%) | 0.003 | 0.805 | ||||
| 男 | 29(72.5) | 28(70.0) | 34(85.0) | 19(47.5) | ||
| 女 | 11(27.5) | 12(30.0) | 6(15.0) | 21(52.5) | ||
| BMI(kg/m2) | 22.51±3.11 | 22.83±2.92 | 23.50±2.72 | 21.70±3.28 | 0.065 | 0.644 |
| 居住地n(%) | 0.012 | 0.639 | ||||
| 城市 | 13(32.5) | 15(37.5) | 27(67.5) | 8(20.0) | ||
| 农村 | 27(67.5) | 25(62.5) | 13(32.5) | 32(20.0) | ||
| 吸烟习惯n(%) | 0.196 | 0.284 | ||||
| 吸烟 | 11(27.5) | 7(17.5) | 4(10.0) | 10(25.0) | ||
| 不吸烟 | 29(72.5) | 33(82.5) | 36(90.0) | 30(75.0) | ||
| 糖尿病n(%) | 0.229 | 0.136 | ||||
| 糖尿病 | 6(15.0) | 2(5.0) | 1(2.5) | 3(7.5) | ||
| 非糖尿病 | 34(85.0) | 38(95.0) | 39(97.5) | 37(97.5) | ||
| 感染类型n(%) | 0.000 | 0.017 | ||||
| HBV | 39(95.0) | 31(77.5) | 40(100.0) | 0(0.0) | ||
| HCV | 1(2.5) | 9(22.5) | 0(0.0) | 0(0.0) | ||
| HCV和HBV | 0(0.0) | 0(0.0) | 0(0.0) | 0(0.0) | ||
| 无 | 1(2.5) | 0(0.0) | 0(0.0) | 40(100.0) | ||
| 腹水n(%) | 0.000 | 0.260 | ||||
| 有 | 15(37.5) | 20(50.0) | 0(0.0) | 0(0.0) | ||
| 无 | 25(62.5) | 20(50.0) | 40(100.0) | 40(100.0) | ||
| ALT(U/mL) | 45.70±34.96 | 41.10±32.03 | 155.02±179.77 | 16.20±8.97 | 0.000 | 0.825 |
| AST(U/mL) | 64.55±43.68 | 48.60±35.31 | 90.40±103.95 | 17.83±5.66 | 0.000 | 0.230 |
| AST/ALT(%) | 1.77±1.12 | 1.33±0.51 | 0.78±0.44 | 1.27±0.41 | 0.000 | 0.005 |
| ALP(IU/L) | 118.64±59.82 | 98.36±40.21 | 84.73±36.94 | 69.65±19.11 | 0.000 | 0.031 |
| GGT(IU/L) | 162.16±185.59 | 61.48±63.80 | 64.93±48.74 | 18.98±18.52 | 0.000 | 0.000 |
| TBIL(mg/mL) | 36.48±59.29 | 26.84±28.96 | 27.45±63.25 | 11.46±5.03 | 0.108 | 0.348 |
| TP(g/L) | 64.63±8.85 | 64.62±7.78 | 70.14±6.77 | 60.91±5.43 | 0.001 | 0.996 |
| ALB(g/L) | 35.02±4.92 | 34.75±5.59 | 41.88±5.61 | 39.73±6.35 | 0.000 | 0.829 |
| AFP(ng/mL) | 340.39±477.22 | 22.87±73.03 | 14.76±35.86 | 2.86±1.63 | 0.000 | 0.000 |
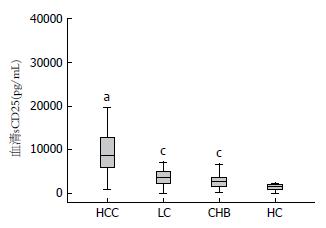
| sCD25(pg/mL) | 9641.23±6431.09 | 3746.34±2111.76 | 2724.64±1520.13 | 1427.23±709.03 | 0.000 | 0.000 |
对HCC组及肝硬化组血清sCD25水平与生化指标之间相关性的研究表明, 除了在HCC组sCD25水平与体质量指数(body mass index, BMI)及白蛋白水平之间存在微弱相关外, 与其他生化之间无明显相关性(表2).
| 参数 | HCC组 | 肝硬化组 | ||
| 相关系数(r) | P值 | 相关系数(r) | P值 | |
| 年龄 | -0.357 | 0.024 | -0.065 | 0.689 |
| BMI | 0.444 | 0.004 | 0.061 | 0.710 |
| 随机血糖 | -0.129 | 0.429 | -0.171 | 0.290 |
| ALT | 0.123 | 0.450 | -0.026 | 0.873 |
| AST | 0.283 | 0.077 | -0.099 | 0.544 |
| AST/ALT | 0.118 | 0.470 | 0.066 | 0.685 |
| ALP | -0.162 | 0.319 | 0.055 | 0.736 |
| GGT | 0.017 | 0.916 | -0.064 | 0.693 |
| AFP | -0.169 | 0.296 | -0.036 | 0.825 |
| TBIL | 0.042 | 0.799 | -0.70 | 0.668 |
| TP | 0.059 | 0.716 | -0.072 | 0.658 |
| ALB | 0.320 | 0.044 | 0.050 | 0.759 |
HCC患者血清sCD25水平(均值 = 9641.23 pg/mL)显著高于肝硬化组(均值 = 3746.34 pg/mL, P<0.05)、CHB组(均值 = 2724.64.23 pg/mL, P<0.05)及健康对照组(均值 = 1427.23 pg/mL, P<0.05)(图1).
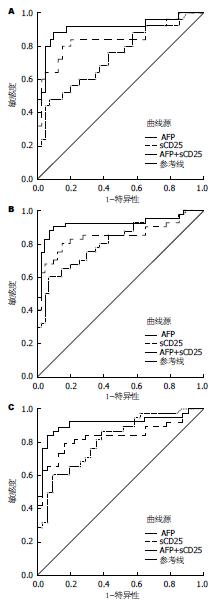
早期HCC(巴塞罗那分级A级)与肝硬化组相比较时, sCD25曲线下面积(0.844, 95%CI: 0.734-0.954)大于AFP曲线下面积(0.737, 95%CI: 0.609-0.864), 二者联合使得曲线下面积增加为(0.911, 95%CI: 0.825-0.997)(图2A). HCC组与肝硬化组比较时sCD25曲线下面积(0.847, 95%CI: 0.756-0.939)、AFP曲线下面积(0.808, 95%CI: 0.714-0.903)均有所增加, 二者联合使得曲线下面积进一步增加(0.919, 95%CI: 0.850-0.989)(图2B). 当HBV相关HCC与HBV相关肝硬化组相比较时, sCD25曲线下面积(0.835, 95%CI: 0.736-0.934), AFP曲线下面积(0.814, 95%CI: 0.715-0.913), 二者联合曲线下面积(0.911, 95%CI: 0.834-0.987)(图2C).
在HCC的检测中, sCD25比AFP敏感性更高, AFP最佳工作点处(39.29 ng/mL)敏感度为60%, sCD25最佳工作点处(5815.96 pg/mL)敏感度为80%, 二者联合后, 敏感度提升至90%. 对于早期HCC患者而言, sCD25敏感度提升至80%, AFP敏感度却明显降低48%, 二者联合后敏感度进一步提升88%. 在HBV相关HCC的检测中, sCD25仍保持较高敏感度78.9%, AFP敏感度仍较低60.5%, 二者于回归模型联合后敏感度提升至84.2%.
HCC是世界范围内最常见的六大肿瘤之一, 占肿瘤相关死亡第3位, 每年有5000000人死于HCC[12]. 最近的一项研究[13]表明美国在1975-2005年之间HCC的发病率提高了3倍. 在我国, HCC的发病率在近十年内提升了3倍, 这主要是由于持续增长的HBV感染. HCC死亡率高与早期诊断率较低有关, 患者通常在确诊后的几个月内死亡. 目前, HCC的早期诊断成为HCC患者管理的重要一步. 现有的影像学手段在HCC发展到一定阶段才能诊断. 大多数情况下临床医生把AFP作为影像学检查之外的一种评估HCC常用及可行的办法. 然而, 因为其较低的敏感性及特异性, AFP并不能作为早期肝癌诊断、预防及治疗的一个完全值得信赖的标志物[14]. 肝组织活检通常被认为是一种侵入性的检查手段, 具有一定的风险, 且难以被患者接受. 因此, 寻找能有效诊断的生化指标意义重大[15].
理想的肝脏肿瘤标志物应具有很高的敏感性及特异性并且在肝硬化患者中检测不大. 他应当具备以下优点: 易于获得、易于测量、微创、廉价、精确、易于被患者及医生接受[16].
本研究的目的在于发现可用于肝硬化患者HCC监测的新的标志物. 肿瘤的发生和发展与固有免疫系统的激活密切相关, 表现为IL-2受体的过表达及循环中脱落的可溶性IL-2受体α亚基的增加. 研究[10,17]证明, 多种肿瘤中sCD25水平升高与肿瘤的侵袭、进展及转移有关.
本研究发现HCC组血清sCD25水平明显高于肝硬化组及正常对照组. 当截断值为5815.96 pg/mL时, 血清sCD25监测HCC发生的敏感性为80%左右. 而且, sCD25在早期HCC的监测中依旧保持较高的敏感性80%. 在HCC发生的监测中, 尤其是在早期HCC的诊断中, sCD25比AFP显示出更高的敏感性. 本研究中sCD25在区分HCC和肝硬化及CHB上显示出较高的敏感性78.9%. 二者联合进一步提高了HCC诊断的敏感性和特异性(84.2%, 93.5%), 提示二者在HCC诊断中相互补充. 肿瘤监视的重要一步是发现亚临床肿瘤, 因此, 可以考虑把sCD25作为一种补充诊断的标志物, 有望通过这种方法提高对肿瘤早期检测的能力.
本实验表明sCD25水平与慢性肝脏疾病不同阶段具有明显相关性, 暗示他有可能作为HCC预后的一个预测因素. 进一步的关于sCD25水平在随访患者中浓度变化的研究, 有望为sCD25作为早期HCC检测提供进一步依据.
目前, 我们缺乏有效的用于早期HCC诊断的血清学指标. 本研究表明, sCD25能明显区别HCC患者及肝硬化患者, 并且比AFP更有效的检测HCC的发生. sCD25较高的敏感性暗示其有望作为早期HCC的血清学指标. 为进一步描述sCD25在早期HCC检测中的应用, 需要大规模的纵向及确认实验.
sCD25产生于白介素-2(interleukin-2, IL-2)受体的膜相关α亚基的水解释放. 当sCD25与β、γ链共同表达于T细胞膜表面时, 就组成了具有高亲和力的IL-2受体, 与相应配体结合后引起T细胞的活化和增殖. 研究表明sCD25作为一种免疫因子, 是肝细胞癌(hepatocellular carcinoma, HCC)免疫抑制系统的一部分, 有望作为HCC的标志物.
姜春萌, 教授, 大连医科大学附属第二医院消化科
通过ELISA测定HCC、肝硬化、慢乙型肝炎及健康对照者血清sCD25水平, 并结合患者临床病理资料进行分析, 探讨其在HCC中的表达情况及其意义.
Cabrera等研究表明在多种肿瘤中sCD25水平升高与肿瘤侵犯、浸润及转移有关.但有关其在HCC中的表达情况研究较少.
本实验对HCC、肝硬化及健康对照组血清中sCD25水平进行检测, 结果表明, HCC组血清sCD25水平明显升高, 早期HCC患者sCD25水平亦明显升高, 提示其有望作为肝硬化患者早期HCC监测的新的标志物.
对于血清中sCD25浓度的监测有可能发现早期HCC, 进一步关于sCD25浓度与肿瘤分期的研究有望指导预后, 并有可能作为一个新的肿瘤靶向治疗的靶点.
sCD25: 即可溶性IL-2受体的膜相关α亚基, IL-2R由α、β、γ三个亚基组成, 与相应配体结合激活T细胞, 后α亚基脱落于循环中即sCD25.
本文设计简单实用, 具有实际意义.
编辑: 韦元涛 电编:闫晋利
| 1. | Sanyal AJ, Yoon SK, Lencioni R. The etiology of hepatocellular carcinoma and consequences for treatment. Oncologist. 2010;15 Suppl 4:14-22. [PubMed] [DOI] |
| 2. | Fattovich G, Stroffolini T, Zagni I, Donato F. Hepatocellular carcinoma in cirrhosis: incidence and risk factors. Gastroenterology. 2004;127:S35-S50. [PubMed] [DOI] |
| 3. | Wong LL, Limm WM, Severino R, Wong LM. Improved survival with screening for hepatocellular carcinoma. Liver Transpl. 2000;6:320-325. [PubMed] [DOI] |
| 4. | Daniele B, Bencivenga A, Megna AS, Tinessa V. Alpha-fetoprotein and ultrasonography screening for hepatocellular carcinoma. Gastroenterology. 2004;127:S108-S112. [PubMed] [DOI] |
| 5. | Sherman M. Current status of alpha-fetoprotein testing. Gastroenterol Hepatol (N Y). 2011;7:113-114. [PubMed] |
| 6. | He XX, Li Y, Ren HP, Tian DA, Lin JS. [2010 guideline for the management of hepatocellular carcinoma recommended by the American Association for the Study of Liver Diseases]. Zhonghua Ganzangbing Zazhi. 2011;19:249-250. [PubMed] |
| 7. | Villanueva A, Minguez B, Forner A, Reig M, Llovet JM. Hepatocellular carcinoma: novel molecular approaches for diagnosis, prognosis, and therapy. Annu Rev Med. 2010;61:317-328. [PubMed] [DOI] |
| 8. | Nakamoto Y, Guidotti LG, Kuhlen CV, Fowler P, Chisari FV. Immune pathogenesis of hepatocellular carcinoma. J Exp Med. 1998;188:341-350. [PubMed] [DOI] |
| 9. | Cacalano NA, Johnston JA. Interleukin-2 signaling and inherited immunodeficiency. Am J Hum Genet. 1999;65:287-293. [PubMed] [DOI] |
| 10. | Cabrera R, Ararat M, Cao M, Xu Y, Wasserfall C, Atkinson MA, Liu C, Nelson DR. Hepatocellular carcinoma immunopathogenesis: clinical evidence for global T cell defects and an immunomodulatory role for soluble CD25 (sCD25). Dig Dis Sci. 2010;55:484-495. [PubMed] [DOI] |
| 11. | Ueno Y, Sollano JD, Farrell GC. Prevention of hepatocellular carcinoma complicating chronic hepatitis C. J Gastroenterol Hepatol. 2009;24:531-536. [PubMed] [DOI] |
| 12. | Venook AP, Papandreou C, Furuse J, de Guevara LL. The incidence and epidemiology of hepatocellular carcinoma: a global and regional perspective. Oncologist. 2010;15 Suppl 4:5-13. [PubMed] [DOI] |
| 13. | Stefaniuk P, Cianciara J, Wiercinska-Drapalo A. Present and future possibilities for early diagnosis of hepatocellular carcinoma. World J Gastroenterol. 2010;16:418-424. [PubMed] [DOI] |
| 14. | Marrero JA, Feng Z, Wang Y, Nguyen MH, Befeler AS, Roberts LR, Reddy KR, Harnois D, Llovet JM, Normolle D. Alpha-fetoprotein, des-gamma carboxyprothrombin, and lectin-bound alpha-fetoprotein in early hepatocellular carcinoma. Gastroenterology. 2009;137:110-118. [PubMed] [DOI] |
| 15. | Makuuchi M, Kokudo N, Arii S, Futagawa S, Kaneko S, Kawasaki S, Matsuyama Y, Okazaki M, Okita K, Omata M. Development of evidence-based clinical guidelines for the diagnosis and treatment of hepatocellular carcinoma in Japan. Hepatol Res. 2008;38:37-51. [PubMed] [DOI] |
| 16. | Mendy M, Walton R. Molecular pathogenesis and early detection of hepatocellular carcinoma--perspectives from West Africa. Cancer Lett. 2009;286:44-51. [PubMed] [DOI] |
| 17. | Bien E, Balcerska A. Serum soluble interleukin 2 receptor alpha in human cancer of adults and children: a review. Biomarkers. 2008;13:1-26. [PubMed] [DOI] |