修回日期: 2014-10-14
接受日期: 2014-10-29
在线出版日期: 2014-12-08
目的: 观察砷暴露肝纤维化大鼠肝组织中微小RNA(microRNA, miRNA)-21和Smad7的表达情况, 探讨丹芍化纤胶囊预防砷暴露所致肝纤维化的可能机制.
方法: 将75只♂SD大鼠随机分为5组, 即空白对照组(A组)、砷暴露模型组(B组)、扶正化瘀胶囊预防组(C组)、丹芍化纤胶囊低剂量预防组(D组)、丹芍化纤胶囊高剂量预防组(E组), 每组15只. 各组大鼠自由饮水, 其中A组饮用自来水, B-E组饮用含亚砷酸钠(NaAsO2)100 mg/L水. 同时, C组大鼠予扶正化瘀胶囊(0.8 g/kg), D组予丹芍化纤胶囊(0.5 g/kg), E组予丹芍化纤胶囊(1.0 g/kg)分别灌胃, 2次/d, 5 d/wk, 共16 wk. 全自动生化分析仪测定大鼠血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)及天冬氨酸氨基转移酶(aspartate aminotransferase, AST)活性, ELISA法检测肝匀浆透明质酸(hyaluronic acid, HA)、转化生长因子-β1(transforming growth factor-β1, TGF-β1)的水平, HE及Masson染色法观测肝组织病理改变, RT-PCR法检测肝组织miRNA-21与Smad7 mRNA的表达, 免疫组织化学法及Western blot检测肝组织Smad7蛋白的表达.
结果: 与A组比较, B-E组大鼠血清ALT、AST, 肝匀浆HA、TGF-β1显著升高, 但C、D、E组显著低于B组(F = 129.159、291.878、5316.239、1269.287, P<0.01). B组大鼠肝脏可见明显病理改变甚至肝纤维化形成, 而C、D、E组肝脏病变及肝纤维化程度显著轻于B组(F = 62.832、68.112, P<0.05或P<0.01). 与A组比较, B-E组大鼠肝组织miRNA-21显著升高, 但C、D、E组显著低于B组(F = 552.231, P<0.01). 与A组比较, B-E组大鼠肝组织Smad7 mRNA与蛋白的表达均显著降低, 但C、D、E组显著高于B组(F = 129.512、68.249、43.435, P<0.05或P<0.01).
结论: 饮水砷暴露16 wk可导致大鼠肝功能受损甚至引起肝纤维化, 其机制可能与上调miRNA-21、下调Smad7的表达有关, 丹芍化纤胶囊对砷暴露致大鼠肝纤维化有潜在的预防作用, 可能通过下调miRNA-21、上调Smad7而实现.
核心提示: 目前, 临床上较为理想的肝纤维化防治药物不多, 尤其是针对贵州地区砷中毒所致慢性肝病的防治, 仍处于探索阶段. miRNA-21很可能是本课题组新发现的丹芍化纤胶囊的药物作用靶点, 有望成为抗肝纤维化药物作用的靶标及疗效评价指标, 本研究结果对该药防治砷中毒所致肝纤维化的机制探讨及临床应用具有一定的指导意义.
引文著录: 詹洁, 吴君, 赵雪珂. miRNA-21和Smad7在砷暴露肝纤维化大鼠肝组织中的表达及药物干预. 世界华人消化杂志 2014; 22(34): 5249-5257
Revised: October 14, 2014
Accepted: October 29, 2014
Published online: December 8, 2014
AIM: To investigate the expression of microRNA (miRNA)-21 and Smad7 in arsenic-induced hepatic fibrosis in rats and to explore the possible mechanism of Danshao Huaxian capsule for preventing arsenic-induced hepatic fibrosis.
METHODS: Seventy-five male SD rats were randomly divided into a control group (A), an arsenic exposure group (B), a Fuzheng Huayu capsule group (C), low- (D) and high-dose (E) Danshao Haxian capsule groups (n = 15 for each). Rats in group A were given tap water, while rats in groups B-E were given 100 mg/L NaAsO2 solution. Moreover, rats in groups C-E were respectively administered by gastrogavage with Fuzheng Huayu capsule (0.8 g/kg) or Danshao Haxian capsule (0.5, 1.0 g/kg), twice per day, 5 d/wk for 16 wk. By the end of the experiment, alanine transaminase (ALT) and aspartate transaminase (AST) in serum were measured with an automatic biochemical analyzer, and levels of hyaluronic acid (HA) and transforming growth factor (TGF)-β1 in liver homogenates were determined by ELISA. Histological changes in the liver were observed after HE and Masson's trichrome staining. The expression of miRNA-21 in liver tissue was determined by RT-PCR. The mRNA and protein expression of Smad7 in liver tissue was determined by RT-PCR, immunohistochemistry, and Western blot analysis.
RESULTS: Compared with group A, serum activities of ALT and AST, levels of HA and TGF-β1 in liver homogenates were significantly increased in groups B-E, but these indices were significantly lower in groups C-E compared with group B (F = 129.159, 291.878, 5316.239, 1269.287, P < 0.01). Obvious proliferation and widened collagen fibers were seen in liver tissues of group B rats, while the degree of hepatic fibrosis was significantly milder in groups C-E than in group B (F = 62.832, 68.112, P < 0.05 or P < 0.01). Compared with group A, the expression of miRNA-21 was significantly higher in groups B-E, but it was significantly lower in groups C-E than in group B (F = 552.231, P < 0.01). Compared with group A, the mRNA and protein expression of Smad7 was significantly lower in groups B-E, but the expression was significantly higher in groups C-E than in group B (F = 129.512, 68.249, 43.435, P < 0.05 or P < 0.01).
CONCLUSION: Oral arsenic solution for 16 wk induced obvious hepatic fibrosis in rats, partly by up-regulating miRNA-21 and down-regulating Smad7 expression. The mechanism of Danshao Haxian capsule for preventing hepatic fibrosis in rats may be associated with inhibition of the expression of miRNA-21 and up-regulation of the expression of Smad7.
- Citation: Zhan J, Wu J, Zhao XK. Expression of miRNA-21 and Smad7 in arsenic-induced hepatic fibrosis in rats: Possible mechanism of traditional Chinese herbs for preventing hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2014; 22(34): 5249-5257
- URL: https://www.wjgnet.com/1009-3079/full/v22/i34/5249.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i34.5249
肝纤维化是慢性肝病的中间环节, 可发展为肝硬化甚至肝癌[1], 在新版的疾病国际统计分类中的编码为ICD-10 k 74.0, 已成为一种独立疾病[2], 其病因众多, 常见的有肝炎病毒的慢性感染、饮酒、环境污染等[3-5], 转化生长因子-β1(transforming growth factor-β1, TGF-β1)在肝纤维化发生机制中扮演着重要角色, TGF-β1可通过其下游分子Smads信号转导途径, 使细胞外基质(extracellular matrix, ECM)的合成和分泌增加[6]. 近年研究[7]发现, 微小RNA(microRNA, miRNA)通过调节其靶基因的表达进而影响某些肝纤维化相关细胞因子的功能, 也间接参与了肝纤维化的发生发展或转归进程. 随着慢性肝病疾病谱的日臻完善, 环境砷污染引起的肝纤维化已成为医学界的研究热点. 砷是一种已知的毒物和人类致癌物, 在自然界中广泛存在, 饮水型砷中毒和燃煤型砷中毒是我国环境砷中毒的两大主要类型[8], 贵州省西南地区砷中毒所致疾病较为常见, 其中尤以砷中毒引起的慢性肝损伤最具代表性[9]. 本课题组曾对砷污染所致肝损伤及其致病机制进行了初步探讨[10], 并对贵州省兴仁县的部分砷中毒所致肝损伤患者进行了药物治疗观察[11,12], miRNA-21、Smad7与多种病因所致肝纤维化的发生密切相关[7,13], 但在砷暴露肝组织中的表达尚未见报道. 目前, 临床上较为理想的肝纤维化防治药物不多, 尤其是针对贵州地区砷中毒所致慢性肝病的防治, 仍处于探索阶段. 我们的前期研究发现, 丹芍化纤胶囊(原名汉丹肝乐)具有确切的保肝、抗肝纤维化效果[14-16], 本实验拟在前期工作基础上[11,12,14-16], 观察miRNA-21、Smad7在砷暴露大鼠肝组织中的表达及丹芍化纤胶囊对其的干预, 以进一步探讨丹芍化纤胶囊干预肝纤维化的可能机制, 为贵州省砷中毒患者抗肝纤维化药物的研发及临床应用提供可靠的实验依据.
亚砷酸钠(NaAsO2)分析纯(美国Sigma, 批号76H0240); 丹芍化纤胶囊(由汉防己甲素、丹参、赤芍、黄芪、银杏叶等组成), 贵阳制药厂生产(批号20081011), 棕黄色细颗粒胶囊制剂, 临用前取胶囊内容物研磨成粉末, 蒸馏水稀释至所需浓度. SD♂大鼠, 75只, 清洁级, 体质量180-200 g, 合格证号SCXK(黔)2002-0001, 由贵阳医学院实验动物中心提供. 普通饲料喂养, 自由饮水, 自然采光, 室温15 ℃-25 ℃, 实验前适应环境1 wk. 透明质酸(hyaluronic acid, HA)、TGF-β1检测试剂盒(南京建成, 批号: 20100128、20100211), 逆转录试剂盒(加拿大Fermentas MBI, 00087036), 电化学发光(ECL)试剂盒(美国Millipore, 1219101), 全蛋白提取试剂盒(南京凯基生物, KGP250), BCA蛋白定量试剂盒(美国Thermo SCIENTIFIC, 23227); Smad7一抗(武汉博士德, BA0312); miRNA-21上、下游引物序列分别为5'-GCGGTAGCTTATCAGACTGA-3'和5'-TGCGTGTCGTGGAGTC-3', 63 bp; 以U6 snRNA为内参照, 上、下游引物序列分别为5'-GCTTCGGCAGCACATATACTAAAA T-3'和5'-CGCTTCACGAATTTGCGTGTCAT-3', 89 bp; Smad7上、下游引物序列分别为5'-GAGTCCTTTCCTCTCT-3'和5'-GGCTCAATGAGCATGCTCACC-3', 125 bp; β-actin上、下游引物序列分别为5'-TCCTCCTGAGCGCAAGTACTCT-3'和5'-GCTCAGTAACAGTCCGCCTAGAA-3', 1536 bp, 均由上海生工生物工程有限公司合成. 核酸扩增实时荧光检测系统(DA7600型, 中山大学达安基因), 核酸定量仪(美国Amersham Biosciences), Gel Doc EQ凝胶成像仪(美国Bio-Rad), 显微图像采集系统(日本Olympus), 752紫外分光光度计(上海菁华科技)等.
1.2.1 动物模型制备及标本留取: 将75只♂SD大鼠随机分成5组: 空白对照组(A组)、砷暴露模型组(B组)、扶正化瘀胶囊预防组(C组)、丹芍化纤胶囊低剂量预防组(D组)、丹芍化纤胶囊高剂量预防组(E组), 每组各15只. 各组大鼠自由饮水, 其中A组饮用自来水, B-E组饮用含NaAsO2 100 mg/L水[17]. 同时, C组大鼠予扶正化瘀胶囊悬液(0.8 g/kg)[18]、D组予丹芍化纤胶囊悬液(0.5 g/kg)、E组予丹芍化纤胶囊悬液(1.0 g/kg)[14]分别灌胃, 2次/d, 5 d/wk, 共16 wk. 造模结束时, 大鼠麻醉后处死, 留取血液, 常规制备血清并于-80 ℃保存; 取相同部位部分肝脏用40 g/L中性甲醛固定, 其他肝组织则-80 ℃保存. 全自动生化分析仪测定大鼠血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)及天冬氨酸氨基转移酶(aspartate aminotransferase, AST)活性. 制备肝组织匀浆, 严格按试剂盒操作测定各组大鼠肝匀浆HA、TGF-β1水平.
1.2.2 肝脏组织形态学观察: 取相同部位肝脏, 石蜡包埋, 切片, 行HE染色, 光镜下观察肝脏病理变化. Masson染色观察肝组织内胶原纤维沉积程度, 由贵阳医学院附属医院病理科完成. 在400×光学显微镜下, 通过SONY摄像头将实验动物肝组织切片图像采集并输入Biomias2001图像分析系统进行单位(视场)面积纤维组织面积测量. 每张切片随机选取5个视场, 用HSV颜色分割法测量单位面积内纤维组织的面积, 计算各组小鼠肝内纤维组织面积的均值, 反映肝组织纤维化的程度.
1.2.3 RT-PCR法检测各组大鼠肝组织miRNA-21与Smad7 mRNA的表达: 采用TRIzol-酚-氯仿一步法提取总RNA并纯化, 测定RNA浓度, 逆转录合成cDNA后行RT-PCR. 实验过程中以U6 snRNA、β-actin分别作为miRNA-21、Smad7的内对照, 进行标准化转换得到各样本的拷贝数(Ct值), 2-△△Ct为目的基因的相对表达强度.
1.2.4 免疫组织化学法检测各组大鼠肝组织Smad7蛋白的表达: 采用EnVision二步法, 光镜下观察. 结果判定: 肝细胞胞浆染成棕黄色为阳性. 每张切片随机选取5个高倍视野(×400), 计数100个细胞中的阳性细胞百分比.
1.2.5 Western blot检测各组大鼠肝组织Smad7蛋白的表达: 提取蛋白并测定蛋白含量, 取蛋白质样品40 μg, 10%SDS-PAGE电泳, 转膜, 封闭, 用Smad7抗体(1:1000)4 ℃孵育过夜, 二抗(1:3000)室温1 h, ECL曝光显影, Gel Doc EQ凝胶成像仪扫描, Quantity One软件分析结果. 以β-actin表达水平作为内参照, 目标蛋白的表达量以目标蛋白与内参照蛋白灰度值的相对比值表示.
统计学处理 采用SPSS16.0统计学软件进行分析. 计量资料以mean±SD表示, 多组间比较采用单因素方差分析, 组间两两比较时, 对于方差齐的情况采用LSD法, 方差不齐的情况采用Tamhane法; P<0.05为差异有统计学意义.
A组大鼠皮毛光泽, 行动灵活, 食量及大便正常. 染砷组大鼠皮毛暗淡, 活动减少, 进食及饮水量减少, 体质量比A组小鼠增长缓慢. 实验结束时, B组死亡3只、C组死亡1只、D组死亡3只、E组死亡1只.
B-E各组血清ALT、AST均显著高于A组, C-E组均显著低于B组, 而C组、E组显著低于D组(F = 129.159和291.878, 均P<0.01); B-E各组肝匀浆HA、TGF-β1均显著高于A组, C-E组均显著低于B组, 而C组、E组显著低于D组(F = 5316.239和1269.287, 均P<0.01)(表1).
| 分组 | n | ALT(U/L) | AST(U/L) | HA(µg/g) | TGF-β1(µg/g) |
| A | 15 | 52.30±6.52 | 171.22±18.87 | 1837.26±125.39 | 279.41±19.73 |
| B | 12 | 105.39±13.89b | 287.15±33.28b | 6439.41±288.57b | 731.91±32.46b |
| C | 14 | 73.98±7.79bdf | 202.83±23.92bdf | 4797.58±197.87bdf | 493.62±23.53bdf |
| D | 12 | 91.37±11.25bd | 239.18±31.82bd | 5129.92±276.33bd | 587.61±31.26bd |
| E | 14 | 79.87±9.05bdf | 210.29±26.22bdf | 4763.18±246.91bdf | 507.64±26.93bdf |
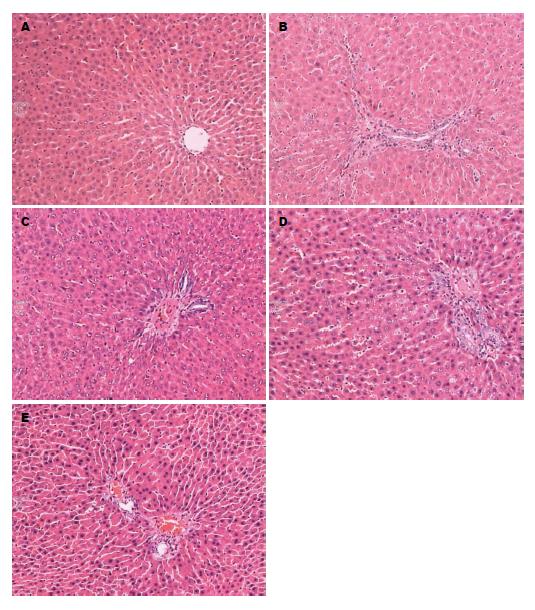
A组大鼠肝细胞以中央静脉为中心, 呈放射状排列, 无肝细胞变性、坏死及炎症细胞浸润, 小叶结构完整. B组大鼠肝细胞可见水样变性、气球样变性, 汇管区见炎症细胞浸润, 部分肝细胞坏死, 还可见汇管区纤维组织增生, 纤维条索形成. C组、D组、E组大鼠肝细胞见轻度水样变性及气球样变性, 汇管区及肝小叶内可见少量炎细胞浸润, 肝细胞坏死少, 肝小叶结构完整, 与B组比较病理改变明显减轻(F = 62.832, P<0.05)(图1).
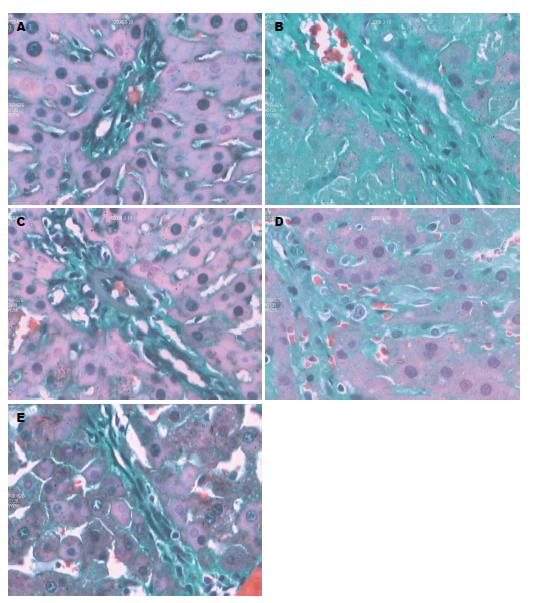
A组大鼠肝组织可见少量绿色胶原纤维, B组大鼠肝组织胶原纤维显著增生、宽大, 延伸分布于肝小叶内, C组、D组、E组大鼠肝组织增生的胶原纤维较B组显著减少、变细, 部分向肝小叶延伸, 如图2. B-E组纤维化面积均显著高于A组, C-E组纤维化面积均显著低于B组, 而C组、E组纤维化面积均显著低于D组(F = 68.112, P<0.01)(表2).
B-E组miRNA-21的相对表达强度均显著高于A组, C组、D组、E组均显著低于B组, 而C组、E组显著低于D组(F = 552.231, P<0.01); B-E组Smad7 mRNA的相对表达强度均显著低于A组, C组、D组、E组均显著高于B组, 而C组、E组显著高于D组(F = 129.512, P<0.01)(表3).
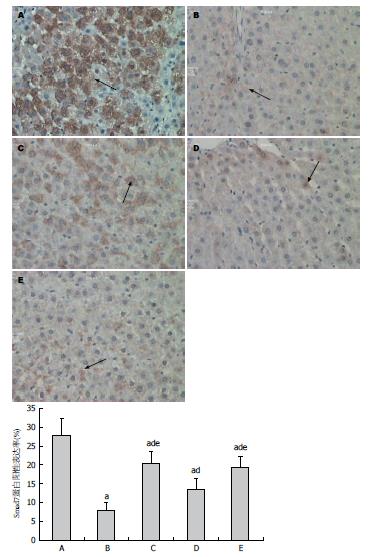
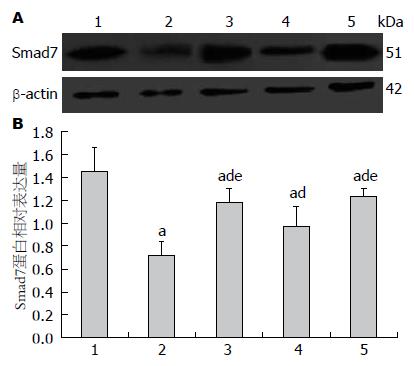
B-E组Smad7的蛋白阳性表达率与相对表达量均显著低于A组, C组、D组、E组Smad7的蛋白阳性表达率与相对表达量均显著高于B组, 而C组、E组显著高于D组(F = 68.249和43.435, P<0.05或P<0.01)(图3, 4).
肝星状细胞(hepatic stellate cell, HSC)的活化是肝纤维化发生的中心环节[19], 有多种细胞因子参与了肝纤维化的发生发展, 其中TGF-β1是迄今已知的最强促HSC活化的细胞因子, TGF-β1通过激活下游Smad信号转导, 使HA、胶原纤维等合成和分泌增加, 诱导HSC向肌成纤维细胞转化, 最终引起ECM在肝内过量沉积[20,21]. miRNA是转录后水平的细胞调控因子, 参与调节细胞与细胞间一系列的生理及病理活动, 肝脏内存在一些表达相对丰富的miRNA, 可能参与调控肝脏疾病的发生发展或预后转归[22]. Smad7由TGF-β1诱导生成, 对TGF-β1信号转导起自身负反馈调节作用, 抑制TGF-β1介导的肝纤维化进程[23]. Marquez等[24]发现, 在慢性丙型肝炎病毒感染的肝细胞中, miRNA-21的上调可通过抑制其靶基因Smad7的表达来促进纤维化, 认为miRNA-21通过抑制TGF-β1信号传导通路的负调节子Smad7, 从而在肝纤维化过程中形成了正反馈机制.
近年来, 人群流行病学调查及动物实验均表明砷与肝纤维化、肝硬化的发生发展密切相关[8,25], 而砷对肝细胞的损伤机制目前仍不十分清楚. 贵州燃煤污染型砷中毒主要分布在黔西南兴仁县, 是世界上最早确认的燃煤污染型砷中毒病区[26], 1992年卫生部正式把"燃煤污染型砷中毒"确定为一种新的地方病, 并列入国家重点疾病防治计划. 因此, 砷中毒相关肝病的发病机制及防治研究已成为贵州省医务工作者的当务之急.
丹芍化纤胶囊是根据中医活血化淤、通络软坚理论及多年基础研究、临床探索研制而成的中药复方制剂, 该药可上调肝纤维化大鼠肝脏过氧化物酶体增殖物激活受体-γ(peroxisome proliferator activatived receptors-γ, PPAR-γ), 下调TGF-β1的表达, 促进肝内Ⅰ、Ⅲ胶原的降解, 发挥治疗肝纤维化的作用[14,27,28], 我们曾成功建立了饮水砷暴露致肝纤维化的动物模型, 并对其发病机制作了初步探讨[16,29]. 故本实验在前期工作基础上, 以具有确切抗肝纤维化疗效的药物扶正化瘀胶囊[30-32]作为阳性对照, 观测丹芍化纤胶囊对饮水砷暴露所致肝纤维化大鼠肝组织中miRNA-21、Smad7表达的影响, 探讨其干预肝纤维化的可能机制.
结果表明, 模型组大鼠在饮用含NaAsO2 100 mg/L水16 wk后可发生肝纤维化, 其血清ALT、AST, 肝匀浆HA、TGF-β1、肝组织中miRNA-21表达均显著高于空白对照组, 而肝组织中Smad7 mRNA及蛋白质的表达均显著低于空白对照组. 提示长期饮水砷暴露后, 可引起肝脏miRNA-21上调, 抑制Smad7的表达, 使TGF-β1反馈性表达增多, 进而通过其介导的细胞信号转导, 刺激HA等ECM合成增加, 可能是砷所致大鼠肝纤维化的发病机制之一.
在丹芍化纤胶囊预防干预后, 大鼠肝脏病理改变及纤维化程度显著轻于模型组, 血清ALT、AST, 肝匀浆HA、TGF-β1、肝组织中miRNA-21表达显著低于模型组, 肝组织中Smad7 mRNA及蛋白质的表达均显著高于模型组, 且高剂量组与扶正化瘀胶囊阳性对照组相当, 说明丹芍化纤胶囊对饮水砷暴露所致的大鼠肝纤维化具有较好的预防作用, 其机制可能与下调miRNA-21并反馈性上调靶基因Smad7, 进而抑制TGF-β1的表达有关. 同时, 上述指标在丹芍化纤胶囊低、高剂量预防组之间差异有统计学意义, 提示低、高剂量丹芍化纤胶囊对大鼠肝组织miRNA-21与Smad7表达的影响存在明显量效关系. miRNA-21很可能是本课题组新发现的丹芍化纤胶囊的药物作用靶点, 有望成为抗肝纤维化药物作用的靶标及疗效评价指标, 本研究结果对该药防治砷中毒所致肝纤维化的机制探讨及临床应用具有一定的指导意义.
砷中毒所致慢性肝病较常见, 其发病机制仍不十分明了, 且尚缺乏较理想的肝纤维化防治药物. miRNA-21、Smad7与多种病因所致肝纤维化的发生密切相关, 但在砷暴露肝组织中的表达尚未见报道; 研究miRNA-21、Smad7在砷暴露肝组织中的表达, 并选用前期已证实对砷暴露致大鼠肝纤维化具有防治作用的丹芍化纤胶囊进行干预.
鲁玉辉, 副教授, 福建中医药大学中医学院
既往基础及临床试验表明丹芍化纤胶囊具有抗肝纤维化作用, 本实验拟观察该药对砷暴露致肝纤维化大鼠肝脏miRNA-21、Smad7表达的影响.
贵州省西南地区砷中毒所致疾病常见, 尤以砷中毒引起的慢性肝损伤最具代表性; miRNA-21、Smad7与多种病因所致肝纤维化的发生密切相关.
本研究发现, 饮水砷暴露16 wk可致大鼠肝纤维化, 其机制可能与上调miRNA-21、下调Smad7的表达有关, 丹芍化纤胶囊对砷暴露致大鼠肝纤维化有潜在的预防作用, 可能通过下调miRNA-21、上调Smad7而实现.
本研究结果对丹芍化纤胶囊防治砷中毒所致肝纤维化的机制探讨及临床应用具有一定的指导意义.
砷中毒: 砷是一种常见的环境毒物, 可经过皮肤、呼吸道、消化系侵入人体, 可引起不同程度的肝损伤、肝纤维化、肝硬化甚至肝癌.
本研究目标明确, 实验对照设计较为合理, 实验证据充分, 结论可靠. 文章有一定的创新性和可读性, 为中医药参与防治地方性疾病起到一定的借鉴作用.
编辑: 郭鹏 电编:闫晋利
| 1. | Weston SR, Leyden W, Murphy R, Bass NM, Bell BP, Manos MM, Terrault NA. Racial and ethnic distribution of nonalcoholic fatty liver in persons with newly diagnosed chronic liver disease. Hepatology. 2005;41:372-379. [PubMed] [DOI] |
| 2. | Fan JG, Saibara T, Chitturi S, Kim BI, Sung JJ, Chutaputti A. What are the risk factors and settings for non-alcoholic fatty liver disease in Asia-Pacific? J Gastroenterol Hepatol. 2007;22:794-800. [PubMed] [DOI] |
| 4. | 上海交通大学医学院附属新华医院, 美国克利夫兰医学中心消化病院, 加拿大肝脏基金会. 上海国际消化系统疾病会议. 上海. 2012;. |
| 5. | Ratziu V, Bellentani S, Cortez-Pinto H, Day C, Marchesini G. A position statement on NAFLD/NASH based on the EASL 2009 special conference. J Hepatol. 2010;53:372-384. [PubMed] [DOI] |
| 6. | Angulo P. Nonalcoholic fatty liver disease. N Engl J Med. 2002;346:1221-1231. [PubMed] [DOI] |
| 7. | Sanyal AJ. AGA technical review on nonalcoholic fatty liver disease. Gastroenterology. 2002;123:1705-1725. [PubMed] [DOI] |
| 8. | Fan JG, Li F, Cai XB, Peng YD, Ao QH, Gao Y. Effects of nonalcoholic fatty liver disease on the development of metabolic disorders. J Gastroenterol Hepatol. 2007;22:1086-1091. [PubMed] [DOI] |
| 10. | Hsu CS, Kao JH. Non-alcoholic fatty liver disease: an emerging liver disease in Taiwan. J Formos Med Assoc. 2012;111:527-535. [PubMed] [DOI] |
| 12. | Hyogo H, Tazuma S, Arihiro K, Iwamoto K, Nabeshima Y, Inoue M, Ishitobi T, Nonaka M, Chayama K. Efficacy of atorvastatin for the treatment of nonalcoholic steatohepatitis with dyslipidemia. Metabolism. 2008;57:1711-1718. [PubMed] [DOI] |
| 13. | Kashi MR, Torres DM, Harrison SA. Current and emerging therapies in nonalcoholic fatty liver disease. Semin Liver Dis. 2008;28:396-406. [PubMed] [DOI] |
| 14. | Nelson A, Torres DM, Morgan AE, Fincke C, Harrison SA. A pilot study using simvastatin in the treatment of nonalcoholic steatohepatitis: A randomized placebo-controlled trial. J Clin Gastroenterol. 2009;43:990-994. [PubMed] [DOI] |
| 15. | Enjoji M, Yasutake K, Kohjima M, Nakamuta M. Nutrition and nonalcoholic Fatty liver disease: the significance of cholesterol. Int J Hepatol. 2012;2012:925807. [PubMed] [DOI] |
| 16. | Katan MB, Grundy SM, Jones P, Law M, Miettinen T, Paoletti R. Efficacy and safety of plant stanols and sterols in the management of blood cholesterol levels. Mayo Clin Proc. 2003;78:965-978. [PubMed] [DOI] |
| 17. | Demonty I, Ras RT, van der Knaap HC, Duchateau GS, Meijer L, Zock PL, Geleijnse JM, Trautwein EA. Continuous dose-response relationship of the LDL-cholesterol-lowering effect of phytosterol intake. J Nutr. 2009;139:271-284. [PubMed] [DOI] |
| 18. | Davidson MH, Maki KC, Umporowicz DM, Ingram KA, Dicklin MR, Schaefer E, Lane RW, McNamara JR, Ribaya-Mercado JD, Perrone G. Safety and tolerability of esterified phytosterols administered in reduced-fat spread and salad dressing to healthy adult men and women. J Am Coll Nutr. 2001;20:307-319. [PubMed] |
| 19. | Zhang S, Zheng L, Dong D, Xu L, Yin L, Qi Y, Han X, Lin Y, Liu K, Peng J. Effects of flavonoids from Rosa laevigata Michx fruit against high-fat diet-induced non-alcoholic fatty liver disease in rats. Food Chem. 2013;141:2108-2116. [PubMed] [DOI] |
| 20. | Li S, Liao X, Meng F, Wang Y, Sun Z, Guo F, Li X, Meng M, Li Y, Sun C. Therapeutic role of ursolic acid on ameliorating hepatic steatosis and improving metabolic disorders in high-fat diet-induced non-alcoholic fatty liver disease rats. PLoS One. 2014;9:e86724. [PubMed] [DOI] |
| 21. | Cintra DE, Costa AV, Peluzio Mdo C, Matta SL, Silva MT, Costa NM. Lipid profile of rats fed high-fat diets based on flaxseed, peanut, trout, or chicken skin. Nutrition. 2006;22:197-205. [PubMed] [DOI] |
| 22. | Zelber-Sagi S, Ratziu V, Oren R. Nutrition and physical activity in NAFLD: an overview of the epidemiological evidence. World J Gastroenterol. 2011;17:3377-3389. [PubMed] [DOI] |
| 23. | Adams LA, Angulo P, Lindor KD. Nonalcoholic fatty liver disease. CMAJ. 2005;172:899-905. [PubMed] [DOI] |
| 24. | Boden G. Obesity, insulin resistance and free fatty acids. Curr Opin Endocrinol Diabetes Obes. 2011;18:139-143. [PubMed] [DOI] |
| 25. | Nakamuta M, Kohjima M, Higuchi N, Kato M, Kotoh K, Yoshimoto T, Yada M, Yada R, Takemoto R, Fukuizumi K. The significance of differences in fatty acid metabolism between obese and non-obese patients with non-alcoholic fatty liver disease. Int J Mol Med. 2008;22:663-667. [PubMed] [DOI] |
| 26. | Wouters K, van Gorp PJ, Bieghs V, Gijbels MJ, Duimel H, Lütjohann D, Kerksiek A, van Kruchten R, Maeda N, Staels B. Dietary cholesterol, rather than liver steatosis, leads to hepatic inflammation in hyperlipidemic mouse models of nonalcoholic steatohepatitis. Hepatology. 2008;48:474-486. [PubMed] [DOI] |
| 27. | Plat J, Mensink RP. Effects of plant stanol esters on LDL receptor protein expression and on LDL receptor and HMG-CoA reductase mRNA expression in mononuclear blood cells of healthy men and women. FASEB J. 2002;16:258-260. [PubMed] [DOI] |
| 28. | Derdemezis CS, Filippatos TD, Mikhailidis DP, Elisaf MS. Review article: effects of plant sterols and stanols beyond low-density lipoprotein cholesterol lowering. J Cardiovasc Pharmacol Ther. 2010;15:120-134. [PubMed] [DOI] |
| 29. | Berger A, Jones PJ, Abumweis SS. Plant sterols: factors affecting their efficacy and safety as functional food ingredients. Lipids Health Dis. 2004;3:5. [PubMed] [DOI] |
| 30. | Zhang J, Zhao Y, Xu C, Hong Y, Lu H, Wu J, Chen Y. Association between serum free fatty acid levels and nonalcoholic fatty liver disease: a cross-sectional study. Sci Rep. 2014;4:5832. [PubMed] [DOI] |
| 31. | Ibrahim SH, Kohli R, Gores GJ. Mechanisms of lipotoxicity in NAFLD and clinical implications. J Pediatr Gastroenterol Nutr. 2011;53:131-140. [PubMed] [DOI] |
| 32. | National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation. 2002;106:3143-3421. [PubMed] |
| 33. | Hallikainen MA, Sarkkinen ES, Uusitupa MI. Plant stanol esters affect serum cholesterol concentrations of hypercholesterolemic men and women in a dose-dependent manner. J Nutr. 2000;130:767-776. [PubMed] |
| 34. | Gupta R, Sharma AK, Dobhal MP, Sharma MC, Gupta RS. Antidiabetic and antioxidant potential of β-sitosterol in streptozotocin-induced experimental hyperglycemia. J Diabetes. 2011;3:29-37. [PubMed] [DOI] |