修回日期: 2014-10-26
接受日期: 2014-11-04
在线出版日期: 2014-12-08
目的: 探讨内质网氧化还原酶-1α(endoplasmic reticulum oxidoreductin 1α, ERO1α)在同型半胱氨酸(homocysteine, Hcy)诱导的肝细胞内质网应激(endoplasmic reticulum stress, ERS)中的作用及机制.
方法: 培养人肝细胞, 用Hcy(100 µmol/L)干预, 同时设对照组, 使用酶联免疫法(ELISA)检测ERS相关蛋白葡萄糖调节蛋白78(glucose-regulated protein 78, GRP78)、X盒结合蛋白-1(X-box binding protein-1, XBP-1)、内质网类似激酶(protein kinase RNA-like endoplasmic reticulum kinase, PERK)及激活转录因子6(activating transcription factor 6, ATF6)的水平; 用不同浓度Hcy(0、50、100、200、500 µmol/L)和100 µmol/L Hcy+叶酸+维生素B12(VB12)干预, 运用实时定量PCR和Western blot检测ERO1α mRNA和蛋白水平; 构建ERO1α基因重组质粒和RNA干扰片段并感染肝细胞, 检测ERO1α mRNA和蛋白表达变化; 采用ELISA法检测其对ERS相关蛋白的调控作用.
结果: 与对照组比较, Hcy组GRP78、ATF6、PERK、XBP-1水平升高(P<0.01, P<0.01, P<0.05, P<0.01); 不同浓度Hcy干预后, 肝细胞内ERO1α mRNA及蛋白水平呈下降趋势, 且随着Hcy浓度的增加而减少(P<0.01), 呈剂量依赖关系; 将ERO1α重组质粒转染肝细胞后, ERO1α mRNA及蛋白表达明显增加(P<0.01); 将三个不同的ERO1α siRNA片段转染肝细胞后, ERO1α mRNA及蛋白表达降低(P<0.01), 其中siRNA2作用最明显(P<0.01); 与Hcy组相比, Hcy+pERO1α组GRP78、XBP-1、PERK及ATF6均明显降低(P<0.01), 而Hcy+siRNA2组均明显升高(P<0.01).
结论: Hcy可能通过下调ERO1α引起肝细胞GRP78-XBP-1/PERK/ATF6表达增加促进ERS发生.
核心提示: 内质网氧化还原酶-1α(endoplasmic reticulum oxidoreductin 1α)调控葡萄糖调节蛋白78(glucose-regulated protein 78), 激活转录因子6(activating transcription factor 6), 内质网类似激酶(protein kinase RNA-like endoplasmic reticulum kinase), X盒结合蛋白-1(X-box binding protein-1)在同型半胱氨酸引起的肝细胞内质网应激过程中发挥重要作用.
引文著录: 周龙霞, 杨安宁, 陈久凯, 赵丽, 王艳华, 刘现梅, 蔡欣, 张鸣号, 姜怡邓, 曹军. ERO1α介导同型半胱氨酸诱导的肝细胞内质网应激. 世界华人消化杂志 2014; 22(34): 5228-5234
Revised: October 26, 2014
Accepted: November 4, 2014
Published online: December 8, 2014
AIM: To assess the role of endoplasmic reticulum oxidoreductin 1α (ERO1α) in homocysteine (Hcy)-induced endoplasmic reticulum stress (ERS).
METHODS: Hepatocytes were cultured in the presence or absence of Hcy (100 μmol/L), and ELISA was used to determine the concentrations of of glucose-regulated protein 78 (GRP78), X-box binding protein-1 (XBP-1), protein kinase RNA-like endoplasmic reticulum kinase (PERK) and activating transcription factor 6 (ATF6). Hepatocytes were then cultured with different concentrations of Hcy (0, 50, 100, 200, 500 μmol/L) and 100 μmol/L Hcy plus folic acid and vitamin B12, and the expression of ERO1α was detected by qRT-PCR and Western blot. ERO1α recombinant plasmid and ERO1α small interfering RNAs were then used to transfect hepatocytes, and the expression of ERO1α and the concentrations of GRP78, PERK, ATF6 and XBP-1 were measured.
RESULTS: Compared with non-treated cells, the concentrations of GRP78, PERK, ATF6 and XBP-1 significantly increased in Hcy-treated cells (P < 0.01, P < 0.01, P < 0.05, P < 0.01). Hcy decreased the expression of ERO1α at mRNA and protein levels (P < 0.01) in a dose-dependent manner. Transfection with ERO1α recombinant plasmid significantly increased the expression of ERO1α (P < 0.01), while transfection with three ERO1α small interfering RNAs significantly decreased the expression of ERO1α, with siRNA2 having the most significant effect (P < 0.01). Compared with the Hcy group, the concentrations of GRP78, PERK, ATF6 and XBP-1 significantly decreased in the Hcy + pERO1α recombinant plasmid group (P < 0.05), but increased in the Hcy + siRNA2 group (P < 0.01).
CONCLUSION: ERO1α may be involved in Hcy-induced hepatocyte ERS possibly by regulation of the GRP78-XBP-1/PERK/ATF6 signal pathway.
- Citation: Zhou LX, Yang AN, Chen JK, Zhao L, Wang YH, Liu XM, Cai X, Zhang MH, Jiang YD, Cao J. Endoplasmic reticulum oxidoreductin 1α mediates homocysteine-induced hepatocyte endoplasmic reticulum stress. Shijie Huaren Xiaohua Zazhi 2014; 22(34): 5228-5234
- URL: https://www.wjgnet.com/1009-3079/full/v22/i34/5228.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i34.5228
内质网应激(endoplasmic reticulum stress, ERS)是指在多种生理或病理条件下细胞内质网钙稳态失衡或蛋白质加工运输障碍、生理功能发生紊乱的一种亚细胞器的病理过程[1-3], 涉及内质网类似激酶(protein kinase RNA-like endoplasmic reticulum kinase, PERK)/真核细胞翻译起始因子2α(eukaryotic initiation factor 2α, eIF2α)、激活转录因子6(activating transcription factor 6, ATF6)和需肌醇酶-1(inositol-requiring kinase 1, IRE-1α)/X盒结合蛋白-1(X-box binding protein-1, XBP-1)等信号通路[4-6], 而葡萄糖调节蛋白78(glucose-regulated protein 78, GRP78)是细胞ERS状态的标志物[7,8]. 内质网氧化还原酶-1α(endoplasmic reticulum oxidoreductin 1α, ERO1α)是调控内质网腔中蛋白合成、折叠的关键基因[9,10]. 同型半胱氨酸(homocysteine, Hcy)是多种疾病的危险因子, 可引起肝脏ERS[11,12]. 本研究主要探讨Hcy诱导肝细胞ERS过程中ERO1α的调控作用及可能机制, 为进一步寻找Hcy致肝脏ERS中的作用靶点提供实验依据.
HL7220肝细胞株(四川大学华西医学中心, 中国); 超净工作台(苏州安泰空气技术有限公司, 中国); CO2培养箱(Heraeus, 德国); 5415D型微量台式离心机(Eppendorf, 德国); BS110S型精密天平(Sartorius, 德国); 荧光显微镜(奥林巴斯公司, 日本); 荧光定量PCR仪(上海枫岭生物技术有限公司, 中国); 垂直电泳仪和Model680全自动酶标仪(Bio-Rad公司, 美国); HyClone RPMI 1640培养基(Thermo); 胎牛血清(杭州四季青生物工程材料研究所); Hcy(Sigma); RNA提取试剂盒(北京天根生物技术有限公司, 中国); 逆转录和qRT-PCR试剂盒(美国Invitrogen公司); 蛋白提取试剂盒、蛋白定量试剂盒(南京凯基生物科技发展有限公司, 中国); ERO1α兔抗人一抗(Abcam公司), 辣根过氧化物酶(HRP)标记的羊抗兔二抗(北京博奥森生物技术有限公司, 中国); GRP78、PERK、ATF6、XBP-1 ELISA试剂盒(北京雅安达公司, 中国); 引物由上海生工生物工程有限公司合成.
1.2.1 细胞培养: 将人肝细胞用含10%胎牛血清的RPMI 1640培养基置于37 ℃、50 mL/L CO2培养箱中传代培养. 细胞密度达到80%左右时, 用终浓度为0、50、100、200、500 μmol/L Hcy和100 μmol/L Hcy+叶酸+VB12干预, 其中0 μmol/L Hcy为对照组, 48 h后收集细胞, 用于后续试验.
1.2.2 ELISA检测ERS相关蛋白GRP78、PERK、ATF6、XBP-1的水平: ELISA试剂盒室温平衡15 min, 分别设空白孔、待测样品孔. 空白孔加样品稀释液100 μL, 余孔分别加标准品或待测样品100 μL(待测样品蛋白上样浓度统一为21 g/L), 37 ℃反应30 min. 洗板5次, 各1 min, 拍干. 每孔加酶标液100 μL, 37 ℃反应30 min, 洗板5次, 各1 min, 拍干. 加显色试剂A液和B液, 37 ℃显色15 min. 加终止液, 15 min内, 酶标仪上读取各孔A450值.
1.2.3 实时定量PCR检测ERO1α mRNA水平: 按照RNA提取试剂盒说明书提取细胞RNA, 琼脂糖凝胶电泳检测RNA的完整性. 按逆转录试剂盒说明书逆转录合成cDNA; 采用Primer 5.0软件设计引物, ERO1α: 5'-ATCCTTTGGCTTCTGGTCAAG-3'(上游)和5'-GTTGTGTCCCCATTTCTTTTCT-3'(下游); β-actin: 5'-TGACGTGGACATCCGCAAAG-3'(上游)和5'-CTGGAAGGTGGACAGCGACG-3'(下游). PCR条件: 94 ℃预变性10 min, 94 ℃变性30 s、58 ℃退火30 s、72 ℃延长30 s, 扩增40个循环. 待反应结束后, 结合扩增曲线及溶解曲线, 选择符合要求的qRT-PCR原始数据, 结果用2-△△CT法分析.
1.2.4 Western blot检测ERO1α的蛋白表达改变: 细胞裂解法提取各组细胞总蛋白, 取总蛋白18 μL, 经十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳, 80 V 30 min, 120 V 60 min, 15 V恒压转膜10 min, 与ERO1α特异性一抗4 ℃过夜; 与二抗室温孵育1.5 h后, 加入显色底物, 以β-actin为内参, 凝胶成像分析仪上成像分析, 计算ERO1α与β-actin灰度值的比值, 进行分析.
1.2.5 ERO1α重组质粒及siRNA质粒构建: ERO1α重组质粒委托上海汉恒生物技术有限公司完成. ERO1α三个不同siRNA片段委托上海吉凯生物技术有限公司完成.
1.2.6 细胞转染: 转染前2 d取对数期生长的肝细胞接种于6孔板中, 分别用空质粒(pEGFP-N1)和ERO1α重组质粒(pERO1α)及siRNA三个不同片段转染肝细胞, 并设立空白对照组. 操作步骤: LipofectamineTM 2000(μL)和质粒DNA(μg)比例为3:1, 分别溶于无血清培养液中, 室温孵育5 min后将两者混匀, 室温孵育20 min, 与适量无血清培养液轻轻混匀后加入细胞中, 6 h后弃培养液, 加入含血清的培养液继续培养48 h后, 荧光倒置显微镜观察细胞转染效率.
统计学处理 采用Prism 6.0统计软件对实验数据进行分析, 计量资料以mean±SD表示, 两组间比较采用t检验, 多组间两两比较采用单因素方差分析, P<0.05表示差异有统计学意义.
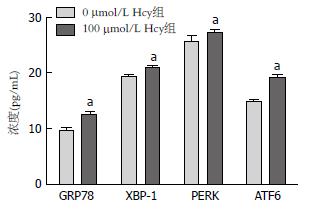
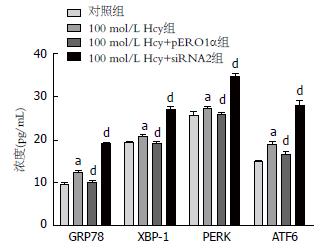
用100 µmol/L Hcy干预肝细胞后, ERS相关蛋白GRP78、XBP-1、PERK及ATF6的含量较对照组分别升高了1.29、1.27、1.06、1.08倍, 差异有统计学意义(P<0.05)(图1).
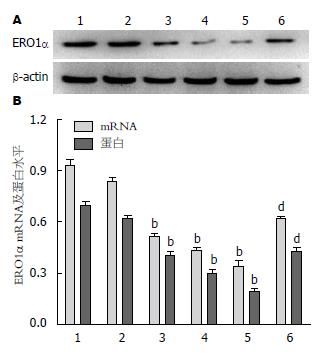
分别用0、50、100、200、500 µmol/L Hcy干预肝细胞后, ERO1α mRNA和蛋白表达水平均有所降低. 其中50 µmol/L组与0 µmol/L组比较无明显差异; 其余组随着Hcy浓度的增加, ERO1α mRNA和蛋白表达水平均显著减少(P<0.01), 且呈剂量依赖关系; 而给予叶酸和VB12干预后, ERO1α表达水平明显增加(P<0.01)(图2).
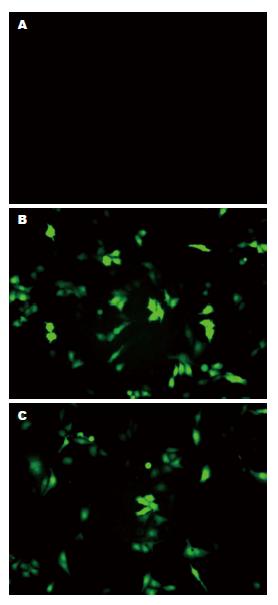
为了分析ERO1α对肝细胞ERS相关蛋白的调控作用, 运用脂质体LipofectamineTM 2000将pEGFP-N1、pERO1α重组质粒及siRNA三个不同片段转染肝细胞48 h后, 荧光显微镜下观察可见绿色荧光蛋白表达明显, 说明转染成功, 可以进行后续实验(图3).
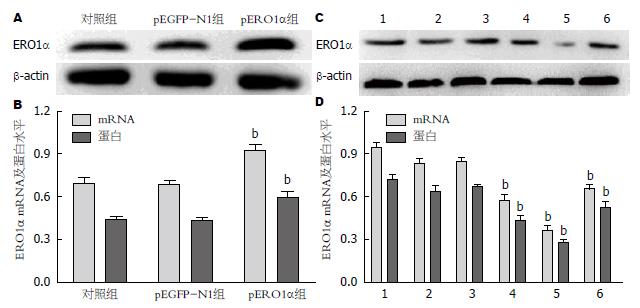
将pEGFP-N1空质粒及ERO1α过表达质粒分别转染肝细胞, 检测ERO1α mRNA及蛋白表达, 结果显示pERO1α组ERO1α mRNA及蛋白表达水平明显增加(P<0.01)(图4A, B), 证实pERO1α转染成功; 将三个不同的ERO1α siRNA片段转染肝细胞, 三个片段均可以降低ERO1α mRNA及蛋白表达明显增加(P<0.01), 尤其以siRNA2作用最为明显(图4C, D).
为了进一步明确ERO1α在Hcy诱导肝细胞ERS中的作用, 分别将ERO1α过表达质粒及ERO1α siRNA片段转染肝细胞并与Hcy(100 µmol/L)共同孵育48 h后, 检测GRP78、ATF6、PERK、XBP-1的表达变化, 结果显示与Hcy组相比, Hcy+pERO1α组GRP78、ATF6、PERK、XBP-1均明显降低(P<0.01); 而Hcy+siRNA2组, GRP78、ATF6、PERK、XBP-1均明显升高(P<0.01)(图5).
ERS反应是细胞的一种自我保护机制, 在保护机体有效应对各种外在刺激中涉及多个信号通路及相关基因的表达调控, 构成一个完整体系, 发挥维持细胞存活和凋亡平衡的重要调节作用[13,14]. 适度的ERS反应有助于保护细胞, 维持生存, 但ERS反应过强不可逆转时则可引起细胞功能障碍, 导致细胞凋亡, 促进疾病的发生发展[15]. Hcy是一种含硫氨基酸, 是体内蛋氨酸代谢的中间产物, 正常机体中含量很低, 当Hcy代谢受阻, 就会在体内积聚, 使其在血中的水平持续升高发生高同型半胱氨酸血症(hyperhomocysteinemia, HHcy)[16,17], 是临床多种疾病的危险因素[18]. 研究[19,20]显示: Hcy参与心肌细胞ERS, 为ERS的诱导因素之一, 而肝脏是调节Hcy代谢的重要器官, 含有丰富的内质网, 在调节Hcy代谢过程中, 更容易发生ERS反应[21,22]. GRP78是一种内质网分子伴侣, 是ERS反应的主要标志性蛋白, 在内质网非应激状态下, PERK、ATF6、IRE1与GRP78结合处于非活性状态, ERS时, GRP78则与这三种转录因子解离并启动PERK/eIF2α、ATF6、IRE-1α/XBP-1信号转导途径[23]. 本实验研究结果提示Hcy干预后, 肝细胞内GRP78、PERK、ATF6与XBP-1表达升高, 表明Hcy可导致肝细胞发生ERS.
ERO1定位于人14号染色体上, 是一种紧贴于ER膜腔面的糖基化黄素酶, 主要参与维持ER内氧化状态[24]. ERO1参与氧化二硫键异构酶, 维持蛋白折叠过程能够持续进行[25]. ERO1在形成二硫键的过程中可产生H2O2, 因此ERO1激活是细胞内活性氧簇(reactive oxygen species, ROS)产生的重要来源之一[26]. 过多的ROS产生, 超过细胞抗氧化防御能力就会影响细胞内氧化还原稳态, 引起氧化应激和ERS等过程[27]. 人类细胞中含有两种ERO1同源异构体, ERO1α和ERO1β. Wright等[28]发现, ERO1α限制胰岛素原突变体诱导的ERS. 另有研究[29,30]发现, ERO1α蛋白可能参与高血压诱导的血管内皮细胞损伤, 并可以作为ERS导致细胞凋亡通路的重要标志蛋白, 表明ERO1α是调控内质网腔中蛋白合成、折叠的关键基因. 我们用不同浓度Hcy刺激肝细胞, 结果显示, Hcy可以引起ERO1α表达下降, 且呈剂量依赖性, 提示ERO1α参与了Hcy引起的肝细胞ERS. 为了进一步明确ERO1α在Hcy致肝细胞ERS中的作用, 我们分别在肝细胞中过表达和干扰ERO1α, 结果发现过表达ERO1α后, ERS相关蛋白GRP78、PERK、ATF6与XBP-1表达减少, 而抑制ERO1α表达后ERS相关蛋白表达升高, 表明ERO1α对ERS起到负性调控作用. 因此, ERO1α可能是Hcy引起的肝细胞ERS过程的关键基因, 是Hcy导致肝细胞ERS过程中的一个重要开关或桥梁.
同型半胱氨酸是多种疾病的危险因子, 可引起细胞发生内质网应激(endoplasmic reticulum stress, ERS), ERS反应过强可引起细胞功能障碍, 导致细胞凋亡, 促进疾病的发生发展, 目前同型半胱氨酸致ERS的机制尚未完全阐明, 因此对于其机制的研究已成为研究热点.
邱伟华, 主任医师, 上海交通大学医学院附属瑞金医院普外科
内质网氧化还原酶-1α(endoplasmic reticulum oxidoreductin 1α, ERO1α)是存在于内质网的一种氧化酶, 是调控内质网腔中蛋白合成、折叠的关键基因, 对维持内质网稳态发挥重要作用. 目前关于ERO1α是否参与了同型半胱氨酸致肝脏ERS的病理过程及调控机制鲜有报道.
有研究人员发现, 萝卜硫素能通过核转录因子Nrf2及其下游抗氧化酶减弱同型半胱氨酸诱导的人肝细胞ERS.
本次研究发现, 同型半胱氨酸可能通过下调ERO1α引起肝细胞葡萄糖调节蛋白78(glucose- regulated protein 78, GRP78)-X盒结合蛋白-1(X-box binding protein-1, XBP-1)/内质网类似激酶(protein kinase RNA-like endoplasmic reticulum kinase, PERK)/激活转录因子6(activating transcription factor 6, ATF6)表达增加促进ERS发生, 同时ERO1α在同型半胱氨酸致肝细胞ERS过程中发挥重要调控作用.
ERS是同型半胱氨酸诱导肝细胞损伤的重要致病环节, ERO1α在内质网应激过程中发挥重要调控作用, 可能成为治疗同型半胱氨酸致肝细胞损伤的重要靶点.
内质网应激(ERS): 指在多种生理或病理条件下细胞内质网钙稳态失衡或蛋白质加工运输障碍、生理功能发生紊乱的一种亚细胞器的病理过程, 涉及PERK/eIF2α、ATF6、IRE-1α/XBP-1等信号通路.
本研究设计合理, 技发可靠, 内容丰富, 学术价值好.
编辑: 郭鹏 电编:闫晋利
| 2. | Jiang P, Gan M, Lin WL, Yen SH. Nutrient deprivation induces α-synuclein aggregation through endoplasmic reticulum stress response and SREBP2 pathway. Front Aging Neurosci. 2014;6:268. [PubMed] [DOI] |
| 3. | Min KJ, Jung KJ, Kwon TK. Carnosic Acid Induces Apoptosis Through Reactive Oxygen Species-mediated Endoplasmic Reticulum Stress Induction in Human Renal Carcinoma Caki Cells. J Cancer Prev. 2014;19:170-178. [PubMed] [DOI] |
| 4. | Shen S, Zhang Y, Wang Z, Liu R, Gong X. Bufalin induces the interplay between apoptosis and autophagy in glioma cells through endoplasmic reticulum stress. Int J Biol Sci. 2014;10:212-224. [PubMed] [DOI] |
| 5. | Zhang XF, Huang HP, Ding WX, Ding N, Lu G, Liu JN, Zhang XL. Adiponectin protects the genioglossus of rats against chronic intermittent hypoxia-induced injury via inhibition of endoplasmic reticulum stress. Chin Med J (Engl). 2013;126:3270-3275. [PubMed] |
| 6. | McCloy RA, Shelley EJ, Roberts CG, Boslem E, Biden TJ, Nicholson RI, Gee JM, Sutherland RL, Musgrove EA, Burgess A. Role of endoplasmic reticulum stress induction by the plant toxin, persin, in overcoming resistance to the apoptotic effects of tamoxifen in human breast cancer cells. Br J Cancer. 2013;109:3034-3041. [PubMed] [DOI] |
| 7. | Cao Y, Hao Y, Li H, Liu Q, Gao F, Liu W, Duan H. Role of endoplasmic reticulum stress in apoptosis of differentiated mouse podocytes induced by high glucose. Int J Mol Med. 2014;33:809-816. [PubMed] [DOI] |
| 8. | Jiang X, Kanda T, Nakamoto S, Haga Y, Sasaki R, Nakamura M, Wu S, Mikata R, Yokosuka O. Knockdown of glucose-regulated protein 78 enhances poly(ADP-ribose) polymerase cleavage in human pancreatic cancer cells exposed to endoplasmic reticulum stress. Oncol Rep. 2014;32:2343-2348. [PubMed] [DOI] |
| 9. | Zhang L, Niu Y, Zhu L, Fang J, Wang X, Wang L, Wang CC. Different Interaction Modes for Protein-disulfide Isomerase (PDI) as an Efficient Regulator and a Specific Substrate of Endoplasmic Reticulum Oxidoreductin-1α (Ero1α). J Biol Chem. 2014;289:31188-31199. [PubMed] |
| 10. | Wang L, Zhang L, Niu Y, Sitia R, Wang CC. Glutathione peroxidase 7 utilizes hydrogen peroxide generated by Ero1α to promote oxidative protein folding. Antioxid Redox Signal. 2014;20:545-556. [PubMed] [DOI] |
| 11. | McDonald I, Connolly M, Tobin AM. A review of psoriasis, a known risk factor for cardiovascular disease and its impact on folate and homocysteine metabolism. J Nutr Metab. 2012;2012:965385. [PubMed] [DOI] |
| 12. | 王 磊, 田 珏, 曹 成建, 杨 程, 蔡 欣, 周 龙霞, 杨 晓玲, 姜 怡邓. 高同型半胱氨酸血症经内质网途径影响ApoE-/-鼠肝细胞凋亡. 中国药理学通报. 2014;30:261-265. |
| 13. | Yadav RK, Chae SW, Kim HR, Chae HJ. Endoplasmic reticulum stress and cancer. J Cancer Prev. 2014;19:75-88. [PubMed] [DOI] |
| 14. | Yao ST, Zhao L, Miao C, Tian H, Yang NN, Guo SD, Zhai L, Chen J, Wang YW, Qin SC. [Endoplasmic reticulum stress mediates oxidized low density lipoprotein-induced scavenger receptor A1 upregulation in macrophages]. Shengli Xuebao. 2014;66:612-618. [PubMed] |
| 15. | Sano R, Reed JC. ER stress-induced cell death mechanisms. Biochim Biophys Acta. 2013;1833:3460-3470. [PubMed] [DOI] |
| 16. | Liang Y, Yang X, Ma L, Cai X, Wang L, Yang C, Li G, Zhang M, Sun W, Jiang Y. Homocysteine-mediated cholesterol efflux via ABCA1 and ACAT1 DNA methylation in THP-1 monocyte-derived foam cells. Acta Biochim Biophys Sin (Shanghai). 2013;45:220-228. [PubMed] [DOI] |
| 17. | 杨 慧君, 李 倩, 崔 玲, 钱 玉中, 李 文静, 唐 燕. 非酒精性脂肪肝患者同型半胱氨酸浓度及叶酸与维生素B12浓度变化及相关性. 世界华人消化杂志. 2007;15:1449-1452. [DOI] |
| 18. | Sirdah MM, Yassin MM, El Shekhi S, Lubbad AM. Homocysteine and vitamin B12 status and iron deficiency anemia in female university students from Gaza Strip, Palestine. Rev Bras Hematol Hemoter. 2014;36:208-212. [PubMed] [DOI] |
| 19. | 张 志敏, 赵 连友, 卢 凡, 邹 青, 李 雪, 丁 璐, 卫 聪颖. 高同型半胱氨酸对高血压大鼠心肌细胞GRP78和CHOP表达及左室肥厚的影响. 中国循证心血管医学杂志. 2014;6:223-228. |
| 20. | Wei H, Zhang R, Jin H, Liu D, Tang X, Tang C, Du J. Hydrogen sulfide attenuates hyperhomocysteinemia-induced cardiomyocytic endoplasmic reticulum stress in rats. Antioxid Redox Signal. 2010;12:1079-1091. [PubMed] [DOI] |
| 22. | Dara L, Ji C, Kaplowitz N. The contribution of endoplasmic reticulum stress to liver diseases. Hepatology. 2011;53:1752-1763. [PubMed] [DOI] |
| 24. | Araki K, Inaba K. Structure, mechanism, and evolution of Ero1 family enzymes. Antioxid Redox Signal. 2012;16:790-799. [PubMed] [DOI] |
| 25. | Benham AM, van Lith M, Sitia R, Braakman I. Ero1-PDI interactions, the response to redox flux and the implications for disulfide bond formation in the mammalian endoplasmic reticulum. Philos Trans R Soc Lond B Biol Sci. 2013;368:20110403. [PubMed] [DOI] |
| 26. | Ozgur R, Turkan I, Uzilday B, Sekmen AH. Endoplasmic reticulum stress triggers ROS signalling, changes the redox state, and regulates the antioxidant defence of Arabidopsis thaliana. J Exp Bot. 2014;65:1377-1390. [PubMed] [DOI] |
| 27. | Hou CH, Lin FL, Hou SM, Liu JF. Hyperthermia induces apoptosis through endoplasmic reticulum and reactive oxygen species in human osteosarcoma cells. Int J Mol Sci. 2014;15:17380-17395. [PubMed] [DOI] |
| 28. | Wright J, Birk J, Haataja L, Liu M, Ramming T, Weiss MA, Appenzeller-Herzog C, Arvan P. Endoplasmic reticulum oxidoreductin-1α (Ero1α) improves folding and secretion of mutant proinsulin and limits mutant proinsulin-induced endoplasmic reticulum stress. J Biol Chem. 2013;288:31010-31018. [PubMed] [DOI] |
| 30. | Lenna S, Han R, Trojanowska M. Endoplasmic reticulum stress and endothelial dysfunction. IUBMB Life. 2014;66:530-537. [PubMed] [DOI] |