修回日期: 2014-10-11
接受日期: 2014-10-16
在线出版日期: 2014-11-28
目的: 建立人肝癌细胞裸鼠移植瘤模型, 并应用于苦参碱(matrine, Ma)的抑瘤作用观察.
方法: 将人肝癌细胞株HepG2接种于BALB/c裸鼠腋部皮下, 建立人肝癌细胞裸鼠皮下移植瘤动物模型. 予Ma 100 mg/kg给药, 随机分为给药3、2、1和0 wk(空白对照)组, 均采用腹腔注射给药, 每周连续给药5 d, 期间观察裸鼠的全身状况、接种部位成瘤时间, 测量动物体质量、瘤体体积和质量、计算抑瘤率以及采用HE染色法进行瘤组织的病理学观察, 进而初步评价Ma的抗肿瘤作用.
结果: 将人肝癌细胞HepG2种植于裸鼠腋部皮下造移植瘤模型成功, 成瘤率达100%; 观察发现Ma对肝癌皮下移植瘤有抑制作用, 给药1、2、3 wk组的抑瘤率分别为8.3%、37.5%、54%, 给药3、2 wk组与0、1 wk组比较差异具有统计学意义(均P<0.01), 给药3 wk组与2 wk组比较、给药1 wk组与0 wk组比较差异也具统计学意义(P<0.05); HE染色给药组癌组织基本结构和癌细胞形态与对照组无明显变化, 给药期间各组裸鼠的体质量等全身状况未出现明显降低且组间差异不明显.
结论: 人肝癌细胞裸鼠移植瘤模型建立成功, 在肝癌模型中, Ma具有一定的抑瘤作用且无明显不良反应, 早期给药比晚期给药抑瘤作用明显.
核心提示: 本研究在成功建立人肝癌细胞裸鼠移植瘤模型的基础上, 使用苦参碱(matrine, Ma)干预, 发现其具有一定的抑瘤作用且无明显不良反应, 早期给药比晚期给药抑瘤作用明显.
引文著录: 胡高裕, 黄桂柳, 黄赞松, 周喜汉, 胡静, 黄炳臣. 人肝癌细胞裸鼠移植瘤模型建立及苦参碱的抑瘤作用. 世界华人消化杂志 2014; 22(33): 5056-5062
Revised: October 11, 2014
Accepted: October 16, 2014
Published online: November 28, 2014
AIM: To establish a human hepatocellular carcinoma model in BALB/c nude mice and to assess the anticancer effects of matrine against human hepatocellular carcinoma.
METHODS: Twenty-four 6-week-old male BALB/c nude mice were used in this study. A xenograft model of human hepatocellular carcinoma was established by subcutaneous injection of HepG2 cells into nude mice. The nude mice were then randomly divided into 4 groups: a 3-wk group, a 2-wk group, a 1-wk group and a control group. Except for the control group, the mice in other groups were given matrine (100 mg/kg) by intraperitoneal injection for 5 d every week. The general status and body weight of mice, the time to tumor formation, tumor volume and weight, and the reduced rate of tumor growth were assessed, and pathological changes were observed after HE staining to evaluate the anticancer effect of matrine.
RESULTS: The success rate of establishing the xenograft model was 100%. Matrine had an inhibitory effect on the growth of tumor xenografts. The reduced rates of tumor growth was 8.3% in the 1-wk group, 37.5% in the 2-wk group, and 54% in the 3-wk group. The reduced rates of tumor growth were significantly higher in the 3-wk and 2-wk groups than in the 1-wk group and control group (P < 0.01). There was also a significant difference between the 1-wk group and control group (P < 0.05), and between the 3-wk group and 2-wk group (P < 0.05). No obvious differences were found in histology of cancerous tissues between the three treatment groups and the control group. There were also no apparent differences in the general status or body weight of the animals among the four groups.
CONCLUSION: A nude mouse xenograft model of human hepatocellular carcinoma has been established successfully. Matrine at a dose of 100 mg/kg has anticancer effects without obvious toxic effects.
- Citation: Hu GY, Huang GL, Huang ZS, Zhou XH, Hu J, Huang BC. Establishment of a human hepatocellular carcinoma xenograft model in nude mice and evaluation of anticancer effects of matrine. Shijie Huaren Xiaohua Zazhi 2014; 22(33): 5056-5062
- URL: https://www.wjgnet.com/1009-3079/full/v22/i33/5056.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i33.5056
迄今, 肝细胞癌(hepatocellular carcinoma, HCC)是影响人类健康最常见的恶性肿瘤之一, 年均死亡人数约69万例, 而我国约占其中的1/2, HCC治疗棘手, 虽说目前肝癌的手术、肝移植、介入化疗、生物靶向治疗等技术有所提高, 但疗效仍然不尽如人意[1-3], 因此, 寻找新的低毒高效的药物已成为HCC治疗研究的重点. 苦参碱(matrine, Ma)是从中药苦参中提取的主要成分, 因具有抗炎、抗病毒、诱导肿瘤细胞凋亡及抑制肿瘤细胞生长等广泛的药理作用, 而用于慢性活动性肝炎及癌症的治疗[4-7]. 已有研究[8]发现: Ma可通过下调核因子(nuclear factor, NF)-κB即NF-κB信号通路抑制基质金属蛋白酶-9的表达和人类肝癌细胞的入侵. 先前大量的实验结果表明Ma可通过作用于凋亡相关基因(Caspase、c-myc、Bcl-2、bax)、microRNA水平或上调自噬相关基因(Atg5、Beclin1)的表达等途径来诱发体外肝癌细胞发生凋亡[9-12]. 而迄今, Ma抗肝癌作用的体内实验研究资料甚少. 人类肝癌的基础实验和临床研究多数都借助于实验动物模型. 基于此, 本实验研究以人肝癌裸鼠皮下移植瘤为模型, 并应用于Ma的抗肿瘤疗效观察.
改良型RPMI 1640培养基(Hyclone公司, 批号: NYF0906), 无支原体胎牛血清(浙江天杭生物科技有限公司, 批号: 130617), PBS漂洗缓冲液[博士德(Boster)生物工程有限公司], 0.25%胰蛋白酶-EDTA消化液(Solarbio)、二甲基亚砜(DMSO)(北京索莱宝科技有限公司), 苦参碱注射液[广州杰景药业有限公司(广州白云山明兴制药有限公司, 批号: 140101, 规格: 5 mL: 50 mg)]. 人肝癌细胞株HepG2购自中科院上海细胞库[11], 并由本实验中心传代、保存. ♂BALB/c裸鼠24只(合格证: Scxk桂2009-0002), SPF级, 周龄6 wk, 体质量16-20 g, 购自广西医科大学实验动物中心, 于室温22-26 ℃, 相对湿度40%-60%的SPF级动物实验室饲养, 垫料、水及饲料均经高压灭菌处理, 每3 d更换一次, 笼具浸泡在1:1000的新洁尔灭中消毒.
1.2.1 动物模型的建立: 参照文献[13,14], 将冻存于液氮罐中的人肝癌细胞HepG2复苏, 培养在含10%胎牛血清的改良型RPMI 1640培养液中, 置于37 ℃、5%CO2培养箱里培养, 采取胰酶消化法培养、传代, 常规更换培养液. 待细胞成对数生长期, 用胰酶消化法收集细胞, 低速离心1000 r/min, 共3 min, 制成细胞浓度为5.0×106/0.2 mL单细胞悬液. 在无菌条件下, 用1 mL注射器抽取0.2 mL单细胞悬液, 常规消毒裸鼠腋部皮肤, 将细胞悬液接种于该部位皮下, 7 d左右可在接种处触及结节, 10 d后成瘤, 瘤径约6 mm.
1.2.2 实验分组及给药: 予Ma 100 mg/kg, 依干预时间的不同随机分为: (1)3 wk组:种植癌细胞的同时注射Ma, 注射时间为0-3 wk; (2)2 wk组: 模型建立后的第1周开始注射Ma, 注射时间为1-3 wk; (3)1 wk组: 模型建成后的第2周始注射Ma, 注射时间为2-3 wk; (4)0 wk组: 0 wk组为模型建立3 wk内均未注射Ma的对照组; 均采用腹腔注射给药, 每周连续给药5 d, 第21天采用颈椎脱臼法处死, 分离肿瘤组织, 置于40 g/L甲醛中固定.
1.2.3 观察指标: 接种肿瘤细胞和给药干预后, 观察裸鼠的精神状态, 饮食饮水等一般状况及死亡情况并称取各组裸鼠的体质量; 分别于种植癌细胞后的7、10、12、14、17、19、21 d用精密游标卡尺测量移植瘤大小, 按以下公式计算肿瘤体积(tumor volume, TV), 计算公式为: TV = 0.5×a×b2(其中a、b分别表示长、宽); 实验结束时称瘤质量, 抑瘤率 = (对照组平均瘤质量-给药组平均瘤质量)/对照组平均瘤质量×100%.
1.2.4 大体解剖及组织病理学观察: 21 d后, 采用颈椎脱臼法处死实验动物, 进行大体解剖观察, 肉眼观察瘤体的大小、形态、有无胸腹水及各脏器表面有无转移性结节; 分离肿瘤组织, 置于40 g/L甲醛中固定, 然后进行石蜡包埋切片, HE染色, 光镜下观察瘤组织形态.
统计学处理 用SPSS16.0软件对所得数据进行统计分析, 计量资料数据用mean±SD表示, 组间比较采用单因素方差(ANOVA)分析, 多组间均数的两两比较采用q检验; 率的比较用χ2检验, P<0.05为差异具有统计学意义.
接种人肝癌细胞HepG2后约7 d左右可在接种部位触及结节, 除3 wk组成瘤时间稍晚外, 其他组10 d左右均可成瘤, 瘤径约6 mm, 成瘤率100%.
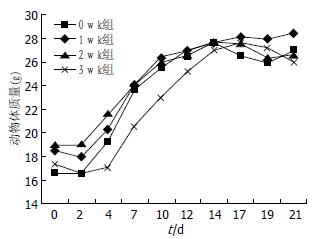
实验过程中, 各组裸鼠精神、活动、食量等无明显异常且组间差异不明显, 未出现实验动物死亡现象. 给药前, 裸鼠体质量迅速增加, 约1-3 g/2 d, 增至26-28 g时裸鼠体质量变化不大; 分组给药后, 发现给药组裸鼠体质量较对照组下降约1-3 g, 考虑由多次注射刺激引起, 给药组之间差异不明显, 根据时间-体质量绘制的曲线变化趋势(图1). 由此可知, 此剂量下的Ma对机体无明显不良反应.
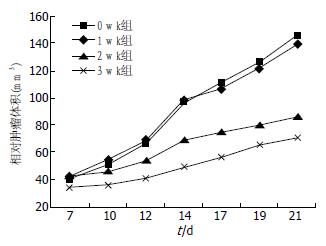
在种植癌细胞后约7 d, 给药0、1及2 wk组组间瘤结节比较无明显差异, 给药3 wk组瘤结节不明显; 给药后, 1 wk组肿瘤仍快速生长, 但较0 wk组慢; 2、3 wk组瘤体生长速度均明显减缓, 尤以3 wk组最慢, 与0、1 wk比较, 差异较为显著, 有统计学意义(P<0.01). 可见, Ma干预越早, 瘤结节出现越迟, 给药疗程延长, 肿瘤生长减慢, 瘤体体积越小(图2, 3).
3、2 wk组瘤质量与0、1 wk组比较差异显著(均P<0.01), 3 wk组与2 wk组比较、1 wk组与0 wk组比较差异也具统计学意义(P<0.05). 1 wk组抑瘤率为8.3%, 2 wk组为37.5%, 3 wk组为54%, 可见Ma使用越早、疗程越长, 其抑瘤作用越明显(表1).
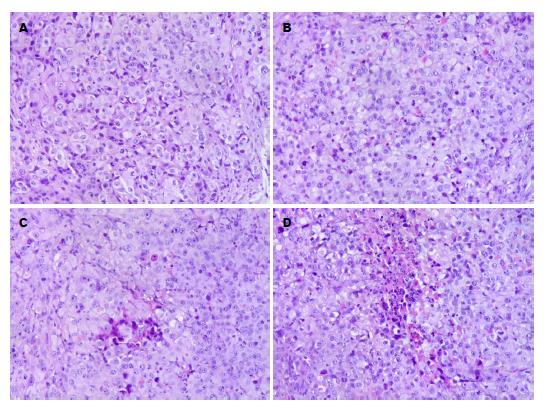
肉眼瘤组织形态、镜下病理组织学检查和原人肝癌组织相似. 瘤体早期多为结节状的实体瘤, 渐生长成不规则形, 表面有结节或分叶状突起, 荷瘤裸鼠胸腹腔未见积液, 肾、肺、脑等脏器未见癌细胞转移结节. HE染色光学显微镜下观察, 发现给药组瘤组织基本结构及细胞形态与对照组比较未发现明显变化, 均为肝实体瘤组织, 癌细胞大小不一致、癌细胞胞质嗜碱性、核浆比例增大、核分裂易见, 部分癌细胞出现脂肪变性, 胞浆透明, 可见散在分布的单个固缩性坏死的凋亡肿瘤细胞, 小灶状或片状凝固性坏死灶. 不同之处是0 wk组偶见散在凋亡细胞(图4A), 1 wk组细胞凋亡增多, 凋亡细胞胞质皱缩、致密、嗜酸性增强、核固缩, 散在性分布(图4B), 此两组小灶状、片状凝固性坏死少见, 且癌细胞核分裂相较多; 而给药2 wk(图4C)、3 wk(图4D)组癌组织内除较多散在性分布凋亡肿瘤细胞外, 出现较多小灶状、片状凝固性坏死灶, 尤以3 wk组明显, 癌细胞核分裂相相对减少. 这表明Ma对癌细胞具有促进凋亡、抑制分裂增殖的作用, 且其抑瘤作用随疗程的延长而增强.
建立适宜的人肝癌动物肿瘤模型, 是研究HCC发生进展及筛选抗肿瘤药物的必备工具. 随着HCC研究的深入, 模型的建立也有新的突破, 由既往的自发性或诱发性动物肝癌模型发展到近来的移植型及基因工程肝癌动物模型等; 用于建立HCC模型的动物较多, 主要有鼠、兔、猪及树晌等[15,16]. 以裸鼠为载体的人肝癌动物模型是目前认为最接近人类肝癌的整体实验模型, 常见的有以下几种类型: 皮下移植瘤(包括肝癌外科标本移植、肝癌细胞株移植)、腹水移植瘤及原位移植瘤等, 皮下移植瘤模型因具有成瘤率高、操作相对简单、成瘤时间短且可直观药物的抑瘤效果等特点, 而为研究者广为采用[14,17].
本实验将5×106个人肝癌HepG2细胞接种于裸鼠腋部皮下, 在建立移植瘤模型过程中用不同疗程的Ma干预, 结果发现给药0、1、2 wk组裸鼠约在7 d左右可在接种部位触及结节, 10 d左右均可成瘤, 瘤径约6 mm, 成瘤率100%, 但给药3 wk组出现结节及成瘤时间均晚约3-4 d. 由此可知, 在接种HepG2细胞的同时采用Ma治疗, 可使移植瘤的成瘤时间延长, 具体延长时间因癌细胞的接种数量、接种部位及给药浓度等的不同而异, 故仍需要大量的实验进一步明确.
Ma是从中药苦参、苦豆子等中分离得到的生物碱, 在抗炎、抗病毒、抗纤维化、促使恶性细胞凋亡、阻抑细胞增殖、调节机体免疫功能及调控细胞周期等方面具有突出的药用价值, 尤其在抗肿瘤方面效果良好、无明显不良反应, 显示出良好的应用前景[18-20], 如: Niu等[21]研究发现, Ma可通过下调凋亡抑制蛋白(inhibitor of apoptosis protein, IAP)和蛋白激酶传导通路(phosphatidylinositol 3-kinase/Akt/mammalian target of rapamycin, PI3K/Akt/mTOR), 促进肺癌A549和95D细胞的凋亡. Xie等[22]研究表明, Ma可通过减少血管内皮生长因子-A(vascular endothelial growth factor-A, VEGF-A)的水平和促使细胞外信号调节激酶1/2(extracellular signal-regulated kinase1/2, ERK1/2)的失活, 诱导人鼻咽癌细胞的凋亡. 基于前期实验研究表明, Ma对体外培养的肝癌细胞系SMMC-7721[23]、H22[24]、HepG2[25,26]和BEL-7402[27]均有显著的抑制增殖及诱导凋亡的作用, 且与剂量呈正相关. 现有研究资料表明, 作为与肿瘤密不可分的局部微环境, 对肿瘤的发生、发展有重要作用. 研究肿瘤生物学特性必须以肿瘤组织整体来观察, 单纯的肿瘤细胞系无法准确模拟肿瘤的生物学特征. 已有研究[28]表明Ma对人胃腺癌SGC-7901裸小鼠移植瘤、小鼠宫颈癌细胞株u14移植瘤[29]等具有抑制作用且无明显不良反应; 据我们所知, Ma体内实验抗HCC作用研究资料甚少, 而细胞实验与体内实验是有差异的. 故本次选用人来源的肝癌细胞HepG2建立裸鼠皮下移植瘤模型以探讨Ma体内抗HCC作用. 本课题组之前将5×106的肝癌H22细胞接种于昆明小鼠腋下造模, 然后给予Ma(2 mg/kg, 0.2 mL/只)腹腔内注射治疗, 1次/d, 连续18 d, 结果发现其抑瘤率可达27.6%[30]; 屈飞等[24]用浓度为2×107/mL的肝癌H22细胞, 每只0.2 mL, 接种至小鼠腋部皮下造模, 然后将剂量分别为25、50和100 mg/kg的Ma用于实验, 0.2 mL/只, 1次/d, 连续给药10 d, 结果发现其抑瘤率分别为: 22%、35%和50%; 以上实验均说明Ma具有抗小鼠肝癌H22细胞移植瘤作用且可随给药浓度的增加而增强. 通过查阅文献[24,28]及预试验, 我们基本确定了相对合理的给药剂量和频率, 即Ma: 100 mg/kg具有较好的体内抗人肝癌HepG2细胞的作用且试验裸鼠均未出现死亡事件, 其结果和正式实验具有较好的一致性. 故本实验在成功建立人肝癌裸鼠皮下移植瘤模型的基础上, 采用该剂量的Ma进行干预, 结果发现, 给药1 wk和2 wk组抑瘤率分别为8.3%和37.5%, 3 wk组肿瘤体积较其他组缩小, 给药3 wk其抑瘤率高达54%, 这表明Ma具有体内抗HCC作用, 这与上述研究结论一致. 通过实验我们还发现, 越早期给药, 肿瘤生长减慢, 瘤体体积越小, 这说明Ma可抑制肿瘤病程进展, 取得了预期效果, 但其具体机制有待进一步研究.
总之, 人肝癌细胞裸鼠移植瘤模型建立成功, 成瘤率高, 在肝癌模型中, Ma具有一定的抑瘤作用且无明显不良反应, 早期给药比晚期给药抑瘤作用明显. 关于Ma对HCC的疗效与治疗浓度及疗程的关系和作用机制尚需要更多的实验研究进一步探讨.
临床常用于肝细胞癌(hepatocellular carcinoma, HCC)化疗的药物对机体的不良反应极大, 给患者的身心带来沉重打击, 导致患者及家属难以接受. 因此, 寻找低毒高效, 同时又具有免疫调节、保护肝肾功能、升高白细胞、缓解癌痛等作用的抗肿瘤药物成为广大医学工作者的重要使命. 近年的研究发现, 中药提取物苦参碱(matrine, Ma)在此领域具有许多常规化疗药物所不具备的优势, 因而, 受到医学研究者的普遍青睐.
荚卫东, 教授, 安徽省立院肝脏外科
Ma是从苦参、苦豆子等传统中药中提取的生物碱. 较多研究表明, Ma对体外肝癌细胞具有抑制增殖及诱导凋亡的作用, 且对正常肝细胞无明显损伤, 但关于其是否具有体内抗HCC作用及其具体时相效应的研究少见.
已有研究报道Ma具有抗胃癌、肺癌、宫颈癌等肿瘤作用, 且能提高机体免疫力, 缓解癌性疼痛, 改善生活质量.
先前较多的实验结果表明, Ma对体外肝癌细胞具有抑制增殖、诱导凋亡的作用. 而迄今, Ma抗HCC作用的体内实验研究资料甚少. 本研究主要探讨Ma的体内抗HCC作用及其时相效应.
本研究发现: 在HCC模型中, Ma具有一定的抑瘤作用且无明显不良反应, 早期给药比晚期给药抑瘤作用明显, 为其应用于该病的临床治疗提供了实验依据.
本研究成功建立人肝癌细胞裸鼠移植瘤模型, 在此基础上探索了Ma抑瘤作用, 研究结果发现, Ma具有一定的抑瘤作用且无明显不良反应, 早期给药比晚期给药抑瘤作用明显. 该研究具有一定创新性, 且对临床应用有一定的指导作用.
编辑: 韦元涛 电编:都珍珍
| 1. | Livraghi T, Mäkisalo H, Line PD. Treatment options in hepatocellular carcinoma today. Scand J Surg. 2011;100:22-29. [PubMed] |
| 2. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 4. | Wan XY, Luo M, Li XD, He P. Hepatoprotective and anti-hepatocarcinogenic effects of glycyrrhizin and matrine. Chem Biol Interact. 2009;181:15-19. [PubMed] [DOI] |
| 5. | Wang L, Gao C, Yao S, Xie B. Blocking autophagic flux enhances matrine-induced apoptosis in human hepatoma cells. Int J Mol Sci. 2013;14:23212-23230. [PubMed] [DOI] |
| 8. | Yu HB, Zhang HF, Li DY, Zhang X, Xue HZ, Zhao SH. Matrine inhibits matrix metalloproteinase-9 expression and invasion of human hepatocellular carcinoma cells. J Asian Nat Prod Res. 2011;13:242-250. [PubMed] [DOI] |
| 9. | Zhou H, Xu M, Gao Y, Deng Z, Cao H, Zhang W, Wang Q, Zhang B, Song G, Zhan Y. Matrine induces caspase-independent program cell death in hepatocellular carcinoma through bid-mediated nuclear translocation of apoptosis inducing factor. Mol Cancer. 2014;13:59. [PubMed] [DOI] |
| 10. | 韦 星, 黄 赞松, 黄 岑汉, 周 喜汉, 黄 衍强, 邓 志华. 苦参素注射液联合顺铂对人肝癌SMMC-7721细胞凋亡相关基因c-myc、bcl-2和bax表达的影响. 山东医药. 2012;52:12-14. |
| 11. | 黄 赞松, 向 发良, 周 喜汉, 黄 衍强, 邓 志华, 仇 仪英. 苦参素对肝癌细胞HepG2细胞增殖和MicroRNA-122、MicroRNA-21表达的影响. 中国老年学杂志. 2014;36:3079-3081. |
| 13. | Geng ZM, Li QH, Li WZ, Zheng JB, Shah V. Activated human hepatic stellate cells promote growth of human hepatocellular carcinoma in a subcutaneous xenograft nude mouse model. Cell Biochem Biophys. 2014;70:337-347. [PubMed] [DOI] |
| 16. | Krupke DM, Begley DA, Sundberg JP, Bult CJ, Eppig JT. The Mouse Tumor Biology database. Nat Rev Cancer. 2008;8:459-465. [PubMed] [DOI] |
| 17. | Song KD, Choi D, Lee JH, Im GH, Yang J, Kim JH, Lee WJ. Evaluation of tumor microvascular response to brivanib by dynamic contrast-enhanced 7-T MRI in an orthotopic xenograft model of hepatocellular carcinoma. AJR Am J Roentgenol. 2014;202:W559-W566. [PubMed] [DOI] |
| 18. | Wang CY, Bai XY, Wang CH. Traditional Chinese medicine: a treasured natural resource of anticancer drug research and development. Am J Chin Med. 2014;42:543-559. [PubMed] [DOI] |
| 21. | Niu H, Zhang Y, Wu B, Zhang Y, Jiang H, He P. Matrine induces the apoptosis of lung cancer cells through downregulation of inhibitor of apoptosis proteins and the Akt signaling pathway. Oncol Rep. 2014;32:1087-1093. [PubMed] [DOI] |
| 22. | Xie M, He G, Wang R, Shi S, Chen J, Ye Y, Xie L, Yi X, Tang A. Matrine-induced apoptosis of human nasopharyngeal carcinoma cells via in vitro vascular endothelial growth factor-A/extracellular signal-regulated kinase1/2 pathway inactivation. Horm Metab Res. 2014;46:556-560. [PubMed] [DOI] |