修回日期: 2014-09-23
接受日期: 2014-09-30
在线出版日期: 2014-11-18
目的: 探讨超声内镜(endoscopic ultrasonography, EUS)对胃神经鞘瘤的诊断及EUS指导下内镜治疗的应用价值.
方法: 回顾性分析山东大学附属省立医院2009-03/2012-09 12例接受EUS检查并经手术获得病理和免疫组织化学确诊的胃神经鞘瘤临床资料.
结果: 6例患者胃神经鞘瘤位于胃体, 5例位于胃窦, 1例位于贲门. EUS主要表现为起源于胃壁固有肌层的低回声均质团块, 肿块边缘可见低回声晕环, 血流丰富; 1例位于幽门处者, EUS表现为黏膜中断, 但肌层可见实质性略强回声. 10例患者接受内镜下治疗, 其中6例患者行内镜黏膜下挖除术治疗, 3例患者行内镜下全层切除术治疗, 1例患者行内镜经黏膜下隧道切除术治疗. 所有病例术后均未出现胃出血、腹膜炎、感染等并发症. 术后9例进行随访, 平均随访时间为10.0 mo±1.9 mo, 均未发现肿瘤复发或转移.
结论: EUS对于辅助诊断胃神经鞘瘤有较高临床价值, EUS指导下的内镜治疗胃神经鞘瘤是安全, 有效的.
核心提示: 本文通过回顾性分析2009-03/2012-09山东大学附属省立医院12例接受超声内镜(endoscopic ultrasonography, EUS)检查并经手术获得病理和免疫组织化学确诊的胃神经鞘瘤临床资料, 发现胃神经鞘瘤EUS下多数表现为起源于固有肌层的均匀的低回声信号, 边缘整齐, 缺乏囊性变和钙化, 边缘有低回声晕环表现和内镜下的"桥形皱襞"表现在诊断中具有特异性.
引文著录: 黄亚, 沙启梅, 李宾, 魏丽丽, 王丛笑, 梁铁军. 胃神经鞘瘤的超声内镜诊断及内镜下治疗的价值. 世界华人消化杂志 2014; 22(32): 4969-4975
Revised: September 23, 2014
Accepted: September 30, 2014
Published online: November 18, 2014
AIM: To assess the diagnostic and therapeutic value of endoscopic ultrasonography in gastric schwannoma.
METHODS: Endoscopic ultrasonography features of 12 cases of pathologically and immunohistochemically confirmed gastric schwannoma were retrospectively analyzed.
RESULTS: The tumor was located in the gastric body in 6 patients, in the gastric antrum in 5 patients, and in the cardia in 1 patient. On endoscopic ultrasound they were observed as hypoechoic tumors arising most commonly from the proper muscle layer, accompanied by hypoechoic halo and rich blood supply. In one patient in whom the tumor was located in the pylorus, endoscopic ultrasound showed mucosal break, but slight hyperecho was seen in the muscular layer. Ten patients received endoscopic treatment, of whom 6 were treated by endoscopic submucosal excavation, 3 by endoscopic full-thickness resection, and 1 by submucosal tunelling endoscopic resection. No bleeding, inflammation or infection occurred. The average follow-up time was 10.0 mo ± 1.9 mo. No recurrence or metastasis was found during follow-up.
CONCLUSION: Endoscopic ultrasonography is safe and effective in the diagnosis and treatment of gastric schwannoma.
- Citation: Huang Y, Sha QM, Li B, Wei LL, Wang CX, Liang TJ. Diagnostic and therapeutic value of endoscopic ultrasonography in gastric schwannoma. Shijie Huaren Xiaohua Zazhi 2014; 22(32): 4969-4975
- URL: https://www.wjgnet.com/1009-3079/full/v22/i32/4969.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i32.4969
胃神经鞘瘤又称雪旺细胞瘤, 是一种临床罕见的胃肠道黏膜下肿瘤, 目前对于其研究国内外多以个案报道, 而影像学文献资料较少[1]. 胃神经鞘瘤的术前诊断比较困难, 对其治疗多以手术切除为主. 本研究回顾性分析山东大学附属省立医院近4年来接受超声内镜(endoscopic ultrasonography, EUS)诊断并经手术获得病理确诊的12例胃神经鞘瘤病例资料, 旨在分析EUS对于胃神经鞘瘤的临床诊断价值和EUS指导下内镜治疗的应用价值.
搜集山东大学附属省立医院2009-03/2012-09经手术病理及免疫组织化学证实的12例胃神经鞘瘤患者的临床资料, 其中男8例, 女4例, 年龄42-78岁, 平均58.7岁±9.5岁. 主要临床表现: 消化系出血10例, 腹部包块2例, 上腹部不适7例. 胃神经鞘瘤好发于男性, 40岁以上多发, 本组12例胃神经鞘瘤患者资料与文献报道一致. 12例患者全部行EUS检查, 其中10例接受了内镜下治疗. EUS采用Olympus UE260-AL5, 使用12或20 Hz高频超声探头; GIF-Q260J治疗胃镜、GIF-2TQ260M双钳道胃镜、Olympus公司D-201-11804透明帽、NM-200L-0521注射针、SD-230U-20双螺旋圈套器、HX-610-135L止血钛夹、KD-620LR Hook刀、FD-410LR热活检钳、KD-611L IT刀.
检查前1天晚8:00开始禁食, 术前常规静推地西泮5 mg, 肌注消旋山莨菪碱10 mg. (1)先行内镜检查, 观察肿瘤大小、色泽、形态、质地、活动度、与周围组织关系等情况; (2)再行EUS检查, 将超声探头置于病变处行环形扫描, 根据管腔层次的组织学特征, 判断肿瘤在消化系壁的起源, 对病变作出EUS诊断并选择治疗方法; (3)在EUS指导下行内镜治疗, 并将切除标本行病理和免疫组织化学分析.
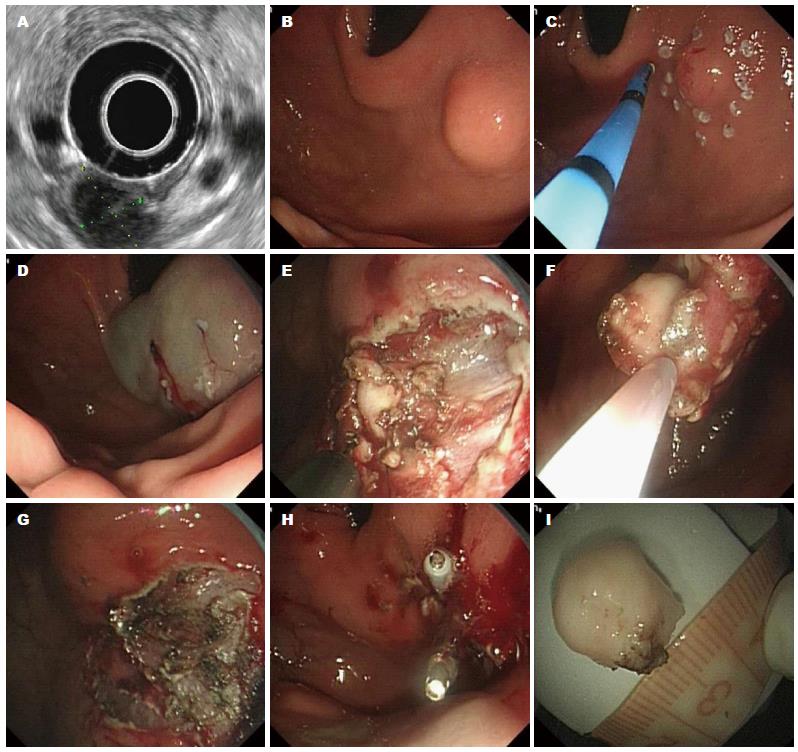
1.2.1 内镜黏膜下挖除术(endoscopic submucosal excavation, ESE): 适用于切除来源于胃壁固有肌层的病变. ESE方法: 在隆起病灶边缘外0.5 cm处电凝标记切除范围, 黏膜下注射含2 mL亚甲蓝和250 mL的甘油果糖氯化钠注射液, 使病灶黏膜充分隆起; 沿标记点预切开黏膜显露病变, 分离黏膜下层至显露瘤体. 用IT2或Hook刀沿瘤体包膜剥离病变, 在分离的过程中如果瘤体和周围组织分界不清楚, 可重复进行黏膜下注射. 经注射后颜色发蓝的即为黏膜下组织, 有肌束的则为肌层组织, 而没有任何染色的呈团块状的则为瘤体; 然后再应用IT或Hook刀切开黏膜下层, 沿病灶边缘处进行瘤体挖除, 较大病变可采用圈套器于病变根部圈套病变进行电切; 切除中和切除后应用氩离子凝固术进行预防性止血, 对于某些剥离层次较深邻近浆膜层的部位, 可给予金属钛夹止血缝合创面; 切除标本固定浸泡后行相应的免疫组织化学分析(图1).
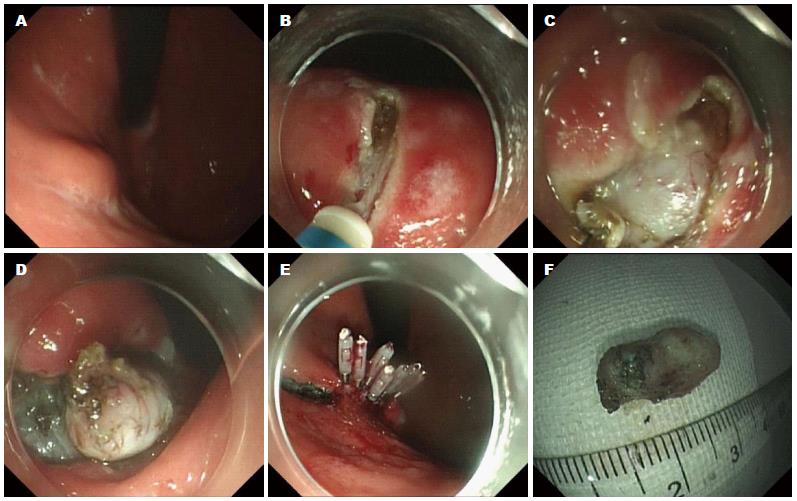
1.2.2 内镜下全层切除术(endoscopic full-thickness resection, EFR): 对于术前EUS提示病变来源层次较深, 或病变与浆膜层黏连无法分离者行EFR切除. EFR方法: 黏膜下注射使病灶充分隆起, 采用ESD技术沿肿瘤边缘分离固有肌层至浆膜层; 应用Hook、IT2刀或圈套器完整切除包括浆膜在内的肿瘤; 切除后应用热活检钳钳夹显露血管电凝止血, 清理创面, 用金属止血夹缝合封闭. 在没有切除多余的黏膜情况下, 瘤体切除后, 单纯应用钛夹即可完成创面封闭的操作. 但如果病变范围大, 黏膜切除多, 只应用钛夹可能难以夹住创面两边的黏膜. 可考虑在创面上下方各打2枚钛夹, 然后应用尼龙绳圈套钛夹, 再用金属钛夹夹闭创面; 一般情况下胃底黏膜下肿瘤的EFR操作, 应常规留置胃肠减压至术后48 h, 根据患者术后有无腹痛、腹胀、发热等情况, 来决定何时停用(图2).
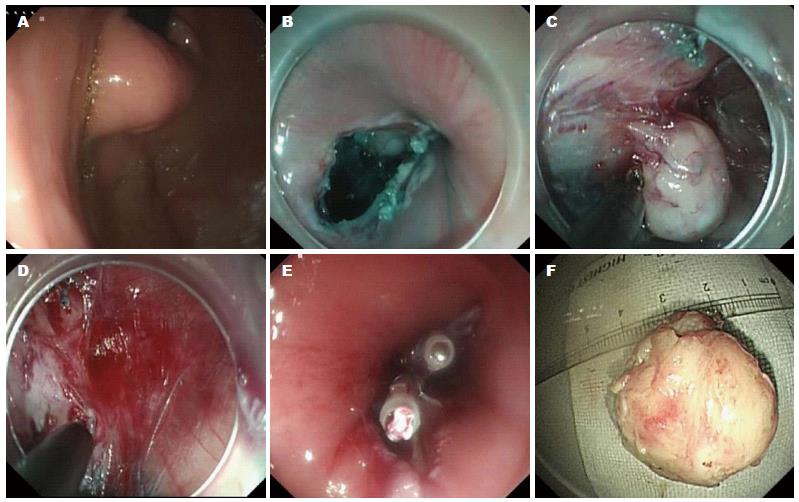
1.2.3 内镜经黏膜下隧道切除术(submucosal tunelling endoscopic resection, STER): 主要应用于食管固有肌层肿瘤的内镜切除, 对于接近胃贲门的固有肌层病变, 也可使用. 方法: 内镜寻找到肿瘤, 氩气标记; 建立黏膜下隧道, 选择距离黏膜下肿瘤近口侧直线5 cm黏膜处作为切口, 将2 mL亚甲蓝和250 mL的甘油果糖氯化钠注射液混合后黏膜下层局部注射, 使拟定切口的黏膜层尽可能隆起, 以最大限度避免切开时肌层的损伤; 用Hook刀纵形切开黏膜, 逐步分离黏膜下层及肌层, 使在两层之间形成一纵行隧道, 隧道口尽可能的宽松, 以免操作时隧道内气体不易排出而导致隧道内压力过高, 气体通过肌层进入纵膈, 引起皮下气肿或气胸; 肿瘤切除后, 应用热活检钳处理瘤床的出血灶和可疑裸露的小动脉, 避免迟发型出血; 最后观察有无黏膜破损, 若有, 给予钛夹封闭, 保持病变周围黏膜的完整性, 否则隧道将失去意义(图3).
12例患者行EUS检查, 其中10例患者超声下主要表现为起源于胃壁固有肌层的圆形或椭圆形低回声团块, 直径约2-30 mm, 边界清晰, 肿块内部多为实质性回声, 回声均匀, 边缘可见低回声晕环, 内部血流丰富. 当肿瘤内部发生玻璃样变时, 可出现不均匀回声. 肿瘤较大时, 内部易发生出血坏死, 并伴有囊性改变, 且向浆膜下生长, 本组1例患者超声下表现为起源于肌层的低回声团块, 大小约20 mm, 边界不清, 回声欠均匀, 伴囊性改变, 并向浆膜下浸润. 肿瘤较大时与肝左叶重叠, 超声易误诊为肝左叶囊性肿瘤, 所以超声检查在上腹部发现肿瘤时, 应饮水观察其来源, 避免误诊. 胃神经鞘瘤表面黏膜常因供血不足发生溃疡, 本组1例患者胃神经鞘瘤位于幽门肌层, 表面黏膜有溃疡糜烂, 肿瘤大小13 mm×9 mm, 由于在幽门口处造成幽门梗阻, 超声图像表现为黏膜中断, 但肌层可见实质性略强回声, 与单纯溃疡超声表现不尽相同.
本组胃神经鞘瘤多为半球形或圆形, 少数为分叶状或不规则形; 肿瘤大小约2-30 mm, 平均12.8 mm, 其中直径≤10 mm者7例, >10 mm者5例; 大部分患者胃镜下观察胃黏膜光滑, 色泽正常, 无黏膜白斑, 肿瘤呈外生性生长, 质地韧, 边界较清, 包膜完整, 活动度好, 与周围组织无黏连, 无腹膜肿瘤转移灶, 其中表面黏膜形成"桥形皱襞"典型表现者7例, 伴有溃疡者1例, 溃疡深度1 mm, 边缘处有充血水肿.
所有手术患者术前禁食, 排空胃肠道, 根据EUS声像图像判断肿瘤在消化系管壁的起源部位和大小, 选择合适的内镜治疗方法. 为预防术后出血和穿孔, 术前我们一般在肿瘤基底黏膜下充分注射使肿瘤明显托起(即抬举征阳性), 术后和术中应用氩离子凝固术(argon plasma coagulation, APC)或金属钛夹夹闭创面. 12例胃神经鞘瘤患者, 其中4例胃体和2例胃窦患者在内镜下行ESE, 2例位于胃体和1例位于胃窦者行EFR治疗, 1例临近贲门处患者行STER. 10例患者在内镜下完整切除, 2例患者因病灶较深, 内镜无法完全切除, 后转外科手术治疗. 病灶长约2-30 mm, 平均12.8 mm±9.2 mm. 术后禁食, 常规使用抗生素及止血药物, 观察患者腹胀情况. 术后3-6 mo复查胃镜了解创面愈合情况. 所有病例术后均未出现胃出血、腹膜炎、感染等并发症.
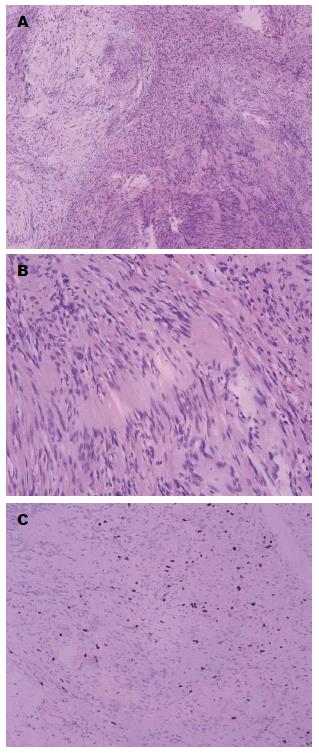
胃神经鞘瘤主要由梭形细胞组成, 多排列为栅栏状, HE染色胞质淡嗜红色, 细胞核可有一定异形性, 核分裂相少见. 外周淋巴细胞套及生发中心形成具有一定特异性, 间质血管较丰富, 散在淋巴细胞浸润. 免疫组织化学: S-100细胞核、细胞质弥漫性(++)、胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)(+)、CD117(-)、CD34(-)、平滑肌肌动蛋白(smooth muscle actin, SMA)(-)、Dog-1(-)、Desmin(-)、Ki-67(+)(<5%)(图4).
胃神经鞘瘤起源于胃壁神经丛的雪旺氏细胞, 又称为雪旺细胞肿瘤, 主要由神经外胚层的Schwann细胞和中胚层的神经内膜组成[2], 临床上属于胃肠道间叶源性肿瘤, 是一种消化系黏膜下隆起性病变, 好发于头颈、 四肢、脊柱等较大神经干, 在消化系中很罕见, 只占胃肿瘤的0.2%[3]. 临床上胃神经鞘瘤的好发部位主要在胃体, 其次是胃窦及胃底. 该肿瘤生长缓慢, 初期症状不明显无特异性[4], 随着肿瘤逐渐生长可以出现上腹部胀痛、消化系出血、呕血、黑便等症状, 与消化性溃疡难以区别, 肿瘤较大时可在上腹部触及肿块.
胃神经鞘瘤的术前确诊较为困难, 普通内镜很难诊断肿瘤的起源、大小和组织学特征, EUS的出现为他的诊断提供了全新的方法. EUS与普通内镜相比, 不仅能观察消化系黏膜表面, 还能准确获得病变来源的消化系管腔层次特征及与临近脏器关系的图像, 根据病变所在管壁层次及其超声特点, 可以对肿瘤组织来源做出大致判断, 这对疾病的鉴别、治疗方案的选择以及预后判断具有重要的指导意义.
EUS可见胃壁由内向外分为的五层: 黏膜层、黏膜肌层、黏膜下层、固有肌层、浆膜层, 超声声像分别表现为高-低-高-低-高回声. 胃神经鞘瘤的EUS显示为起源于固有肌层的圆形或椭圆形的低回声均质团块[5], 回声较相邻肌层明显减弱, 边缘可有低回声晕环表现. 本研究中, 1例肿瘤位于胃体患者术前诊断为胃神经内分泌瘤, 1例胃窦患者诊断为胃平滑肌瘤, 1例诊断为异位胰腺, 另有2例诊断为间质瘤, 其余7例EUS提示病灶起源层次情况与术后实际情况完全一致, EUS诊断与术后病理结果的一致性为58.3%(7/12), 此数值高于一般的文献报道, 可能与本组病例数较少有关. 术后10例患者免疫组织化学提示S-100(++)、CD117(-)、CD34(-)是胃神经鞘瘤的重要病理学特征.
胃黏膜下肿瘤的鉴别诊断是非常困难的[6]. 胃间质瘤是最常见的胃肠道肿瘤, 最近的研究中发现, 他表现出高度恶变的倾向[7]. 但是胃肠道神经鞘瘤却大多是良性的, 并很少表现出症状. 胃神经鞘瘤与胃肠道间质瘤、平滑肌瘤、平滑肌肉瘤和其他消化系肿瘤均可出现类似内镜下表现[8]. 因此, 对胃神经鞘瘤和其他良恶性间质肿瘤进行对比是十分必要的. 胃间质瘤和平滑肌瘤是最常见的两种胃黏膜下肿瘤, 前者来源于固有肌层的胃间叶组织, 具有恶变潜能[9], 并与肿瘤直径的大小呈显著相关[10]. 胃神经鞘瘤超声回声表现为均匀低回声信号, 但相比良恶性胃肠道间质瘤等其他固有肌层略高, 胃神经鞘瘤常有晕环, 边缘多整齐, 生长不浸润, 分叶、囊肿及钙化较少见, 而良性胃肠道间质瘤一般无晕环, 且囊肿多见. 胃神经鞘瘤瘤体与胃壁相连部以外的管壁结构层次正常, 与外生性胃腺癌不同, 肿块周围胃壁黏膜常增厚, 本组病例EUS所见和病理均证实这一点, 神经鞘瘤与平滑肌源性、神经源性肿瘤在影像学上表现极为相似, 难以鉴别, 确诊只有靠病理学检查.
胃神经鞘瘤良性多于恶性, 但从病变生长层次、术中情况和术后随访来看, 胃神经鞘瘤有恶变可能, 因此不论其良性或者恶性肿瘤, 一经诊断, 应切除治疗[11]. ESE、EFR和STER具有操作简便, 创伤小, 花费少, 恢复快等特点, 并可以为病理组织活检提供较为完整的病变组织, 是目前胃神经鞘瘤的首选切除方法[12,13]. ESE和EFR两种技术的区别在于: EFR往往采用主动的穿孔来切除包括部分浆膜层在内的病变, 在切除病变之前, 需吸尽胃腔内残余的液体, 另外切下标本要及时取出, 避免脱落入腹腔瘤体种植转移. 操作术中注意保护瘤体及包膜的完整性, 及时止血. 对于胃底-贲门的黏膜下肿瘤, 因病变越临近贲门越需采用反转内镜技术[14], 镜身的操作角度难以掌控, 且病变位于固有肌层, 穿孔的风险极大; 一旦发生穿孔, 内镜下封闭创面的可能性极小, 故该解剖部位固有肌层黏膜下肿瘤的内镜治疗一直被认为是内镜手术的"禁区"[15]. STER技术创新之处在于利用消化系黏膜和固有肌层之间的隧道空间进行操作, 最大限度的保留消化系黏膜组织, 既能完整切除肿瘤, 又可以避免或极大地降低消化系瘘的发生[16]. 因此只要严格控制好手术指征, ESE、EFR或STER可安全有效地切除消化系黏膜及黏膜下病变.
总之, 胃神经鞘瘤是罕见的胃良性间叶肿瘤. 临床中特别需要与胃部肿瘤相鉴别, 特别是胃肠道间质瘤. 胃神经鞘瘤EUS下的特点是多样的, 但是, 多数表现为起源于固有肌层的均匀的低回声信号, 边缘整齐, 缺乏囊性变和钙化. 以上要点均有助于EUS对胃神经鞘瘤的诊断, 但超声下的晕环表现和内镜下的"桥形皱襞"表现在诊断中更具有特异性, 临床资料证明EUS指导的内镜下切除技术对治疗胃神经鞘瘤是安全有效的, 在实际工作中我们应根据具体情况选择具体方法, 积极处理, 减少术后并发症和后遗症.
胃神经鞘瘤是临床罕见的消化系肿瘤, 迄今, 有诸多辅助检查方法用于胃神经鞘瘤的诊断, 例如: 组织活检行病理检查及免疫组织化学检查、消化系内窥镜检查、钡剂、计算机断层扫描、磁共振成像、B超等. 对于胃神经鞘瘤的治疗以往都以外科手术为主, 近年来随着内镜技术的发展, 根据肿瘤大小、色泽、形态、质地、活动度及与周围组织关系等选择合适的内镜下切除方法逐渐成为治疗消化系黏膜下病变的首选方法.
毛高平, 教授, 中国人民解放军空军总医院
胃神经鞘瘤有恶变可能, 且其对放射治疗、化学药物治疗等效果差, 所以临床上无论良恶性, 一旦确诊, 均应首先考虑手术切除. 目前临床上外科应用腹腔镜技术, 辅以内窥镜治疗方法, 内科则主要采用内镜为主, 腹腔镜为辅, 必要时修补的方式.
Bona、Kakushima及Xu等专家曾报道, 对于胃底-贲门的黏膜下肿瘤, 内镜下切除操作困难, 病变越临近贲门越需采用反转内镜技术, 镜身的操作角度较难掌控, 穿孔的风险大, 而穿孔后内镜下封闭创面的可能性小, 故该解剖部位的固有肌层肿瘤的内镜治疗一直被认为是手术的难点和禁区.
本文将超声诊断和内镜治疗结合在一起, 利用超声内镜(endoscopic ultrasonography, EUS)的特殊功能对胃神经鞘瘤的诊断及内镜下手术治疗方式的选择提供指导作用. 胃神经鞘瘤临床少见, 对其研究及报告甚少.
目前内镜联合腹腔镜治疗消化系黏膜下病变开展较少, 但二者联合可扩大适应症范围, 避免仅局限于治疗较小病变, 且腹腔镜联合内镜可降低单独内镜治疗时出血和穿孔的风险, 大大提高了临床治疗的安全性, 对于临床治疗黏膜下隆起性病变有较大实际意义及临床价值.
超声内镜(EUS): 是将内镜和超声相结合的消化系检查技术, 将微型高频超声探头安置在内镜顶端, 当内镜插入体腔后, 利用内镜下的超声行实时扫描, 不仅能观察消化系黏膜表面病变, 还能准确获得病变来源的消化系管腔层次特征及与临近脏器关系的图像, 根据病变所在管壁层次及其超声特点, 可以对肿瘤来源做出大致判断.
本文对12例胃神经鞘瘤患者的资料进行了回顾总结分析, 尤其通过对EUS影像特点的总结, 提出了EUS对该病的诊断价值, 具有一定的临床应用意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Hong SW, Cho WY, Kim JO, Chun CG, Shim KY, Bok GH, Um WH, Lee JE. Gastric schwannoma diagnosed by endoscopic ultrasonography-guided trucut biopsy. Clin Endosc. 2013;46:284-287. [PubMed] [DOI] |
| 2. | Zheng L, Wu X, Kreis ME, Yu Z, Feng L, Chen C, Xu B, Bu Z, Li Z, Ji J. Clinicopathological and immunohistochemical characterisation of gastric schwannomas in 29 cases. Gastroenterol Res Pract. 2014;2014:202960. [PubMed] [DOI] |
| 5. | Zhong DD, Wang CH, Xu JH, Chen MY, Cai JT. Endoscopic ultrasound features of gastric schwannomas with radiological correlation: a case series report. World J Gastroenterol. 2012;18:7397-7401. [PubMed] [DOI] |
| 6. | Alvarez JF, Ben-David K. Gastric schwannoma: a rare find. J Gastrointest Surg. 2013;17:2179-2181. [PubMed] [DOI] |
| 7. | 沈 赢政, 文 军, 何 新卫. 胃神经鞘瘤1例报道. 中国普外基础与临床杂志. 2012;19:232-232. |
| 9. | Lee IL, Lin PY, Tung SY, Shen CH, Wei KL, Wu CS. Endoscopic submucosal dissection for the treatment of intraluminal gastric subepithelial tumors originating from the muscularis propria layer. Endoscopy. 2006;38:1024-1028. [PubMed] [DOI] |
| 10. | Fletcher CD, Berman JJ, Corless C, Gorstein F, Lasota J, Longley BJ, Miettinen M, O'Leary TJ, Remotti H, Rubin BP. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Int J Surg Pathol. 2002;10:81-89. [PubMed] [DOI] |
| 12. | Zhou PH, Yao LQ, Qin XY, Cai MY, Xu MD, Zhong YS, Chen WF, Zhang YQ, Qin WZ, Hu JW. Endoscopic full-thickness resection without laparoscopic assistance for gastric submucosal tumors originated from the muscularis propria. Surg Endosc. 2011;25:2926-2931. [PubMed] [DOI] |
| 13. | Wang L, Ren W, Fan CQ, Li YH, Zhang X, Yu J, Zhao GC, Zhao XY. Full-thickness endoscopic resection of nonintracavitary gastric stromal tumors: a novel approach. Surg Endosc. 2011;25:641-647. [PubMed] [DOI] |
| 14. | Bona D, Aiolfi A, Siboni S, Bernardi D, Bonavina L. Giant leiomyoma of the gastroesophageal junction: technique and results of endoscopic full-thickness resection. Clin Exp Gastroenterol. 2011;4:263-267. [PubMed] [DOI] |
| 15. | Kakushima N, Yahagi N, Fujishiro M, Kodashima S, Nakamura M, Omata M. Efficacy and safety of endoscopic submucosal dissection for tumors of the esophagogastric junction. Endoscopy. 2006;38:170-174. [PubMed] [DOI] |
| 16. | Xu MD, Cai MY, Zhou PH, Qin XY, Zhong YS, Chen WF, Hu JW, Zhang YQ, Ma LL, Qin WZ. Submucosal tunneling endoscopic resection: a new technique for treating upper GI submucosal tumors originating from the muscularis propria layer (with videos). Gastrointest Endosc. 2012;75:195-199. [PubMed] [DOI] |