修回日期: 2014-09-19
接受日期: 2014-09-30
在线出版日期: 2014-11-18
目的: 了解内镜下黏膜切除术(endoscopic mucosal resection, EMR)及内镜下黏膜下剥离术(endoscopic submucosal dissection, ESD)对胃和食道早癌及癌前病变可行性、安全性及疗效.
方法: 2011-03/2014-06行胃镜及病理活检诊断为胃和食道早癌及癌前病变或术后病理明确, 行内镜下治疗患者共93例, 分为ESD治疗组(n = 61)和EMR治疗组(n = 32). 通过手术时间、病变的大小、整片切除率及手术并发症和术后复发情况, 对两者进行比较.
结果: 两组的年龄、病变大小无统计学差异. ESD组时间明显大于EMR组. ESD组的整片切除率大于EMR组. ESD组有5例术中出血, EMR组有1例术中出血, 均无迟发性出血. ESD组有1例穿孔, EMR组无穿孔. 两组出血及穿孔均无明显差异(P>0.05). 术后随访3-42 mo, ESD组0例复发(0.0%), EMR组4例复发(12.5%), 两组均无死亡病例.
结论: ESD有更高的整片切除率及长期随访中有更低的复发率. 两组出血及穿孔并发症无显著差异, 且均在可控制范围内. 在条件容许条件下, 优先选择ESD.
核心提示: 2011-03/2014-06行胃镜及病理活检诊断为胃和食道早癌及癌前病变或术后病理明确, 行内镜下治疗患者共93例, 分为内镜下黏膜下剥离术(endoscopic submucosal dissection, ESD)治疗组(n = 61)和内镜下黏膜切除术(endoscopic mucosal resection, EMR)治疗组(n = 32). 通过手术时间、病变的大小、整片切除率、及手术并发症和术后复发情况, 对两者进行比较. 了解EMR及ESD对胃和食道早癌及癌前病变可行性、安全性及疗效.
引文著录: 梅雪灿, 孙斌, 许建明, 孔德润. 胃和食道早癌及癌前病变的内镜下黏膜切除术及黏膜下剥离术的临床疗效. 世界华人消化杂志 2014; 22(32): 4954-4959
Revised: September 19, 2014
Accepted: September 30, 2014
Published online: November 18, 2014
AIM: To evaluate the feasibility, safety and efficacy of endoscopic mucosal resection (EMR) vs endoscopic submucosal dissection (ESD) for early gastric and esophageal cancer and precancerous lesions.
METHODS: A retrospective analysis was performed of 93 patients with early gastric/esophageal cancer or precancerous lesions who were endoscopically and pathologically diagnosed and managed by ESD or EMR at our hospital from March 2011 to June 2014. The patients were divided into either an ESD group (61 patients) or an EMR group (32 patients). The operative time, size of the lesion, en bloc resection rate, surgical complications and postoperative recurrence were compared for the two groups to evaluate their feasibility, safety and efficacy.
RESULTS: There was no significant difference in age or lesion size between the two groups. The en bloc rate was significantly higher in the ESD group than in the EMR resection (91.8% vs 56.3%, P < 0.05). There are five cases of bleeding in the ESD group and one in the EMR group, and no delayed bleeding occurred in either group. There was only one case of perforation, which occurred in the ESD group. During the 3-42-month postoperative follow-up, there was no recurrence in the ESD group, but four cases of recurrence occurred in the EMR group.
CONCLUSION: Compared with EMR for early gastric and esophageal cancer and precancerous lesions, ESD shows considerable advantages regarding en bloc resection rate and local recurrence, although there is no significant difference in bleeding or perforation.
- Citation: Mei XC, Sun B, Xu JM, Kong DR. Clinical effects of endoscopic submucosal dissection vs endoscopic mucosal resection for early gastric and esophageal cancer and precancerous lesions. Shijie Huaren Xiaohua Zazhi 2014; 22(32): 4954-4959
- URL: https://www.wjgnet.com/1009-3079/full/v22/i32/4954.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i32.4954
胃食道肿瘤是我国仅次于肺癌的常见的肿瘤, 因胃食道癌早期常无明显症状, 早癌的诊断较困难. 但随着染色内镜、超声内镜、放大内镜及窄带成像技术(narrow band imaging, NBI)的发展, 上消化道早癌及癌前病变的诊治率得到很大提高, 尤其在日本胃癌的5年生存率可达到90%[1]. 随着胃食道早癌的诊断率提高, 相较于外科手术, 有花费少及术后生活治疗提高等优点, 内镜下黏膜切除术(endoscopic mucosal resection, EMR)最先在日本使用, 被用于大片活检, 后来用于消化系癌前状态诊治. 因EMR切除表浅, 且对于直径>2 mm的较大病灶时, EMR的整片切除率将会下降, 影响术后复发率. 在此基础上内镜下黏膜下剥离术(endoscopic submucosal dissection, ESD)被应用, ESD在整片切除率高及术后复发率低等方面优于EMR, 但其对于手术者的技术熟练程度、手术时间、手术条件均有要求, 对于出血、穿孔等并发症的比较仍存在争议[2,3]. 本实验主要对两者的术后复发进行观察.
2011-03/2014-06入住安徽医科大学第一附属医院, 行胃镜及病理检查或术后病理诊断为胃食道癌前病变及早癌明确, 符合内镜下治疗适应症, 自愿签署知情同意后行内镜下治疗的98例患者, 其中3例患者失访, 1例患者行ESD术后1 wk因心理因素行外科手术治疗, 1例患者因ESD术中见肌层受累行外科手术治疗, 共有93例患者(ESD 61例, EMR 32例). 93例患者中68例患者行超声内镜检查明确病灶局限于黏膜及黏膜下浅层, 肌层未被侵犯. 22例行染色内镜、窄带呈像及放大内镜. ESD患者61例(病灶61个), 23个病灶位于食道, 38个病灶位于胃部; 其中男48例, 女13例; 年龄41-88岁, 平均年龄为58岁. EMR患者32例(病灶32个), 13个病灶位于食道, 19个病例位于胃部; 其中男19例, 女13例; 年龄39-73岁, 平均年龄为57岁. Olympus GIF-Q260J电子胃镜, EU-M2000内镜超声系统.
1.2.1 术前准备及术中管理: (l)术前准备: 查血常规、止凝血时间、心电图等, 终止抗血小板聚集或抗凝药数日(5 d); 术前签署知情同意书; 治疗当日禁食; (2)术中管理: 气管插管, 全身静脉麻醉; 心电监护, 血氧饱和度检测.
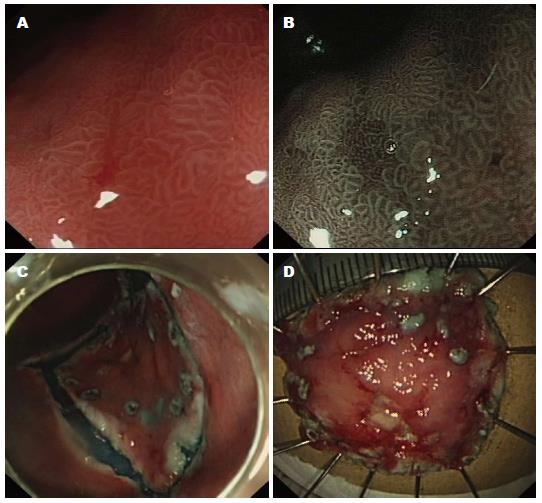
1.2.2 操作: (1)确定病灶范围: 根据常规内镜结合染色内镜、放大内镜(图1A)及NBI(图1B)检查, 确定病灶范围; (2)标记: 距病灶边缘3-5 mm处行电凝标记(图1C); (3)黏膜下注射: 黏膜下多点注射甘油果糖+靛胭脂+0.01%肾上腺素, 使病灶充分抬举; (4)切除: EMR在充分抬举后, 可使用局部注射肾上腺素切除术、透明帽法或内镜下套扎法. 透明帽法将专用圈套器至于透明帽凹槽内, 将透明帽至于病灶近端, 充分吸引, 将病灶吸引至透明帽内, 收紧圈套器, 高频电切除. 若一次无法完整切除, 则行内镜下黏膜分片切除术(endoscopic piecemeal mucosal resection, EPMR), 沿着病灶一侧多次切除, 至病灶完全切除. ESD在充分抬举后, 在标记点外侧缘使用IT刀、勾刀或黏膜切除刀切开病变周围部分黏膜, 术中可反复抬举, 逐渐剥离至病变部位完全脱落, 若遇到剥离困难的病变, 为预防出现严重并发症, 可分块剥离切除病变部位(图1D); (5)术中及术后并发症的处理: 出血、穿孔及术后狭窄, 并给予相应对症处理[3].
1.2.3 标本处理: 术后展开标本, 测量大小直径及数目, 然后中性甲醛固定后送检病理.
1.2.4 术后随访: 术后1、4、12 mo随访病理, 后每年1次定期行常规内镜及病理检查, 必要时行染色内镜、放大内镜和NBI.
统计学处理 采用SPSS17.0软件进行数据分析, 计量资料使用t检验, 计数资料使用χ2检验及相关性分析, P<0.05为差异有统计学意义.
ESD组病变直径范围为0.8-5.0 cm, 平均直径为3.1 cm; EMR组(包括行EPMR患者)病变直径范围为0.5-5.0 cm, 平均直径为2.1 cm, 其中EMR的18例病灶平均直径为1.4 cm; 1次切除无法完成行EPMR的14例病灶平均直径为3.0 cm. EMR整块切除病例平均直径与未整片切除病例及ESD组的平均直径均有差异, 后两者间无显著差异. ESD组手术时间为25-120 min, 平均手术时间为71 min; EMR组平均手术时间为5-45 min, 平均手术时间为23 min, 两者差异有统计学意义(P<0.05). ESD组的整片切除率为91.8%(56/61), EMR组的整片切除率为56.3%(18/32), 两者差异有统计学意义(P<0.05)(表1).
| 项目 | ESD | EMR | P值 |
| 年龄(岁) | 58 | 57 | >0.05 |
| 性别(男/女) | 48/13 | 19/13 | <0.05 |
| 病变大小(cm) | 3.1 | 2.1 | <0.05 |
| 病变部位(食道/胃) | 23/38 | 13/19 | >0.05 |
| 手术时间(min) | 71 | 23 | <0.05 |
| 整片切除 | 56 | 18 | <0.05 |
| 术后病理 | >0.05 | ||
| 低级别上皮内瘤变 | 25 | 18 | |
| 高级别上皮内瘤变 | 22 | 12 | |
| 早癌 | 14 | 2 | |
| 并发症 | >0.05 | ||
| 出血 | 5 | 1 | |
| 穿孔 | 1 | 0 | |
| 中位随访时间(mo) | 10 | 25 | |
| 术后复发 | 0 | 4 | <0.05 |
ESD组术中出血发生率为8.1%(5/61), 所有病例均在行氩离子凝固术(argon plasma coagulation, APC)或钛夹夹闭后出血停止, EMR组术中出血率为3.1%(1/32), 两者差异无统计学意义. ESD组手术患者穿孔发生率为1.6%(1/61), 在禁食、抗感染、抑酸等内科保守治疗下好转后出院. 穿孔患者术后病理提示为高级别上皮内瘤变, 直径为3.5 cm, 位于胃食道交界处. 两者均无术后出血及穿孔. EMR未见穿孔, 两者穿孔无明显差异(P>0.05). 另其中一例ESD组患者, 在术后出现胸闷不适, 行胸部CT见两侧胸腔积液, 考虑为反应性胸膜炎可能.
ESD组患者的术后病理提示为低级别上皮内瘤变25例, 高级别上皮内瘤变22例, 14例提示为早癌(10例局限于黏膜层, 4例侵及黏膜下层). EMR患者术后病理提示低级别上皮内瘤变18例, 高级别上皮内瘤变12例, 早癌为2例.
93例患者, 术后随访3-42 mo, 中位时间为14 mo, 其中19例患者随访超过24 mo, ESD组未见复发病例, EMR组有4例患者复发, 复发率为12.5%. 4例患者均未完成整片切除, 1例术后1 mo病理提示为重度不典型增生, 行外科手术; 1例术后4 mo提示为早癌不能排除行外科手术; 1例患者术后8 mo随访提示为局部高度不典型增生; 1例后11 mo病理提示高度不典型增生, 平均复发时间为6 mo. 均无死亡病例. EMR的复发率高于ESD组, 两者差异有统计学意义(P<0.05)(表2).
| 因素 | 局部复发率 | P值 |
| 手术方式 | <0.05 | |
| ESD | 0/61 | |
| EMR | 0/18 | |
| EPMR | 4/14 | |
| 整片切除 | <0.05 | |
| 是 | 0/74 | |
| 否 | 4/19 | |
| 病变大小(cm) | >0.05 | |
| ≥2 | 4/66 | |
| <2 | 0/27 | |
| 病理类型 | >0.05 | |
| 低级别上皮内瘤变 | 0/43 | |
| 高级别上皮内瘤变 | 3/34 | |
| 早癌 | 1/16 |
随着消化系早癌诊断率的升高, 因局限于黏膜及黏膜下层的胃及食道早癌及癌前病变, 淋巴结转移风险小, 内镜下治疗治愈率高, 内镜下治疗被广泛应用在消化系早癌[4]. 内镜下治疗相较外科手术可减少住院时间及费用, 以及更少病死率等优势. 在1998年, 日本就有近一半胃食道早癌患者选择使用内镜下治疗, 当然这和内镜技术的发有必然的关系. 在韩国也进行了大样本的内镜下治疗与外科手术对比的长期的随访, 内镜下治疗被推荐使用, 尤其是老年人及心肺功能不全不能耐受手术的患者[5]. 随着病灶的增大, EMR术后复发的增加, ESD及整片切除被提出来. 本研究中, ESD组的整片切除率大于EMR组, 对于两者平均直径无统计学意义. 日本的Ishihara等[6]也对于ESD和EMR及透明帽内镜下黏膜切除术(EMR with cap, EMRC)对于<5 mm、5-10 mm、10-15 mm及>15 mm的病灶的整片切除率进行比较. 显示<10 mm的病灶, 三者整片切除率相当, 无明显差异. 对于>10 mm病灶, 且随着病灶越大, ESD的整片切除率明显高于EMRC及EMR组, 其中EMRC组也高于EMR组. 不仅日本和韩国内镜下治疗越发普遍, 在西方国家和我国的应用也越来越多. 我国徐国良等[7]也进行了49例EMR及22例ESD对比的相关报道.
本实验中EMR组的复发率(12.5%)高于ESD组(0%). 而在EMR组中复发患者均为未整块切除的EPMR组患者. 且EMR组随访中位时间为25 mo, 其中4例复发病例平均6 mo内复发, 最早一例为术后1 mo, 复发快. 通常对于>2 cm的肿瘤, EMR将无法行整片切除, 因ESD对技术及设备要求高, 且相对手术时间长及术后并发症增多等因素, 很多手术者选择了EPMR. 然而因分片切除无法判断病理的完整性, 对切除交界部位的深度无法很好的控制, 造成术后复发的增多. 本研究中4例复发病例均≥2 cm, 且随着病灶越大, EMR的分片切除会越多, 无法确定切缘是否达到组织学治愈性切除[8]. 分片的数目增加、病变的深度增加, 边缘及垂直面仍存在病变, 将会导致术后复发率增大[9]. 因此对于较大病灶EMR无法完成整块切除时, 尽量选择ESD术, 而不是EPMR术. 相对于<20 mm的病灶, 有日本学者提出ESD的整片切除率大于EMR组, 即使加用透明帽后, ESD组仍高于使用EMRC组, 且两者的并发症无明显差异[6]. 行EMR术后容易出现黏膜下纤维化, 再次行ESD治疗, 不利于黏膜抬举, 将增加手术难度及风险[10]. 对于减少术后复发, ESD组相较EMR组具有明显优势. 两者术后定期随访胃镜均是必要的.
本研究中两组并发症出血及穿孔均无明显差异. ESD组出血病率为8.1%(5/61), EMR组3.1%(1/32), 均为术中出血, 且在电凝止血及钛夹夹闭后均停止出血. 因ESD是在黏膜下面积大, 贲门及食道部血供丰富, 出血难免发生. 两者在术中及术后出血是否有区别仍存在争议[11,12], 但ESD的出血均可在电凝止血、钛夹封闭后止血, 术后使用质子泵抑制剂可预防出血, 需要外科手术及死亡病例均较少发生[13]. ESD组穿孔率为1.6%(1/61)大于EMR组0.0%(0/32). Takahashi等[14]对食道穿孔的独立危险因素进行分析, 位于食道下段及胃食道交界处的5 cm内早癌容易穿孔, 范围广及侵润程度深也可增加穿孔风险. 本例患者早癌直径为3.5 cm, 位于胃食道交界处, 术后病理为高级别上皮内瘤变, 且术中出现黏连和抬举困难. 也有相关文献报道, 虽ESD的穿孔发生率高于EMR, 但在透明帽、KF刀、HOOK刀等设备的改进后, 在食道早癌的隧道技术的应用下, 及在提高操作者的熟练程度及内镜操作技巧后, 均可减少穿孔发生率[15]. 穿孔的发生会延长手术时间及住院时间, 但若术前肠道准备充分, 术中使用易吸收的二氧化碳气体, 穿孔较小, 大部分的穿孔病例钛夹可以夹闭, 且予以术后禁食, 抗感染及质子泵抑制剂等的治疗, 可减少外科手术的发生. 另1例患者病灶位于食道下段, 大小约4.0 cm, 术后病理为早癌, 侵犯深度达黏膜下层, 在术后出现胸闷, 行胸部CT提示双侧胸腔积液(术前双肺未见明显异常), 且不伴有发热、血象升高等感染征象, 考虑为反应性胸膜炎可能, 予以对症治疗后好转出院.
对于操作时间, ESD(71 min)显著大于EMR组(23 min), 因ESD组的病灶范围较大, 且其操作过程繁琐, 操作技巧要求高, 治疗相关并发症导致耗时增加, 导致其手术时间必然较EMR延长. 对于<20 mm的病灶, ESD组整片切除率更高, 且两者手术时间, 出血率及穿孔率并无明显差异[5]. 对于较大病灶, 在气管插管全麻下进行手术, 可减少其因手术时间延长而造成的患者耐受性下降和气道分泌物增多引起窒息风险增加[16].
总之, ESD和EMR均可用于胃食道早癌及癌前病变. 于EMR相比, ESD可切除病灶范围大, 整片切除率高, 术后复发率低. 对于并发症大多在可控范围内, 且在提高技术水平、操作熟练程度及手术工具和设备后可降低并发症的发生. ESD在应用中有更大的优势.
胃食道肿瘤是我国仅次于肺癌的常见的肿瘤, 胃食道早癌的诊断较困难, 但随着染色内镜、超声内镜、放大内镜及窄带成像技术的发展, 其诊治率得到很大提高. 内镜下黏膜切除术(endoscopic mucosal resection, EMR)及内镜下黏膜下剥离术(endoscopic submucosal dissection, ESD)展现了其极大的应用价值及范围. 本文主要就两者的疗效、安全性及术后随访进行分析.
喻春钊, 教授, 主任医师, 南京医科大学第二附属医院普通外科九区
为了降低内镜下黏膜切除术的操作难度及减少并发症的发生, 越来越多的手术工具及手术方式被使用, 如IT刀、KF刀、Hook刀、多角度弯曲双通道内镜和小探头超声标记等. 对于食道肿瘤及胃贲门食道交界处肿瘤, 内镜下隧道技术也被引用. 相信在不久的将来, 越来越多的工具及手术方式会涌现出来.
韩国的Chung等通过长时间大样本的资料回顾分析, 阐述了内镜下治疗相较于外科治疗的优势. 日本的Ishihara等也对于ESD和EMR及透明帽内镜下黏膜切除术, 对于<5 mm、5-10 mm、10-15 mm、>15 mm的病灶的整片切除率进行比较. 显示ESD组整片切除率高的明显优势. 日本的Wen等对于内镜下黏膜分片切除术的术后复发危险因素进行分析, 其中分片的数目增加、病变的深度增加, 边缘及垂直面仍存在病变, 将会导致术后复发率增大. Park和Lian的分别的2篇Meta分析对ESD及EMR的术后并发症进行对比, ESD的穿孔率高于EMR, 但大多在内科保守治疗中可好转, 二次手术几率小.
本文章主要对行ESD和EMR的93病例患者术后随访3-42 mo, 统计其复发情况与手术方式的选择, 病变大小的相关关系, 了解术中及术后两者并发症的对比与处理.
本文章主要对行ESD和EMR的患者的病变大小, 手术并发症及术后随访进行比较, 并分析术后复发相关因素. 因ESD有更高的整片切除率及长期随访中有更低的复发率. 两组出血及穿孔并发症无显著差异, 且均在可控制范围内. 在条件容许条件下, 优先选择ESD.
本文为回顾性研究, 非随机对照试验, 病例数也较少, 可读性一般, 但讨论理论分明, 有系统的理论分析, 对临床有一定的指导意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Min YW, Min BH, Lee JH, Kim JJ. Endoscopic treatment for early gastric cancer. World J Gastroenterol. 2014;20:4566-4573. [PubMed] |
| 2. | Terasaki M, Tanaka S, Oka S, Nakadoi K, Takata S, Kanao H, Yoshida S, Chayama K. Clinical outcomes of endoscopic submucosal dissection and endoscopic mucosal resection for laterally spreading tumors larger than 20 mm. J Gastroenterol Hepatol. 2012;27:734-740. [PubMed] [DOI] |
| 3. | Isomoto H, Yamaguchi N, Minami H, Nakao K. Management of complications associated with endoscopic submucosal dissection/ endoscopic mucosal resection for esophageal cancer. Dig Endosc. 2013;25 Suppl 1:29-38. [PubMed] [DOI] |
| 4. | Katada C, Muto M, Tanabe S, Higuchi K, Sasaki T, Azuma M, Ishido K, Masaki T, Nakayama M, Okamoto M. Surveillance after endoscopic mucosal resection or endoscopic submucosal dissection for esophageal squamous cell carcinoma. Dig Endosc. 2013;25 Suppl 1:39-43. [PubMed] [DOI] |
| 5. | Chung MW, Jeong O, Park YK, Lee KH, Lee JH, Lee WS, Joo YE, Choi SK, Cho SB. [Comparison on the long term outcome between endoscopic submucosal dissection and surgical treatment for undifferentiated early gastric cancer]. Korean J Gastroenterol. 2014;63:90-98. [PubMed] |
| 6. | Ishihara R, Iishi H, Uedo N, Takeuchi Y, Yamamoto S, Yamada T, Masuda E, Higashino K, Kato M, Narahara H. Comparison of EMR and endoscopic submucosal dissection for en bloc resection of early esophageal cancers in Japan. Gastrointest Endosc. 2008;68:1066-1072. [PubMed] [DOI] |
| 7. | 徐 国良, 罗 广裕, 林 世永, 高 晓燕, 李 茵, 单 宏波, 张 蓉, 黎 建军, 贺 龙君, 王 国宝. 内镜下黏膜切除术及内镜黏膜下剥离术治疗上消化道早期癌及癌前病变. 中国内镜杂志. 2010;10:1013-1016. |
| 8. | Sakamoto T, Matsuda T, Otake Y, Nakajima T, Saito Y. Predictive factors of local recurrence after endoscopic piecemeal mucosal resection. J Gastroenterol. 2012;47:635-640. [PubMed] [DOI] |
| 9. | Wen J, Linghu E, Yang Y, Liu Q, Wang X, Du H, Wang H, Meng J, Lu Z. Relevant risk factors and prognostic impact of positive resection margins after endoscopic submucosal dissection of superficial esophageal squamous cell neoplasia. Surg Endosc. 2014;28:1653-1659. [PubMed] [DOI] |
| 10. | Stroppa I, Milito G, Lionetti R, Palmieri G, Cadeddu F, Pallone F. Rectal laterally spreading tumors successfully treated in two steps by endoscopic submucosal dissection and endoscopic mucosal resection. BMC Gastroenterol. 2010;10:135. [PubMed] [DOI] |
| 11. | Park YM, Cho E, Kang HY, Kim JM. The effectiveness and safety of endoscopic submucosal dissection compared with endoscopic mucosal resection for early gastric cancer: a systematic review and metaanalysis. Surg Endosc. 2011;25:2666-2677. [PubMed] [DOI] |
| 12. | Lian J, Chen S, Zhang Y, Qiu F. A meta-analysis of endoscopic submucosal dissection and EMR for early gastric cancer. Gastrointest Endosc. 2012;76:763-770. [PubMed] [DOI] |
| 13. | Wang J, Ge J, Zhang XH, Liu JY, Yang CM, Zhao SL. Endoscopic submucosal dissection versus endoscopic mucosal resection for the treatment of early esophageal carcinoma: a meta-analysis. Asian Pac J Cancer Prev. 2014;15:1803-1806. [PubMed] |
| 14. | Takahashi H, Arimura Y, Okahara S, Uchida S, Ishigaki S, Tsukagoshi H, Shinomura Y, Hosokawa M. Risk of perforation during dilation for esophageal strictures after endoscopic resection in patients with early squamous cell carcinoma. Endoscopy. 2011;43:184-189. [PubMed] [DOI] |
| 15. | McNeill SA, Good DW, Stewart GD, Stolzenburg JU. Five-year oncological outcomes of endoscopic extraperitoneal radical prostatectomy (EERPE) for prostate cancer: results from a medium-volume UK centre. BJU Int. 2014;113:449-457. [PubMed] [DOI] |
| 16. | Xue ZG, Jin L. [Anesthesia allows a step forward in endoscopic treatment for gastrointestinal diseases]. Zhonghua Wei Chang Wai Ke Za Zhi. 2013;16:1135-1137. [PubMed] |