修回日期: 2014-09-19
接受日期: 2014-09-30
在线出版日期: 2014-11-18
目的: 探讨Toll样受体4(Toll like receptor 4, TLR4)以及肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor associated-factor 6, TRAF6)在大鼠小肠缺血后的表达及其意义.
方法: 将32只SD大鼠随机分为假手术对照组(Con组)、缺血1 h组、缺血3 h组和缺血6 h组, 每组8只. 结扎SD大鼠肠系膜上动脉造成小肠缺血模型, 实时荧光定量PCR(Real-time quantitative PCR)、Western blot方法检测TLR4和TRAF6在小肠组织中的表达. 同时检测髓过氧化物酶(myeloperoxidase, MPO)的水平.
结果: 与对照组比较(20.65 U/L±6.88 U/L), 缺血1 h小肠MPO水平稍升高(23.27 U/L±3.00 U/L), 在3 h升高明显(35.73 U/L±5.04 U/L, P<0.01), 在6 h继续升高(51.79 U/L±2.27 U/L, P<0.01). 小肠中TLR4的表达在结扎肠系膜上动脉1、3、6 h后逐渐升高(P<0.01), 而TRAF6在1 h后表达下降, 然后在3、6 h表达迅速升高(P<0.05).
结论: 在小肠缺血损伤过程中, TLR4和TRAF6可能参与调节小肠损伤及炎症进程.
核心提示: 本研究通过构建小肠缺血动物模型, 应用分子生物学、组织病理学等方法检测小肠缺血后Toll样受体4(Toll like receptor 4, TLR4)、肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor associated-factor 6, TRAF6)的表达, 证实TLR4-TRAF6信号通路参与了小肠缺血后的炎症损伤, 具体机制需要进一步探讨.
引文著录: 刘盛智, 何雪梅, 周翔宇, 向川南. TLR4和TRAF6表达在大鼠小肠缺血损伤中的改变及意义. 世界华人消化杂志 2014; 22(32): 4901-4906
Revised: September 19, 2014
Accepted: September 30, 2014
Published online: November 18, 2014
AIM: To investigate the changes in the expression of Toll-like receptor 4 (TLR4) and tumor necrosis factor receptor associated-factor 6 (TRAF6) in intestinal ischemic injury in rats and to analyze their significance.
METHODS: Thirty-two adult male SD rats were randomly and equally divided into four groups: a sham operation group, and 1-, 3- and 6-h ischemia groups. Superior mesenteric artery ligation was performed in SD rats to induce intestinal ischemia. Real-time quantitative PCR (qPCR) and Western blot were carried out to detect the expression of TLR4 and TRAF6 in intestinal tissues. Meanwhile, the level of myeloperoxidase (MPO) was measured.
RESULTS: Compared with the sham operation group (20.65 U/L ± 6.88 U/L), MPO level was slightly elevated in the intestine in the 1-h ischemia group (23.27 U/L ± 3.00 U/L), but significantly increased in the 3-h (35.73 U/L ± 5.04 U/L, P < 0.01) and 6-h ischemia groups (51.79 U/L ± 2.27 U/L, P < 0.01). TLR4 expression gradually increased in the three ischemia groups (P < 0.01), while TRAF6 expression decreased in the intestine in the 1-h ischemia group, but rapidly increased in the 3- and 6-h groups (P < 0.05).
CONCLUSION: TLR4 and TRAF6 may be involved in regulating intestinal damage and inflammatory processes in rats with intestinal ischemic injury.
- Citation: Liu SZ, He XM, Zhou XY, Xiang CN. Significance of changes in Toll-like receptor 4 and TRAF6 expression in intestinal ischemic injury in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(32): 4901-4906
- URL: https://www.wjgnet.com/1009-3079/full/v22/i32/4901.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i32.4901
小肠缺血是因各种原因造成的肠壁缺血、缺氧, 最终发生梗死的疾病. 广泛的肠管坏死, 大量炎症因子释放, 会引起休克、多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)甚至危及生命, 在临床上发病率高、诊断率低, 但其确切的发病机制尚不清楚[1-4]. 研究[5-7]表明, 在肠组织损伤过程中Toll样受体4(Toll like receptor 4, TLR4)可能起主要的作用. TLR4介导的凋亡信号通路与小肠缺血再灌注损伤密切相关[8,9], 肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor associated-factor 6, TRAF6)介导的c-Jun氨基末端激酶(c-Jun-N-terminal kinase, JNK)信号发挥致炎症和抗炎症作用, 受到外源性或者内源性配体的激活后, TLR4-TRAF6-JNK信号激活多条凋亡信号通路, 加重了细胞的死亡和损伤, 在此过程中, TRAF6起关键的接头蛋白的作用[10-12]. 而在小肠缺血过程中, TRAF6所扮演的角色还少有报道. 本研究旨在观察小肠缺血时, TLR4以及下游关键接头蛋白TRAF6在小肠组织中的表达, 探讨小肠缺血损伤的机制.
健康SD♂大鼠共32只(泸州医学院动物实验中心), 6-7 wk, 体质量250-300 g. 髓过氧化物酶(myeloperoxidase, MPO)检测试剂盒(南京建成生物工程研究所); 手术缝线(强生医疗器材有限公司); 凝胶成像分析系统(Bio-Rad公司); 低温离心机(珠海黑马医学器械有限公司); Ax-70 TRF-A显微成像系统(日本Olympus公司); 一抗购自美国Abcam公司; 二抗购自Bioworld公司; RNA保存液购自QIAGEN公司; 总RNA提取试剂盒(天根生化科技有限公司); RNA浓度和纯度由NanoDrop(thermo fisher scientific)测定, 反转录试剂盒购自ToYoBo公司; 引物由上海生工公司合成(引物序列如表1), 荧光定量PCR试剂盒(QIAGEN), 荧光定量仪(ABI StepOne plus).
| 基因 | 序列 | 扩增片段(bp) |
| TLR4 | F: 5'-GCCCAGTGAGAACAGAAAGG-3' | 131 |
| R: 5'-GGGAAAGGAAGGAAACATTCA-3' | ||
| TRAF6 | F: 5'-AAGTTGCCGAGATGGAAGC-3' | 118 |
| R: 5'-CCAGGGCTATGAATGACCAC-3' | ||
| GAPDH | F: 5'-CCTCAAGATTGTCAGCAAT-3' | 141 |
| R: 5'-CCATCCACAGTCTTCTGAGT-3' |
1.2.1 小肠缺血模型的建立及标本采集: 实验动物均于造模前24 h禁食, 自由饮水, 以3%戊巴比妥钠(30 mg/kg)麻醉, ip. 采用肠系膜上动脉(superior mesenteric artery, SMA)结扎技术复制肠缺血模型[13-15], 常规消毒后取腹正中切口3-4 cm, 游离肠系膜上动脉, 用无创动脉夹夹闭SMA起始部, 造成肠缺血. 大鼠处死后立即取小肠组织(距回盲部10 cm左右的末段回肠), 分别放入RNA保存液, 准备随后的RNA提取; 置于40 g/L中性甲醛固定, 备组织学检测; -80 ℃冻存, 用于Western blot检测.
1.2.2 动物分组: 按照随机对照的原则分为4组: 假手术组(对照组Con), 结扎肠系膜上动脉1、3和6 h组, 每组8只. 对照组分离出肠系膜上动脉后缝合切口, 2 h后处死大鼠. 实验组分离出肠系膜上动脉并结扎后缝合切口, 在1、3和6 h后将大鼠处死.
1.2.3 组织学检测: 经中性甲醛固定后的组织常规石蜡包埋, 5 μm连续切片, 常规苏木素-伊红(HE)染色.
1.2.4 血浆MPO分析: 取大鼠下腔静脉血约2 mL, 静置10 min后4 ℃ 3000 r/min离心10 min取上清, 置于-20 ℃冰箱保存待测. 血浆MPO水平通过MPO检测试剂盒检测, 严格按照说明书操作并准确记录结果.
1.2.5 实时荧光定量(Real-time quantitative PCR)反应: 取50 mg保存于RNA保存液的小肠组织按照说明书进行提取总RNA, 取200 ng总RNA进行反转录. cDNA合成按试剂盒说明书进行, 取上述cDNA 2 µL按说明书进行qPCR, 反应条件为94 ℃预变性5 min, 95 ℃变性10 s, 60 ℃退火延伸30 s, 共40个循环, 最后做溶解曲线. 每个样本进行三重复, 目的基因的Ct值以内参GAPDH基因校正, 以2-△△Ct法计算目的基因的相对表达倍数(relative quantitative, RQ).
1.2.6 Western blot检测蛋白: 取约100 mg小肠组织匀浆, RIPA裂解液裂解1.0-1.5 h, 超声粉碎细胞20 s, 4 ℃下16000 r/min离心15 min, 取上清液. 10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白, 根据各样品蛋白浓度计算上样体积进行上样, 经分离、电泳等将蛋白电转移至PVDF膜, 5%脱脂奶粉封闭1 h, TBST洗涤. 加入一抗(TLR4 1:1000, TRAF6 1:4000), 孵育, TBST冲洗, 加入1:5000辣根过氧化物酶标记的二抗, 孵育, 再冲洗, 曝光显影, 得出结果.
统计学处理 数据均用mean±SD表示, 采用SPSS19.0统计软件分析, 组间比较采用单因素方差分析, 两组间比较用独立样本的t检验, P<0.05表示差异有统计学意义.
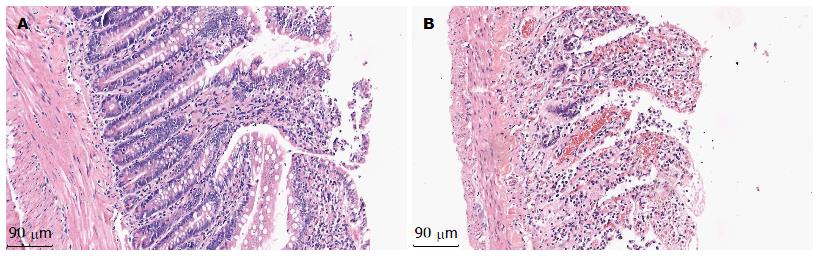
在缺血组均观察到炎症细胞浸润和坏死的肠黏膜, 部分小肠绒毛上皮断裂脱落, 形态结构受到严重的破坏, 显示典型的小肠缺血坏死的病理表现, 证实造模成功, 在对照组, 绒毛排列整齐, 形态结构完整, 无明显小肠坏死的病理表现(图1).
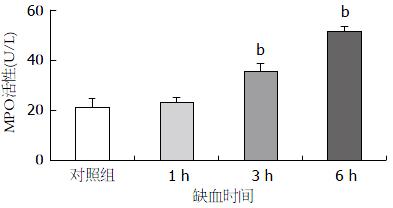
中性粒细胞的浸润程度通过检测小肠MPO的活性来判定. 与对照组(20.65 U/L±6.88 U/L)比较, 缺血1 h小肠MPO水平稍有升高(23.27 U/L±3.00 U/L); 在3 h升高明显(35.73 U/L±5.04 U/L, P<0.01); 在6 h继续升高, 差异非常显著(51.79 U/L±2.27 U/L, P<0.01)(图2).
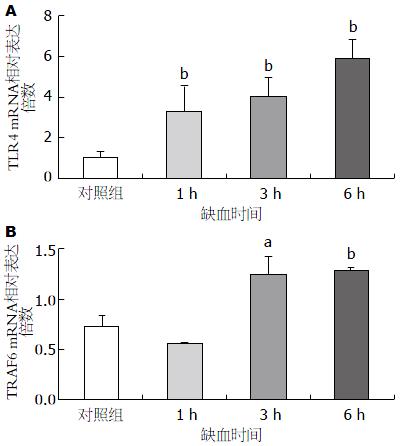
相对于对照组, 小肠中TLR4 mRNA的表达在缺血1、3和6 h后迅速上调, 6 h达到高峰, 显著高于对照组(P<0.01); TRAF6 mRNA在缺血1 h后表达下调, 而缺血3 h和6 h后, TRAF6 mRNA表达明显上调, 高于对照组, 且差异具有统计学意义(P<0.05)(图3).
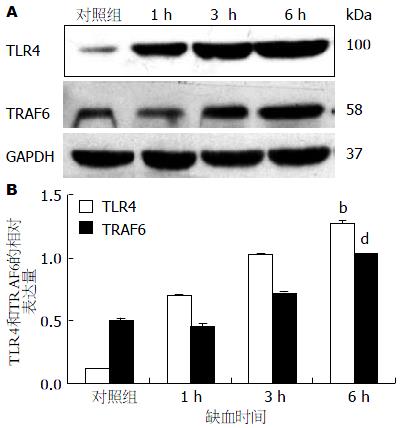
与qPCR结果相似, 相对于对照组, 小肠中TLR4的表达在缺血1、3和6 h后迅速上调, 在6 h达到高峰, 显著高于对照组(P<0.01); TRAF6在缺血1 h后表达下调, 而缺血3和6 h后, TRAF6表达明显上调, 在6 h达到高峰, 且差异具有统计学意义(P<0.01)(图4).
小肠缺血是由肠系膜上动脉血栓或者栓塞引起的, 也可能是由心功能不全、脓毒症以及收缩血管药物等引起的血液灌注不足, 易导致小肠缺血缺氧坏死以及伴发全身多器官功能不全, 病死率居高不下[16-18].
本研究旨在观察TLR4和TRAF6在大鼠小肠缺血模型中的作用. 在大鼠小肠缺血模型的小肠组织中, 通过典型肠缺血坏死病理学变化和小肠MPO水平变化, 证实在小肠缺血损伤早期, 小肠的炎症程度增加不明显, 随着缺血时间的增加, 炎症程度明显加重.
TRAF6是肿瘤坏死因子受体家族成员, 大量研究证实, TRAF6在先天免疫和获得免疫、细胞凋亡、应激反应以及炎症等方面, 发挥重要的作用[19-21], 研究发现, 在小鼠急性胰腺炎时, TRAR6在胰腺组织和肺组织上表达是先降低后升高的, 并认为TLR4-TRAF6通路参与了胰腺炎症和胰腺炎相关的肺损伤, TLR4在肠缺血再灌注引起的肺损伤和炎症过程中也起着重要的作用[22,23]. 另外, TRAF6 shRNA可以抑制LPS/TLR4信号传导通路, 从而减轻内毒素炎症反应[24], 这说明干扰TRAF6后, 可能影响细胞生存或凋亡的进程. 在小肠缺血缺氧损伤中, TLR4也扮演重要角色, 据Xu等[25]报道, TLR4/髓样分化因子88/核因子κB(TLR4/myeloid differentiation factor 88/nuclear factor kappa B, TLR4/MyD88/NF-κB)信号通路参与肠缺氧环境下调节菌群失调, Luo等[26]也发现, 急性缺氧暴露后的大鼠肠组织TLR4和NF-κB的表达升高. 以上的研究说明, 在小肠缺血过程中, TLR4-TRAF6信号通路可能介导肠道的炎症和凋亡.
既往研究[27,28]证实了TLR4在小肠缺血再灌注损伤中起重要的作用, 并在小肠缺血阶段参与调控, 具体调控机制还不清楚[29,30]. 而作为TLR4下游关键信号蛋白, TRAF6可能在小肠缺血过程中也发挥作用. 为此我们采用实时荧光定量qPCR技术检测肠TLR4 mRNA和TRAF6 mRNA水平, 结果证实, 相对于对照组, TLR4在缺血1、3和6 h后迅速上调, 在6 h达到高峰. TRAF6则在缺血1 h后表达下调, 但在缺血3 h和6 h后, TRAF6表达明显上调. 另外, 对照组肠道TLR4的低表达保证了生理状态下肠道对细菌的"绝缘", 可视为肠黏膜屏障功能的组成部分之一. 蛋白印迹检测TLR4和TRAF6蛋白水平也证实相似的结果, 这就说明, TLR4和TRAF6参与小肠缺血过程中的肠道损伤.
总之, 小肠缺血过程中, TLR4和TRAF6上调的时候, MPO代表的炎症水平是明显升高的, 因此我们认为TLR4-TRAF6通路的上调介导了小肠缺血过程中肠道的损伤, 而TRAF6在缺血早期下调的时候, TLR4是上调的, MPO所代表的炎症水平没有明显变化, 这可能是在缺血早期诱导了交联免疫耐受(cross-tolerance), 通过抑制下游的TRAF6-NF-κB信号通路和上调TLR4表面受体而产生的, 这种保护的作用的机制尚不清楚[31]. 我们虽然只证实了TLR4-TRAF6信号通路的部分机制, 但这些研究可能有利于临床干预小肠缺血相关的肠道损伤.
小肠缺血是因各种原因造成的肠壁缺血、缺氧, 最终发生梗死的疾病. 广泛的肠管坏死, 大量炎症因子释放, 会引起休克、多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)甚至危及生命, 在临床上发病率高、调控机制不清. 研究证实先天免疫的门户蛋白Toll样受体4(Toll like receptor 4, TLR4)参与调控小肠缺血, 作为TLR4下游关键信号蛋白, 肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor associated factor 6, TRAF6)可能在小肠缺血过程中也发挥作用.
陈光, 教授, 吉林大学第一医院消化器官外科
近几年TLR4在小肠缺血中的作用的研究成果显著, 但关于TLR4-TRAF6信号通路对小肠缺血损伤的作用国内外关注不多.
据Xu报道, TLR4/MyD88/NF-κB信号通路参与肠缺氧环境下调节菌群失调, Luo等也发现, 急性缺氧暴露后的大鼠肠组织TLR4和NF-κB的表达升高. 提示了TLR4信号通路可能介导肠道的炎症和凋亡.
小肠缺血是极易造成不良后果的急危重症, 发病机制不清. 本研究应用分子生物学手段探讨小肠缺血后TLR4、TRAF6的表达, 分析探讨TLR4、TRAF6和缺血后炎症损伤的关系, 以期为临床调控小肠缺血提供理论依据和调控靶点.
TLR4、TRAF6在小肠缺血损伤后的高表达与机体的炎症程度密切相关, 可能参与了小肠缺血的调控.
Toll样受体4(TLR4): 能识别病原微生物的免疫受体, 是一种跨膜蛋白, 具有信号转导功能, 介导免疫反应;
肿瘤坏死因子受体相关因子6(TRAF6): TLR4下游关键蛋白, 是肿瘤坏死因子受体家族成员, 研究证实, TRAF6在先天免疫和获得免疫、细胞凋亡、应激反应以及炎症等方面, 发挥重要的作用.
本文具有一定的研究意义.
编辑: 郭鹏 电编:闫晋利
| 1. | 银 东智, 袁 又能, 左 燕妮, 王 珍. 41例急性肠系膜上动脉缺血性疾病的临床诊治经验. 中国普外基础与临床杂志. 2014;21:358-360. |
| 3. | Akyıldız HY, Sözüer E, Uzer H, Baykan M, Oz B. The length of necrosis and renal insufficiency predict the outcome of acute mesenteric ischemia. Asian J Surg. 2014; Aug 30. [Epub ahead of print]. [PubMed] [DOI] |
| 4. | Yadav V, Hussain A, Sahoo K, Awasthi V. Remediation of Hemorrhagic Shock-Induced Intestinal Barrier Dysfunction by Treatment with Diphenyldihaloketones EF24 and CLEFMA. J Pharmacol Exp Ther. 2014; Sep 9. [Epub ahead of print]. [PubMed] |
| 5. | Yazji I, Sodhi CP, Lee EK, Good M, Egan CE, Afrazi A, Neal MD, Jia H, Lin J, Ma C. Endothelial TLR4 activation impairs intestinal microcirculatory perfusion in necrotizing enterocolitis via eNOS-NO-nitrite signaling. Proc Natl Acad Sci U S A. 2013;110:9451-9456. [PubMed] [DOI] |
| 6. | Jiang W, Tang W, Geng Q, Xu X. Inhibition of Toll-like receptor 4 with vasoactive intestinal peptide attenuates liver ischemia-reperfusion injury. Transplant Proc. 2011;43:1462-1467. [PubMed] [DOI] |
| 8. | Tatum PM, Harmon CM, Lorenz RG, Dimmitt RA. Toll-like receptor 4 is protective against neonatal murine ischemia-reperfusion intestinal injury. J Pediatr Surg. 2010;45:1246-1255. [PubMed] [DOI] |
| 9. | Moses T, Wagner L, Fleming SD. TLR4-mediated Cox-2 expression increases intestinal ischemia/reperfusion-induced damage. J Leukoc Biol. 2009;86:971-980. [PubMed] [DOI] |
| 10. | Jakus PB, Kalman N, Antus C, Radnai B, Tucsek Z, Gallyas F, Sumegi B, Veres B. TRAF6 is functional in inhibition of TLR4-mediated NF-κB activation by resveratrol. J Nutr Biochem. 2013;24:819-823. [PubMed] [DOI] |
| 11. | Tang HW, Liao HM, Peng WH, Lin HR, Chen CH, Chen GC. Atg9 interacts with dTRAF2/TRAF6 to regulate oxidative stress-induced JNK activation and autophagy induction. Dev Cell. 2013;27:489-503. [PubMed] [DOI] |
| 12. | Jung SM, Lee JH, Park J, Oh YS, Lee SK, Park JS, Lee YS, Kim JH, Lee JY, Bae YS. Smad6 inhibits non-canonical TGF-β1 signalling by recruiting the deubiquitinase A20 to TRAF6. Nat Commun. 2013;4:2562. [PubMed] [DOI] |
| 13. | Saba L, Berritto D, Iacobellis F, Scaglione M, Castaldo S, Cozzolino S, Mazzei MA, Di Mizio V, Grassi R. Acute arterial mesenteric ischemia and reperfusion: macroscopic and MRI findings, preliminary report. World J Gastroenterol. 2013;19:6825-6833. [PubMed] [DOI] |
| 14. | Lloris Carsi JM, Cejalvo Lapeña D, Toledo AH, Zaragoza Fernandez C, Toledo Pereyra LH. Pentoxifylline protects the small intestine after severe ischemia and reperfusion. Exp Clin Transplant. 2013;11:250-258. [PubMed] |
| 15. | Kim M, Park SW, Kim M, D'Agati VD, Lee HT. Isoflurane post-conditioning protects against intestinal ischemia-reperfusion injury and multiorgan dysfunction via transforming growth factor-β1 generation. Ann Surg. 2012;255:492-503. [PubMed] [DOI] |
| 16. | Bruhn RS, Distelmaier MS, Hellmann-Sokolis M, Naami A, Kuhl CK, Hohl C. Early detection of acute mesenteric ischemia using diffusion-weighted 3.0-T magnetic resonance imaging in a porcine model. Invest Radiol. 2013;48:231-237. [PubMed] [DOI] |
| 17. | Arumugam TV, Okun E, Tang SC, Thundyil J, Taylor SM, Woodruff TM. Toll-like receptors in ischemia-reperfusion injury. Shock. 2009;32:4-16. [PubMed] [DOI] |
| 18. | Cakmaz R, Büyükaşık O, Kahramansoy N, Erkol H, Cöl C, Boran C, Buğdaycı G. A combination of plasma DAO and citrulline levels as a potential marker for acute mesenteric ischemia. Libyan J Med. 2013;8:1-6. [PubMed] [DOI] |
| 19. | Lin Y, Qiu Y, Xu C, Liu Q, Peng B, Kaufmann GF, Chen X, Lan B, Wei C, Lu D. Functional role of asparaginyl endopeptidase ubiquitination by TRAF6 in tumor invasion and metastasis. J Natl Cancer Inst. 2014;106:dju012. [PubMed] [DOI] |
| 20. | Kim HS, Han SY, Sung HY, Park SH, Kang MK, Han SJ, Kang YH. Blockade of visfatin induction by oleanolic acid via disturbing IL-6-TRAF6-NF-κB signaling of adipocytes. Exp Biol Med (Maywood). 2014;239:284-292. [PubMed] [DOI] |
| 21. | Stack J, Hurst TP, Flannery SM, Brennan K, Rupp S, Oda S, Khan AR, Bowie AG. Poxviral protein A52 stimulates p38 mitogen-activated protein kinase (MAPK) activation by causing tumor necrosis factor receptor-associated factor 6 (TRAF6) self-association leading to transforming growth factor β-activated kinase 1 (TAK1) recruitment. J Biol Chem. 2013;288:33642-33653. [PubMed] [DOI] |
| 22. | Zhou XY, Zhou ZG, Ding JL, Wang L, Wang R, Zhou B, Gu J, Sun XF, Li Y. TRAF6 as the key adaptor of TLR4 signaling pathway is involved in acute pancreatitis. Pancreas. 2010;39:359-366. [PubMed] [DOI] |
| 23. | Ben DF, Yu XY, Ji GY, Zheng DY, Lv KY, Ma B, Xia ZF. TLR4 mediates lung injury and inflammation in intestinal ischemia-reperfusion. J Surg Res. 2012;174:326-333. [PubMed] [DOI] |
| 24. | 陈 锋, 孙 继民, 何 生松, 庞 然, 许 娟娟, 董 继华. TRAF6 shRNA对LPS/TLR4信号传导通路的体外干预作用. 世界华人消化杂志. 2011;19:2637-2643. |
| 25. | Xu CL, Sun R, Qiao XJ, Xu CC, Shang XY, Niu WN. Protective effect of glutamine on intestinal injury and bacterial community in rats exposed to hypobaric hypoxia environment. World J Gastroenterol. 2014;20:4662-4674. [PubMed] [DOI] |
| 26. | Luo H, Guo P, Zhou Q. Role of TLR4/NF-κB in damage to intestinal mucosa barrier function and bacterial translocation in rats exposed to hypoxia. PLoS One. 2012;7:e46291. [PubMed] [DOI] |
| 27. | Pope MR, Hoffman SM, Tomlinson S, Fleming SD. Complement regulates TLR4-mediated inflammatory responses during intestinal ischemia reperfusion. Mol Immunol. 2010;48:356-364. [PubMed] [DOI] |
| 28. | He GZ, Zhou KG, Zhang R, Chen XF. The effects of n-3 PUFA and intestinal lymph drainage on high-mobility group box 1 and Toll-like receptor 4 mRNA in rats with intestinal ischaemia-reperfusion injury. Br J Nutr. 2012;108:883-892. [PubMed] [DOI] |
| 29. | Mkaddem SB, Bens M, Vandewalle A. Differential activation of Toll-like receptor-mediated apoptosis induced by hypoxia. Oncotarget. 2010;1:741-750. [PubMed] |
| 30. | Chassin C, Hempel C, Stockinger S, Dupont A, Kübler JF, Wedemeyer J, Vandewalle A, Hornef MW. MicroRNA-146a-mediated downregulation of IRAK1 protects mouse and human small intestine against ischemia/reperfusion injury. EMBO Mol Med. 2012;4:1308-1319. [PubMed] [DOI] |