修回日期: 2014-09-04
接受日期: 2014-09-17
在线出版日期: 2014-11-08
目的: 探讨G蛋白偶联受体C家族5A(G pro-tein-coupled receptor family C, member 5, group A, GPRC5A)和信号转导子与转录激活子3(signal transducer and activator of transcription 3, STAT3)在食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)组织中的表达、两者的相关性及其临床病理意义.
方法: 采用免疫组织化学法分别检测ESCC、癌旁组织及正常食管黏膜组织中GPRC5A及STAT3蛋白的表达, 并分析两者表达水平相关性及与临床病理因素的关系. 采用χ2检验进行统计学分析.
结果: GPRC5A在ESCC、癌旁组织、正常食管黏膜组织中的阳性表达率分别为41.79%、58.21%、68.66%, STAT3在ESCC、癌旁组织、正常食管黏膜组织中的阳性表达率分别为80.60%、71.64%、53.73%. 两者在组间的表达差异有统计学意义(P<0.05). 食管鳞癌组织中GPRC5A和STAT3蛋白表达与肿瘤分级及浸润深度均密切有关(P<0.05), 与年龄、性别、淋巴结转移无关, 两者在ESCC组织中的表达呈负相关(r = -0.254, P<0.05).
结论: GPRC5A和STAT3蛋白表达与ESCC发生、发展、浸润有关, 联合检测GPRC5A和STAT3两蛋白可更准确判断ESCC的生物学行为, 对食管鳞癌的预后判断具有重要的意义, 并有望成为食管癌基因治疗的新靶点.
核心提示: 当G蛋白偶联受体C家族5A(G pro-tein-coupled receptor family C, member 5, group A, GPRC5A)在各种因素的作用下表达降低时, 不能抑制细胞内蛋白信号转导和转录激活因子(singnal transducers and transcription activators, STATs)的表达, STAT3通过多种机制导致肿瘤的发生. 维甲酸、cAMP可诱导GPRC5A的表达, 提示如果在食管鳞癌中GPRC5A是一种抑癌基因, 维甲酸、cAMP有可能可用于食管鳞癌的治疗.
引文著录: 刘娇, 白霞, 李颖霞, 陈奎生, 温洪涛. GPRC5A和STAT3在食管鳞癌组织中的表达及临床病理意义. 世界华人消化杂志 2014; 22(31): 4810-4815
Revised: September 4, 2014
Accepted: September 17, 2014
Published online: November 8, 2014
AIM: To investigate the expression of G protein-coupled receptor family C, member 5, group A (GPRC5A) and signal transducer and activator of transcription 3 (STAT3) proteins in esophageal squamous cell carcinoma (ESCC) and to analyze their clinicopathological significance.
METHODS: Immunohistochemistry was used to detect the expression of GPRC5A and STAT3 proteins in ESCC, matched tumor-adjacent tissue and normal esophageal tissue. The correlation between the expression of these proteins and clinicopathologic features of ESCC was analyzed.
RESULTS: The rate of GPRC5A protein expression in ESCC was significantly lower than those in tumor-adjacent tissue and normal esophageal tissue (41.79% vs 58.21%, 68.66%, P < 0.05 for both). The positive rate of STAT3 expression was significantly higher in ESCC than in tumor-adjacent tissue and normal esophageal tissue (80.60% vs 71.64%, 53.73%, P < 0.05 for both). Expression of GPRC5A was significantly associated with tumor invasion depth and histological grade, but not with age, sex or lymph node metastasis. STAT3 expression was significantly associated with tumor invasion depth and histological grade, but not with age, sex or lymph node metastasis. GPRC5A protein expression was positively correlated with the expression of STAT3 proteins (r = -0.254, P < 0.05).
CONCLUSION: GPRC5A and STAT3 may participate in the occurrence and metastasis of esophageal carcinoma. Combined detection of the expression of these proteins will be helpful to the diagnosis of esophageal carcinoma and accurate determination of the biological behavior of this malignancy. GPRC5A and STAT3 may become new targets for gene therapy of esophageal carcinoma.
- Citation: Liu J, Bai X, Li YX, Chen KS, Wen HT. Clinicopathological significance of GPRC5A and STAT3 expression in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(31): 4810-4815
- URL: https://www.wjgnet.com/1009-3079/full/v22/i31/4810.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i31.4810
食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)是人类常见的消化系恶性肿瘤, 是环境因素和宿主因素相互作用的结果, 但其发生机制还不是很清楚[1]. G蛋白偶联受体C家族5A(G protein-coupled receptor family C, member 5, group A, GPRC5A)是从口腔鳞癌细胞株UMSCC-22B中发现的一种基因[2]. 他是一种全反式维甲酸所诱导的新基因, 定位在12p12.3-p13区域, 编码的蛋白是GPRC5A蛋白, GPRC5A蛋白包含7个跨膜结构域, G蛋白偶联受体为其基本特征. GPRC5A蛋白在口腔鳞癌中的表达明显低于在正常口腔鳞状细胞中的表达[3]. 在胃癌组织中高表达, 明显高于正常胃组织和癌旁组织中的表达[4]. 另外还有研究表明, GPRC5A可促进乳腺癌细胞的增殖. 这提示GPRC5A可能与肿瘤的发生、发展及预后密切相关[5]. 细胞内蛋白信号转导和转录激活因子(signal transducers and transcription activators, STATs)是一族具有高度同源性的转录因子, 可介导多种细胞因子和生长因子的信号向细核内转导, 影响靶基因的转录, 从而调节细胞功能, 与肿瘤发生、发展和凋亡有密切关系[6]. STAT3是其重要成员之一, 近年研究表明其在白血病、乳腺癌、恶性黑色素瘤、头颈部鳞状细胞癌等恶性肿瘤中存在异常表达[7]. GPRC5A和STAT3在肿瘤的发生、发展的作用及相互关系在肺癌等恶性肿瘤中有文献报道[8]. 虽然STAT3在食管鳞癌中的作用国内曾有报道, 但GPRC5A在食管鳞癌组织中作用及与STAT3表达的相关性研究目前尚未见报道. 联合检测GPRC5A和STAT3在ESCC中的表达情况及两者之间的关系, 可能为ESCC的早期诊断和分子靶向治疗带来新的前景. 为此, 本研究检测食管鳞癌、癌旁组织及正常食管黏膜组织中GPRC5A和STAT3的蛋白的表达及其与临床病理特征的关系, 以探讨二者在食管癌组织中表达的意义.
郑州大学第一附属医院2010-06/2012-06手术切除的67例食管鳞癌患者的食管组织(患者对本研究知情, 并签署知情同意书, 本研究也通过伦理委员会的批准), 病理诊断证明为鳞状细胞癌. 患者术前均未接受化疗放疗和免疫治疗. 其中男38例, 女29例, 年龄范围为35-80岁, 年龄≤60岁的36例, 年龄>60岁的31例; 组织学分级: 高及高中分化(Ⅰ/Ⅰ-Ⅱ级)27例, 中分化(Ⅱ级)30例, 中低分化及低分化(Ⅱ-Ⅲ及Ⅲ级)10例; 浸润深度: 浅层(黏膜层或黏膜下层)33例, 深层(肌层或外膜)34例; 淋巴结转移37例, 无淋巴结转移34例. 所有标本分别在癌灶、癌旁3 cm以内及手术远端正常黏膜组织(距离癌组织边缘超过5 cm), 均经100 g/L甲醛溶液固定, 石蜡包埋, 4 μm厚的连续切片. 兔抗GPRC5A多克隆抗体、兔抗人STAT3多克隆抗体均购自博奥森公司, SP免疫组织化学试剂盒购自康为世纪生物科技有限公司. 以高温修复法进行抗原修复.
免疫组织化学染色采用链酶卵白素-生物素过氧化物酶法(streptavidin peroxidase, SP). GPRC5A抗体稀释浓度为1:100, STAT3抗体稀释度为1:75, DAB显色, 苏木素复染, 操作步骤严格按照说明书进行. 实验中以已知的阳性组织(GPRC5A: 胃癌组织; STAT3: 乳腺癌组织)作阳性对照, PBS代替一抗作阴性对照. 参考冯艳等[9]计分方法并做适当的修改: 以胞质和/或胞核或胞膜出现棕黄或黄褐色颗粒为阳性细胞, 随机选取5个高倍视野计数, 以阳性细胞数和着色强度综合判断结果, 其中阳性细胞数记分: <5%为0分, ≥5%且<25%为1分, ≥25%且<50%为2分, ≥50%且<75%为3分, ≥75%为4分; 着色强度计分: 阴性染色1分, 弱染色2分, 中等强度染色3分, 强染色4分. 两者得分相乘结果: ≤3分者为(-); 4-8分者为(+); >8分者(++), 以+和++视为阳性.
统计学处理 采用SPSS17.0统计软件进行数据分析, 统计方法采用χ2检验, 检验水准α = 0.05, P<0.05表示差异有统计学意义.
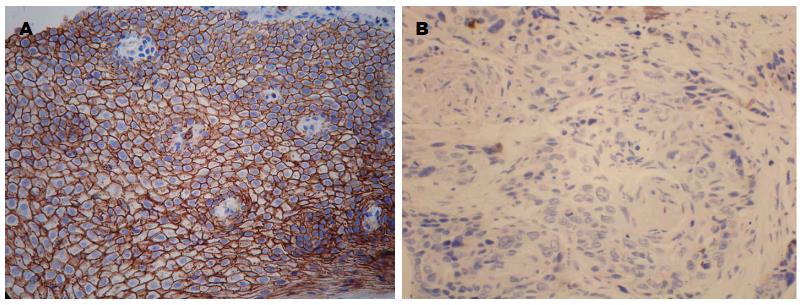
GPRC5A蛋白阳性表达主要位于细胞膜, 部分表达于细胞质, 阳性表达颜色为棕褐色(图1), GPRC5A蛋白在正常组织、癌旁组织、鳞癌组织中的阳性表达率分别为: 68.66%、58.21%和41.79%, 组间差异有统计学意义(P<0.01)(表1).
| 分组 | GPRC5A蛋白 | |||
| - | + | 阳性率(%) | 3组比较P值 | |
| 正常组织 | 21 | 46 | 68.66 | <0.01 |
| 癌旁组织 | 28 | 39 | 58.21 | |
| 鳞癌组织 | 39 | 28 | 41.79 | |
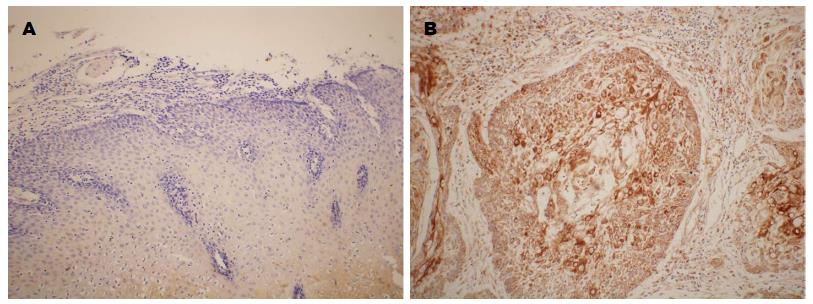
STAT3的阳性表达主要位于细胞质, 部分表达于细胞核, 颜色为棕黄色(图2). STAT3蛋白在正常组织、癌旁组织、鳞癌组织中的阳性表达率分别为: 53.73%、71.64%和80.60%, 组间差异有统计学意义(P<0.01)(表2).STAT3在食管鳞状上皮组织中的阴性和阳性表达(SP×100). A: STAT3在正常食管鳞状上皮组织中的阴性表达; B: STAT3在食管鳞状细胞癌组织中的阳性表达. STAT3: 细胞内蛋白信号转导和转录激活因子3.
| 分组 | STAT3蛋白 | |||
| - | + | 阳性率(%) | 3组比较P值 | |
| 正常组织 | 31 | 36 | 53.73 | <0.01 |
| 癌旁组织 | 19 | 48 | 71.64 | |
| 鳞癌组织 | 13 | 54 | 80.60 | |
由表3可知, STAT3蛋白的表达与组织学分级、浸润深度有关, 而与年龄、性别、淋巴结转移无关; GPRC5A蛋白的表达与组织学分级、浸润深度有关, 与年龄、性别、淋巴结转移无关.
| 分组 | n | GPRC5A | STAT3 | ||||||
| - | + | 阳性率(%) | P值 | - | + | 阳性率(%) | P值 | ||
| 性别 | 0.660 | 0.816 | |||||||
| 男 | 38 | 23 | 15 | 37.47 | 7 | 31 | 81.58 | ||
| 女 | 29 | 16 | 13 | 44.83 | 6 | 23 | 79.31 | ||
| 年龄(岁) | 0.635 | 0.542 | |||||||
| ≤60 | 36 | 20 | 16 | 44.44 | 6 | 30 | 83.33 | ||
| >60 | 31 | 19 | 12 | 38.71 | 7 | 24 | 77.42 | ||
| 淋巴结转移 | 0.078 | 0.610 | |||||||
| 无 | 30 | 21 | 9 | 30.00 | 5 | 25 | 83.33 | ||
| 有 | 37 | 18 | 19 | 51.35 | 8 | 29 | 78.38 | ||
| 浸润深度 | 0.037 | 0.026 | |||||||
| 深层 | 34 | 24 | 10 | 29.41 | 3 | 31 | 91.18 | ||
| 浅层 | 33 | 15 | 18 | 54.55a | 10 | 23 | 69.70a | ||
| 组织学分级 | 0.003 | 0.039 | |||||||
| Ⅰ/Ⅰ-Ⅱ级 | 27 | 9 | 18 | 66.67 | 9 | 18 | 66.67 | ||
| Ⅱ级 | 30 | 22 | 8 | 26.67 | 4 | 26 | 86.67 | ||
| Ⅲ/Ⅱ-Ⅲ级 | 10 | 8 | 2 | 20.00d | 0 | 10 | 100.00c | ||
食管癌的发生发展是一个由多种因素参与调控的过程, 有多种基因参与肿瘤细胞的增殖、分化及凋亡[10], 但其确切的发病机制目前尚不清楚, 且早期食管癌症状多不典型, 易被忽略, 确诊时多处于晚期阶段, 严重影响了食管癌患者的预后. 找到食管癌发生及侵袭转移的主要相关因子, 对食管癌的防治及预后具有重要的意义[11].
1998年Cheng等[2]在人类口腔鳞癌细胞株中UMSCC-22B中发现了GPRC5A基因, 他是一种全反式维甲酸诱导的基因. 维甲酸诱导基因GPRC5A基因定位在12p12.3-p13区域, GPRC5A蛋白包含7个跨膜结构域, G蛋白偶联受体为其基本特征. 近年来很多研究证实G蛋白偶联受体以二聚体的形式参与调节生理活动, 对信号识别及转导有重要作用[12]. 已有的一些研究证实GPRC的多个家族成员参与了肿瘤的早期事件, 并在肿瘤的浸润以及转移过程中起关键作用[13,14]. Tao等[5]研究发现GPRC5A纯合子敲除的小鼠在1-2年内有76%发生肺腺瘤, 17%发生肺腺癌, 而在杂合子和野生型小鼠中无一例发生肺癌, 提示GPRC5A可能是一种肺癌抑癌基因. Wu等[15]研究发现在乳腺癌组织中, GPRC5A表达率是升高的, 他可促进乳腺癌细胞株的增殖[16]. GPRC5A敲除小鼠在肺上皮细胞中增强了核因子-κB(nuclear factor-κB, NF-κB)的活化, 导致自分泌和旁分泌的相互作用增加, 细胞自主性增高, 炎性反应增强, 最终协同产生促进肿瘤发生的微环境改变[17]. 本实验研究结果显示, GPRC5A在正常食管组织、癌旁组织、食管鳞癌组织中的表达率逐渐降低, 每二者之间的差异有显著地统计学意义, 并且与食管癌的分化程度、浸润深度有关. 本实验提示, GPRC5A蛋白的低表达可能参与了食管鳞癌的发生. 维甲酸、cAMP可诱导GPRC5A的表达[18,19], 提示如果在食管鳞癌中GPRC5A是一种抑癌基因, 维甲酸、cAMP有可能可用于食管鳞癌的治疗.
STAT3基因在人类定位于第17号染色体(q21)[20], 编码的蛋白STAT3是一种核转录因子. 多项研究表明, STAT3与肿瘤相关, 在大肠癌、乳腺癌等多种肿瘤组织中高表达[21]. STAT3蛋白在接受多种细胞外信号刺激后进入细胞核中, 与其特异性的DNA序列结合, 调控目的靶基因的转录, 从而影响细胞的增殖分化和凋亡[22]. 张建民等[23]研究发现这包括调节细胞周期的c-Myc和影响细胞凋亡的Bcl-2家族成员. c-Myc在细胞分裂周期中表达增加, 调控细胞增殖或分化, 促进G0期细胞向G1/S期转化, c-Myc过度表达可诱导细胞转化与肿瘤形成. 本实验研究结果是, STAT3在ESCC中的表达高于食管正常组织中的表达, 且低分化食管鳞癌组织中的表达高于中分化、高分化食管鳞癌中的表达, 这与王新华等[24]、Yan等[25]及刘俊茹等[26]在食管鳞癌中的研究结论是一致的. 王新华等[27]研究还发现用小干扰RNA阻断食管鳞癌中STAT3的持续激活可抑制肿瘤的增殖, 进一步证明了STAT3参与了肿瘤的发生.
Chen等[8]在肺癌中研究了GPRC5A和STAT3的相互关系, GPRC5A基因敲除的小鼠肺组织中STAT3的表达明显升高, 持续活化STAT3, 这对于细胞的存活与转型起重要作用; 在肺癌组织中GPRC5A通过稳定细胞因子信号抑制因子(suppressor of cytokine signaling-3, SOCS3), 抑制STAT3信号通路, 部分介导其抑癌作用. 本研究发现GPRC5A与STAT3的表达呈负相关, 提示GPRC5A在食管鳞癌组织中可能是一种抑癌基因, 通过某种机制抑制STAT3基因的表达, 当GPRC5A在各种因素的作用下表达降低时, 不能抑制STAT3的表达, STAT3通过多种机制导致肿瘤的发生. 其具体的分子机制目前尚未清楚, 且本研究采用免疫组织化学研究方法, 误差相对较大, 因而还需要进一步的研究工作. 联合检测食管鳞癌中GPRC5A与STAT3蛋白的表达有利于进一步了解食管鳞癌的生物行为, 指导临床工作.
食管鳞癌是人类常见的消化系恶性肿瘤, 严重影响了人类的健康. G蛋白偶联受体C型5A(G protein-coupled receptor family C, member 5, group A, GPRC5A)是一种细胞膜蛋白, 参与细胞的多种生物行为, 与肺癌、乳腺癌、胃癌等多种肿瘤相关. 因而推测GPRC5A可能与食管鳞癌的发生发展、浸润转移有关.
李苏宜, 教授, 主任医师, 安徽省肿瘤医院肿瘤内科
食管癌的发病机制、诊断及靶向治疗越来越受到医学界的关注, 而新的肿瘤标志基因GPRC5A在食管癌中未有研究, GPRC5A在食管癌发病中的具体机制及与STAT3如何相互作用抑制肿瘤形成及浸润转移是目前需要研究的问题.
Chen等报道了GPRC5A和STAT3在肺癌的发生、发展中的作用及相互关系. 该文章报道GPRC5A通过稳定细胞因子信号抑制因子3(suppressor of cytokinesignaling-3, SOCS3), 抑制STAT3信号通路, 部分介导其抑癌作用.
本文首次探讨了GPRC5A及STAT3在食管癌中表达的相关关系, 提示在食管癌中GPRC5A的低表达不能抑制STAT3的表达, STAT3通过多种机制促进细胞增殖, 加速肿瘤形成.
本研究发现, GPRC5A蛋白的表达与组织学分级、浸润深度有关, STAT3蛋白的表达与组织学分级、浸润深度有关. GPRC5A蛋白与STAT3蛋白表达呈负相关; 联合使用免疫组织化学进行检测, 可作为食管癌早期诊断及评价肿瘤生物学行为的重要指标.
本文具有一定的创新性, 临床研究的设计也合理较为严谨, 因而数据也较为可靠. 作者对该领域的研究进展也颇为熟悉.
编辑: 郭鹏 电编:都珍珍
| 2. | Cheng Y, Lotan R. Molecular cloning and characterization of a novel retinoic acid-inducible gene that encodes a putative G protein-coupled receptor. J Biol Chem. 1998;273:35008-35015. [PubMed] [DOI] |
| 3. | Liu SL, Zhong SS, Ye DX, Chen WT, Zhang ZY, Deng J. Repression of G protein-coupled receptor family C group 5 member A is associated with pathologic differentiation grade of oral squamous cell carcinoma. J Oral Pathol Med. 2013;42:761-768. [PubMed] [DOI] |
| 4. | Cheng L, Yang S, Yang Y, Zhang W, Xiao H, Gao H, Deng X, Zhang Q. Global gene expression and functional network analysis of gastric cancer identify extended pathway maps and GPRC5A as a potential biomarker. Cancer Lett. 2012;326:105-113. [PubMed] [DOI] |
| 5. | Tao Q, Fujimoto J, Men T, Ye X, Deng J, Lacroix L, Clifford JL, Mao L, Van Pelt CS, Lee JJ. Identification of the retinoic acid-inducible Gprc5a as a new lung tumor suppressor gene. J Natl Cancer Inst. 2007;99:1668-1682. [PubMed] [DOI] |
| 6. | Yu H, Jove R. The STATs of cancer--new molecular targets come of age. Nat Rev Cancer. 2004;4:97-105. [PubMed] [DOI] |
| 8. | Chen Y, Deng J, Fujimoto J, Kadara H, Men T, Lotan D, Lotan R. Gprc5a deletion enhances the transformed phenotype in normal and malignant lung epithelial cells by eliciting persistent Stat3 signaling induced by autocrine leukemia inhibitory factor. Cancer Res. 2010;70:8917-8926. [PubMed] [DOI] |
| 11. | 符 仲标, 张 蕾, 李 颖霞, 张 同贞, 张 云汉, 温 洪涛. Bmi-1和S100A4蛋白在食管鳞状细胞癌中的表达及其临床病理意义. 世界华人消化杂志. 2010;13:1344-1349. |
| 13. | Gugger M, White R, Song S, Waser B, Cescato R, Rivière P, Reubi JC. GPR87 is an overexpressed G-protein coupled receptor in squamous cell carcinoma of the lung. Dis Markers. 2008;24:41-50. [PubMed] [DOI] |
| 14. | Lee HJ, Wall B, Chen S. G-protein-coupled receptors and melanoma. Pigment Cell Melanoma Res. 2008;21:415-428. [PubMed] [DOI] |
| 15. | Nagahata T, Sato T, Tomura A, Onda M, Nishikawa K, Emi M. Identification of RAI3 as a therapeutic target for breast cancer. Endocr Relat Cancer. 2005;12:65-73. [PubMed] [DOI] |
| 16. | Wu Q, Ding W, Mirza A, Van Arsdale T, Wei I, Bishop WR, Basso A, McClanahan T, Luo L, Kirschmeier P. Integrative genomics revealed RAI3 is a cell growth-promoting gene and a novel P53 transcriptional target. J Biol Chem. 2005;280:12935-12943. [PubMed] [DOI] |
| 17. | Deng J, Fujimoto J, Ye XF, Men TY, Van Pelt CS, Chen YL, Lin XF, Kadara H, Tao Q, Lotan D. Knockout of the tumor suppressor gene Gprc5a in mice leads to NF-kappaB activation in airway epithelium and promotes lung inflammation and tumorigenesis. Cancer Prev Res (Phila). 2010;3:424-437. [PubMed] [DOI] |
| 18. | Hirano M, Zang L, Oka T, Ito Y, Shimada Y, Nishimura Y, Tanaka T. Novel reciprocal regulation of cAMP signaling and apoptosis by orphan G-protein-coupled receptor GPRC5A gene expression. Biochem Biophys Res Commun. 2006;351:185-191. [PubMed] [DOI] |
| 19. | Ye X, Tao Q, Wang Y, Cheng Y, Lotan R. Mechanisms underlying the induction of the putative human tumor suppressor GPRC5A by retinoic acid. Cancer Biol Ther. 2009;8:951-962. [PubMed] [DOI] |
| 20. | Wegrzyn J, Potla R, Chwae YJ, Sepuri NB, Zhang Q, Koeck T, Derecka M, Szczepanek K, Szelag M, Gornicka A. Function of mitochondrial Stat3 in cellular respiration. Science. 2009;323:793-797. [PubMed] [DOI] |
| 22. | Yu H, Pardoll D, Jove R. STATs in cancer inflammation and immunity: a leading role for STAT3. Nat Rev Cancer. 2009;9:798-809. [PubMed] [DOI] |
| 25. | Yan S, Zhou C, Zhang W, Zhang G, Zhao X, Yang S, Wang Y, Lu N, Zhu H, Xu N. beta-Catenin/TCF pathway upregulates STAT3 expression in human esophageal squamous cell carcinoma. Cancer Lett. 2008;271:85-97. [PubMed] [DOI] |