修回日期: 2014-09-23
接受日期: 2014-09-30
在线出版日期: 2014-11-08
目的: 比较有机食物与常规食物对大鼠肠道菌群多样性的影响, 并观察给予麦粒灸足三里、脾俞穴后大鼠肠道菌群结构的变化.
方法: 将24只SPF级SD大鼠随机分为3组: 有机组、常规组和常规+麦粒灸组, 其中有机组给予有机饲料饲喂12 wk、常规组给予常规饲料饲喂12wk、常规组+麦粒灸组常规饲料饲喂8 wk后, 并于麦粒灸足三里、脾俞穴干预4 wk, 借助PCR-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient electrophoresis, PCR-DGGE)方法检测肠道菌群的变化.
结果: 相似性聚类分析显示3组大鼠肠道菌群结果具有差异性, 且常规+麦粒灸组大鼠肠道微生物多样性指数升高(P<0.05), 测序结果表明食用有机饲料可促进大鼠肠道内拟杆菌门粪便拟杆菌(Bacteroides stercoris)的繁殖, 麦粒灸足三里、脾俞穴可促进大鼠肠道内拟杆菌门Barnesiella intestinihominis、粪便拟杆菌的繁殖.
结论: 本实验采用有机食物和麦粒灸对大鼠进行干预证实了有机食物和麦粒灸足三里、脾俞穴可提高肠道菌群的多样性, 且麦粒灸干预效果显著. 这提示食用有机食物是一种有利于肠道菌群稳定的健康饮食方式, 若无法确保使用有机食物, 可采取麦粒灸足三里、脾俞穴自我康复干预.
核心提示: 长期食用有机食物和麦粒灸足三里、脾俞穴可提高肠道菌群的多样性, 且麦粒灸干预效果显著.
引文著录: 江杨洋, 王旭东, 王冰, 彭娟娟. 有机食物与麦粒灸对大鼠肠道菌群多样性的影响. 世界华人消化杂志 2014; 22(31): 4800-4806
Revised: September 23, 2014
Accepted: September 30, 2014
Published online: November 8, 2014
AIM: To compare the effect of organic and conventional food on the diversity of rat gut microbiota and to observe the changes in the composition of gut microbiota after moxibustion at Zusanli and Piyu points.
METHODS: Twenty-four SD rats of SPF grade were randomly divided into three groups: an organic food group, a conventional food group and a conventional food + moxibustion group. The mice of the organic food group were fed organic food for 12 wk, the mice of the convention food group were fed conventional food for 12 wk, and the combination group were fed conventional food for 8 wk and given moxibustion at Zusanli and Piyu points for additional 4 wk. The changes in gut microbiota were analyzed by polymerase chain reaction-denaturing gradient gel electrophoresis (PCR-DGGE).
RESULTS: The similarity clustering analysis showed that the composition of gut microbiota had significant differences among the three groups. The gut bacterial diversity index in the combination group significantly increased (P < 0.05). DNA sequencing showed that organic diet promoted Bacteroides stercoris to bloom in the gut of mice, and Moxibustion at Zusanli and Piyu points promoted the multiplication of Barnesiella intestinihominis and Bacteroides stercoris.
CONCLUSION: Organic diet and moxibustion obviously increase gut bacterial diversity index, and Moxibustion has a more significant effect. Organic diet is conducive to the stability of the intestinal flora. If organic diet cannot be ensured, moxibustion at Zusanli and Piyu points is helpful.
- Citation: Jiang YY, Wang XD, Wang B, Peng JJ. Effect of organic food and moxibustion on diversity of rat gut microbiota. Shijie Huaren Xiaohua Zazhi 2014; 22(31): 4800-4806
- URL: https://www.wjgnet.com/1009-3079/full/v22/i31/4800.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i31.4800
定植于人体胃肠道的微生物是一个庞大的群体, 肠道微生物的数量是人体细胞数量的10倍, 人体微生物组的宏基因组测序表明, 人体微生物共有330万个非冗余基因, 而其中99%以上的基因源于细菌[1]. 肠道菌群基因组比人类基因组大150倍, 被称为人类的"第二基因组". 这些肠道菌群通过多种机制参与机体的能量代谢、维持机体的能量平衡, 参与生长与衰老过程、生产若干酶类, 参与营养代谢、抑癌作用等多种与机体健康息息相关的生理过程, 对人体的健康起着重要作用. Cani[2]在其研究中指出肠道菌群现在已被视为影响主机生理和代谢的最重要环境因素之一. 由于当今环境污染和饮食结构改变所导致的亚健康状态和代谢性疾病的高发率, 促使人们研究饮食介导的肠道功能变化在疾病发生发展过程中的作用机制, 并为其治疗寻找更加有效的治疗手段和方法. 故本实验借助PCR-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient electrophoresis, PCR-DGGE)方法探索食用农药、抗生素、激素残留等常规食品与食用无农药、化肥、激素、添加剂, 非反季节的有机食品对大鼠肠道菌群结构的影响, 并观察麦粒灸对肠道菌群是否具有良性调节作用, 研究其对肠道中的哪类菌群有明显的影响作用, 为以肠道菌群为靶点进行的健康饮食和康复干预提供理论参考.
体质量为200 g±20 g SPF级♂SD大鼠24只, 购于北京维通利华实验动物技术有限公司. 饲料由江苏省协同医药生物工程有限责任公司提供. 有机饲料为协同公司提供的大鼠饲料配方(玉米38%、小麦22%、黄豆15%、鱼粉12%、麸皮10%、酵母粉2%, 余为矿物质和微量元素), 将玉米、小麦、黄豆等量替换为有机玉米、有机燕麦、有机黄豆. 其中有机玉米和有机黄豆购于松原市诚信实业有限责任公司所产的德伟有机系列, 有机燕麦购于禾谷实业(上海)有限公司所生产的艾谷有机系列. 所购买的产品包装上皆有有机商标标志. 屏蔽环境实验设施: 南京中医药大学动物实验中心. 艾绒为1:50精制艾绒、黄芩油膏(20 g/盒, 批号: 1401020), 购于江苏省中医院. 细菌通用引物GC-338F、518R和338F/518R, 溶菌酶、蛋白酶、高效离心柱型琼脂糖凝胶回收试剂盒和限制性内切酶均购于北京亿鸣复兴生物技术有限公司; 去离子甲酰胺、丙烯酰胺、双丙烯酰胺、N,N,N',N'-四甲基二乙胺购于Sigma公司.
1.2.1 动物分组及处理: 24只SD大鼠适应性饲养3 d后, 使用SPSS17.0产生随机数字并进行完全随机设计分组, 将24只SD大鼠随机分成3组, 即有机组、常规组和常规组+麦粒灸干预组. 实验期间有机组喂以有机饲料, 常规组和常规组+麦粒灸干预组喂以常规饲料. 8 wk后, 常规组+麦粒灸干预组开始麦粒灸干预, 时长4 wk, 余两组不做任何处理.
1.2.2 麦粒灸干预: 人工固定大鼠, 暴露后背及后肢(治疗穴位部位剃毛1 cm×1 cm), 穴位定位参考《基础医学实验动物操作基本技能》. 足三里(后三里)穴: 后肢膝关节下方, 当腓骨小头内约5 mm处; 脾俞: 第十二胸椎下两旁肋间, 左右侧各穴, 在穴位处涂敷黄芪油膏, 采用5 mg/壮麦粒大小的灸绒置于所需灸穴位处, 使用线香点燃艾绒, 每壮待大鼠出现所灸部位的收缩动作, 即可移去艾绒. 按此重复, 每穴5壮, 1次/d两侧交替. 6 d为一个疗程, 共干预4个疗程, 疗程之间休息1 d.
1.2.3 大鼠肠道粪便的提取: 干预结束后, 第13周将大鼠颈椎脱位处死后, 立即放于超净工作台上, 无菌采集各组肠道粪便, 同组每2只大鼠的肠道粪便收集在一起, 取材后快速冷冻在液氮中保存.
1.2.4 粪便标本DNA的提取: 粪便标本解冻以后,按照粪便基因组DNA快速提取试剂盒的操作手册逐步操作, 提取细菌DNA.
1.2.5 细菌16S rDNA片段的扩增: 提取的DNA通过0.8%的琼脂糖凝胶电泳检测其DNA完整性. 以16S rDNA可变区V3区为靶标, 采用细菌通用引物GC-338F和518R进行PCR扩增, 引物序列如表1. PCR扩增体系(50 μL)为: 10×PCR buffer 5 μL; dNTP(2.5 mmol/L) 3.2 μL; rTaq(5 U/μL) 0.4 μL; GC-338F(20 mmol/L) 1 μL; 518R(20 mmol/L) 1 μL; 模板DNA 50 ng; 补ddH2O至50 μL. PCR扩增程序为: 94 ℃预变性5 min; 94 ℃变性1 min, 55 ℃复性45 s, 72 ℃延伸1 min, 30个循环; 最终72 ℃延伸10 min. PCR产物纯化回收后在紫外凝胶成像系统下成像, 保存图谱.
| 引物 | 序列 |
| 338F | 5'-CCTACGGGAGGCAGCAG-3' |
| 518R | 5'-ATTACCGCGGCTGCTGG-3' |
| GC338F | 5'-CGCCCGGGGCGCGCCCCGGGGCGGGGCGGGGGCGCGGGGGGCCTACGGGAGGCAGCAG-3' |
1.2.6 PCR产物的DGGE分析: 取10 μL PCR的产物进行DGGE分析. 采用变形梯度为35%-55%、浓度为8%的聚丙烯酰胺凝胶(100%的化学变性剂含7 mol/L尿素和40%(v/v)的丙烯酰胺)在1×TAE缓冲液中150 V 60 ℃下电泳5 h. DGGE完毕后、采用银染法染色、步骤如下: (1)固定液(乙醇50 mL、冰醋酸2.5 mL、定容500 mL)固定15 min; (2)Milli-Q纯水清洗、20 s和2 min各1次; (3)银染液(硝酸银1 g、37%甲醛0.75 mL、定容500 mL)染色15 min; (4)Milli-Q纯水清洗、20 s和2 min各1次; (5)显色液(氢氧化钠7.5 g、37%甲醛2.5 mL、定容500 mL)显色5-7 min. 最后用终止液(乙醇50 mL、冰醋酸2.5 mL、定容500 mL)终止反应.
1.2.7 DGGE图谱中优势条带的回收与测序: 用灭菌的手术刀切下待回收DGGE条带, 使用上述相同的方法重新扩增16S rDNA V3区. 将重新扩增的DNA片段切胶回收、纯化后, 连接到Pmd18-T载体上, 并转化至DH5α感受态细胞中, 筛选阳性克隆, 进行序列测定.
统计学处理 采用SPSS17.0软件进行数据处理. 实验数据均以mean±SD表示, 组间比较采用单因素方差分析, SNK检验, P<0.05为差异有统计学意义.
使用试剂盒提取的DNA样品可以得到清晰的条带. 由图1可知, 有淡淡的拖尾现象、蛋白量少、亮度明显, 说明DNA量足够多, 能够进行PCR.
以GC-338F和518R为引物扩增各组大鼠肠道细菌16S rDNA V3区基因, 得到约200 bp的DNA片段, 2%琼脂糖凝胶电泳、EB染色后, 在紫外灯下于200 bp处可见明亮清晰条带(图2), 用于DGGE分析.
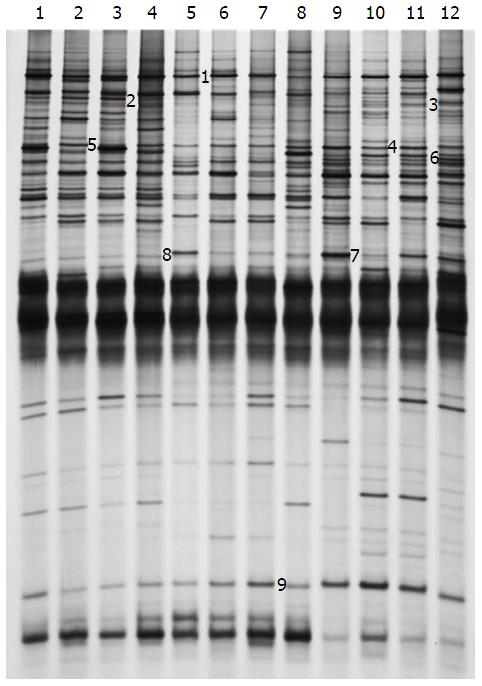
各组大鼠粪便细菌的16S rDNA V3区的DGGE图谱(图3)显示其条带的数量和强度在每组样本泳道中呈现不同变化. 不同位置的条带代表不同的优势细菌, 亮度反映出细菌相对量的多少. 由图3可看出, 有机组1、2、3、4泳道的条带数和亮度都高于泳道5、6、7、8常规组; 进行麦粒灸干预后泳道9、10、11、12的条带数和亮度有所增加, 说明有机组大鼠肠道菌群的多样性高于常规组大鼠, 且常规组大鼠进行麦粒灸干预后, 其肠道菌群的多样性有所增加.
为量化分析, 采用Quantity one软件对每个样本的电泳条带数目、条带密度进行数字化分析, 丰度(S)、香农指数(H')和均衡指数(E)等指标被用来比较不同样本的多样性情况. 丰度(S)用DGGE图谱中每条泳道的条带数表示; 香农指数(H')算法如下所示: (公式1); Pi = Ni/N; 其中, Pi为样本中单一条带的强度在该样品所有条带总强度中所占的比率, N为DGGE图谱单一泳道上所有条带的丰度, Ni为第i条带的丰度; S是某样本中所有条带数目总和; 均衡指数(E)表示菌群种属分布的一致性, 计算方法为E = H'/lnS[3]. 结果如表2. 单因素方差分析显示: (1)各组间均匀度均>0.05, 无统计学意义; (2)各组间Shannon指数均P>0.05, 无统计学意义. 但常规组与常规+麦粒灸组P = 0.06, 考虑每组样本量为4, 如增加样本量, 则麦粒灸干预后肠道菌群的多样性可能具有差异性; (3)常规组与有机组间的丰富度P1>0.05, 无统计学意义. 与常规组相比, 常规+麦粒灸组丰富度具有显著差异(P2 = 0.02<0.05); 与有机组相比, 常规+麦粒灸组丰富度具有差异性(P3 = 0.04<0.05), 且P2<P3, 说明有机组大鼠肠道菌群的丰富度略高于常规组大鼠, 进行麦粒灸足三里、脾俞穴可显著提高肠道菌群的丰富度.
| 分组 | 均匀度(E) | Shannon指数(H') | 丰富度(S) |
| 有机组 | 0.98±0.00 | 3.62±0.03 | 40. 0 0±1.15 |
| 常规组 | 0.98±0.01 | 3.59±0.12 | 39.50±3.87 |
| 常规+麦粒灸组 | 0.98±0.00 | 3.78±0.04 | 47.25±2.06 |
| Band | 最相似菌株 | 相似百分比 | 相似菌株登录号 | 菌门 |
| Band1 | Clostridium populeti | 100 | NR_026103 | Firmicutes |
| Band2 | Bacteroides stercoris | 95 | NR_027196 | Bacteroidetes |
| Band3 | Barnesiella intestinihominis | 96 | NR_041668 | Bacteroidetes |
| Band4 | Bacteroides stercoris | 99 | NR_027196 | Bacteroidetes |
| Band5 | Coprococcus comes | 99 | NR_044048 | Firmicutes |
| Band6 | Novosphingobiumnitrogenifigens | 99 | NR_043857 | Proteobacteria |
| Band7 | Flavonifractor plautii | 97 | NR_043142 | Firmicutes |
| Band8 | Clostridium methylpentosum | 95 | NR_029355 | Firmicutes |
| Band9 | Barnesiella intestinihominis | 90 | NR_041668 | Bacteroidetes |
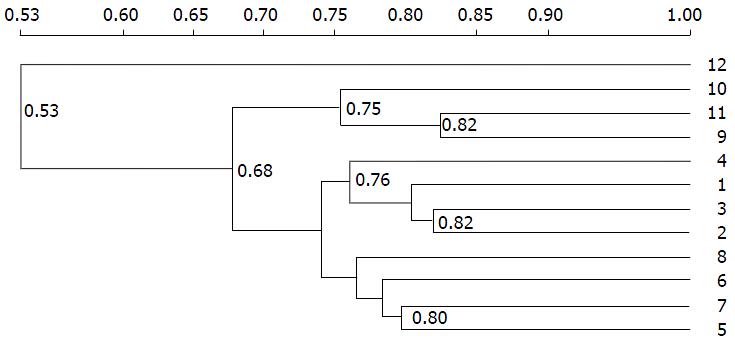
用平均数进行非权重配对法(unweighted pair-group method with arithmetic means, UPGMA)[4]对电泳图进行相似性聚类分析(图4), 发现有机组1、2、3、4单独聚成一簇, 常规组5、6、7、8单独聚成一簇, 表明有机组与常规组大鼠的肠道菌群结构具有较明显的差异. 而常规+麦粒灸干预组除去12, 9、10、12也能聚成一簇, 表明进行麦粒灸干预后大鼠的肠道菌群结构有所改变, 与常规组有一定的差别. 可见, 长期的食用有机食物、麦粒灸均能影响大鼠肠道菌群的结构.
DGGE图谱中条带的差别可以很好地反映出实验过程中大鼠肠道细菌组成的差异与相同之处. 将差异性条带经切割测序后, 用Blast工具与GenBank数据库中已有序列进行比对, 结果如表3所示. 大鼠粪便中的细菌与数据库中的已知细菌序列有很高的相似性, 均在90%以上. 在DGGE图谱中1、5、8、9为3组共有条带, 其中9号条带在9-12泳道信号有所增强, 测序结果表明1、5、8、9号条带可能菌为包氏梭菌(Clostridium populeti)、陪伴粪球菌(Coprococcus comes)、Clostridium methylpentosum、Barnesiella intestinihominis, 相似性分别为100%、99%、95%、90%, 提示厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是常规大鼠肠道内正常的优势菌群, 且麦粒灸能提高Barnesiella intestinihominis的丰度; 2为有机组特有条带, 测序结果表明2号条带可能是粪便拟杆菌(Bacteroides stercoris), 相似性为95%, 提示长期食用有机食材能促进此种细菌在大鼠肠道内的繁殖; 3、4号为常规+麦粒灸组特有条带, 测序结果表明3、4号条带可能是Barnesiella intestinihominis、粪便拟杆菌, 相似性分别为96%、99%, 提示麦粒灸能促进这两种细菌在大鼠肠道内的繁殖.
本实验中有机组、常规组、常规+麦粒灸干预组在实验12 wk后, 根据相似性聚类分析三组肠道菌群各自单独成簇, 此3组肠道菌群多样性具有差异性, 表明食用有机食物和麦粒灸足三里、脾俞穴与肠道菌群的多样性的改变存在一定的联系. 而常规+麦粒灸组中的12号单独成支, 这可能是因为个体差异性不同. DGGE整体图谱提示12 wk的有机饲料喂养大鼠肠道菌群的多样性高于常规组大鼠, 且常规组大鼠进行麦粒灸足三里、脾俞穴后, 肠道菌群的多样性有所增加. 但数字化分析此3组肠道菌群多样性情况发现, 除常规+麦粒灸组丰富度的差异具有统计学意义(P2 = 0.02<0.05、P3 = 0.04<0.05), 其余均无统计学意义. 这可能由于本实验不属于大样本(n = 4), 如常规组与常规+麦粒灸组间Shannon P = 0.06, 提示增加样本量, 则麦粒灸足三里、脾俞穴可增加大鼠肠道菌群的Shannon指数. 肠道菌群的多样性指数越高, 肠道菌群结构越稳定, 平衡越难被打破. 提示麦粒灸足三里、脾俞穴可增加肠道菌群的稳定性. 对DGGE图谱上差异性条带进行割胶回收测序, 结果表明: (1)厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是常规大鼠肠道内正常的优势菌群. 2005年Eckburg等[5]研究发现肠道微生物基本可分属于厚壁菌门、拟杆菌门、变形菌门、放线菌门、疣微菌门和梭杆菌门6大门, 其中拟杆菌门和厚壁菌门为主要优势菌群. 本实验结果与Eckburg的报道一致; (2)有机组大鼠肠道内粪便拟杆菌丰度增加, 提示此种肠道菌在食用有机饲料环境下更具有竞争力; (3)常规+麦粒灸组大鼠肠道内Barnesiella intestinihominis和粪便拟杆菌丰度增加, 提示麦粒灸足三里、脾俞穴能促进这两种细菌在大鼠肠道内的繁殖. Barnesiella intestinihominis、粪便拟杆菌属于拟杆菌门, 说明食用有机饲料和麦粒灸足三里、脾俞穴能增加拟杆菌门的丰度. Jumpertz等[6]报道, 摄入卡路里量的比例与粪便中拟杆菌门的丰度呈正相关性, 与粪便中厚壁杆菌门的丰度呈负相关性. Gordon实验室的一系列研究表明肠道菌群在"门"水平上的差异是取决于体质量水平, 临床研究也证实在肥胖患者的肠道中表现为低丰度的拟杆菌和高丰度的厚壁菌门[7,8]. 本实验结果与此相符合, 相比于常规大鼠, 经麦粒灸干预的大鼠具有高丰度的拟杆菌门.
有机食品是国际上对无污染天然食品比较统一的提法, 是一类真正来自于自然、富营养、高品质和安全环保的生态食品. 饮食是决定肠道菌群细菌组成的最重要的因素之一[9], Zhang等[10]研究发现饮食结构的变化能够引起肠道菌群结构发生改变. 任婷婷等[11]实验发现高脂饮食可导致肠道菌群结构的改变, 益生菌(乳杆菌、双歧杆菌)及常规共生菌(拟杆菌、肠球菌)数目的下降. 本实验发现相比于饲喂常规饲料的大鼠, 长期饲喂有机食物能增加大鼠肠道菌群的多样性.
麦粒灸法是我国最早的治病方法之一, 文献报道麦粒灸具有一定的抗炎[12]、调脂[13,14], 改善消化系统[15], 提高免疫力等作用[16,17], 还能改善亚健康人群的生存质量[18]. 近几年, 研究发现作为人体最大的微生态系统, 肠道菌群能直接和间接地影响宿主机体的生长、发育以及免疫活性和内环境的稳态等, 其与代谢性疾病存在密切联系. 高仁元等[19]研究发现肠癌大鼠与正常对照组相比出现粪便菌群结构的偏移, 毛螺菌科(Lachnospiraceae)、Ruminococcaceae科菌、肠乳杆菌(Lactobacillus intestinalis)、帕拉普氏菌属(Paraprevotella)、鼠乳杆菌(Lactobacillusmurinus)、乳杆菌属(Lactobacillus)、普氏菌属(Prevotella)、卷曲乳杆菌(Lactobacilluscrispatus)和Lachnospiracea incertae sedis等有益菌减少, 粪芽孢菌属(Coprobacillus)潜在致病菌增加. 虽无麦粒灸在饮食诱导的模型中对肠道菌群影响的报道, 但成泽东等[20]研究发现艾灸关元灸可有效升高肠道中双歧杆菌、乳酸杆菌两种厌氧菌及大肠埃希菌、肠球菌两种需氧菌的菌群数量, 调整肠道菌群失调, 并可改善慢性疲劳状态. 足三里属胃经的代表性穴位, 其经脉在表"从缺盆理乳内廉, 下夹脐, 入气街中", 在里"起于胃口, 下循腹里, 下至气街中而合", "入缺盆, 下膈, 属胃, 络脾", 对中焦气机失调, 腹部气血异常起调整作用. 脾俞是足太阳脾经的背部腧穴, 与脾脏有内外相应的联系, 为脾经经气输注于背部之处, 脾为后天之本, 主统血, 脾健则精充, 精充则气壮, 气壮则能摄血; 同时脾主运化水谷精微和水湿, 有促进水液代谢的作用. 余华等[15]在麦粒灸对实验性脾虚泄泻证大鼠空肠肥大细胞的影响研究中发现, 麦粒灸灸"脾俞"、"胃俞"、"足三里"可促进机体消化吸收功能、改善机体内环境、调节免疫功能, 从而使抗原减少、肠道菌群紊乱得以遏制、炎症减轻. 故本实验采用麦粒灸法, 取足三里、脾俞穴以健脾和胃、调理中焦、培补后天之本, 发现麦粒灸足三里、脾俞穴可提高肠道菌群的多样性、增加拟杆菌门的丰度.
总之, 本研究结果显示有机食物与常规食物对大鼠肠道菌群有差异性改变, 食用有机食物、麦粒灸足三里、脾俞穴均可提高肠道菌群的多样性, 且麦粒灸干预效果较显著; 提示长期有机饮食、麦粒灸有利于肠道菌群的稳定、利于健康.
肠道菌群系统作为人体最大的微生态系统, 能直接和间接地影响宿主机体的生长、发育以及免疫活性和内环境的稳态等, 因其对机体的健康和疾病都有着重要的作用. 而基因、饮食、年龄、肠道环境及生存环境等, 都将影响肠道菌群结构.
谭周进, 教授, 湖南中医药大学
基于PCR-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient electrophoresis, PCR-DGGE)对食用不同食材大鼠肠道菌群进行比较, 并观察麦粒灸对大鼠肠道菌群的影响, 便于寻求一种利于肠道菌群稳定的健康养生方式.
目前已有研究发现肠道菌群与肥胖、糖尿病、肠道疾病以及心血管疾病等多种代谢性疾病密切相关甚至是起到关键作用, 其可能机制与低度炎症及肠屏障功能损伤相关. 通过调节肠道菌群, 可以帮助恢复肠道内环境的稳态, 减少疾病的发生.
本文以PCR-DGGE技术为手段, 结合中国传统康复方法与理念, 从微生态学的角度, 首次观察有机食物和麦粒灸对大鼠肠道菌群多样性的影响.
随着对肠道微生态及其致病机制的深入研究, 相关研究成果可以为以肠道菌群为靶点进行的健康饮食和康复干预提供理论参考.
PCR-DGGE技术: 主要原理是基于DNA碱基配对的基础, 将具有相同长度但不同组成的双链PCR产物分离, 使具有不同序列的DNA片段停留在凝胶的不同位置, 形成相互分开的条带图谱, 从而对菌群进行分离.
本文从微生态学的角度, 以SD大鼠为模型, 首次观察了有机食物和麦粒灸对大鼠肠道菌群多样性的影响, 证实了食材质量以及麦粒灸对肠道微生态都有调节作用. 该文选题新颖、设计合理、结果有说服力, 对于理论和临床实践都有一定的开拓意义.
编辑: 郭鹏 电编:都珍珍
| 1. | Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T, Pons N, Levenez F, Yamada T. A human gut microbial gene catalogue established by metagenomic sequencing. Nature. 2010;464:59-65. [PubMed] [DOI] |
| 2. | Cani PD. Crosstalk between the gut microbiota and the endocannabinoid system: impact on the gut barrier function and the adipose tissue. Clin Microbiol Infect. 2012;18 Suppl 4:50-53. [PubMed] [DOI] |
| 3. | Muyzer G, de Waal EC, Uitterlinden AG. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA. Appl Environ Microbiol. 1993;59:695-700. [PubMed] |
| 4. | Fromin N, Hamelin J, Tarnawski S, Roesti D, Jourdain-Miserez K, Forestier N, Teyssier-Cuvelle S, Gillet F, Aragno M, Rossi P. Statistical analysis of denaturing gel electrophoresis (DGE) fingerprinting patterns. Environ Microbiol. 2002;4:634-643. [PubMed] [DOI] |
| 5. | Eckburg PB, Bik EM, Bernstein CN, Purdom E, Dethlefsen L, Sargent M, Gill SR, Nelson KE, Relman DA. Diversity of the human intestinal microbial flora. Science. 2005;308:1635-1638. [PubMed] |
| 6. | Jumpertz R, Le DS, Turnbaugh PJ, Trinidad C, Bogardus C, Gordon JI, Krakoff J. Energy-balance studies reveal associations between gut microbes, caloric load, and nutrient absorption in humans. Am J Clin Nutr. 2011;94:58-65. [PubMed] [DOI] |
| 7. | Ley RE, Turnbaugh PJ, Klein S, Gordon JI. Microbial ecology: human gut microbes associated with obesity. Nature. 2006;444:1022-1023. [PubMed] |
| 8. | Ley RE, Bäckhed F, Turnbaugh P, Lozupone CA, Knight RD, Gordon JI. Obesity alters gut microbial ecology. Proc Natl Acad Sci U S A. 2005;102:11070-11075. [PubMed] |
| 9. | Zhang C, Zhang M, Wang S, Han R, Cao Y, Hua W, Mao Y, Zhang X, Pang X, Wei C. Interactions between gut microbiota, host genetics and diet relevant to development of metabolic syndromes in mice. ISME J. 2010;4:232-241. [PubMed] [DOI] |
| 10. | Zhang X, Shen D, Fang Z, Jie Z, Qiu X, Zhang C, Chen Y, Ji L. Human gut microbiota changes reveal the progression of glucose intolerance. PLoS One. 2013;8:e71108. [PubMed] [DOI] |