修回日期: 2014-08-26
接受日期: 2014-09-10
在线出版日期: 2014-11-08
肝细胞癌(hepatocellular carcinoma)并不是单纯由肝癌细胞构成, 他还包括了由多种彼此之间相互作用的细胞以及细胞外基质所形成的存在复杂交汇网络的肝癌微环境. 肝癌微环境不仅对肝癌细胞的生长起支持作用, 还可通过刺激肝癌细胞的增殖、迁移以及血管新生从而促进肝癌细胞的侵袭, 因此, 其可从多方面决定肝癌的表型. 本文就肝癌微环境在肝癌发生发展中的作用及其在肝癌预后预测和治疗中的应用作一综述.
核心提示: 对于肝癌的发生发展的认识, 要重视肝癌细胞自身的情况下, 同时不能忽略肝癌微环境的影响. 尽管肝癌细胞自身是肝癌发展的根据, 但是肝癌微环境对肝癌的发展起着加速或延缓的作用. 肝癌细胞和肝癌微环境两者在相互依存、相互利用、相互促进中共同地得到发展, 并决定了肿瘤发展的基本趋势.
引文著录: 章诺贝, 张吉翔. 肝癌微环境的研究进展. 世界华人消化杂志 2014; 22(31): 4774-4784
Revised: August 26, 2014
Accepted: September 10, 2014
Published online: November 8, 2014
Hepatocellular carcinoma (HCC) is not just composed of liver cancer cells; it contains several cell types and extracellular matrix that interact with each other, creating a complex interaction network within a permissive microenvironment. The tumor microenvironment in HCC can not only support liver cancer cell growth but also promote tumor invasion through the stimulation of cancer cell proliferation, migration, and invasion and activation of angiogenesis, which together determine the phenotype of HCC. In this review, we provide an overview of current knowledge on the role of the tumor microenvironment in HCC and its application in prognosis prediction and treatment.
- Citation: Zhang NB, Zhang JX. Advances in research of tumor microenvironment in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(31): 4774-4784
- URL: https://www.wjgnet.com/1009-3079/full/v22/i31/4774.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i31.4774
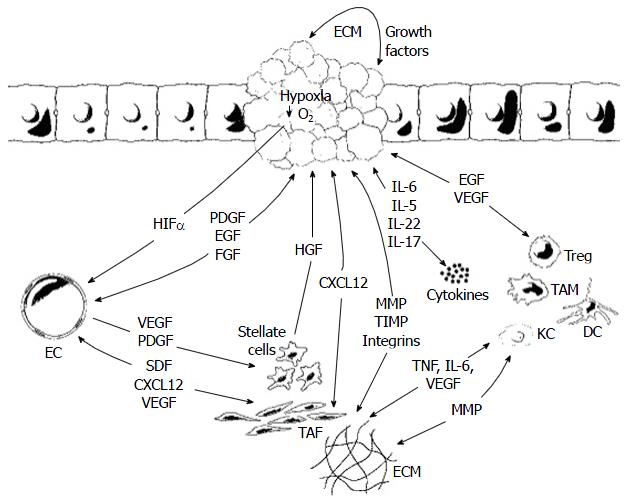
肝癌微环境是指肝癌组织中由非肝癌细胞和细胞外基质(extracellular matrix, ECM)所共同构成的复杂混合物, 其可促进肝癌的发生和发展[1]. 肝癌细胞并不能完全展示肿瘤的全部特征, 被异常激活的ECM, 也参与形成了肝癌细胞的恶性表型[2](图1).
肝细胞癌(hepatocellular carcinoma, HCC)的发生发展是一个多阶段、多步骤的过程. 慢性损害因素如乙型肝炎病毒(hepatitis B virus, HBV), 丙型肝炎病毒(hepatitis C virus, HCV)感染和酒精性肝炎可通过产生活性氧(reactive oxygen species, ROS)、DNA损伤、内质网应激, 肝细胞坏死而诱导肝脏损伤. 肝脏对慢性损害因素的反应包括肝星状细胞(hepatic stellate cells, HSCs)和巨噬细胞等基质细胞的激活, 他们可生成细胞外基质及生长因子进而促进内皮细胞(endothelial cells, ECs)迁移、血管新生以及纤维化. 此过程与实质细胞的变形, ECs窗孔面积的缩小, Ⅳ型胶原和层黏连蛋白等基底膜成分在Disse间隙的沉积以及以进行性毛细血管化为特点的血管构筑有关. 此过程通过炎症及DNA氧化损伤诱导癌前(preneoplastic)肝细胞或肝干细胞内基因突变与表观遗传异常, 从而促使异常增生结节形成及其恶性转化[3].
越来越多的证据表明[4], 基质细胞参与癌症特征的形成, 如持续的增殖信号、生长抑制的逃避、细胞永生化、血管新生、肿瘤细胞的侵袭与转移、能量代谢的重塑、免疫逃逸等, 因此, 微环境的改变被认为可促进肿瘤的进展, 并在肿瘤化学治疗抵抗中起重要作用. 此外, 肝癌微环境在肝癌的预后评估中起关键作用, 肝癌周边的非肝癌组织的病理状态可对肝癌手术切除或局部消融后肿瘤复发进行预测, 敏感性为70%[5]. 肝癌在手术切除或消融后具有代表性的2种复发模式有: 原肿瘤的转移(一般在肿瘤切除或肝移植后2年内, 即早期复发)和再发(在治疗2年后, 即远期复发)[6,7]. 其中, 远期复发是由发生肝纤维化以及肝硬化的肝脏内受损的周围微环境所持续释放的促肿瘤信号所诱导的[8]; 肝癌微环境中不同的分子亚组已经被确认, 并与预后不良有关[9]. 由邻近肝癌的非肿瘤组织所编码的基因表达谱是在肿瘤的早期(例如, <2 cm的肿瘤、无血管入侵或肝外扩散)对患者临床预后进行预测所必须的, 其可能比对肿瘤细胞本身的基因描述更加具有说服力[9].
慢性肝病的癌前环境是以炎症、纤维化以及血管新生为特征性表现. 以上这些生物学进程在肝脏衰竭的进展中越发显著, 同时肿瘤的发生风险也呈指数性上升. 此外, 缺氧、氧化应激也在此过程中同步出现.
血管新生在肝癌发生的早期阶段就开始扮演重要角色, 包括诸如动脉化以及肝窦毛细血管化等血管异常[10]. HCC是一种血供丰富的肿瘤, 病理性血管新生是慢性肝病的主要病理生理改变之一. 慢性肝脏损害所致的肝脏损伤-修复反应可导致肝纤维化, 该过程需要基质细胞分泌某些促血管生成因子, 尤其是基质金属蛋白酶(matrix metalloproteinases, MMPs)、血小板源性生长因子(platelet-derived growth factor, PDGF)、转化生长因子β1(transforming growth factor-β1, TGF-β1)、成纤维细胞生长因子(fibroblast growth factor, FGF)以及血管内皮生长因子(vascular endothelial growth factor, VEGF).
VEGF基因的表达产物是最关键的促血管因子, 其在异常增生结节中被诱导生成, 其表达量在HCC的进展过程中进一步增加. 一旦肿瘤出现, 肿瘤细胞的存活要求形成新的血管网络以为其提供足够的氧气及养分. HCC中的血管新生是一个极为复杂的、受到精密调控的过程, 并在分别来自肿瘤细胞和宿主细胞的促血管生成因子和抗血管生成因子之间取得平衡. 肿瘤的生长可造成一个缺乏氧气和养分的微环境, 其可诱导EC的激活与增殖, 进而导致ECs从原有血管中出芽生成新的血管. ECs由此变得具有增殖性, 并可释放出酶类以破坏基底膜, 之后他们出现迁移并集结, 最终与ECM一起形成新生血管[11]. VEGF基因的表达与HCC的侵袭性有关. VEGF在与其受体VEGFR1与VEGFR2结合后可导致参与内皮增殖、迁移、侵袭的信号途径的激活. 其次, VEGF还可以作为一种细胞因子直接作用于HSC、Kupffer细胞以及肝细胞[12], 并介导血管基底膜与细胞间质中基质的降解. VEGF与血管生成素2(angiopoietin 2)被认为是进展期HCC的独立预测标志物[13,14]. 血管生成素2在HCC中常出现表达上调, 其可增强VEGF对ECs的作用. 此外, ECs及HSCs均有血管生成素受体Tie-2的表达, 进一步表明HCC中可能存在复杂的血管生成调控机制.
FGF是肝素结合生长因子家族成员之一, 可与VEGF协同诱导血管新生, 而PDGF则参与了细胞的迁移和新生血管的成熟. 肿瘤细胞可通过由ECs与成纤维细胞参与的旁分泌机制分泌PDGF, 其与HCC的进展有关. 另外, 其他重要的血管新生中介物, 如, 整合素和钙黏蛋白可分别通过介导细胞-基质和细胞-细胞间的相互作用而诱导HCC的血管新生[11].
HCC常发生于具有活动性炎症环境的肝病中. 炎症是损伤与修复的必要病理生理过程. 而慢性炎症可导致不恰当的损伤修复反应并促使肝细胞的死亡与再生, 最终促使异常增生结节与肿瘤的产生.
一些炎症介质在持续的炎症和免疫抑制中发挥作用从而参与HCC的发生发展. 肿瘤的发生与细胞因子持续的产生有关, 细胞因子可激活多种具有不同特征的细胞并介导细胞间过度的相互作用. 在肝癌细胞内以及在肝癌微环境中细胞因子均出现改变. 与辅助T细胞Th1样细胞因子相比, 在肿瘤微环境中占主导地位的Th2样细胞因子[白介素4(interleukin-4, IL-4)、IL-5、IL-8、IL-10]在介导HCC的侵袭与转移中具有更加重要的作用[15,16]. 在肝硬化的肝组织中表达大量的IL-6, 他是由Kupffer细胞在对肝细胞损伤信号作出反应后产生的, 其可激活转录激活因子3(signal transducer and activator of transcription 3, STAT3)信号通路, 与HCC的发生以及预后不良有关[17]. 近来发现, 雌激素可通过抑制HGF和IL-6对炎症微环境进行调控从而抑制HCC的转移[18]. 在HCC的微环境中还发现有IL-22的高水平表达, 其也可通过激活STAT3诱导肿瘤生长, 抑制肿瘤细胞凋亡并促进肿瘤转移[19]. 此外, IL-23可通过激活核因子-κB(nuclear factor κB, NF-κB)/p65信号途径上调MMP9的表达进而促进HCC的转移[18,20]. 然而, 在HCC及其癌周组织中IL-2和IL-15、IL-24、IL-36α高水平的表达却与肿瘤肝内复发的风险降低以及患者生存期延长有关[21-23].
趋化因子(CXCL12、CX3CL、CCL20)是一类具有趋化特性的与细胞因子类似的分子, 其在诱导细胞进出肿瘤微环境中起关键作用. 他们通过与炎症细胞, ECs和上皮细胞表面的4个其受体家族(CCR、CXCR、CX3CR、XCR)结合从而协同调控炎症反应. 趋化因子在包括免疫逃逸, 血管新生, 肿瘤细胞侵袭, 扩散等肿瘤进展的多个关键步骤中均起重要作用[24]. CXCL12-CXCR4信号转导通路对调控血管新生尤为重要, 其在HCC中的表达量要高于肝硬化. CXCL12在ECs上与CXCR4结合后可与VEGF协同促进ECs的迁移、增殖以及血管新生[25]. CXCL12-CXCR4信号转导通路同样也在HCC的生长、侵袭以及转移中发挥重要作用[26]. 在调控HCC发生发展中另一个重要的信号转导通路为CCL20-CCR6, 其可诱导循环中的调节T细胞(regulatory T cells, Tregs)进入肿瘤微环境. CCR6的表达上调可促进肿瘤生长, 肿瘤细胞的低分化以及肿瘤肝内转移[27]. 此外, 近来还发现, 可产生CCL2的中性粒细胞也参与了HCC的进展, 并与患者生存率下降有关[28].
由NF-κB和STAT3介导的信号途径参与了肝脏损伤的炎症反应从而在肝细胞再生过程中起关键作用. 在这两条信号途径中具有相互重叠的靶基因. 促炎刺激物, 如肝炎病毒, 游离脂肪酸可通过激活NF-κB从而促进炎症性肝脏内HCC的发生发展[29]. STAT3在未受到刺激的细胞内处于失活状态, 而其在受到由肿瘤微环境内产生的细胞因子以及生长因子的磷酸化作用后而被迅速的激活. 在HCC的组织标本中已检测到活化的STAT3, 并且其与肿瘤具有更强的侵袭性以及患者预后不良有关[30]. Toll样受体(Toll-like receptors, TLR)是参与非特异性免疫(天然免疫)的一类重要蛋白质分子, 也是连接非特异性免疫和特异性免疫的桥梁, 分布于不同的免疫细胞表面. 其中, TLR3、TLR4、TLR9高表达与HCC的侵袭性增强和预后不良有关[31].
此外, 某些生长因子还可在HCC的微环境中调控免疫及炎症反应, 如TGF-β、HGF以及表皮生长因子(epidermal growth factor, EGF). TGF-β是一种在正常及癌前细胞中的肿瘤抑制因子, 但其却在肿瘤细胞内扮演癌性生长因子的角色. TGF-β绝大部分在基质细胞而不是在恶性上皮细胞内表达, 其表达水平在HCC中显著升高[32]. TGF-β受体Ⅱ的表达下调与HCC预后不良, 如肿瘤体积大, 分化程度低, 肝内转移以及无复发生存期短等有关. 另外, HGF与EGF也可调控肝癌细胞的增殖与侵袭[33]. 在HCC等多种肿瘤中均发现HGF受体c-Met的过度表达, 其也与HCC患者预后不良有关. 而由c-Met调控的下游基因也可作为对具有预后不良和侵袭性表型的HCC患者进行预测的标记[34]. EGF受体通过对血管生成因子的调控以及对肿瘤细胞和ECs的直接作用同样也在肿瘤血管新生与肿瘤进展中发挥重要作用[35].
ECM是肝脏维持正常构造所必须的, 其不断的与肿瘤周围环境发生相互作用, 介导信号的转导并影响基因的表达. 在肝脏疾病中, ECM修饰酶类的活性失调, 从而导致以弹性下降和生长因子大量产生为特点的肝纤维化微环境的形成进而参与HCC的发生. 过量的ECM可干扰肝纤维化的可逆性. 胶原蛋白交联的失控以及ECM的硬化可通过增强整合素信号转导从而在HCC的发生中扮演重要角色[36]. 此可导致纤维状胶原Ⅰ, 纤维状胶原Ⅱ以及纤维连接蛋白在肝脏内过多的沉积, 并通过对整合素家族活性的调控进而增强肿瘤细胞的生长、存活以及增殖能力. 在阻断整合素α1β1和α2β1后可抑制肝癌细胞通过某些生长因子(如TGF-β1、EGF、FGF)而发生的迁移, 由此可提示以上两者可参与肿瘤的侵袭[37].
ECM稳态的失调可直接作用于上皮细胞并导致细胞的恶性转化以及恶性细胞的转移. 肿瘤生长要求肝组织原有边界的崩解与重构, 此过程主要由MMPs和基质金属蛋白酶抑制物(inhibitor of metalloproteinases, TIMPs)所调控. 过量表达的MMPs可使肿瘤细胞更易通过基底膜屏障而发生侵袭. HCC具有高蛋白水解活性以及高MMP2表达水平. 另外, MMPs与TIMPs之间的失衡也与肿瘤转移及预后不良有关[38]. 在受肿瘤细胞侵袭以及血管新生较活跃的部位常可见到线性的致密的胶原纤维形成, 一些研究显示, 肿瘤细胞可在胶原纤维上进行迁移[39]. 另外, 赖氨酰氧化酶2可通过促进纤维状胶原蛋白1的交联从而调节ECM的硬化, 其参与了病理性基质的形成进而促进肿瘤的生长与转移[40].
虽然HCC为高度血管化的肿瘤, 但肿瘤血管功能存在异常, 故局部缺血缺氧较为常见. 另外, 细胞外基质的沉积以及纤维化进程中的解剖学改变也可使血管阻力增加, 从而影响氧气的交换导致组织缺氧. 细胞氧供的下降可诱导缺氧诱导因子1(hypoxia-inducible factor 1, HIF-1)的表达, HIF-1是一可对某些在血管新生、免疫逃逸、肿瘤细胞侵犯、转移中起关键作用的基因表达进行调控的转录因子. HIF-1高表达水平还提示HCC患者预后不良[41].
癌细胞除了可固有地产生氧化应激外, 其还处于由某些间质成分所造成的促氧化微环境中. ROS的过量产生可通过其与DNA、RNA、脂质以及蛋白质的相互作用引起氮化应激与氧化应激进而导致基因突变频率增加, 表观遗传变化以及蛋白质功能异常. 氧化应激可激活成纤维细胞并产生可介导肿瘤进展的介质. 肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)可通过激活NADPH氧化酶2(nicotinamide adenine dinucleotide phosphate-oxidase 2, NOX2)和可诱导型一氧化氮合成酶产生ROS从而促进肿瘤的生长, 侵袭与转移. 最近, 有研究报道, 某些调控Wnt/β-catenin信号途径的特殊基因(RPS6KA3-AXIN1和NFE2L2-CTNNB1)的突变可通过影响氧化应激与代谢作用进而促进HCC的发生[42]. 此外, 高水平的ROS也可通过诱导MMPs的产生而增强HCC的侵袭性[43].
HCC常由严重受干扰的可使上皮细胞功能失调以及恶性转化的微环境中发展而来. 因此, 将微环境成分作为靶点对HCC进行干预可作为一条合理的治疗途径. 因此我们对微环境中一些主要的细胞成分进行描述.
HSCs可通过产生生长因子和细胞因子(如HGF、IL-6)促进肿瘤细胞的增殖[44,45]. 另外, 由激活的HSCs所产生ECM成份(如层黏连蛋白-5)也可调控肝癌细胞的增殖与转移[46]. 新近研究发现, 脱氧胆酸(deoxycholic acid, DCA)可通过激活HSCs内的衰老相关分泌表型(senescence-associated secretory phenotype, SASP)从而刺激HSCs分泌多种炎症因子及促肿瘤因子进而促使HCC的发生发展. DCA是一种肠道细菌代谢产物, 可经肠肝循环进入肝内, 其可导致DNA损失伤. 饮食或遗传性肥胖可导致肠道菌群失调, 从而促使肠道DCA水平升高[47]. 将HSCs暴露于来源于肝癌细胞的条件培养基中可导致HSC的激活, 迁移以及促血管生长因子A(VEGFA)的表达[44]. 近来还有研究发现, 肝癌细胞与激活的HSCs之间的相互作用可上调HSCs中IL-6、IL-8等炎症因子与趋化因子的表达, 调节肝癌细胞的表型向能动细胞转化, 还可通过诱导HSCs表达VEGFA和MMP-9从而形成一种促血管生成微环境[48]. 有趣的是, 整合基因组学显示, 与肝癌细胞和HSCs之间相互作用有关的基因标记可提示肝癌的预后不良和肿瘤转移倾向[48]. TGF-β除了作为促炎因子外, 还在由HSCs所诱导的肝细胞恶性转化中起关键作用[49]. HSCs除了参与HCC早期进程, 还通过产生诸如TGF-β、ECM蛋白、MMP、VEGFA等上皮-间充质细胞转化的诱导因子, ECM形成的调控因子, 促血管形成因子以及免疫抑制因子直接参与形成促肿瘤转移微环境, 从而促进HCC后期进展[45]. 其次, HSCs可通过产生免疫调节因子(如MCP1、RANTES、CCL21)从而增强炎症因子的趋化性, 并促进其黏附与活化[44,50]. 另外, HSCs还可通过向ECs旁分泌VEGFA和血管生成蛋白从而形成一个促血管新生微环境[50].
HCC中富含免疫细胞. 肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes, TILs)是实体瘤中固有的免疫细胞, 其构成了是一种宿主抗肿瘤反应. 大部分肿瘤浸润细胞为CD4+ T细胞(Th或Treg细胞). 在HCC中, 由CD4+淋巴细胞分泌的IL-17的水平上调与肿瘤切除后复发有关. Treg细胞因其可引起宿主对肿瘤细胞的免疫耐受故而在肿瘤发生发展中起决定性作用并与HCC的TNM分期有关[51,52]. HCC中常有Treg细胞浸润, 若Treg细胞较TCD8+更占优势则提示患者预后不良[53]. 近来发现, Treg细胞可通过TGF-β和IL-10干预γδ T细胞的功能, γδT细胞是执行固有免疫功能的T细胞, 能识别癌抗原, 杀伤癌细胞[54]. 还有学者指出, 髓源性抑制细胞在T细胞调控和诱导中发挥作用, 可促进微环境内的免疫抑制反应[55]. 在HCC患者体内发现, 树突状细胞(dendritic cells, DC)数量减少且功能失调, 此可导致宿主对肿瘤的免疫抵抗低下. 然而, 最近却有研究发现, CD14+树突状细胞可显著抑制T细胞反应进而促进肝癌的进展[56]. 此外, Vγ4 γδ T细胞也可通过产生IL-17A从而促进HCC的生长. IL-17A可抑制由CD8+ T细胞介导的肿瘤免疫反应[57].
肿瘤相关成纤维细胞(tumor-associated fibroblasts, TAFs)是HCC基质中胶原蛋白的主要来源. TAFs与正常的成纤维细胞不同, 其可分泌高水平的基质细胞衍生因子与CXCL12, 并可促进肿瘤的生长以及血管新生. TAFs与肿瘤细胞之间存在复杂的交汇, TAFs与肿瘤细胞均可分泌PDGF和TGF-β从而诱导HSCs的激活以及ECM的沉积, 而PDGF和TGF-β又可促进肿瘤细胞的生长与迁移[58]. 另外, TAFs可通过分泌VEGF和MMPs以及某些肝细胞生长因子(如HGF)而与微血管系统发生相互作用[44]. 其次, TAFs还可分泌免疫调节因子(IFN-γ、IL-6、TNF)进而动员细胞毒T淋巴细胞, 自然杀伤细胞以及TAMs[59]. TAMs代表了CD11b+肿瘤浸润细胞的一个亚群, 以可表达Tie-2血管生成素受体为特征[60]. TAMs可抑制HCC中的抗肿瘤免疫反应, 其水平增高与患者预后不良有关. TAMs还可释放EGF, 趋化因子, MMPs和VEGF从而调控肿瘤生长, ECM重塑, 血管新生以及肿瘤侵袭与转移[1]. 最近有报道指出, c-Myc可控制TAMs的活化, 并可干扰VEGF信号途径以及炎症细胞的浸润. 此为一双向调控机制, 肿瘤微环境条件改变, 如组织缺氧也可影响Myc信号途径[61].
基因组研究显示, 肿瘤的微环境可用于评价HCC患者的预后. 有研究报道, 来自肝癌周边非肿瘤组织中的36个基因标记可对HCV相关性肝癌患者的多中心发生和晚期复发进行预测[62]. 另外, Hoshida等[7]确认了一些在早期肝癌患者的肿瘤周边肝硬化组织中针对于肿瘤晚期复发进行预测的标记. 这些标记反映出存在一种不依赖于已经被切除的原发性肝癌的, 在异时性肿瘤的发生发展中起促进作用的促瘤微环境(protumorigenic milieu). 有趣的是, 在另一项对216例HCV相关性肝硬化患者10年的随访中也发现以上基因标记可对肝癌的发生进行预测[2]. 这些标记包括了IL-6、NF-κB等参与炎症的基因以及EGF. EGF因其具有致癌活性故在HCC的分子发病学机制中具有重要地位. 近年来发现, EGF基因的多态性(EGF 61*G)与慢性HCV感染、进展性肝纤维化以及肝硬化患者罹患肝癌的风险显著升高有关[63]. 此多态性可延长癌前组织中EGF mRNA的半衰期, 从而导致在受损的癌前组织中有持续的EGF表达进而促进HCC的发生. 此外, 还有研究报道, 来自由不同病因所致HCC患者的邻近肿瘤的非肿瘤组织中, 有19个microRNA可对预后不良的患者进行较为精确的预测. 与其他转录组学研究的数据相似, 此报道同样也发现, 来自肿瘤本身的microRNA并不能对HCC患者的预后进行评价[64].
肿瘤细胞, 基质细胞与ECs之间的相互作用对肿瘤细胞的迁移、侵入ECM和血管新生具有深远的影响, 可促进肿瘤细胞的转移. 已发生转移的肝癌的肝脏内的基因表达与未发生转移的肝脏内基因表达存在差异. 研究者发现, 利用来自HBV相关性HCC患者癌旁组织中的17个基因标记可对肿瘤的转移进行预测. 这些基因的产物大部分为受Th2所调控的细胞因子, 他们与原发肿瘤中的标记存在明显区别. 更重要的是, 肿瘤邻近组织中提示预后不良的标记与转移相关性标记并不依赖整个肝脏的炎症状态[7,16]. 然而, 包括CXCL10、CCL5和CCL2在内的可诱导CD8+ T细胞和自然杀伤细胞的14个免疫基因标记却被发现与早期HCC患者相对好的预后有关[65].
由于肿瘤微环境在HCC的自然史中扮演关键角色, 故针对肿瘤与基质之间的动态网络进行合理的调控, 可成为治疗该疾病的一项策略. 对肿瘤微环境的调控的优势在于这些靶细胞具有基因稳定性的特点, 因此很少出现抗药性. 近年来, 肿瘤微环境已被作为一个针对于处于癌前状态或HCC患者的关键性治疗靶点. 炎症、纤维化、血管新生以及细胞增殖、生存信号途径的调控剂, 可对早期HCC进行有效地预防和治疗. 由于炎症途径(如IL-6、NF-κB)以及EGF参与了肝硬化患者肝癌的发生和早期肝癌的病理生理进程, 因此干预以上网络将是一种有效的防治策略. 如上所述, 近来发现存在EGF基因61*G多态性的肝硬化患者比其他肝硬化患者具有更高的罹患HCC的风险, 此进一步支持EGF途径在癌前阶段的促肿瘤作用. 因此, EGF途径的抑制剂如EGF受体细胞内区域的酪氨酸激酶抑制剂(如埃罗替尼, 吉非替尼)被认为是一种具有前途的药物. 化学治疗研究中的一个关键问题是需要数千例患者以及长期随访以显示其临床有效性, 而这些问题可以通过针对具有高风险罹患HCC的患者进行研究而得到解决. 例如, 将具有提示预后不良标记的患者(约占20%)或存在EGF基因G/G表型的患者挑选出来[6].
除了EGF的抑制剂外, 预临床研究结果显示索拉非尼也可作为一种有效的化学预防药物. 索拉非尼除了可阻止由硫代乙酰胺导致的大鼠肝纤维化并降低门脉压力, 还可显著改善和缓解肝硬化大鼠的肝脏损害, 肝内炎症与血管新生. 由于血管新生是HCC的标志之一故阻止新生血管生长或使肿瘤血管正常化的治疗可作为阻止肿瘤进展的一项重要策略. 索拉非尼可通过同时作用于肿瘤血管(以VEGFR2、VEGFR3、PDGFR-β为靶点)和肿瘤细胞(抑制Ras/MEK/ERK途径)从而抑制血管新生和肿瘤增殖[66]. 有报道称尤其是那些接受经导管动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)的患者可在索拉非尼抗血管生成作用中获益, TACE人为的干预了进入肿瘤的血管, 此导致肿瘤处于缺氧状态故而引起术后患者体内出现高水平的VEGF[67]. 其他若干针对HCC的抗血管生成药物也正在接受第2或第3期临床试验, 他们当中大部分均为针对血管生成介质和生长因子受体(如VEGF受体、PDGF受体、FGF受体)的小分子抑制剂, 而另一部分为特异性单克隆抗体, 如贝伐单抗, 其针对于VEGF, 并已经被FDA推荐用于治疗包括转移性结肠癌在内的多种肿瘤. 另外, ramucirumab也是一针对VEGF2的单克隆抗体[68]. 尽管在刚开始, 运用抗血管新生治疗HCC是令人兴奋的, 然而, 他们出现的不良反应(如消化系出血, 血栓栓塞, 高血压)也开始受到人们的关注. 关于比较舒尼替尼与索拉非尼两者药效的第三期临床试验也因为严重的药物不良反应而被迫中止. 此外, HCC还可通过激活其他替代途径而形成针对抗血管生成药的抗药性, 此可干扰对HCC患者的临床治疗[10].
HCC微环境中纷繁复杂的免疫成分可部分解释HCC治疗的棘手. 因此, 新的治疗策略还应针对HCC的炎症途径与免疫调控. 已有报道称, STAT3抑制剂可影响TGF-β的信号转导. OPB-31121作为一种口服的STAT3抑制剂正在进展期肝癌的患者中进行第一期和第二期临床试验. 其次, 单克隆抗体(anti-CTLA4, tremelimumab)可通过结合并刺激T淋巴细胞从而提升抗肿瘤免疫反应, 其疗效正在针对HCV相关性HCC患者的临床试验中于予评价[69].
此外, ECM重构控制信号的调节剂或肿瘤转移抑制剂(如TGF-β、HGF/c-Met、MMPs)也可作为另一种针对HCC微环境的化学治疗. TGF-β抑制剂LY2109761在HCC异种移植模型中的预临床试验结果显示出其具有较好的应用前景[70]. 然而, 关于MMPs抑制剂的临床试验发现, 其对处于肿瘤进展阶段的患者无效, 并可导致一些不可耐受的不良反应[71]. 最近, 一项针对于已对一线治疗耐药或无反应的无法手术切除的HCC患者的2期随机对照临床试验研究显示, 一种特异性Met抑制剂tivantinib(ARQ197)可延长具有高水平Met的HCC患者的生存期[65]. 另一个c-Met/VEGFR2的双向抑制剂卡博替尼(XL184)在2期临床试验中也显示出其具有抗肿瘤活性[72]. 而一个完善的治疗方案将要求同时以肿瘤微环境及肿瘤本身为靶点, 例如, 在HCC的异种模型中发现唑来膦酸可通过减少TAMs而显著增强肿瘤对索拉非尼的反应[73].
HCC常发生于出现广泛炎症及纤维化的受损肝脏中. 免疫细胞, HSCs以及巨噬细胞等可通过产生细胞因子和ECM成分从而促进血管生成以及受损肝细胞的存活, 此再生反应可促进突变和表观遗传变异进而可导致异常增生结节的恶性转化. 基质与肿瘤细胞间的相互作用是动态变化的, 并可显著影响HCC尤其是早期HCC的生物学行为. 近年来研究表明了EGF和炎症途径在肝硬化患者HCC发生发展中以及在HCC患者手术切除后肿瘤复发中的重要作用. 这些发现为人们提供了预防及治疗HCC的新靶点. 虽然一些抗血管生成药和抗细胞增殖药已经进入第2期或第3期临床试验, 但是现在仍然缺乏关于ECM成分的调控剂与炎症途径抑制剂的深入研究. 此外, 由于免疫细胞在HCC发生发展中的重要作用, 因此, 对肿瘤免疫微环境的重新编配, 如减少Treg细胞的数量以及逆转免疫/炎症因子与免疫细胞之间的失衡或许也可代表一种能够改善肿瘤治疗标准方案效果的具有前景的治疗策略.
近年来研究发现肝癌在发生发展的不同阶段、不同环节中, 肝癌细胞与肝癌微环境存在着相互适应、相互作用, 甚至相互利用, 表现出亦敌亦友的关系、呈现高度的动态平衡.
邓庆, 副研究员, 上海人类基因组研究中心功能基因组部
肿瘤的演变取决于肿瘤与宿主的相互作用, 两者的互动关系已经成为近年肿瘤研究的热点与难点, 肿瘤微环境作为其中重要的内容日益受到重视.
肝癌免疫逃逸可能与PDL1、HLA-G有关, 其高表达组肝癌复发率明显升高; 术前血清谷氨酰转肽酶(glutamyl transpeptidase, GGT)/谷丙转氨酶(alanine transaminase, ALT)比值是预测Child-Pugh A级肝癌患者预后的良好指标; 缺氧诱导因子1(hypoxia-inducible factor 1, HIF-1)是肝癌复发和生存的独立预测因素; 肝癌组织中RKIP下调是不良预后的独立预测因素.
对于肝癌微环境的认识, 不能孤立地离开微环境来看肿瘤, 也不能忽视肿瘤而片面地看微环境. 正确认识肿瘤微环境, 把握肿瘤与微环境相互作用的实质和关键, 对于准确认识肝癌起始、演进和转移具有极其重要的意义.
加强肝癌微环境研究将有助于肝癌的分子诊断、分期和分型以及针对高危人群的干预与预防手段的探索. 各种治疗手段对微环境的影响将直接影响肿瘤生物学特性、影响治疗效果的发挥.
衰老: 一种被动过程, 但是随着研究的深入发现衰老细胞分泌一些因子能主动改变周围环境,这些因子被称为衰老相关分泌表型(senescence-associated secretory phenotype, SASP). SASP包含多种因子, 如生长因子、蛋白酶和炎性因子等, 这些分泌因子依赖其所处的生物环境既可以诱导自身衰老又能促进细胞增殖, 具有双向调节作用.
本文概括了近年来在肝癌微环境研究领域内生物学进程、免疫炎症、应激反应、临床预后以及靶向治疗等方面的研究结果, 文献引用量较大, 涉及多方面的最新研究成果, 因此对肝癌微环境领域的研究人员具有一定的阅读价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Wu SD, Ma YS, Fang Y, Liu LL, Fu D, Shen XZ. Role of the microenvironment in hepatocellular carcinoma development and progression. Cancer Treat Rev. 2012;38:218-225. [PubMed] [DOI] |
| 2. | Hernandez-Gea V, Toffanin S, Friedman SL, Llovet JM. Role of the microenvironment in the pathogenesis and treatment of hepatocellular carcinoma. Gastroenterology. 2013;144:512-527. [PubMed] [DOI] |
| 3. | Seitz HK, Stickel F. Risk factors and mechanisms of hepatocarcinogenesis with special emphasis on alcohol and oxidative stress. Biol Chem. 2006;387:349-360. [PubMed] |
| 4. | Hanahan D, Coussens LM. Accessories to the crime: functions of cells recruited to the tumor microenvironment. Cancer Cell. 2012;21:309-322. [PubMed] [DOI] |
| 5. | Llovet JM, Schwartz M, Mazzaferro V. Resection and liver transplantation for hepatocellular carcinoma. Semin Liver Dis. 2005;25:181-200. [PubMed] |
| 6. | Sherman M. Recurrence of hepatocellular carcinoma. N Engl J Med. 2008;359:2045-2047. [PubMed] [DOI] |
| 7. | Hoshida Y, Villanueva A, Kobayashi M, Peix J, Chiang DY, Camargo A, Gupta S, Moore J, Wrobel MJ, Lerner J. Gene expression in fixed tissues and outcome in hepatocellular carcinoma. N Engl J Med. 2008;359:1995-2004. [PubMed] [DOI] |
| 8. | Tao Y, Ruan J, Yeh SH, Lu X, Wang Y, Zhai W, Cai J, Ling S, Gong Q, Chong Z. Rapid growth of a hepatocellular carcinoma and the driving mutations revealed by cell-population genetic analysis of whole-genome data. Proc Natl Acad Sci U S A. 2011;108:12042-12047. [PubMed] [DOI] |
| 9. | Hoshida Y, Nijman SM, Kobayashi M, Chan JA, Brunet JP, Chiang DY, Villanueva A, Newell P, Ikeda K, Hashimoto M. Integrative transcriptome analysis reveals common molecular subclasses of human hepatocellular carcinoma. Cancer Res. 2009;69:7385-7392. [PubMed] [DOI] |
| 10. | Zhu AX, Duda DG, Sahani DV, Jain RK. HCC and angiogenesis: possible targets and future directions. Nat Rev Clin Oncol. 2011;8:292-301. [PubMed] [DOI] |
| 11. | Coulon S, Heindryckx F, Geerts A, Van Steenkiste C, Colle I, Van Vlierberghe H. Angiogenesis in chronic liver disease and its complications. Liver Int. 2011;31:146-162. [PubMed] [DOI] |
| 12. | Lichtenberger BM, Tan PK, Niederleithner H, Ferrara N, Petzelbauer P, Sibilia M. Autocrine VEGF signaling synergizes with EGFR in tumor cells to promote epithelial cancer development. Cell. 2010;140:268-279. [PubMed] [DOI] |
| 13. | Llovet JM, Peña CE, Lathia CD, Shan M, Meinhardt G, Bruix J. Plasma biomarkers as predictors of outcome in patients with advanced hepatocellular carcinoma. Clin Cancer Res. 2012;18:2290-2300. [PubMed] [DOI] |
| 14. | Matsubara T, Kanto T, Kuroda S, Yoshio S, Higashitani K, Kakita N, Miyazaki M, Sakakibara M, Hiramatsu N, Kasahara A. TIE2-expressing monocytes as a diagnostic marker for hepatocellular carcinoma correlates with angiogenesis. Hepatology. 2013;57:1416-1425. [PubMed] [DOI] |
| 15. | Budhu A, Wang XW. The role of cytokines in hepatocellular carcinoma. J Leukoc Biol. 2006;80:1197-1213. [PubMed] |
| 16. | Budhu A, Forgues M, Ye QH, Jia HL, He P, Zanetti KA, Kammula US, Chen Y, Qin LX, Tang ZY. Prediction of venous metastases, recurrence, and prognosis in hepatocellular carcinoma based on a unique immune response signature of the liver microenvironment. Cancer Cell. 2006;10:99-111. [PubMed] |
| 17. | Liu Y, Fuchs J, Li C, Lin J. IL-6, a risk factor for hepatocellular carcinoma: FLLL32 inhibits IL-6-induced STAT3 phosphorylation in human hepatocellular cancer cells. Cell Cycle. 2010;9:3423-3427. [PubMed] |
| 18. | Wang YC, Xu GL, Jia WD, Han SJ, Ren WH, Wang W, Liu WB, Zhang CH, Chen H. Estrogen suppresses metastasis in rat hepatocellular carcinoma through decreasing interleukin-6 and hepatocyte growth factor expression. Inflammation. 2012;35:143-149. [PubMed] [DOI] |
| 19. | Jiang R, Tan Z, Deng L, Chen Y, Xia Y, Gao Y, Wang X, Sun B. Interleukin-22 promotes human hepatocellular carcinoma by activation of STAT3. Hepatology. 2011;54:900-909. [PubMed] [DOI] |
| 20. | Li J, Lau G, Chen L, Yuan YF, Huang J, Luk JM, Xie D, Guan XY. Interleukin 23 promotes hepatocellular carcinoma metastasis via NF-kappa B induced matrix metalloproteinase 9 expression. PLoS One. 2012;7:e46264. [PubMed] [DOI] |
| 21. | Zhou H, Huang H, Shi J, Zhao Y, Dong Q, Jia H, Liu Y, Ye Q, Sun H, Zhu X. Prognostic value of interleukin 2 and interleukin 15 in peritumoral hepatic tissues for patients with hepatitis B-related hepatocellular carcinoma after curative resection. Gut. 2010;59:1699-1708. [PubMed] [DOI] |
| 22. | Huo W, Li ZM, Zhu XM, Bao YM, An LJ. MDA-7/IL-24 suppresses tumor adhesion and invasive potential in hepatocellular carcinoma cell lines. Oncol Rep. 2013;30:986-992. [PubMed] [DOI] |
| 23. | Pan QZ, Pan K, Zhao JJ, Chen JG, Li JJ, Lv L, Wang DD, Zheng HX, Jiang SS, Zhang XF. Decreased expression of interleukin-36α correlates with poor prognosis in hepatocellular carcinoma. Cancer Immunol Immunother. 2013;62:1675-1685. [PubMed] [DOI] |
| 24. | Roussos ET, Condeelis JS, Patsialou A. Chemotaxis in cancer. Nat Rev Cancer. 2011;11:573-587. [PubMed] [DOI] |
| 25. | Kryczek I, Lange A, Mottram P, Alvarez X, Cheng P, Hogan M, Moons L, Wei S, Zou L, Machelon V. CXCL12 and vascular endothelial growth factor synergistically induce neoangiogenesis in human ovarian cancers. Cancer Res. 2005;65:465-472. [PubMed] |
| 26. | Liu H, Pan Z, Li A, Fu S, Lei Y, Sun H, Wu M, Zhou W. Roles of chemokine receptor 4 (CXCR4) and chemokine ligand 12 (CXCL12) in metastasis of hepatocellular carcinoma cells. Cell Mol Immunol. 2008;5:373-378. [PubMed] [DOI] |
| 27. | Uchida H, Iwashita Y, Sasaki A, Shibata K, Matsumoto T, Ohta M, Kitano S. Chemokine receptor CCR6 as a prognostic factor after hepatic resection for hepatocellular carcinoma. J Gastroenterol Hepatol. 2006;21:161-168. [PubMed] |
| 28. | Tsuda Y, Fukui H, Asai A, Fukunishi S, Miyaji K, Fujiwara S, Teramura K, Fukuda A, Higuchi K. An immunosuppressive subtype of neutrophils identified in patients with hepatocellular carcinoma. J Clin Biochem Nutr. 2012;51:204-212. [PubMed] [DOI] |
| 29. | Kim HR, Lee SH, Jung G. The hepatitis B viral X protein activates NF-kappaB signaling pathway through the up-regulation of TBK1. FEBS Lett. 2010;584:525-530. [PubMed] [DOI] |
| 30. | He G, Yu GY, Temkin V, Ogata H, Kuntzen C, Sakurai T, Sieghart W, Peck-Radosavljevic M, Leffert HL, Karin M. Hepatocyte IKKbeta/NF-kappaB inhibits tumor promotion and progression by preventing oxidative stress-driven STAT3 activation. Cancer Cell. 2010;17:286-297. [PubMed] [DOI] |
| 31. | Eiró N, Altadill A, Juárez LM, Rodríguez M, González LO, Atienza S, Bermúdez S, Fernandez-Garcia B, Fresno-Forcelledo MF, Rodrigo L. Toll-like receptors 3, 4 and 9 in hepatocellular carcinoma: Relationship with clinicopathological characteristics and prognosis. Hepatol Res. 2014;44:769-778. [PubMed] [DOI] |
| 33. | Amann T, Bataille F, Spruss T, Dettmer K, Wild P, Liedtke C, Mühlbauer M, Kiefer P, Oefner PJ, Trautwein C. Reduced expression of fibroblast growth factor receptor 2IIIb in hepatocellular carcinoma induces a more aggressive growth. Am J Pathol. 2010;176:1433-1442. [PubMed] [DOI] |
| 34. | Kaposi-Novak P, Lee JS, Gòmez-Quiroz L, Coulouarn C, Factor VM, Thorgeirsson SS. Met-regulated expression signature defines a subset of human hepatocellular carcinomas with poor prognosis and aggressive phenotype. J Clin Invest. 2006;116:1582-1595. [PubMed] |
| 35. | Chitcholtan K, Asselin E, Parent S, Sykes PH, Evans JJ. Differences in growth properties of endometrial cancer in three dimensional (3D) culture and 2D cell monolayer. Exp Cell Res. 2013;319:75-87. [PubMed] [DOI] |
| 36. | Schrader J, Gordon-Walker TT, Aucott RL, van Deemter M, Quaas A, Walsh S, Benten D, Forbes SJ, Wells RG, Iredale JP. Matrix stiffness modulates proliferation, chemotherapeutic response, and dormancy in hepatocellular carcinoma cells. Hepatology. 2011;53:1192-1205. [PubMed] [DOI] |
| 37. | Yang C, Zeisberg M, Lively JC, Nyberg P, Afdhal N, Kalluri R. Integrin alpha1beta1 and alpha2beta1 are the key regulators of hepatocarcinoma cell invasion across the fibrotic matrix microenvironment. Cancer Res. 2003;63:8312-8317. [PubMed] |
| 38. | Giannelli G, Bergamini C, Marinosci F, Fransvea E, Quaranta M, Lupo L, Schiraldi O, Antonaci S. Clinical role of MMP-2/TIMP-2 imbalance in hepatocellular carcinoma. Int J Cancer. 2002;97:425-431. [PubMed] |
| 39. | Provenzano PP, Eliceiri KW, Campbell JM, Inman DR, White JG, Keely PJ. Collagen reorganization at the tumor-stromal interface facilitates local invasion. BMC Med. 2006;4:38. [PubMed] |
| 40. | Barry-Hamilton V, Spangler R, Marshall D, McCauley S, Rodriguez HM, Oyasu M, Mikels A, Vaysberg M, Ghermazien H, Wai C. Allosteric inhibition of lysyl oxidase-like-2 impedes the development of a pathologic microenvironment. Nat Med. 2010;16:1009-1017. [PubMed] [DOI] |
| 41. | De Bels D, Corazza F, Balestra C. Oxygen sensing, homeostasis, and disease. N Engl J Med. 2011;365:1845; author reply 1846. [PubMed] [DOI] |
| 42. | Guichard C, Amaddeo G, Imbeaud S, Ladeiro Y, Pelletier L, Maad IB, Calderaro J, Bioulac-Sage P, Letexier M, Degos F. Integrated analysis of somatic mutations and focal copy-number changes identifies key genes and pathways in hepatocellular carcinoma. Nat Genet. 2012;44:694-698. [PubMed] [DOI] |
| 43. | Chung JS, Park S, Park SH, Park ER, Cha PH, Kim BY, Chung YM, Woo SR, Han CJ, Kim SB. Overexpression of Romo1 promotes production of reactive oxygen species and invasiveness of hepatic tumor cells. Gastroenterology. 2012;143:1084-94.e7. [PubMed] [DOI] |
| 44. | Friedman SL. Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver. Physiol Rev. 2008;88:125-172. [PubMed] [DOI] |
| 45. | Kang N, Gores GJ, Shah VH. Hepatic stellate cells: partners in crime for liver metastases? Hepatology. 2011;54:707-713. [PubMed] [DOI] |
| 46. | Santamato A, Fransvea E, Dituri F, Caligiuri A, Quaranta M, Niimi T, Pinzani M, Antonaci S, Giannelli G. Hepatic stellate cells stimulate HCC cell migration via laminin-5 production. Clin Sci (Lond). 2011;121:159-168. [PubMed] [DOI] |
| 47. | Yoshimoto S, Loo TM, Atarashi K, Kanda H, Sato S, Oyadomari S, Iwakura Y, Oshima K, Morita H, Hattori M. Obesity-induced gut microbial metabolite promotes liver cancer through senescence secretome. Nature. 2013;499:97-101. [PubMed] [DOI] |
| 48. | Coulouarn C, Corlu A, Glaise D, Guénon I, Thorgeirsson SS, Clément B. Hepatocyte-stellate cell cross-talk in the liver engenders a permissive inflammatory microenvironment that drives progression in hepatocellular carcinoma. Cancer Res. 2012;72:2533-2542. [PubMed] [DOI] |
| 49. | Mikula M, Proell V, Fischer AN, Mikulits W. Activated hepatic stellate cells induce tumor progression of neoplastic hepatocytes in a TGF-beta dependent fashion. J Cell Physiol. 2006;209:560-567. [PubMed] |
| 50. | Mallat A, Lotersztajn S. Cellular mechanisms of tissue fibrosis. 5. Novel insights into liver fibrosis. Am J Physiol Cell Physiol. 2013;305:C789-C799. [PubMed] [DOI] |
| 51. | Pedroza-Gonzalez A, Verhoef C, Ijzermans JN, Peppelenbosch MP, Kwekkeboom J, Verheij J, Janssen HL, Sprengers D. Activated tumor-infiltrating CD4+ regulatory T cells restrain antitumor immunity in patients with primary or metastatic liver cancer. Hepatology. 2013;57:183-194. [PubMed] [DOI] |
| 52. | Shen X, Li N, Li H, Zhang T, Wang F, Li Q. Increased prevalence of regulatory T cells in the tumor microenvironment and its correlation with TNM stage of hepatocellular carcinoma. J Cancer Res Clin Oncol. 2010;136:1745-1754. [PubMed] [DOI] |
| 53. | Fu J, Xu D, Liu Z, Shi M, Zhao P, Fu B, Zhang Z, Yang H, Zhang H, Zhou C. Increased regulatory T cells correlate with CD8 T-cell impairment and poor survival in hepatocellular carcinoma patients. Gastroenterology. 2007;132:2328-2339. [PubMed] |
| 54. | Yi Y, He HW, Wang JX, Cai XY, Li YW, Zhou J, Cheng YF, Jin JJ, Fan J, Qiu SJ. The functional impairment of HCC-infiltrating γδ T cells, partially mediated by regulatory T cells in a TGFβ- and IL-10-dependent manner. J Hepatol. 2013;58:977-983. [PubMed] [DOI] |
| 55. | Arihara F, Mizukoshi E, Kitahara M, Takata Y, Arai K, Yamashita T, Nakamoto Y, Kaneko S. Increase in CD14+HLA-DR -/low myeloid-derived suppressor cells in hepatocellular carcinoma patients and its impact on prognosis. Cancer Immunol Immunother. 2013;62:1421-1430. [PubMed] [DOI] |
| 56. | Han Y, Chen Z, Yang Y, Jiang Z, Gu Y, Liu Y, Lin C, Pan Z, Yu Y, Jiang M. Human CD14+ CTLA-4+ regulatory dendritic cells suppress T-cell response by cytotoxic T-lymphocyte antigen-4-dependent IL-10 and indoleamine-2,3-dioxygenase production in hepatocellular carcinoma. Hepatology. 2014;59:567-579. [PubMed] [DOI] |
| 57. | Ma S, Cheng Q, Cai Y, Gong H, Wu Y, Yu X, Shi L, Wu D, Dong C, Liu H. IL-17A produced by γδ T cells promotes tumor growth in hepatocellular carcinoma. Cancer Res. 2014;74:1969-1982. [PubMed] [DOI] |
| 58. | Zhang DY, Friedman SL. Fibrosis-dependent mechanisms of hepatocarcinogenesis. Hepatology. 2012;56:769-775. [PubMed] |
| 59. | Kalluri R, Zeisberg M. Fibroblasts in cancer. Nat Rev Cancer. 2006;6:392-401. [PubMed] |
| 60. | Lucas T, Abraham D, Aharinejad S. Modulation of tumor associated macrophages in solid tumors. Front Biosci. 2008;13:5580-5588. [PubMed] |
| 61. | Sodir NM, Swigart LB, Karnezis AN, Hanahan D, Evan GI, Soucek L. Endogenous Myc maintains the tumor microenvironment. Genes Dev. 2011;25:907-916. [PubMed] [DOI] |
| 62. | Okamoto M, Utsunomiya T, Wakiyama S, Hashimoto M, Fukuzawa K, Ezaki T, Hanai T, Inoue H, Mori M. Specific gene-expression profiles of noncancerous liver tissue predict the risk for multicentric occurrence of hepatocellular carcinoma in hepatitis C virus-positive patients. Ann Surg Oncol. 2006;13:947-954. [PubMed] |
| 63. | Abu Dayyeh BK, Yang M, Fuchs BC, Karl DL, Yamada S, Sninsky JJ, O'Brien TR, Dienstag JL, Tanabe KK, Chung RT. A functional polymorphism in the epidermal growth factor gene is associated with risk for hepatocellular carcinoma. Gastroenterology. 2011;141:141-149. [PubMed] [DOI] |
| 64. | Jiang J, Gusev Y, Aderca I, Mettler TA, Nagorney DM, Brackett DJ, Roberts LR, Schmittgen TD. Association of MicroRNA expression in hepatocellular carcinomas with hepatitis infection, cirrhosis, and patient survival. Clin Cancer Res. 2008;14:419-427. [PubMed] [DOI] |
| 65. | Chew V, Chen J, Lee D, Loh E, Lee J, Lim KH, Weber A, Slankamenac K, Poon RT, Yang H. Chemokine-driven lymphocyte infiltration: an early intratumoural event determining long-term survival in resectable hepatocellular carcinoma. Gut. 2012;61:427-438. [PubMed] [DOI] |
| 66. | Wilhelm SM, Adnane L, Newell P, Villanueva A, Llovet JM, Lynch M. Preclinical overview of sorafenib, a multikinase inhibitor that targets both Raf and VEGF and PDGF receptor tyrosine kinase signaling. Mol Cancer Ther. 2008;7:3129-3140. [PubMed] [DOI] |
| 67. | Sergio A, Cristofori C, Cardin R, Pivetta G, Ragazzi R, Baldan A, Girardi L, Cillo U, Burra P, Giacomin A. Transcatheter arterial chemoembolization (TACE) in hepatocellular carcinoma (HCC): the role of angiogenesis and invasiveness. Am J Gastroenterol. 2008;103:914-921. [PubMed] [DOI] |
| 68. | Hurwitz H, Fehrenbacher L, Novotny W, Cartwright T, Hainsworth J, Heim W, Berlin J, Baron A, Griffing S, Holmgren E. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med. 2004;350:2335-2342. [PubMed] |
| 69. | Sangro B, Gomez-Martin C, de la Mata M, Iñarrairaegui M, Garralda E, Barrera P, Riezu-Boj JI, Larrea E, Alfaro C, Sarobe P. A clinical trial of CTLA-4 blockade with tremelimumab in patients with hepatocellular carcinoma and chronic hepatitis C. J Hepatol. 2013;59:81-88. [PubMed] [DOI] |
| 70. | Mazzocca A, Fransvea E, Lavezzari G, Antonaci S, Giannelli G. Inhibition of transforming growth factor beta receptor I kinase blocks hepatocellular carcinoma growth through neo-angiogenesis regulation. Hepatology. 2009;50:1140-1151. [PubMed] [DOI] |
| 71. | Xu J, Xu HY, Zhang Q, Song F, Jiang JL, Yang XM, Mi L, Wen N, Tian R, Wang L. HAb18G/CD147 functions in invasion and metastasis of hepatocellular carcinoma. Mol Cancer Res. 2007;5:605-614. [PubMed] |
| 72. | Zhu AX. Molecularly targeted therapy for advanced hepatocellular carcinoma in 2012: current status and future perspectives. Semin Oncol. 2012;39:493-502. [PubMed] [DOI] |
| 73. | Zhang W, Zhu XD, Sun HC, Xiong YQ, Zhuang PY, Xu HX, Kong LQ, Wang L, Wu WZ, Tang ZY. Depletion of tumor-associated macrophages enhances the effect of sorafenib in metastatic liver cancer models by antimetastatic and antiangiogenic effects. Clin Cancer Res. 2010;16:3420-3430. [PubMed] [DOI] |