修回日期: 2014-09-04
接受日期: 2014-09-17
在线出版日期: 2014-11-08
目的: 筛选人肝癌组织及癌旁正常肝组织差异性表达的mRNA并作生物信息学分析.
方法: 运用Agilent 8×60 K基因芯片技术检测肝癌组织及癌旁正常肝组织的基因表达谱, 用生物信息学方法进行差异基因分析及GO Pathway分析, 并用Real-time PCR验证芯片结果.
结果: 与正常肝组织相比, 肝癌组织差异性表达的基因共有2694个, 其中上调基因有924个, 下调基因有1770个. GO Pathway分析提示差异性表达基因参与转录过程、氧化还原、信号转导、离子转运、免疫应答、细胞黏附及结合功能等过程. 实时PCR验证结果提示与芯片检测结果具有较好的一致性.
结论: 基因芯片筛选出的差异性表达mRNA可能参与信号转导, 免疫应答等诸多关键环节, 为肝癌相关特异性标记的靶向治疗提供新的思路.
核心提示: 我们利用基因芯片筛选出人肝癌组织与癌旁正常肝组织的差异性表达基因共有2694个, 其中上调基因有924个, 下调基因有1770, 差异性表达mRNA可能参与信号转导, 免疫应答等诸多关键环节, 为肝癌相关特异性标记的靶向治疗提供新的思路.
引文著录: 高冰, 宁淑芳, 唐艳萍, 刘海洲, 利基林, 张力图. 人肝癌组织及癌旁正常肝组织的mRNA差异表达谱. 世界华人消化杂志 2014; 22(31): 4734-4744
Revised: September 4, 2014
Accepted: September 17, 2014
Published online: November 8, 2014
AIM: To identify differentially expressed genes between hepatocellular carcinoma and normal liver tissues and to carry out bioinformatics analysis.
METHODS: Agilent 8×60 K microarray was used to detect the changes of gene expression between hepatocellular carcinoma and adjacent normal liver tissues. Bioinformatics methods were used to identify differentially expressed genes and perform GO pathway analysis. Real-time PCR was applied to verify microarray data.
RESULTS: Microarray analysis screened a total of up-regulated 924 mRNAs and 1770 down-regulated mRNAs in hepatocellular carcinoma tissues compared with the normal tissues. GO pathway analysis demonstrated that these mRNAs are involved in transcription, redox, signal transduction, ion transport, immune response, cell adhesion, and binding functions. The results of real-time PCR were in high concordance with microarray results.
CONCLUSION: Differentially expressed genes identified in this study may be involved in signal transduction, immune response and other key biological processes. These genes may provide new targets for targeted therapy.
- Citation: Gao B, Ning SF, Tang YP, Liu HZ, Li JL, Zhang LT. Differential mRNA expression profiles between hepatocellular carcinoma and adjacent normal liver tissue. Shijie Huaren Xiaohua Zazhi 2014; 22(31): 4734-4744
- URL: https://www.wjgnet.com/1009-3079/full/v22/i31/4734.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i31.4734
肝癌死亡率高, 是仅次于胃癌、食道癌的世界第三大常见恶性肿瘤, 是严重威胁人们健康乃至生命的恶性疾病[1,2]. 目前手术切除和肝脏移植是主要治疗肝癌的方法, 而只有20%的肝癌患者适合接受切除手术. 但是由于肝癌复发率高, 化疗效果不佳, 且抗药性强, 应用传统治疗方法效果并不理想. 如果能找到正常肝细胞恶变的原因, 或其表面特异性标志, 将对肿瘤发病机制、早期诊断、针对特异性标志的靶向治疗产生重大意义[3,4].
基因芯片, 又称微阵列技术, 是指采用原位合成或直接点样的方法将DNA片段或寡核苷酸片段排列在硅片、玻璃等介质上, 形成微矩阵, 用荧光分子标记后的待检样品和微距阵杂交, 通过荧光扫描及计算机分析即可获得样品中大量的基因序列及表达信息, 以达到快速、高效、高通量地分析生物信息的目的[5,6]. 基因芯片技术的基本原理是分子杂交, 用荧光染料标记样本, 使之与基因芯片杂交. 经激光共聚焦荧光显微镜检出杂交信号, 经过计算机分析处理, 即可得到所需要的信息, 可在同一基因芯片上同时检测两样本的基因差异表达[7,8].
基因芯片用途广泛多样化, 可用于疾病诊断、DNA测序、药物筛选及预防医学研究, 环境保护、军事农业司法等方面. 而基因芯片中应用最为广泛的即为表达谱芯片, 可用于研究基因功能, 即在不同组织或细胞, 不同发育阶段中的基因改变, 通过差异性表达阐明基因的功能[9-11]. 本研究通过收集肝癌患者的肝癌组织及其正常肝组织样本, 利用基因芯片技术进行实验分析, 筛选差异表达的mRNA, 并进行生物信息学分析, 为肝癌发病机制、早期诊断、针对特异性标志的靶向治疗提供新的思路.
本研究选取的肝癌患者的肝癌组织及癌旁正常肝组织均源自广西医科大学附属肿瘤医院标本库的组织样本, 均为原发病灶的首次手术切除样本, 均未接受过化疗、放疗, 切除的组织样本经液氮速冻后-80 ℃保存. TRIzol(Invitrogen, USA); NucleoSpin® RNA clean-up试剂盒(MACHEREY-NAGEL, Germany), 分光光度计(上海仪器设备厂); Human (V2) Gene Expression Microarray, 8×60 K芯片(Agilent公司); NucleoSpin® RNA clean-up试剂盒(MACHEREY-NAGEL, 德国); Feature Extraction图像分析软件和GeneSpring GX软件.
1.2.1 总RNA提取及质量鉴定: 液氮下充分研磨组织样品至粉末状, 加入TRIzol试剂提取组织块中的总RNA, 并进一步采用NucleoSpin® RNA clean-up试剂盒对总RNA进行过柱纯化, 最后用分光光度计定量, 琼脂糖凝胶电泳质检. 各组提取的总RNA:RNA纯度: 2.0≥A260/280≥1.80, 满足表达谱芯片实验要求; RNA总量≥1 μg, 满足表达谱芯片实验要求.
1.2.2 基因芯片实验: 对质检合格的样品RNA进行Cy3荧光标记, 然后与Agilent 8×60 K芯片杂交并清洗, 用Agilent G2565CA Microarray Scanner扫描杂交后芯片, 得到杂交图片.
1.2.3 芯片图像的采集和数据分析: (1)荧光信号值提取: 采用Feature Extraction图像分析软件对芯片图像进行分析, 把图像信号转化为数字信号; (2)差异基因筛选: 将原始数据输入到GeneSpring GX软件中, 采用percentile shift方法对信号值进行归一化处理, 然后用Absolute Fold change≥2, 同时Flag标记为Detected的标准进行差异基因筛选, 利用KEGG、GenMAPP、 Biocarta数据库进行生物信息学分析.
1.2.4 Real-time PCR验证芯片: 为验证芯片结果, 我们选择了3条与肝癌密切相关的基因进行Real-time PCR验证, 取1000 ng的总RNA进行反转录, 以反转录后的cDNA为模板进行实时PCR扩增, SYBR Premix Ex Taq™ 10 μL, 正反向引物(10 μmol/L)0.5 μL, 95 ℃预变性30 s变性95 ℃ 5 s 退火延伸60 ℃ 20 s, 共40个循环, 60 ℃-95 ℃绘制溶解曲线, 并严格按照试剂说明书和仪器的操作规程. 具体引物如表1, 我们以GAPDH为参照计算表达的差异倍数. 数据采用2-△△CT法进行分析, 计算mRNA在肝癌组织及癌旁正常肝组织中的差异表达倍数.
| 基因 | 基因公共数据库号 | 引物5'-3' |
| GAPDH | NM_002046 | F: GCACCGTCAAGGCTGAGAAC |
| R: TGGTGAAGACGCCAGTGGA | ||
| GPC3 | NM_001164617 | F: CCTTTGCTGGAATGGACAAGAAC |
| R: CAGCTCATGGAGATTGAACTGG | ||
| CCL20 | NM_004591 | F: TTGGGTGAAATATATTGTGCGTCTC |
| R: TGATGTGCAAGTGAAACCTCCA | ||
| CTHRC1 | NM_138455 | F: GAGTCCTGGACACCCAACTACAAG |
| R: AGCCGAAGTGAGCCACTGAA |
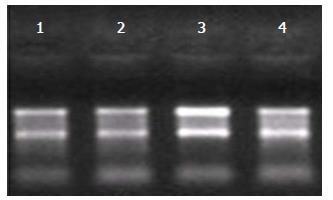
如琼脂糖凝胶电泳图片(图1)所示: 经琼脂糖凝胶电泳检测, 3号RNA样品电泳条带清晰, 28S:18S rRNA条带亮度大于或接近2:1, 质量符合表达谱芯片实验要求; 其余RNA样品电泳条带清晰, 28S:18S rRNA条带亮度大于或接近1:1, RNA完整性好, 质量基本符合表达谱芯片实验要求.
应用Agilent 8×60 K芯片进行杂交, 对原始数据的处理后发现, 与正常肝组织相比, 肝癌组织差异性表达的基因共有2694个, 其中上调基因有924个, 下调基因有1770个(表2). 其中TMC5上调高达249.31倍(表3), ALDH1A3下调高达878.02倍(表4).
| 改变倍数 | 差异性表达基因总数 | 上调基因数量 | 下调基因数量 |
| 2倍以上 | 1647 | 538 | 1109 |
| 5倍以上 | 555 | 227 | 328 |
| 10倍以上 | 284 | 94 | 190 |
| 20倍以上 | 160 | 43 | 117 |
| 50倍以上 | 33 | 15 | 18 |
| 100倍以上 | 15 | 7 | 8 |
| 总和 | 2694 | 924 | 1770 |
| 基因公共数据库号 | 上调倍数 | 基因符号 | 描述 |
| NM_024780 | 249.31 | TMC5 | 人类跨膜通道-5, 转录本3, mRNA |
| NR_024418 | 183.46 | LOC389332 | 人类非典型通路389332, 非编码mRNA |
| NM_001958 | 158.38 | EEF1A2 | 人类真核·译延伸因子1α2, mRNA |
| NM_005980 | 127.23 | S100P | 人类S100钙结合蛋白P, mRNA |
| NM_006183 | 119.47 | NTS | 人类神3/4降压素, mRNA |
| NM_004181 | 103.23 | UCHL1 | 人类泛素末端羧基酯酶L1, mRNA |
| NM_001080494 | 94.24 | TTC39A | 人类肽重复序列结构域39A, 转录本2, mRNA |
| NM_152997 | 93.56 | C4orf7 | 人类染色体4开放阅读框架7, mRNA |
| NM_006142 | 89.26 | SFN | 人类分层蛋白, mRNA |
| NM_020647 | 86.98 | JPH1 | 人类亲联蛋白, mRNA |
| 基因公共数据库号 | 下调倍数 | 基因符号 | 描述 |
| NM_000693 | 878.02 | ALDH1A3 | 人类醛脱氢酶1家族A3成员, mRNA |
| NR_039975 | 304.52 | LOC100506229 | 人类非典型通路100506229, 转录本1, 非编码RNA |
| NM_013267 | 287.93 | GLS2 | 人类谷氨酰胺酶2, mRNA |
| NM_001144904 | 195.67 | CLEC4M | 人类C型凝集域4家族M成员, 转录本2, mRNA |
| NM_152338 | 183.42 | ZG16 | 人类酶Ô颗粒蛋白16同系物, mRNA |
| NM_057157 | 132.69 | CYP26A1 | 人类细胞色素P450 26家族A亚科1肽, 转录本2, mRNA |
| NM_022820 | 104.75 | CYP3A43 | 人类细胞色素P450 3家族A亚科43肽, 转录本1, mRNA |
| NM_176782 | 101.39 | FAM151A | 人类相似序列151家族A成员, mRNA |
| NM_152722 | 96.31 | HEPACAM | 人类肝细胞和胶质细胞黏附分子, mRNA |
| NM_004108 | 93.07 | FCN2 | 人类无花果酶2, 转录本SV0, mRNA |
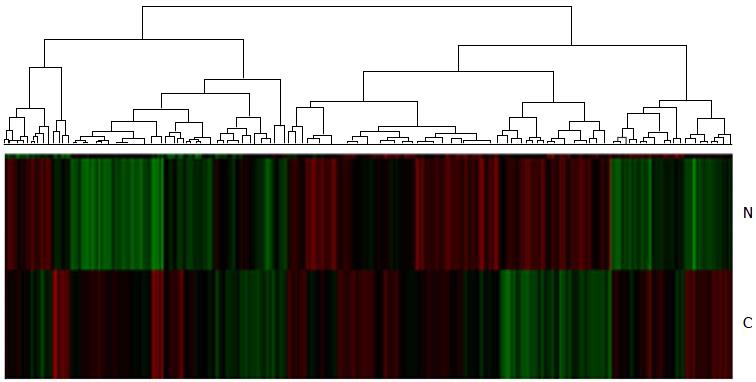
对差异性基因进行聚类分析, 结果显示肝癌组织(C)及其正常肝组织(N)有明显不同的表达谱(图2). 红色表示上调基因, 绿色表示下调基因, 黑色表示改变少于2倍基因.
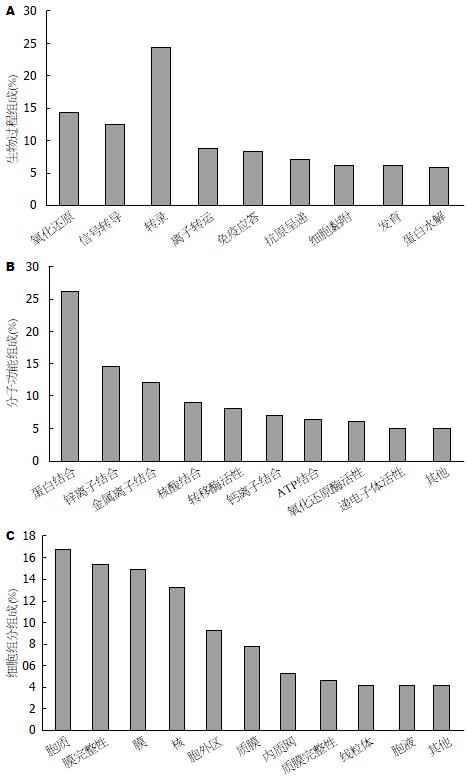
为更加详细研究差异表达基因的功能, 我们对差异表达基因做了GO分析(图3): 差异表达的基因被分为3大部分, 分别为生物过程(biological process), 分子功能(molecular fuction), 细胞组分(cellular component). 在生物过程中, 主要涉及: 转录过程(GO: 0006350 transcription)包括DNA依赖性转录及DNA非依赖性转录、氧化还原(GO: 0055114 oxidation reduction)、信号转导(GO: 0007165 signal transduction)、离子转运(GO: 0006811 ion transport)、免疫应答(GO: 0006955 immune response)、细胞黏附(GO: 0007155 cell adhesion)等过程. 在分子功能中, 结合(binding)相关功能高达75.66%, 包括蛋白结合(GO: 0005515 protein binding)、核酸结合(GO: 0000166 nucleotide binding)、离子结合(ion binding)、ATP结合(GO: 0005524 ATP binding), 另外比例较高者还有转移酶活性(GO: 0016740 transferase activity)、氧化还原酶活性(GO: 0016491 oxidoreductase activity)、递电子体活性(GO: 0009055 electron carrier activity)等功能. 在细胞组分中, 主要包括胞质(GO: 0005737 cytoplasm)、胞外区(GO: 0005576 extracellular region)、质膜(GO: 0005886 plasma membrane)、内质网(GO: 0005783 endoplasmic reticulum)、线粒体(GO: 0005739 mitochondrion)等.
研究表明, 肝癌的发病机制及发生发展与信号通路密切相关. 我们利用KEGG、GenMAPP、Biocarta数据库对整理后的数据进行Pathway分析, 与肝癌发生发展密切相关的信号通路有Wnt、JAK-信号传导与转录激活因子(signal transducer and activator of transcription, STAT)、丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、ERBB2、Mtor、血管内皮生长因子(vascular endothelial growth factor, VEGF)等. 在差异表达的基因中共有15个参与Wnt信号通路转导, 上调的有7个、下调的有8个, 上调基因中SFRP4达14.4倍, 下调基因中SFRP5高达54.29倍(表5). 另外, 共有13个差异性表达的基因参与JAK-STAT信号通路转导, 上调的有4个、下调的有9个, 上调基因中CSF2RA达13.66倍, 下调基因中IL20RB达21.09倍(表6).
| 基因公共数据库号 | 基因标记 | 改变倍数 | 上调/下调 | 描述 |
| NM_003508 | FZD9 | 2.21 | 下调 | 卷曲家族受体9 |
| NM_006238 | PPARD | 2.38 | 上调 | 激活型受体δ |
| NM_002739 | PRKCG | 2.47 | 下调 | 蛋白激酶C |
| NR_028062 | PRKY | 2.63 | 上调 | 蛋白激酶Y关联基因 |
| NM_001198531 | TCF7L2 | 3.12 | 下调 | 转录因子7-2 |
| NM_005052 | RAC3 | 3.42 | 下调 | C3相关ras基因 |
| NM_001198531 | TCF7 | 3.62 | 下调 | 转录因子7 |
| ENST00000394822 | PPP3CB | 3.94 | 上调 | 蛋白磷酸酶3 |
| NM_003506 | FZD6 | 4.84 | 上调 | 卷曲家族受体6 |
| NM_172082 | CAMK2B | 4.99 | 下调 | 钙依赖型蛋白激酶2 |
| NM_002752 | MAPK9 | 6.75 | 上调 | 蛋白激酶9 |
| NM_016269 | LEF1 | 8.96 | 上调 | 淋巴结核因子1 |
| NM_003014 | SFRP4 | 14.41 | 上调 | 分泌型蛋白4 |
| NM_014420 | DKK4 | 16.91 | 下调 | 一直同族体4 |
| NM_003015 | SFRP5 | 54.29 | 下调 | 分泌型蛋白5 |
| 基因公共数据库号 | 基因标记 | 改变倍数 | 上调/下调 | 描述 |
| NM_005465 | AKT3 | 2.23 | 上调 | 蛋白激酶B |
| NM_001206866 | IL6R | 2.39 | 下调 | 白介素6受体 |
| NM_152594 | SPRED1 | 2.42 | 上调 | 包º域1 |
| NM_001559 | IL12RB2 | 2.58 | 下调 | 白介素12受体 |
| NM_181523 | PIK3R1 | 2.61 | 下调 | 调节亚基1 |
| NM_000163 | GHR | 2.72 | 下调 | 生长因子受体 |
| NM_001330 | CTF1 | 3.21 | 下调 | 营养液1 |
| NM_173065 | IL28RA | 4.79 | 下调 | 白介素28受体 |
| NM_172200 | IL15RA | 6.25 | 上调 | 白介素15受体 |
| NM_000600 | IL6 | 7.56 | 下调 | 白介素6 |
| NM_001003679 | LEPR | 13.38 | 下调 | 瘦素受体 |
| NM_172249 | CSF2RA | 13.66 | 上调 | 集落刺激因子受体 |
| NM_144717 | IL20RB | 21.09 | 下调 | 白介素20受体 |
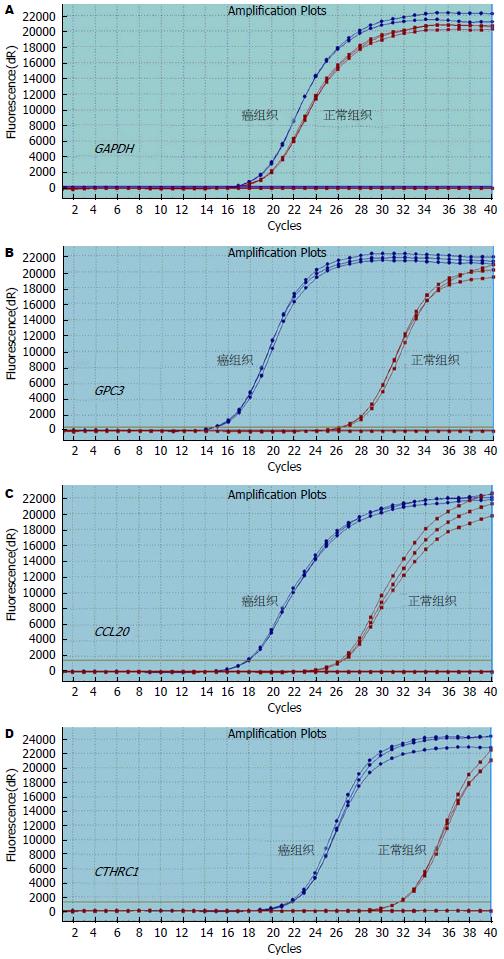
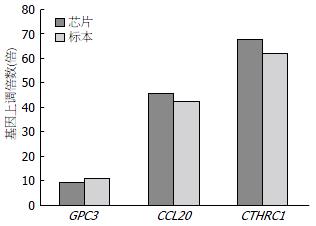
我们挑选与肝癌发生密切相关的3个基因进行定量验证, GPC3、CCL20、CTHRC1在肝癌组织中均表现为高表达, 扩增曲线(图4)及溶解曲线(图5). Real-time PCR结果与芯片结果相比较, 虽然变化倍数不尽相同, 但变化方向一致(图6).
肝组织中差异性表达基因及相关信号通路异常可导致肝癌的发生, 本研究通过基因芯片技术筛选肝癌组织及其正常肝组织差异性表达的mRNA, 并进行了生物信息学分析. 应用Agilent 8×60 K芯片进行杂交, 对原始数据的处理后发现, 与正常肝组织相比, 肝癌组织差异性表达的基因共有2694个, 其中上调基因有924个, 下调基因有1770个. 这些在肝癌组织中差异性表达的基因可能与肝癌的发生发展密切相关.
为进一步探究差异基因的相关功能, 我们做了GO分析. 综合GO分析我们可以发现: 肝癌的发病机制可与转录过程、氧化还原、信号转导、离子转运、免疫应答、细胞黏附、结合功能、酶活性等功能相关.
目前, 普遍认为肝癌的发生发展与其相关的信号传导通路异常关系密切. 为此, 我们做了Pathway分析, 发现差异表达的基因中与肝癌发病机制密切相关的信号通路. 如Wnt、JAK-STAT、MAPK、ERBB2、Mtor、VEGF信号通路, 通过对这些信号通路的深入探索研究为肝癌发病机制、早期诊断及相关特异性标记的靶向治疗提供新的思路.
Wnt信号通路是一条进化上保守的信号传导途径, 具有高度同源性, 对细胞增殖分化、胚胎发育及肿瘤发生发展有重要作用[12,13]. Wnt信号转导途径主要有3条, 分别为经Wnt信号途径, Wnt-Ca2+途径和Wnt-planar极化途径[14]. 其中经典Wnt信号通路研究最多且相关机制较为清楚, 他包括信号蛋白(Wnt蛋白)、跨膜受体、胞质蛋白、核内转录因子及下游靶基因, 其激活的重要标志是β-catenin在胞质稳定表达及核内定位, 其中差异性表达的基因和蛋白参与了肝癌的发生发展[15-17]. 当没有Wnt信号时, 糖原合成酶激酶-3β(glycogen synthesis kinase-3β, GSK-3β)可与APC、Axin形成复合物, 磷酸化肝细胞胞质内β-catenin, 经泛素-蛋白酶体途径使其降解, 维持细胞内β-catenin的低水平状态, Wnt信号通路关闭. 当上述稳态被打破, 可激活经典Wnt信号通路产生, 使β-catenin大量堆积在肝细胞内, 最后向核内转移, 与转录因子T细胞因子/淋巴增强因子(T cell factor/lymphoid enhancer factor, TCF/LEF)相结合成异源二聚体, 调控相关靶基因基质金属蛋白酶9(matrix metallopeptidase 9, MMP-9)、细胞周期蛋白(CyclinD1)、c-myc、Cox-2的转录, 从而调控肝细胞的增殖过程[18,19]. 在本研究中, 差异表达的基因中共有15个参与Wnt信号通路转导, 上调的有7个、下调的有8个, 上调基因中SFRP4达14.4倍, 下调基因中SFRP5高达54.29倍, 这些异常基因的激活, 可导致肝细胞无限增殖而引起肝癌.
JAK-STAT信号通路是一条极为快速的信号通路, 通过激活受体-酪氨酸激酶-信号传导及转录激活因子-靶基因, 将细胞外的信号传导至细胞核, 引起生物学效应[20,21]. 研究表明该信号通路异常与肝癌的发生发展密切相关[22]. 在JAK-STAT信号通路中, 细胞因子或生长因子与细胞膜上的受体相结合, 形成二聚体, 使胞内的JAKs磷酸化而激活, 受体上的酪氨酸位点被磷酸化, 产生与STAT结合的区域. STAT通过其SH2结构域与磷酸化的JAK-受体复合物相结合, 使STAT的一个羟基酪氨酸磷酸化, 激活STAT. 活化的STAT与受体分离, 形成二聚体转运至核内, 与特定的DNA片段结合, 诱导调控细胞功能的基因转录[15,23,24]. 正常组织细胞中STAT的激活是短暂迅速的, 而在肝癌组织细胞中STAT的激活则呈现持续性激活[25]. 有研究表明, 在肝癌组织中, STAT的过度表达与肝癌的病理分级和临床分期呈正相关[26,27]. 尤其是STAT3可调节细胞的生长、分化与凋亡, 促进肝癌的发生与发展; 且可通过VEGF的表达形成肿瘤新生血管, 以及通过抑制炎性介质的释放, 协助肿瘤细胞免疫逃避机制, 促进癌症的侵袭转移[28,29]. 张斌等[30]研究发现JAK1蛋白和STAT3蛋白在肝癌组织的阳性表达率明显高于正常肝组织, 且随着肝癌侵袭转移, 两者的阳性表达率进一步增高. 在本研究中在差异表达的基因中共有13个参与JAK-STAT信号通路转导, 上调的有4个、下调的有9个, 上调基因中CSF2RA达13.66倍, 下调基因中IL20RB达21.09倍, 这些异常表达的基因可能与肝癌的发生发展密切相关.
总之, 我们认为肝癌组织及其正常肝组织表达谱有显著差异, 本研究中筛选到的肝癌组织及其正常肝组织中差异性表达的mRNA, GO分析中包含的与肝癌发病密切相关的转录过程、氧化还原、信号转导、离子转运、免疫应答等过程, Pathway分析中发现的与肝癌发生发展相关的MAPK、ERBB2、PPAR、Wnt、Gnrh、JAK-STAT等信号通路, 这些肝癌相关的生物信息学, 将为我们今后的研究奠定基础, 并为进一步探究肝癌发病机制、早期诊断及相关特异性标记的靶向治疗提供新的思路.
肝癌复发率高, 化疗效果不佳, 且抗药性强, 应用传统治疗方法效果并不理想. 如果能找到正常肝细胞恶变的原因, 或其表面特异性标志, 将对肿瘤发病机制、早期诊断、针对特异性标志的靶向治疗产生重大意义.
肖恩华, 教授, 中南大学湘雅二医院放射教研室
基因芯片筛选出的差异性mRNA, GO分析及相关信号通路中所包含的生物学信息, 将为进一步探究肝癌发病机制、早期诊断及相关特异性标记的靶向治疗提供新的思路.
目前普遍认为肝癌的发生发展与其相关的信号传导通路异常关系密切. Wnt、JAK-信号传导与转录激活因子(signal transducer and activator of transcription, STAT)、丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、ERBB2、Mtor、血管内皮生长因子(vascular endothelial growth facto, VEGF)等信号通路的深入探索研究为肝癌发病机制、早期诊断及相关特异性标记的靶向治疗提供新的思路.
本研究中筛选到的肝癌组织及其正常肝组织中差异性表达的mRNA, GO分析中包含的与肝癌发病密切相关的转录过程、氧化还原、信号转导、离子转运、免疫应答等过程, Pathway分析中发现的与肝癌发生发展相关的MAPK、PPAR、Wnt、JAK-STAT等信号通路.
基因芯片可用于疾病诊断、DNA测序、药物筛选及预防医学研究等方面. 而基因芯片中应用最为广泛的即为表达谱芯片, 可用于研究基因功能, 即在不同组织或细胞, 不同发育阶段中的基因改变, 通过差异性表达阐明基因的功能.
基因芯片: 指采用原位合成或直接点样的方法将DNA片段或寡核苷酸片段排列在硅片, 用荧光分子标记后的待检样品和微距阵杂交, 通过荧光扫描及计算机分析即可获得样品中大量的基因序列及表达信息, 以达到快速、高效、高通量地分析生物信息的目的.
作者采用基因芯片技术发现差异性表达基因参与转录过程、氧化还原、信号转导、离子转运、免疫应答、细胞黏附及结合功能等过程. 研究成果有助于进一步研究肝癌发病机制、早期诊断、针对特异性标志的靶向治疗.
编辑: 郭鹏 电编:都珍珍
| 1. | Ilboudo A, Nault JC, Dubois-Pot-Schneider H, Corlu A, Zucman-Rossi J, Samson M, Le Seyec J. Overexpression of phosphatidylinositol 4-kinase type IIIα is associated with undifferentiated status and poor prognosis of human hepatocellular carcinoma. BMC Cancer. 2014;14:7. [PubMed] [DOI] |
| 2. | Chen B, Chen XP, Wu MS, Cui W, Zhong M. Expressions of heparanase and upstream stimulatory factor in hepatocellular carcinoma. Eur J Med Res. 2014;19:45. [PubMed] [DOI] |
| 3. | Fan J, Lou B, Chen W, Zhang J, Lin S, Lv FF, Chen Y. Down-regulation of HDAC5 inhibits growth of human hepatocellular carcinoma by induction of apoptosis and cell cycle arrest. Tumour Biol. 2014; Aug 17. [Epub ahead of print]. [PubMed] [DOI] |
| 4. | Xu L, Beckebaum S, Iacob S, Wu G, Kaiser GM, Radtke A, Liu C, Kabar I, Schmidt HH, Zhang X. MicroRNA-101 inhibits human hepatocellular carcinoma progression through EZH2 downregulation and increased cytostatic drug sensitivity. J Hepatol. 2014;60:590-598. [PubMed] [DOI] |
| 5. | Staib F, Krupp M, Maass T, Itzel T, Weinmann A, Lee JS, Schmidt B, Müller M, Thorgeirsson SS, Galle PR. CellMinerHCC: a microarray-based expression database for hepatocellular carcinoma cell lines. Liver Int. 2014;34:621-631. [PubMed] [DOI] |
| 6. | Wu CL, Zhao SP, Yu BL. Microarray analysis provides new insights into the function of apolipoprotein O in HepG2 cell line. Lipids Health Dis. 2013;12:186. [PubMed] [DOI] |
| 7. | He TL, Zheng KL, Li G, Song B, Zhang YJ. Identification of typical miRNAs and target genes in hepatocellular carcinoma by DNA microarray technique. Eur Rev Med Pharmacol Sci. 2014;18:108-116. [PubMed] |
| 8. | Marshall A, Lukk M, Kutter C, Davies S, Alexander G, Odom DT. Global gene expression profiling reveals SPINK1 as a potential hepatocellular carcinoma marker. PLoS One. 2013;8:e59459. [PubMed] [DOI] |
| 9. | Maass T, Sfakianakis I, Staib F, Krupp M, Galle PR, Teufel A. Microarray-based gene expression analysis of hepatocellular carcinoma. Curr Genomics. 2010;11:261-268. [PubMed] [DOI] |
| 10. | Ren G, Fan X, Liang Q, Wang Y, Luo G. Screening and evaluation of traditional Chinese medicine by microarray expression analysis. J Ethnopharmacol. 2013;147:564-569. [PubMed] [DOI] |
| 11. | Ma R, Fredriksson I, Karthik GM, Winn G, Darai-Ramqvist E, Bergh J, Hartman J. Superficial scrapings from breast tumors is a source for biobanking and research purposes. Lab Invest. 2014;94:796-805. [PubMed] [DOI] |
| 13. | D'Alimonte I, Lannutti A, Pipino C, Di Tomo P, Pierdomenico L, Cianci E, Antonucci I, Marchisio M, Romano M, Stuppia L. Wnt signaling behaves as a "master regulator" in the osteogenic and adipogenic commitment of human amniotic fluid mesenchymal stem cells. Stem Cell Rev. 2013;9:642-654. [PubMed] [DOI] |
| 15. | Bush BM, Brock AT, Deng JA, Nelson RA, Sumter TF. The Wnt/β-catenin/T-cell factor 4 pathway up-regulates high-mobility group A1 expression in colon cancer. Cell Biochem Funct. 2013;31:228-236. [PubMed] [DOI] |
| 17. | Dweep H, Sticht C, Kharkar A, Pandey P, Gretz N. Parallel analysis of mRNA and microRNA microarray profiles to explore functional regulatory patterns in polycystic kidney disease: using PKD/Mhm rat model. PLoS One. 2013;8:e53780. [PubMed] [DOI] |
| 18. | Koga H, Tsedensodnom O, Tomimaru Y, Walker EJ, Lee HC, Kim KM, Yano H, Wands JR, Kim M. Loss of the SxxSS motif in a human T-cell factor-4 isoform confers hypoxia resistance to liver cancer: an oncogenic switch in Wnt signaling. PLoS One. 2012;7:e39981. [PubMed] [DOI] |
| 19. | Ye X, Hemida MG, Qiu Y, Hanson PJ, Zhang HM, Yang D. MiR-126 promotes coxsackievirus replication by mediating cross-talk of ERK1/2 and Wnt/β-catenin signal pathways. Cell Mol Life Sci. 2013;70:4631-4644. [PubMed] [DOI] |
| 21. | Xie JX, Yin JH, Zhang Q, Pu R, Zhang YW, Lu WY, Cao GW. [Association of genetic polymorphisms of key molecules in JAK/STAT signaling pathway with susceptibility of hepatocellular carcinoma]. Zhonghua Liu Xing Bing Xue Za Zhi. 2012;33:215-219. [PubMed] |
| 22. | Calvisi DF, Pascale RM, Feo F. Dissection of signal transduction pathways as a tool for the development of targeted therapies of hepatocellular carcinoma. Rev Recent Clin Trials. 2007;2:217-236. [PubMed] |
| 23. | Chen G, Qiu H, Ke S, Hu S, Yu S, Zou S. The fibroblast growth factor receptor 2-mediated extracellular signal-regulated kinase 1/2 signaling pathway plays is important in regulating excision repair cross-complementary gene 1 expression in hepatocellular carcinoma. Biomed Rep. 2013;1:604-608. [PubMed] [DOI] |
| 24. | Liao J, Xu T, Zheng JX, Lin JM, Cai QY, Yu DB, Peng J. Nitidine chloride inhibits hepatocellular carcinoma cell growth in vivo through the suppression of the JAK1/STAT3 signaling pathway. Int J Mol Med. 2013;32:79-84. [PubMed] [DOI] |
| 25. | Liu YY, Zheng Q, Fang B, Wang W, Ma FY, Roshan S, Banafa A, Chen MJ, Chang JL, Deng XM. Germacrone induces apoptosis in human hepatoma HepG2 cells through inhibition of the JAK2/STAT3 signalling pathway. J Huazhong Univ Sci Technolog Med Sci. 2013;33:339-345. [PubMed] [DOI] |
| 28. | Jang JY, Jeon YK, Lee CE, Kim CW. ANT2 suppression by shRNA may be able to exert anticancer effects in HCC further by restoring SOCS1 expression. Int J Oncol. 2013;42:574-582. [PubMed] [DOI] |
| 29. | Yen CH, Lu YC, Li CH, Lee CM, Chen CY, Cheng MY, Huang SF, Chen KF, Cheng AL, Liao LY. Functional characterization of glycine N-methyltransferase and its interactive protein DEPDC6/DEPTOR in hepatocellular carcinoma. Mol Med. 2012;18:286-296. [PubMed] [DOI] |
| 30. | 张 斌, 钟 德玝, 王 群伟, 苗 雄鹰, 戴 卫东, 刘 春, 潘 凯华. JAK/STAT信号通路与肝细胞性肝癌的肿瘤进展和预后的相关性研究. 细胞与分子免疫学杂志. 2010;4:368-370, 373. |