修回日期: 2014-09-05
接受日期: 2014-09-30
在线出版日期: 2014-11-08
目的: 探讨热休克蛋白90α(heat shock protein 90α, HSP90α)在食管癌(esophageal carcinoma, EC)细胞侵袭转移中的作用机制.
方法: 分别采用RT-PCR和Western blot检测HSP90α在具有不同侵袭转移潜能的EC细胞株CE81T-0和CE81T-4中mRNA水平和蛋白质水平的表达差异; 细胞转染技术将siRNA-HSP90α转染入CE81T-4细胞中, 并分为实验组、阴性对照组、空白对照组; 并用RT-PCR和Western blot检测3组细胞中HSP90α mRNA水平和蛋白质水平的表达差异, 验证是否转染成功. MTT法检测3组细胞的增殖活力, 流式细胞术分析细胞周期、凋亡的改变, 划痕实验和Transwell体外侵袭实验检测转染后CE81T-4细胞迁移和侵袭的变化.
结果: CE81T-4细胞中的HSP90α的mRNA和蛋白质表达水平明显高于CE81T-0细胞(P<0.05); siRNA-HSP90α成功转染CE81T-4细胞后, RT-PCR和Western blot检测3组结果显示, 实验组中HSP90α mRNA水平和蛋白水平表达量显著低于空白对照组和阴性对照组(P<0.05); MTT实验结果显示, 实验组细胞的增殖能力明显减弱, 与其他两组比较差异具有统计学意义(P<0.05); HSP90α基因表达沉默后, 细胞凋亡率为32.67%, 较空白对照组和阴性对照组明显增加(P<0.05); 实验组细胞周期被阻滞在G0/G1期; Transwell体外侵袭实验显示实验组侵袭迁移的细胞数显著低于空白照组与阴性对照组(P<0.05); 划痕实验结果显示, 72 h后实验组细胞的迁移力较其他两组明显降低.
结论: HSP90α的下调会降低EC细胞的转移侵袭能力.
核心提示: 热休克蛋白90α(heat shock protein 90α, HSP90α)的表达与食管癌(esophageal carcinoma, EC)的侵袭转移能力密切相关, 应用RNA干扰技术使HSP90α的表达下调会导致EC细胞的增殖、侵袭和转移受到抑制, 并促进EC细胞凋亡并使其细胞周期阻滞在G0/G1期, 为EC的治疗提供临床参考价值.
引文著录: 郭雨, 李秀娟, 张琪琪, 张志强. HSP90α的表达对食管癌细胞侵袭转移能力的影响. 世界华人消化杂志 2014; 22(31): 4719-4725
Revised: September 5, 2014
Accepted: September 30, 2014
Published online: November 8, 2014
AIM: To investigate the correlation between heat shock protein 90α (HSP90α) expression and invasion and metastasis of esophageal cell carcinoma.
METHODS: The differential expression of HSP90α mRNA and protein was tested by RT-PCR and Western blot, respectively, in esophageal cell carcinoma cell lines with different invasive ability (CE81T-0 and CE81T-4). An siRNA targeting HSP90α was transfected into CE81T-4 cells, and cells transfected with a negative control and non-transfected cells were used as controls. The expression of HSP90α mRNA and protein was tested by RT-PCR and Western blot in these three groups of cells. The viability of cells was examined by MTT assay; cell cycle and apoptosis were analyzed by flow cytometry; and the changes in migration and invasion of CE81T-4 cells after transfection were tested by scratch assay and Transwell assay.
RESULTS: The expression levels of HSP90α mRNA and protein in CE81T-4 cells were significantly higher than those in CE81T-0 cells (P < 0.05). After HSP90α siRNA transfection in EC81T-4 cells, RT-PCR and Western blot analyses showed that the levels of HSP90α mRNA and protein expression were significantly lower in the experimental than in the blank control and negative control group (P < 0.05). MTT assay showed that cell proliferation ability in the experimental group was significantly lower compared with the other two groups (P < 0.05). Cell apoptosis rate was significantly higher in the experimental group compared with other two groups (P < 0.05). HSP90α siRNA transfection resulted in cell cycle arrest in G0/G1 phase. Transwell invasion assay indicated that number of cells penetrating the polycarbonate membrane was significantly lower in the experimental group than in the other two groups (P < 0.05). In addition, the migration ability of cells in the experimental group was significantly lower compared with the other two groups.
CONCLUSION: Down-regulation of expression of HSP90α may reduce invasion and metastasis of esophageal cell carcinoma cells.
- Citation: Guo Y, Li XJ, Zhang QQ, Zhang ZQ. Correlation between HSP90α expression and invasion and metastasis of esophageal cancer cells. Shijie Huaren Xiaohua Zazhi 2014; 22(31): 4719-4725
- URL: https://www.wjgnet.com/1009-3079/full/v22/i31/4719.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i31.4719
食管癌(esophageal carcinoma, EC)是消化系最常见的恶性肿瘤之一, 中国是全世界EC的高发地区[1]. EC的5年生存率低于30%[2], 浸润与转移是导致EC患者死亡的重要因素[3]. 目前发现与EC转移侵袭能力相关的基因、蛋白、因子有许多种, 如: Ras基因[4]、基质金属蛋白酶(matrix metalloproteinase, MMP)家族[5,6]、血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)[7]等, 但缺乏特异的分子靶标. 目前EC的转移机制尚不清楚, 仍需要进一步研究. 大量研究显示HSP90α在胃癌、肝瘤、子宫颈癌、胰腺癌等多种恶性肿瘤中呈现高表达, 并参与了肿瘤的浸润与转移[8-12]. 本研究在两种高低侵袭力不同的EC细胞中发现HSP90α在高侵袭力CE81T-4细胞的中表达更高. 利用RNA干扰技术, 通过沉默抑制高侵袭EC细胞CE81T-4中HSP90α的基因表达, 观察HSP90α基因沉默后对EC细胞生物学性状的影响. 以探讨HSP90α的表达对EC细胞转移侵袭能力的影响, 为EC的基因治疗提供理论依据.
EC细胞系: CE81T-4与CE81T-0为台湾高雄医学大学附设中和纪念医院的吴明苍教授惠赠[13]. DMEM培养基、胎牛血清(fetal calf serum, FBS)购于Gibico公司; 细胞周期、凋亡试剂盒购于贝博公司; MTT、Western blot二抗试剂盒、Lipofectamine™ 2000、Opti-MEM购于Invitrogen公司; RIPA裂解液、PCR产物纯化试剂盒购于百泰克公司; primeScript™ one step RT-PCR kit、SYBR Green PCR premix、DNA Marker购于TaKaRa宝生物工程有限公司; Transwell小室购于Millicell公司; HSP90α兔抗人多克隆抗体购于Cell Signal Technology公司.
1.2.1 细胞培养: 人EC细胞CE81T-4与CE81T-0接种于含10%胎牛血清的培养基中, 置37 ℃, 5%CO2培养箱中培养, 至对数生长期进行实验.
1.2.2 RT-PCR HSP90α引物序列: 上游引物: 5'-CTGCTTATTTGGTTGCTGAGAAAGT-3', 下游引物: 5'-TCCTTTATTCTTCGTTCCTCCAAG-3'. 取总RNA 2 μg/L进行逆转录, 取cDNA 2 μL扩增HSP90α基因序列, 以β-actin为内对照. 取PCR产物进行凝胶电泳, 凝胶成像系统上扫描, 并分析结果.
1.2.3 Western blot检测: 取30 mg蛋白煮沸后上样, 10%SDS-聚丙烯酰胺凝胶电泳分离, 转移至PVDF膜, 37 ℃封闭60 min. 加入1:250稀释的兔抗人HSP90α多克隆抗体, 4 ℃封闭过夜. 二抗孵育30 min, 发光剂孵育至条带清楚, 用水终止显色. 用凝胶成像仪扫描, 并进行灰度值分析.
1.2.4 细胞转染: 选用CE81T-4进行瞬时转染. 分为实验组、阴性对照组及空白对照组. 各组用Opti-MEM稀释对应的siRNA和Lipofectamine™ 2000. 将各组已经稀释的siRNA分别和Lipofectamine™ 2000稀释物混合, 室温避光孵育20 min. 将siRNA-Lipofectamine™ 2000复合物以每孔600 μL均匀的滴入各组转染细胞孔, 转染完成后继续培养. 每组设置3个平行样孔.
1.2.5 验证: 用RT-PCR及Western blot检测3组细胞(实验组、空白对照组、阴性对照组)中mRNA水平和蛋白质水平的表达差异, 验证是否转染成功. 方法同上.
1.2.6 噻唑兰比色(MTT)法细胞生长检测: 取转染后细胞种于96孔板, 分别在培养后的24、48、72 h, 向待测孔先后加入MTT及DMSO, 在490 nm波长下用酶标仪测定各孔吸光度(A)值, 记录结果.
1.2.7 细胞周期检测: 取转染后48 h的3组细胞, 75 mL/L冰冻乙醇4 ℃固定过夜. 向待测细胞加入RNase A溶液后37 ℃水浴, 筛网过滤. 加入PI染液4 ℃避光孵育. 用流式细胞仪检测DNA-PI的荧光强度, 最长激发波长为488 nm.
1.2.8 细胞凋亡检测: 取转染后48 h的3组细胞, 用1×Annexin V结合液悬浮细胞, 加入Annexin V-FITC染色液, 4 ℃避光孵育, 加入PI染色液后4 ℃避光孵育5 min. 用流式细胞仪检测.
1.2.9 划痕实验: 取转染后24 h的3组细胞, 用10 μL无菌枪头在每孔底部画一条直线, 确保每孔直线粗细均匀. 倒置显微镜下观察划痕宽度及细胞密度比较一致的部分做标记, 分别在0、24、48、72 h直至细胞划痕愈合, 进行拍照测量划痕宽度并观察划痕的愈合速度.
1.2.10 Transwell体外侵袭实验: 取转染后24 h的3组细胞, 细胞撤血清培养12 h后再制备细胞悬液. 使Transwell小室中基质胶再水化, 将细胞悬液加到小室中. 加入500 μL含10%胎牛血清的培养液在底层, 孵育36 h. 擦去上室底部基质胶及未侵袭细胞, 加入结晶紫染色. 在倒置显微镜下观察并计数.
统计学处理 本文数据使用SPSS13.0统计学软件进行处理, 计量资料采用mean±SD的形式表示, 两组间差异采用t检验, 3组之间采用单因素方差检验, P<0.05为差异具有统计学意义.
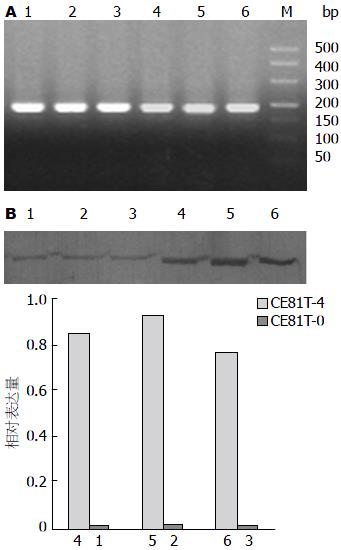
CE81T-4细胞中HSP90α的mRNA表达水平(1.8107±0.4579)明显高于CE81T-0(0.5306±0.08249)(P<0.05)(图1A). CE81T-4细胞中HSP90α的蛋白质表达水平(0.842±0.073)明显高于CE81T-0(0.0085±0.00092), 差异有统计学意义(P<0.05)(图1B).
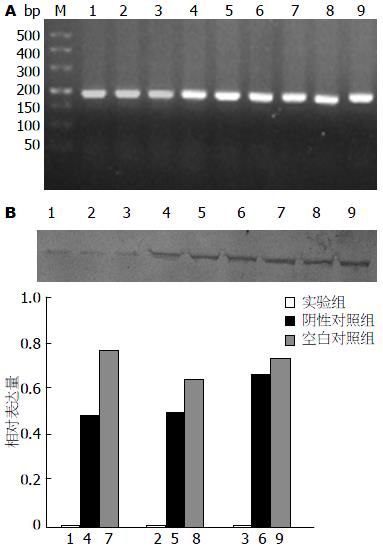
实验组HSP90α mRNA的表达量(0.01572±0.00266)明显低于空白对照组(0.03318±0.00942)和阴性对照组(0.03250±0.00252), 且差异均有统计学意义(P = 0.020, P = 0.026)(图2A). 实验组HSP90α蛋白的表达量(0.0076±0.00034)明显低于阴性对照组(0.550±0.094)和空白对照组HSP90α为(0.722±0.062), 且差异均有统计学意义(P = 0.000, P = 0.000)(图2B).
转染24 h后3组比较细胞增殖能力无明显差异(P>0.05), 在转染后48、72、96 h实验组细胞增殖能力较空白对照组、阴性对照组显著降低(P<0.05)(表1).
与空白对照组和转染阴性对照相比, 转染siRNA-HSP90α的实验组细胞能明显引起细胞周期阻滞. 在空白对照组中G0/G1期细胞比例的平均值为65.930%±0.862%, 在阴性对照组中为66.900%±0.556%, 转染siRNA-HSP90α实验组中G0/G1期细胞比例的平均值为72.000%±2.606%, 实验组与对照组相比较均有显著统计学差异(P = 0.004, P = 0.008)(表2).
空白对照组、阴性对照组、实验组中发生凋亡的细胞所占的比率分别为9.230%±0.551%、4.87%±1.44%、32.67%±5.28%. 实验组与阴性对照组和空白对照组之间有差异有统计学意义(P = 0.000), 阴性对照组和空白对照组差异无统计学意义(P = 0.151).
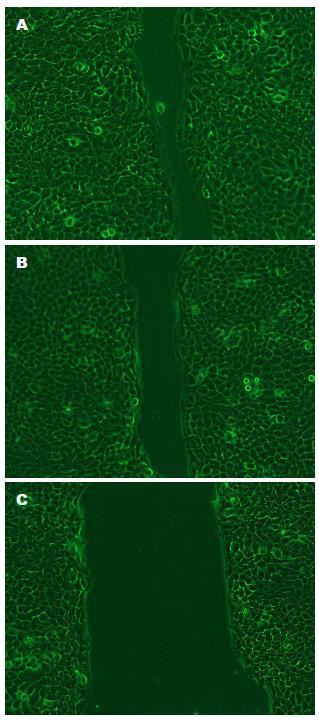
实验组细胞的移动速度明显慢于空白对照组以及阴性对照组; 在转染后72 h后, 空白对照组以及阴性对照组细胞划痕宽度基本愈合, 而实验组细胞划痕宽度明显, 可见沉默HSP90α基因的表达后, EC细胞的迁移力显著下降(图3).
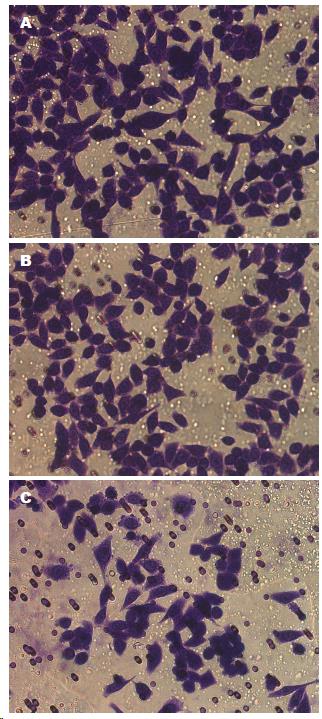
实验组侵袭迁移的细胞个数为76.4个±8.7个, 显著低于空白照组(140.3个±5.8个, P<0.05)与阴性对照组(129.3个±10.1个, P<0.05)(图4).
CE81T-4和CE81T-0细胞是已经证实其转移侵袭能力有差异的两者EC细胞(CE81T-4的转移侵袭能力大于CE81T-0), 其性能稳定, 是研究EC良好的细胞模型.
HSP是一种ATP依赖的分子伴侣, HSP90是其中的大家族, 在细菌和真核细胞中广泛存在. 在正常细胞中, HSP90是受到细胞周期调控的, HSP90可以促进蛋白进行适当的折叠、合成、转位, 在应激条件下维持细胞必需的蛋白质空间构象, 从而保护细胞的功能、生存和对应激源的耐受[14]. 但在癌细胞中, HSP90不需要应激, 即可呈现持续性高表达, 稳定肿瘤细胞中活性癌蛋白, 这些活性癌蛋白大多是在肿瘤恶性转化中起关键作用的激酶和转录因子, 从而促进肿瘤的产生、生长和转移[15]. HSP90有两个亚型, HSP90α和HSP90β, 这两个亚型的氨基酸序列的相似性为93%, 一致性达86%[16], 目前已经发现了分别与他们特异性结合的底物蛋白[17]. 其中HSP90α与肿瘤的关系更为密切, 在肿瘤细胞中多呈过量表达.
在国外, 对EC与HSP90α之间的具体研究极少. 在国内, 许建功等[18]、仝瑞锋[19]应用免疫组织化学技术发现HSP90α与EC有密切相关性, 但也有报道称HSP90α与食管鳞癌无密切关系[20], 并无EC细胞水平层次的相关研究. 本研究在细胞水平上, 发现CE81T-4和CE81T-0两种EC细胞中, 侵袭力较高的CE81T-4细胞中HSP90α的mRNA及蛋白表达水平明显高于侵袭力较低的CE81T-0细胞. 将siRNA-HSP90α瞬时转染入CE81T-4细胞, RT-PCR和Western blot结果显示将HSP90α干扰后CE81T-4细胞中HSP90α在mRNA和蛋白水平表达显著下降, 通过细胞增殖实验、划痕实验、Transwell实验、细胞凋亡和周期实验结果证实了沉默HSP90α的表达可以抑制EC细胞的增殖、侵袭和转移促进凋亡并使细胞周期阻滞在G0/G1期. 本研究提示我们HSP90α在EC细胞的增殖、侵袭和转移中发挥着重要的作用. 为将来应用siRNA对EC基因治疗的研究奠定了基础, 同时也为临床药物靶向治疗提供了新的思路.
有研究[21-24]显示HSP90α不仅存在于胞浆内, 也可以由肿瘤细胞主动分泌致细胞外, 促进肿瘤细胞的侵袭和转移. 有研究[25]报道, 血浆中HSP90α水平在恶性肿瘤中特异性的升高, 炎症的发生不会干扰血浆中HSP90α的含量检测. 众多研究表明HSP90α与肿瘤的发生发展的多个过程有着密切相关性, 且阳性率及敏感性高, 提示血浆HSP90α具有作为临床肿瘤标志物及评估肿瘤预后的潜在应用价值. 有不少针对特异性抑制HSP90α功能以达到靶向治疗癌症的药物已经被研究证实, 例如格尔德霉素(GA)[26]及17-丙烯胺基-17-去甲氧基格尔德霉素[27]. RNA干扰技术具有严格的序列特异性、高效性, 治疗针对性强、不良反应小等特点, 已成为肿瘤基因治疗研究的重要工具之一[28-30], 体现在针对过表达凋亡抑制因子或癌基因、对肿瘤的耐药基因等方面. 但应用siRNA-HSP90α对EC进行靶向治疗仍需要进一步研究及大量的临床试验, 如应用干扰HSP90α后的EC细胞进行动物体内实验以及临床患者基因靶向治疗后的生存分析及影像学对比分析等.
志谢: 真诚的感谢台湾高雄医学大学附设中和纪念医院的吴明苍教授赠与的EC细胞以及对于实验的指导和帮助.
食管癌(esophageal carcinoma, EC)是一种高发病率、高死亡率且病因尚未明确的疾病. 热休克蛋白(heat shock protein, HSP)家族是一种ATP依赖的分子伴侣, 目前国内外大量研究发现其中的HSP27、HSP70、HSP90等与癌症的发生发展密切相关. HSP90又分为HSP90α和HSP90β, 据研究发现HSP90α较HSP90β与癌症的关系更紧密.
张力为, 副教授, 新疆医科大学第一附属医院胸外科
本实验在细胞水平上验证了HSP90α对EC的转移侵袭能力影响. 并应用siRNA-HSP90α对EC进行靶向治疗奠定了基础, 同时也为临床药物靶向治疗提供了新的思路.
目前有大量研究显示HSP90α与癌症密切相关, 但对于EC与HSP90α关系的研究结论并不一致. 目前, 国内外相关RNA干扰技术用于疾病的治疗已有大量报道, 均充分肯定了该技术在肿瘤治疗方面的价值, 在临床上具有较高的应用价值.
在EC细胞水平上对HSP90α的研究在国内为首例. 用RNA干扰技术来抑制基因表达, 为治疗癌症、遗传病等疾病开辟了新的途径.
RNA干扰技术可应用于基因治疗、新药开发、生物医学研究等多个领域. 目前如老年视黄斑退化、帕金森、肌肉萎缩性侧索硬化症、类风湿性关节炎、肥胖症等病已经尝试采用该方法进行疾病治疗. 肿瘤治疗方面也已经取得了一些成果.
本文HSP90α在EC侵袭转移中的作用机制, 采用RT-PCR和Western blot检测HSP90α在具有不同侵袭转移潜能的EC细胞株CE81T-0和CE81T-4中mRNA水平和蛋白质水平的表达差异, 具有一定的创新型.
编辑: 郭鹏 电编:都珍珍
| 2. | Li H, Yao SC. Surgical treatment for carcinoma of the oesophagus in Chinese language publications. Br J Surg. 1997;84:855-857. [PubMed] [DOI] |
| 3. | 王 晓兰. 67LR_MMP_7和TIMP_1在食管鳞癌组织中的表达及其意义. 郑州: 郑州大学基础医学院 2009; . |
| 4. | Réjiba S, Wack S, Aprahamian M, Hajri A. K-ras oncogene silencing strategy reduces tumor growth and enhances gemcitabine chemotherapy efficacy for pancreatic cancer treatment. Cancer Sci. 2007;98:1128-1136. [PubMed] [DOI] |
| 5. | 吴 清泉, 吴 健, 陈 亮. MMP-2蛋白在食管磷状细胞癌中的表达及意义. 南京医科大学学报(自然科学版). 2012;32:1229-1231. |
| 7. | Takei Y, Kadomatsu K, Yuzawa Y, Matsuo S, Muramatsu T. A small interfering RNA targeting vascular endothelial growth factor as cancer therapeutics. Cancer Res. 2004;64:3365-3370. [PubMed] [DOI] |
| 13. | Chen YK, Chang WS, Wu IC, Li LH, Yang SF, Chen JY, Hsu MC, Chen SH, Wu DC, Lee JM. Molecular characterization of invasive subpopulations from an esophageal squamous cell carcinoma cell line. Anticancer Res. 2010;30:727-736. [PubMed] |
| 14. | Pratt WB, Toft DO. Regulation of signaling protein function and trafficking by the hsp90/hsp70-based chaperone machinery. Exp Biol Med (Maywood). 2003;228:111-133. [PubMed] |
| 15. | Whitesell L, Lindquist SL. HSP90 and the chaperoning of cancer. Nat Rev Cancer. 2005;5:761-772. [PubMed] [DOI] |
| 16. | Wright L, Barril X, Dymock B, Sheridan L, Surgenor A, Beswick M, Drysdale M, Collier A, Massey A, Davies N. Structure-activity relationships in purine-based inhibitor binding to HSP90 isoforms. Chem Biol. 2004;11:775-785. [PubMed] [DOI] |
| 17. | Chadli A, Felts SJ, Toft DO. GCUNC45 is the first Hsp90 co-chaperone to show alpha/beta isoform specificity. J Biol Chem. 2008;283:9509-9512. [PubMed] [DOI] |
| 19. | 仝 瑞锋. 热休克蛋白27、90α和核因子κBP65在食管鳞状细胞癌中的表达及意义的研究. 石家庄: 河北医科大学 2011; . |
| 21. | Tsutsumi S, Neckers L. Extracellular heat shock protein 90: a role for a molecular chaperone in cell motility and cancer metastasis. Cancer Sci. 2007;98:1536-1539. [PubMed] [DOI] |
| 22. | Wang X, Song X, Zhuo W, Fu Y, Shi H, Liang Y, Tong M, Chang G, Luo Y. The regulatory mechanism of Hsp90alpha secretion and its function in tumor malignancy. Proc Natl Acad Sci U S A. 2009;106:21288-21293. [PubMed] [DOI] |
| 23. | Eustace BK, Sakurai T, Stewart JK, Yimlamai D, Unger C, Zehetmeier C, Lain B, Torella C, Henning SW, Beste G. Functional proteomic screens reveal an essential extracellular role for hsp90 alpha in cancer cell invasiveness. Nat Cell Biol. 2004;6:507-514. [PubMed] [DOI] |
| 24. | Eustace BK, Jay DG. Extracellular roles for the molecular chaperone, hsp90. Cell Cycle. 2004;3:1098-1100. [PubMed] |
| 25. | 宋 晓敏. 分泌型热休克蛋白90α在肿瘤发生和转移中的作用机理. 北京: 清华大学生命科学学院 2010; 43. |
| 28. | Wang X, Dong L, Xie J, Tong T, Zhan Q. Stable knockdown of Aurora-A by vector-based RNA interference in human esophageal squamous cell carcinoma cell line inhibits tumor cell proliferation, invasion and enhances apoptosis. Cancer Biol Ther. 2009;8:1852-1859. [PubMed] |
| 29. | 张 云汉. RNA干扰作用的机制及其在肿瘤基因治疗中的应用前景. 郑州大学学报: 医学版. 2006;41:393-395. |