修回日期: 2014-09-10
接受日期: 2014-09-21
在线出版日期: 2014-10-28
目的: 探讨Tregs在人幽门螺杆菌(Helicobacter pylori, H. pylori)感染中的作用.
方法: 168例胃窦黏膜标本中H. pylori阳性89例, H. pylori阴性79例; 60例H. pylori根除治疗前后患者的胃窦黏膜标本, 均采用免疫组织化学的方法检测病理标本中Foxp3阳性细胞浸润情况.
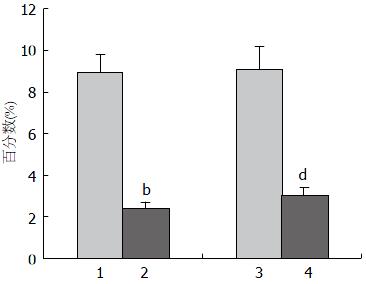
结果: H. pylori阳性组胃窦黏膜标本中Tregs浸润程度显著高于H. pylori阴性组(8.9% vs 2.4%, P<0.01); H. pylori根除治疗前胃窦黏膜标本中Tregs浸润程度显著高于根除治疗后(9.1% vs 3.0%, P<0.01).
结论: Tregs参与了H. pylori感染的免疫应答, H. pylori感染致胃黏膜Tregs浸润数量显著增加, 抑制黏膜局部免疫反应, 减轻免疫损伤的同时导致H. pylori逃逸机体的免疫清除, 造成H. pylori持续慢性感染及黏膜慢性炎症; 根除H. pylori后, 胃黏膜Tregs浸润数量显著减少, 黏膜可重新恢复免疫平衡状态.
核心提示: 本研究显示幽门螺杆菌(Helicobacter pylori, H. pylori)阳性的胃窦黏膜Treg浸润显著高于H. pylori阴性者; 根除H. pylori后, Treg细胞浸润密度显著降低. 结果提示Tregs参与了H. pylori感染的免疫应答, 造成H. pylori持续慢性感染, 根除H. pylori后, 胃黏膜可重新恢复免疫平衡状态, 从而减轻炎症.
引文著录: 袁小刚, 黄艳娟, 胡红松. Tregs在幽门螺杆菌感染中的作用. 世界华人消化杂志 2014; 22(30): 4714-4718
Revised: September 10, 2014
Accepted: September 21, 2014
Published online: October 28, 2014
AIM: To investigate the role of Foxp3+ regulatory T cells (Tregs) in Helicobacter pylori (H. pylori) infection.
METHODS: By using biopsies from 89 H. pylori-positive patients, 60 of whom underwent treatment for eradication of H. pylori, and 79 H. pylori-negative adults, immunohistochemistry was performed to semi-quantify the number of Tregs in the gastric mucosa.
RESULTS: The proportion of Tregs was 2.4% in H. pylori-negative individuals, and 8.9% in H. pylori-positive patients (P < 0.01). After eradication of H. pylori, the proportion of Tregs significantly declined (3.0%, P < 0.01).
CONCLUSION: Tregs actively participate in the immune response to H. pylori infection. H. pylori chronically colonizes the stomach and increases the frequency of Tregs in the gastric mucosa, thereby suppressing the immune response and contributing to the persistence of H. pylori infection. Tregs decrease in the gastric mucosa after eradication of H. pylori, and mucosal immune balance is then restored.
- Citation: Yuan XG, Huang YJ, Hu HS. Role of Tregs in Helicobacter pylori infection. Shijie Huaren Xiaohua Zazhi 2014; 22(30): 4714-4718
- URL: https://www.wjgnet.com/1009-3079/full/v22/i30/4714.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i30.4714
幽门螺杆菌(Helicobacter pylori, H. pylori)慢性持续感染是慢性胃炎、消化性溃疡及胃黏膜相关淋巴组织淋巴瘤(mucosa associated lymphadenoma, MALT)及胃癌的主要病因[1]. H. pylori感染机体后, 可产生一系列的促炎免疫应答反应, 包括宿主固有免疫应答和获得性H. pylori特异性T细胞及B细胞相关的免疫应答, 但这些免疫应答却难以清除体内感染的H. pylori, 从而导致H. pylori持续慢性感染, 甚至持续终生[2].
1995年, Sakaguchi等[3]首先报道CD4+CD25+调节性T细胞(Treg)亚群具有免疫调节作用, Treg可抑制自身免疫性疾病的发生. Treg可通过细胞直接接触及分泌抑制性细胞因子等作用方式发挥其免疫调节作用, 维持自身免疫耐受及免疫平衡. 叉状头/翅膀状螺旋转录因子(Foxp3) mRNA及其编码的Scurfy蛋白特异性表达于Treg细胞, 目前认为Foxp3是Treg最具特异性的分子标志, 是Treg获得免疫调节特性的关键转录因子[4].
目前普遍认为Treg可抑制病原微生物感染后机体产生的强烈促炎免疫反应, 从而减轻组织的免疫损伤, 但与此同时也保护了病原微生物, 造成病原微生物的慢性持续感染. 这提示Treg可能与H. pylori持续慢性感染而不被机体免疫清除及H. pylori感染导致的胃黏膜慢性炎症有关. 国外有研究[5]发现Treg能调节小鼠H. pylori感染后的胃黏膜炎症, 抑制小鼠对H. pylori的免疫清除, 导致H. pylori慢性持续感染. 同时也有研究[6]发现H. pylori阳性的胃炎、胃溃疡及胃癌组织中Treg细胞浸润显著增加. 但也有与此相反的研究结果, Satoh等[7]研究发现: H. pylori阳性及阴性的患者外周血T细胞无显著差异. 至今鲜有报道, 在H. pylori根除治疗前后, 人的胃黏膜Treg浸润情况是否会发生变化. 故本研究以人体胃窦黏膜标本作为研究对象, 采用免疫组织化学的方法, 比较H. pylori阳性和阴性及H. pylori根除治疗前后的胃窦黏膜标本中Treg浸润差异, 旨在进一步探讨Tregs在人H. pylori感染中的作用.
168例胃窦黏膜标本均取自因上消化道症状而就诊的患者, 其内镜及病理诊断为慢性浅表性胃炎或胃溃疡, 在患者行胃镜检查时于幽门前2-3 cm胃窦小弯侧活检胃窦黏膜2-3块, 行改良Gimesa染色, 患者胃镜检查前行14C呼气试验检查, 以上两项检查均阳性者判断为H. pylori阳性, 以上两项检查均阴性者判断为H. pylori阴性; 共纳入H. pylori阳性组89例, H. pylori阴性组79例; 其中60例H. pylori阳性患者在根除H. pylori治疗结束, 停药4 wk以上时复查胃镜, 复查胃镜前常规复查14C呼气试验检查, 阴性者在复查胃镜时, 再次活检胃窦黏膜2-3块, 同样采用改良Gimesa染色判断H. pylori感染情况, 以上两项检查均阴性者确定为H. pylori根除治疗成功. 试剂: 浓缩型鼠抗人Foxp3单克隆抗体(ab22510, 美国Abcam公司), 工作浓度均为1:300(体积比); PV-9000第二代通用型二步法免疫组织化学染色试剂盒及浓缩型DAB试剂盒(614864A; 3 mL)(北京中杉金桥生物技术有限公司).
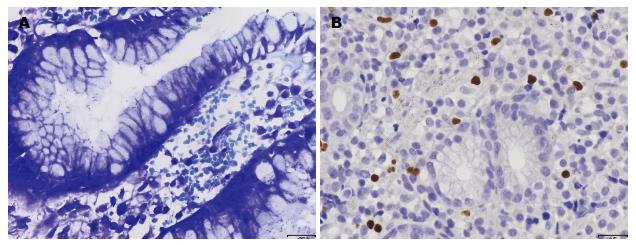
1.2.1 H. pylori检测: 胃窦黏膜石蜡标本行4 μm厚连续切片, 行病理常规HE染色, 采用改良Gimesa染色方法检测H. pylori. Giemsa染液配制: 2 g Giemsa染料, 加入蒸馏水10 mL, 过滤. 染色主要步骤: (1)石蜡切片常规脱蜡、水化; (2)蒸馏水洗3遍, 滴染Giemsa染液, 25 min后自来水稍洗, 950 mL/L乙醇分化3次, 无水乙醇分化2次, 自然晾干、封片.
1.2.2 Treg检测: 采用免疫组织化学二步法, 其主要步骤: (1)石蜡切片常规脱蜡、水化; (2)3%过氧化氢浸泡8 min, 以阻断内源性过氧化物酶; (3)切片置于0.01 mol/L柠檬酸盐缓冲液中, 微波炉热修复抗原15 min; (4)滴加新鲜配制的鼠抗人Foxp3单克隆抗体, 4 ℃冰箱恒温过夜; (5)滴加聚合酶辅助剂(Polymer Helper), 37 ℃恒温培养箱内孵育30 min; (6)滴加辣根酶标记羊抗兔/小鼠IgG多聚体, 37 ℃恒温孵育30 min; (7)DAB显色、苏木素复染、脱水、透明、封片. 对照: 淋巴结组织作为阳性对照, 以PBS代替一抗作为阴性对照.
结果判断: Foxp3蛋白以细胞核染成棕黄色为阳性细胞; 每张切片随机观察10个高倍视野, 每个视野分别计数阳性细胞及所有炎症细胞, 以阳性细胞除以总炎症细胞得出Tregs浸润比率, 以该比率的平均值作为Tregs浸润程度.
统计学处理 采用SPSS17.0软件进行数据处理, 计量资料以mean±SD表示, 组间比较采用t检验, P<0.05为差异具有统计学意义.
在普通光学显微镜下, 改良Gimesa染色后H. pylori呈弯曲杆状或弧状(图1A), 主要位于胃黏膜黏液层表面. 免疫组织化学研究结果显示H. pylori阳性组胃黏膜Treg浸润程度(8.9%±0.9%)显著高于H. pylori阴性组(2.4%±0.3%), 差异具有统计学意义(P<0.01); 根除治疗前(9.1%±1.1%)显著高于根除治疗后(3.0%±0.4%), 差异具有统计学意义(P<0.01)(图2).
流行病学研究[8]显示, 随着年龄的增长, 儿童H. pylori感染率逐渐升高, 故可以推测多数成人H. pylori相关性疾病的患者是儿童期即感染了H. pylori, 只是机体免疫系统很难将其完全清除. 即使目前有许多H. pylori根除治疗方案, 但因H. pylori耐药以及机体免疫等因素导致现有的治疗方案均难以100%将其根除, 如何防治H. pylori感染以及提高防治疗效, 这是摆在广大临床医师面前的一大难题. H. pylori是通过什么机制逃逸宿主免疫清除的呢? 通过某种方式适当改变宿主的免疫状态, 是否可提高H. pylori根除率呢? 为此, 本研究从免疫作用机制的角度, 以Treg细胞入手, 探讨H. pylori慢性持续感染及其致病的作用机制.
研究[9]显示H. pylori染宿主后定植于胃黏液层及胃黏膜上皮细胞, 激活宿主抗原提呈细胞, 并导致中性粒细胞、单核细胞及巨噬细胞等浸润至胃黏膜层, 诱导以Th1型免疫应答为主的特异性T细胞免疫反应, 与此同时Th2型免疫应答受到抑制, 导致B细胞分泌的IgA减少, 不足以清除H. pylori, 导致H. pylori持续慢性感染, 甚至终生存在. Th1型免疫应答反应释放了大量的细胞因子如白介素(interleukin, IL)-12、IL-18、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、干扰素(interferon, IFN)-1等作用于B淋巴细胞、自然杀伤(natural killer, NK)细胞、巨噬细胞, 使其在胃黏膜局部增殖、分化、激活, 产生特异性和非特异性免疫反应, 从而损伤局部胃黏膜组织; 同时进一步激活T淋巴细胞, 协同促进Thl反应, 加重Thl介导的胃黏膜损伤, 最终引起胃黏膜不同程度的损伤, 导致不同胃十二指肠疾病[10,11]. 本研究显示H. pylori阳性的胃窦黏膜Treg浸润显著高于H. pylori阴性者. 这与Lundgren等[12]研究结论吻合, Lundgren等[12]研究表明胃溃疡、十二指肠球部溃疡患者胃黏膜上和外周血中均高表达相同表型的Treg. 且有研究[13]发现在十二指肠球部溃疡患者中, 十二指肠球部胃黏膜化生处Treg细胞浸润数量也显著增加. Cho等[14]研究发现H. pylori相关性胃炎组织中, H. pylori定植密度与Treg浸润密度及胃炎严重程度成正比. H. pylori感染后, 胃窦黏膜Treg浸润密度显著升高可能是机体的一种保护机制, 机体为了维持免疫稳态, 避免Th1型免疫反应过度造成组织损伤, 故通过Treg细胞接触或分泌抑制性细胞因子抑制功能性T细胞, 从而抑制Th1型免疫反应, 增强Th2型免疫反应. 但这也同时导致H. pylori难以被机体的免疫功能所清除, 造成H. pylori慢性持续感染. 但当这种免疫稳态再次失衡时, 就可能导致H. pylori相关性疾病, 如消化性溃疡等[15].
本研究还显示根除H. pylori后, 胃窦黏膜Treg细胞浸润密度显著降低, 胃黏膜炎症程度减轻, 提示根除H. pylori后黏膜可重新恢复Th1/Th2的免疫平衡状态. 这也进一步提示H. pylori感染后可直接增加胃黏膜组织中Treg细胞的浸润, 从而导致胃黏膜免疫功能失衡.
总之, 本研究结果提示Tregs参与了H. pylori感染的免疫应答, H. pylori感染致胃黏膜Tregs浸润数量显著增加, 抑制黏膜局部免疫反应, 减轻胃黏膜免疫损伤的同时也导致了H. pylori逃逸机体的免疫清除作用, 造成H. pylori持续慢性感染及黏膜慢性炎症, 根除H. pylori后, 胃黏膜可重新恢复一种免疫平衡状态, 从而炎症可减轻.
CD4+CD25+调节性T细胞(Treg)可抑制病原微生物感染后机体产生的强烈促炎免疫反应, 从而减轻组织的免疫损伤, 但与此同时也保护了病原微生物, 造成病原微生物的慢性持续感染.
李瑜元, 教授, 广州市第一人民医院内科
Rad等研究发现Treg能调节小鼠H. pylori感染后的胃黏膜炎症, 抑制小鼠对H. pylori的免疫清除, 导致H. pylori慢性持续感染.
Cho等研究发现H. pylori相关性胃炎组织中, H. pylori定植密度与Treg浸润密度及胃炎严重程度成正比.
鲜有报道在H. pylori根除治疗前后, 人的胃黏膜组织中Treg浸润情况是否会发生变化.
Tregs参与了H. pylori感染的免疫应答, 导致H. pylori逃逸机体的免疫清除; 当根除H. pylori后, 胃黏膜Tregs浸润数量显著减少, 黏膜可重新恢复免疫平衡状态.
本文具有一定指导意义.
编辑: 田滢 电编:闫晋利
| 1. | Calvet X, Ramírez Lázaro MJ, Lehours P, Mégraud F. Diagnosis and epidemiology of Helicobacter pylori infection. Helicobacter. 2013;18 Suppl 1:5-11. [PubMed] [DOI] |
| 2. | Peek RM, Fiske C, Wilson KT. Role of innate immunity in Helicobacter pylori-induced gastric malignancy. Physiol Rev. 2010;90:831-858. [PubMed] [DOI] |
| 3. | Sakaguchi S, Sakaguchi N, Asano M, Itoh M, Toda M. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. J Immunol. 1995;155:1151-1164. [PubMed] |
| 4. | van Loosdregt J, Coffer PJ. Post-translational modification networks regulating FOXP3 function. Trends Immunol. 2014;35:368-378. [PubMed] [DOI] |
| 5. | Rad R, Brenner L, Bauer S, Schwendy S, Layland L, da Costa CP, Reindl W, Dossumbekova A, Friedrich M, Saur D. CD25+/Foxp3+ T cells regulate gastric inflammation and Helicobacter pylori colonization in vivo. Gastroenterology. 2006;131:525-537. [PubMed] |
| 6. | Cheng HH, Tseng GY, Yang HB, Wang HJ, Lin HJ, Wang WC. Increased numbers of Foxp3-positive regulatory T cells in gastritis, peptic ulcer and gastric adenocarcinoma. World J Gastroenterol. 2012;18:34-43. [PubMed] [DOI] |
| 7. | Satoh Y, Ogawara H, Kawamura O, Kusano M, Murakami H. Clinical Significance of Peripheral Blood T Lymphocyte Subsets in Helicobacter pylori-Infected Patients. Gastroenterol Res Pract. 2012;2012:819842. [PubMed] [DOI] |
| 8. | Serrano C, Wright SW, Bimczok D, Shaffer CL, Cover TL, Venegas A, Salazar MG, Smythies LE, Harris PR, Smith PD. Downregulated Th17 responses are associated with reduced gastritis in Helicobacter pylori-infected children. Mucosal Immunol. 2013;6:950-959. [PubMed] [DOI] |
| 9. | Koch M, Meyer TF, Moss SF. Inflammation, immunity, vaccines for Helicobacter pylori infection. Helicobacter. 2013;18 Suppl 1:18-23. [PubMed] [DOI] |
| 10. | Bhuiyan TR, Islam MM, Uddin T, Chowdhury MI, Janzon A, Adamsson J, Lundin SB, Qadri F, Lundgren A. Th1 and Th17 responses to Helicobacter pylori in Bangladeshi infants, children and adults. PLoS One. 2014;9:e93943. [PubMed] [DOI] |
| 11. | Moyat M, Velin D. Immune responses to Helicobacter pylori infection. World J Gastroenterol. 2014;20:5583-5593. [PubMed] [DOI] |
| 12. | Lundgren A, Strömberg E, Sjöling A, Lindholm C, Enarsson K, Edebo A, Johnsson E, Suri-Payer E, Larsson P, Rudin A. Mucosal FOXP3-expressing CD4+ CD25high regulatory T cells in Helicobacter pylori-infected patients. Infect Immun. 2005;73:523-531. [PubMed] |
| 13. | Kindlund B, Sjöling A, Hansson M, Edebo A, Hansson LE, Sjövall H, Svennerholm AM, Lundin BS. FOXP3-expressing CD4(+) T-cell numbers increase in areas of duodenal gastric metaplasia and are associated to CD4(+) T-cell aggregates in the duodenum of Helicobacter pylori-infected duodenal ulcer patients. Helicobacter. 2009;14:192-201. [PubMed] [DOI] |
| 14. | Cho KY, Cho MS, Seo JW. FOXP3+ regulatory T cells in children with helicobacter pylori infection. Pediatr Dev Pathol. 2012;15:118-126. [PubMed] [DOI] |