修回日期: 2013-11-30
接受日期: 2013-12-04
在线出版日期: 2014-01-28
目的: 观察在距大肠癌3个不同部位的癌旁组织隐窝微架构的变化及其相关上皮细胞特征分子E-cadherin和PAR-3表达分布差异. 检测E-cadherin、PAR-3在距大肠癌病灶不同距离的癌旁组织中的表达及分布差异, 探讨其对大肠癌发生的意义.
方法: 从距离大肠癌病灶近端10、5、2 cm处获取组织样本, 并分别命名为1、2、3号位组织样本, 观察3个部位组织隐窝微架构变化规律, 并采用免疫组织化学(SP法)和半定量法Western blot检测1、2、3号位组织E-cadherin、PAR-3表达分布变化.
结果: 随着距离肿瘤病灶越来越近, 组织隐窝微架构破坏(隐窝微架构不整齐, 上皮缺损)愈来愈明显, 免疫组织化学及Western blot实验表明, 随着组织越来越靠近病灶, 上皮细胞表面E-cadherin和PAR-3表达量依次递减, 分布由细胞膜转向细胞浆愈来愈明显.
结论: 在大肠癌组织中, 越靠近病灶的癌旁组织, 隐窝微架构的变化越明显, 甚至完全消失, 而隐窝上皮细胞中E-cadherin和PAR-3表达也逐渐减弱, 且分布由细胞膜逐渐转向细胞浆.
核心提示: 肿瘤的发生发展与组织结构的重塑密切相关. 观察距离肿瘤不同距离部位组织结构变化及上皮细胞表面特征分子E-cadherin和PAR-3不同部位组织中的表达分布差异, 探讨其与组织微架构变化的关系, 具有重要意义.
引文著录: 苏孟, 文彬, 胡丰良, 刘金元. 人大肠癌癌旁不同部位组织架构及相关分子差异. 世界华人消化杂志 2014; 22(3): 444-449
Revised: November 30, 2013
Accepted: December 4, 2013
Published online: January 28, 2014
AIM: To observe the variation of crypt architecture, expression and distribution of E-cadherin and PAR-3 expression in tissues at different distances from colorectal cancer lesions.
METHODS: Tissue samples at 10, 5 and 2 cm from the tumor lesion were collected. The variation of crypt architecture was observed among the three groups. E-cadherin and PAR-3 expression was detected by immunohistochemistry and Western blot.
RESULTS: With the distance getting closer to the tumor lesion, crypt architecture was destroyed more and more obviously. Cell crypts were irregularly arranged, and some of them disappeared. With the distance getting closer to the tumor lesion, the expression of E-cadherin and PAR-3 decreased progressively, and E-cadherin and PAR-3 translocated gradually from the plasma membrane to the cytoplasm.
CONCLUSION: With the distance getting closer to the tumor lesion, crypt architecture was destroyed more and more obviously, and some crypts disappeared; E-cadherin and PAR-3 expression in crypt epithelial cells decreased progressively and gradually translocated from the plasma membrane to cytoplasm.
- Citation: Su M, Wen B, Hu FL, Liu JY. Variance of crypt architecture and E-cadherin and PAR-3 expression in tissues at different distances from colorectal cancer lesions. Shijie Huaren Xiaohua Zazhi 2014; 22(3): 444-449
- URL: https://www.wjgnet.com/1009-3079/full/v22/i3/444.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i3.444
2011年Hanahan和Weinberg[1]梳理肿瘤研究近40年的研究成果指出, 肿瘤是远远胜过健康组织而更能处理复杂功能的异常器官. 肿瘤组织原则的构建使人们意识到正常组织结构的重塑对肿瘤的发生发展有重要意义[2]. 组织结构及相关基质细胞的类型、丰度、表型特征是组织重塑的重要内容, 其改变与肿瘤的发生发展密切相关[3-5]. 隐窝是肠上皮组织的基本结构单元, 也是承载着肠道疾病变化的基本结构单元. 异常隐窝(aberrant crypt foci, ACF)是大肠癌癌变早期最早可见的组织形态学改变[6-8]. 我们分别从距离肿瘤病灶不同部位取材, 观察不同部位组织结构及上皮细胞表面特征分子E-cadherin和PAR-3在不同部位癌旁组织中的表达分布差异表达变化, 以探讨分析组织结构及相关细胞表型特征对大肠癌发生发展中的作用.
组织样本选取2012-04/2013-02在广州中医药大学第一附属医院, 广州军区总医院的结肠中分化腺癌患者, 其中男15例, 年龄为41-81岁, 中位数年龄63岁, 女8例, 年龄为42-76岁, 中位数年龄为58.5岁. 所有大肠癌患者均为散发性大肠癌, 均经过纤维结肠镜检查和术后活组织病理确诊, 术前均未接受过放、化疗. 每例病例依次取距离肿瘤病灶组织约10、5、2 cm 3个部位, 按顺序编为1、2、3号, 切取位置如图1所示. 距离肿瘤病灶距离>5 cm的部位是公认的安全区, 被看做是正常的组织, 标记为1号位. 距离肿瘤5 cm的组织被认为是中间位, 通常处于肿瘤浸润组织和正常组织之间, 标记为2号位. 距离肿瘤1-3 cm的组织是公认的肿瘤浸润区, 标记为3号位, 被认为是最快发展为肿瘤的区域. 免疫组织化学和Western blot选用的兔抗人多克隆抗体均购自北京博奥森生物有限公司, 包括E-cadherin(bs-1519R)、PAR-3(bs-9510R)兔抗人多克隆抗体, 免疫组织化学二抗试剂盒购自北京中杉金桥生物技术公司. Western blot实验所用的链脲佐菌素、亮肽酶、抑肽酶、叠氮钠、二硫苏糖醇均为Sigma产品, PVDF膜为Millipore产品.
1.2.1 免疫组织化学DAB显色及结果判定: 所有组织均经4%多聚甲醛固定, 石蜡包埋. 石蜡切片经二甲苯2次脱蜡, 每次10 min, 无水乙醇, 950 mL/L乙醇, 700 mL/L乙醇分别5 min梯度水化后, PBS清洗3次, 每次2 min, 3%H2O2阻断内源性过氧化物酶的活性, 于柠檬酸盐缓冲液中微波修复, 小牛血清孵育20 min, 加上一抗4 ℃冰箱过夜, 以PBS代替一抗作阴性对照, 二抗37 ℃孵育30 min, DAB显色, 复染, 封片. 应用IPP6.0病理图像分析软件测定各组免疫阳性产物的光密度(A)值, 每张切片随机测定6个视野, 定同一张切片上组织的A值作为背景, 免疫反应产物的A值减去背景A值得到校正的A值(CA)值, 即为各阳性产物的实际吸光度值, 然后求平均值作为该样本的CA值. 用CA值进行分析和比较, 以避免染色过程中的非特异性染色等导致的误差.
1.2.2 Western blot: 在组织中加入蛋白裂解液, 低温离心, 取上清液作为蛋白样品并定量, 进行SDS-PAGE电泳, 转至PVDF膜, 用5%脱脂奶粉室温封闭, 一抗4 ℃过夜, 洗膜, 二抗室温孵育, ECL显影. 采用WO-9413B型凝胶成像系统自带软件Gelpro32来分析胶片中的蛋白条带, 并与β-actin的值相比, 进行标准化.
统计学处理 各组实验数据以mean±SD表示, 采用SPSS6.0统计软件, 计量资料进行均数比较采用t检验或方差分析, P<0.05为差异有统计学意义.
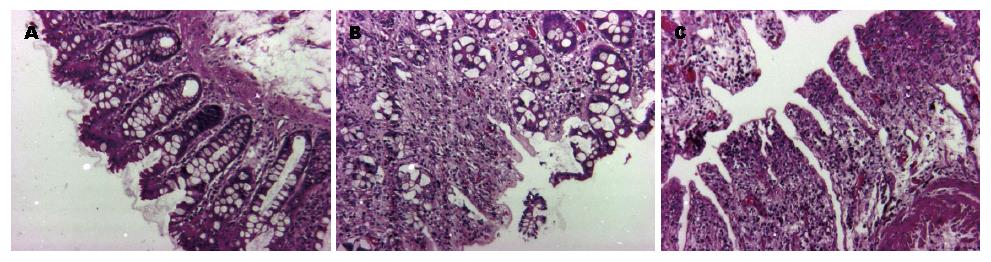
1987年, 研究人员第一次在啮齿动物模型中, 报道了大肠异常隐窝的大肠癌分子特征[9], 而推测异常隐窝可能是肠道最早的病变单元. 2009年Gupta等[10]对各种相关文献进行了整理: 从流行病学和分子生物学的角度进行研究都支持异常隐窝是结肠腺瘤的前体, 是大肠癌发生早期的生物标识. 正常隐窝和异常隐窝形态学有很大差别[11]. 在大肠癌"腺瘤-癌"发生过程中, 发育不良的隐窝具有发展为大肠癌的潜能, 不同病变期隐窝的体积、形状、表面光滑度以及有无分支都与正常隐窝不同. 这种组织原则的改变使细胞中生长信号的分泌和释放, 控制都发生紊乱. 我们分别从距离肿瘤病灶不同部位取材, 观察距离肿瘤病灶不同部位组织隐窝结构变化的特征(图2), 结果发现在距离肿瘤病灶最远端的1号部位组织中, 隐窝结构基本正常, 隐窝细胞呈单层排列(图2A), 随着距离病灶越来越近, 2号部位组织隐窝开始表现为出现增生, 隐窝细胞发生密集, 重叠, 少部分细胞出现缺失, 隐窝间质细胞增多(图2B). 在最靠近病灶的3号部位组织隐窝结构发生很大变化, 细胞密集非常明显, 丧失组织结构, 间质细胞明显增多, 细胞形态发生很大变化, 甚至隐窝结构完全消失. 越靠近肿瘤, 隐窝异常程度越高(图2C). 比较这3个部位可以得出结论: 越靠近肿瘤, 隐窝结构异常程度越高, 隐窝细胞排列方式及形态特征变化越大.
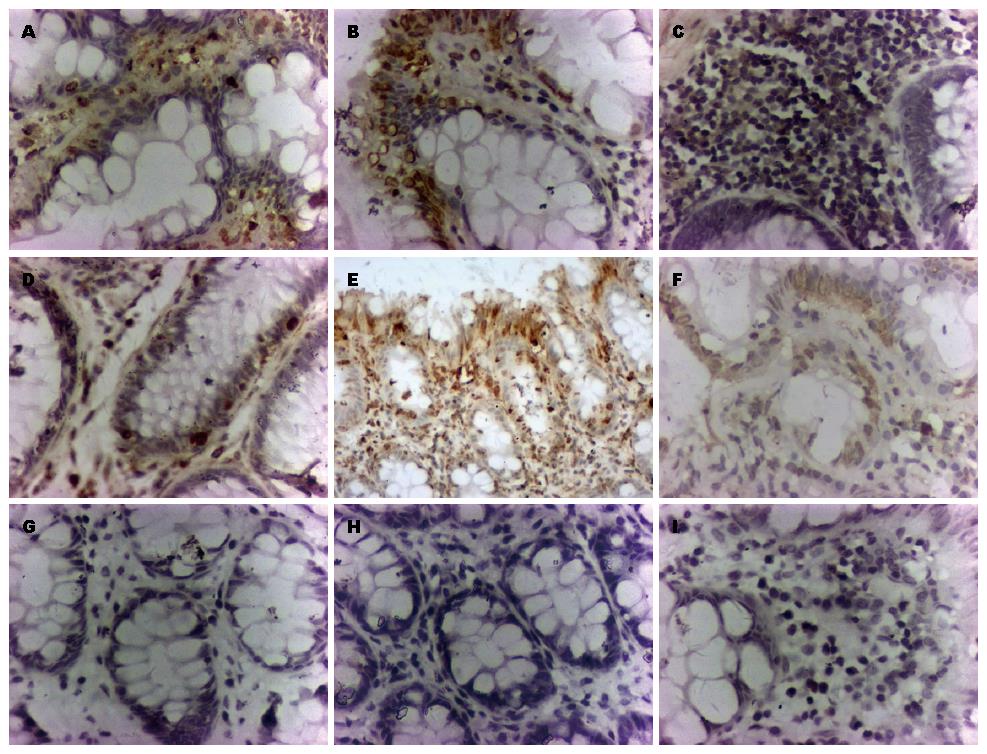
E-cadherin的黏附受体是构建健康组织原则的决定因素[12]. 有关E-cadherin经典的理论认为E-cadherin的生物学行为是通过与收缩肌动蛋白细胞骨架相互作用而激活, 不仅是黏附作用, E-cadherin还可以调控收缩肌动蛋白本身的装配. 更进一步的研究表明, 与黏附、收缩相关的组织细胞空间架构模式决定了细胞的形态发生[13-15]. 我们采用免疫组织化学法对不同隐窝部位上皮细胞E-cadherin表达分布进行了检测, 结果显明1、2和3号部位组织中E-cadherin均有表达, 但随着距离肿瘤病灶最远端的1号组织中, 隐窝细胞排列规则, 呈单层排列. E-cadherin主要表达分布在隐窝细胞膜上(图3), 随着距离病灶组织越来越近, 隐窝细胞出现增生密集, 2号部位E-cadherin有部分表达于隐窝细胞胞浆中(图3), 在距离病灶最近的3号组织中, 隐窝细胞增生明显, 且排列拥挤, E-cadherin主要表达于隐窝细胞的胞浆中(图3), 应用IPP6.0病理图象分析软件测定各组免疫阳性产物的光密度值, 1、2、3号部位光密度值分别为0.486219±0.03479、0.296056±0.029211、0.280068±0.034564. 统计学分析显示, E-cadherin表达在1号位组织和2号位组织有明显差异(P<0.05), 有统计学意义, 2号位组织和3号位组织没有明显差异(P>0.05), 无统计学意义.
上皮细胞分布在组织器官的内外表面, 要将这些上皮细胞有机的分布在组织三维结构的表面, 需要包括极性、黏附、生长等多种生理功能共同协作完成[16,17]. 在此过程中, 跨膜蛋白PAR-3是上皮组织最重要的极性的构建者和维持者, 当PAR-3功能发生变化, 则上皮细胞极性减少或消失, 上皮细胞从上皮组织中逃逸出来, 进入细胞间质, 从而改变组织微环境. 肿瘤的病理学研究发现, 在肿瘤进程中, 组织极性和细胞极性都将消失[18,19]. 我们检测PAR-3在不同部位的免疫组织化学结果显示在1号部位主要表达分布在隐窝细胞膜和少量胞浆(图3), 2号组织PAR-3在少部分隐窝细胞膜和部分胞浆中表达(图3), 3号组织PAR-3则几乎全部表达于胞浆(图3). 对其进行光密度值测定, 1、2、 3号部位值分别为0.45834±0.06501、0.423177±0.03873、0.350675±0.036247. 统计学分析显示, PAR-3表达在1号位组织和2号位组织没有显著差异(P>0.05), 无统计意义, 在2号位和3号位差异显著(P<0.05), 有统计学意义.
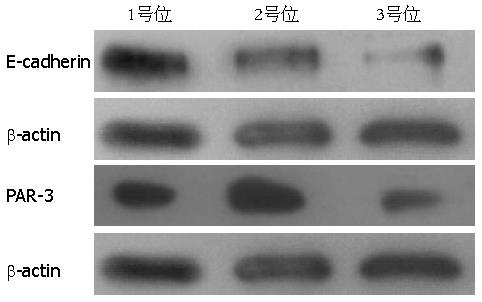
Western blot免疫印迹反应的吸光度结果提示E-cadherin、PAR-3在1、2、3号部位呈递减关系(E-cadherin: 10.23, 6.85, 5.86; PAR-3: 9.78, 9.65, 9.45), 3个部位两两之间的差异性检测, 差异有统计学意义(P<0.05). 隐窝微架构破坏与E-cadherin和PAR-3表达呈现明显负相关(图4).
近些年来, 肿瘤细胞中心观指导下的肿瘤研究模式受到了巨大的冲击, 以肿瘤相关机制为基础的肿瘤组织原则的构建, 使人们意识到组织结构重塑对肿瘤启动的重要意义. 正常组织可以精确地产生、释放、控制促进生长信号, 以维持正常组织架构和功能. 组织架构和内稳态的转变是肿瘤启动的早期信号. 大量研究表明,组织微架构的重塑是肿瘤恶性启动的重要表征. 肿瘤恶性启动的本质就是癌细胞与其微环境相互作用的过程, 在肿瘤启动过程中, 癌细胞逐渐破坏了邻近的细胞与基质之间的正常联系, 原本这些联系可以使基质和细胞感受正常的信号调节, 以保证组织细胞的正常功能, 但当癌细胞处于这个正常的组织微环境中, 他可以尝试着重新去塑造一种新的表型和行为[20,21].
正常的组织和细胞具有极性, 能维持组织架构并且行驶正常的生理功能. E-cadherin和PAR-3对维持组织细胞极性有重要作用, 其表达分布与组织架构紧密相关. 而在肿瘤进程中, 组织极性和细胞极性都将消失[18]. 探讨E-cadherin和PAR-3在肿瘤进程中的变化机制对研究肿瘤的启动有重要的意义.
隐窝结构的改变与E-cadherin和PAR-3表达分布密切相关, 距离肿瘤病灶越近, 表达逐渐减少, 且分布由细胞膜转到细胞浆. E-cadherin和PAR-3不能在膜上表达时, 细胞形态改变, 极性消失[22-24]. 据此可以推断在肿瘤发生过程中, 上皮细胞失去自身稳定的结构, 极性消失, 细胞运动能力增强, 转化成为活动能力较强的间质细胞表型, 组织微架构发生变化. 病理观察结果显示距离肿瘤病灶越近, 隐窝细胞排列出现重叠, 拥挤, 间质细胞增多. 隐窝是肠组织微架构的直接体现, 肿瘤发生过程中, 存在上皮-间质表型转化.
我们的研究显示, 在癌变早期, 肠组织发生了明显的形态学变化, 出现异常隐窝病灶, 距离肿瘤病灶越近, 隐窝异常越明显, 间质细胞增多, E-cadherin和PAR-3的表达由细胞膜逐步表达到胞浆, 并且表达量逐渐下降. E-cadherin和PAR-3都是极性相关分子, 说明组织结构, 微环境的变化及E-cadherin和PAR-3的表达下降均对大肠癌的启动有重要意义, 可将二者结合运用于大肠癌早期分子机制研究, 但是二者之间的相互作用机制仍需探索.
肿瘤的研究模式在逐渐发生改变,过去人们专注于研究肿瘤细胞本身. 近年来, 人们逐渐意识到组织结构及其重塑对肿瘤启动的重要意义. 组织中细胞表面特征分子是反映组织结构变化的重要内容.
顾国利, 副主任医师, 空军总医院普通外科
肿瘤的启动, 首先表现为细胞表型和组织微架构的改变. E-cadherin和PAR-3作为细胞表面反映细胞特征形态的分子, 初步探讨肿瘤发生早期E-cadherin和PAR-3在细胞组织中的表达分布具有重要意义.
Wu, Yap报道了E-cadherin的黏附受体是构建健康组织原则的决定因素. 更进一步的研究表明, 与黏附、收缩相关的组织细胞空间架构模式决定了细胞的形态发生. 进而我们应该探讨肿瘤发生过程中组织细胞形态及细胞特征分子的变化.
摒弃E-cadherin和PAR-3在肿瘤研究中的有关分子生物学的经典论述, 从生物学行为角度来阐述其对肿瘤发生发展的作用.
细胞表型分子表达分布与组织微架构变化相辅相成, 对肿瘤发生早期以组织微架构为基础的研究有指导意义.
本文提供了比较充足的有意义的信息, 能促进读者对肿瘤组织架构的理解, 并且实验结果可能使患者受益.
编辑: 田滢 电编:鲁亚静
| 1. | Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144:646-674. [PubMed] [DOI] |
| 2. | Ivanov AI, Naydenov NG. Dynamics and regulation of epithelial adherens junctions: recent discoveries and controversies. Int Rev Cell Mol Biol. 2013;303:27-99. [PubMed] [DOI] |
| 3. | Bettington M, Walker N, Clouston A, Brown I, Leggett B, Whitehall V. The serrated pathway to colorectal carcinoma: current concepts and challenges. Histopathology. 2013;62:367-386. [PubMed] [DOI] |
| 4. | Tarin D. Cell and tissue interactions in carcinogenesis and metastasis and their clinical significance. Semin Cancer Biol. 2011;21:72-82. [PubMed] [DOI] |
| 5. | Valásková Z, Kinová S, Danihel L, Duris I, Markovicová D, Mravec B, Hulín I. [The complexity of interactions of the tumour growth process]. Vnitr Lek. 2009;55:1145-1158. [PubMed] |
| 6. | Fuchs E, Tumbar T, Guasch G. Socializing with the neighbors: stem cells and their niche. Cell. 2004;116:769-778. [PubMed] |
| 7. | Khare S, Chaudhary K, Bissonnette M, Carroll R. Aberrant crypt foci in colon cancer epidemiology. Methods Mol Biol. 2009;472:373-386. [PubMed] [DOI] |
| 8. | Lopez-Ceron M, Pellise M. Biology and diagnosis of aberrant crypt foci. Colorectal Dis. 2012;14:e157-e164. [PubMed] [DOI] |
| 9. | Bird RP. Observation and quantification of aberrant crypts in the murine colon treated with a colon carcinogen: preliminary findings. Cancer Lett. 1987;37:147-151. [PubMed] |
| 10. | Gupta AK, Schoen RE. Aberrant crypt foci: are they intermediate endpoints of colon carcinogenesis in humans? Curr Opin Gastroenterol. 2009;25:59-65. [PubMed] [DOI] |
| 11. | Tamura S, Furuya Y, Tadokoro T, Higashidani Y, Yokoyama Y, Araki K, Onishi S. Pit pattern and three-dimensional configuration of isolated crypts from the patients with colorectal neoplasm. J Gastroenterol. 2002;37:798-806. [PubMed] |
| 12. | Wu SK, Yap AS. Patterns in Space: Coordinating Adhesion and Actomyosin Contractility at E-cadherin Junctions. Cell Commun Adhes. 2013;20:201-212. [PubMed] |
| 13. | Gomez GA, McLachlan RW, Yap AS. Productive tension: force-sensing and homeostasis of cell-cell junctions. Trends Cell Biol. 2011;21:499-505. [PubMed] [DOI] |
| 14. | Levayer R, Lecuit T. Biomechanical regulation of contractility: spatial control and dynamics. Trends Cell Biol. 2012;22:61-81. [PubMed] [DOI] |
| 15. | Martin AC, Gelbart M, Fernandez-Gonzalez R, Kaschube M, Wieschaus EF. Integration of contractile forces during tissue invagination. J Cell Biol. 2010;188:735-749. [PubMed] [DOI] |
| 16. | Mohl PC, Lomax J, Tasman A, Chan C, Sledge W, Summergrad P, Notman M. Psychotherapy training for the psychiatrist of the future. Am J Psychiatry. 1990;147:7-13. [PubMed] [DOI] |
| 17. | Leung CT, Brugge JS. Outgrowth of single oncogene-expressing cells from suppressive epithelial environments. Nature. 2012;482:410-413. [PubMed] [DOI] |
| 18. | Huang L, Muthuswamy SK. Polarity protein alterations in carcinoma: a focus on emerging roles for polarity regulators. Curr Opin Genet Dev. 2010;20:41-50. [PubMed] [DOI] |
| 19. | Zen K, Yasui K, Gen Y, Dohi O, Wakabayashi N, Mitsufuji S, Itoh Y, Zen Y, Nakanuma Y, Taniwaki M. Defective expression of polarity protein PAR-3 gene (PARD3) in esophageal squamous cell carcinoma. Oncogene. 2009;28:2910-2918. [PubMed] [DOI] |
| 20. | Nowell PC. Foundations in cancer research. Chromosomes and cancer: the evolution of an idea. Adv Cancer Res. 1993;62:1-17. [PubMed] |
| 21. | Thiery JP. Epithelial-mesenchymal transitions in tumour progression. Nat Rev Cancer. 2002;2:442-454. [PubMed] |
| 22. | Thiery JP, Acloque H, Huang RY, Nieto MA. Epithelial-mesenchymal transitions in development and disease. Cell. 2009;139:871-890. [PubMed] [DOI] |
| 23. | Huang RY, Guilford P, Thiery JP. Early events in cell adhesion and polarity during epithelial-mesenchymal transition. J Cell Sci. 2012;125:4417-4422. [PubMed] [DOI] |
| 24. | Mertens AE, Pegtel DM, Collard JG. Tiam1 takes PARt in cell polarity. Trends Cell Biol. 2006;16:308-316. [PubMed] |