修回日期: 2013-12-11
接受日期: 2013-12-15
在线出版日期: 2014-01-28
目的: 研究肝再生增强因子(augmenter of liver regeneration, ALR)在乙型肝炎病毒(hepatitis B virus, HBV)相关肝硬化患者中的表达及临床意义.
方法: 病例来源于我科门诊及住院的慢性乙型肝炎患者, 包括性慢性乙型肝炎轻度组(n = 196)、代偿期肝硬化组(n = 69)、失代偿期肝硬化组(n = 148); 失代偿肝硬化患者根据并发症进一步分为腹水组(n = 51)、消化系出血组(n = 32)、肝性脑病组(n = 27)和慢性肝衰竭组(n = 38), 其中腹水组分为原发性腹膜炎组(n = 9)与非原发性腹膜炎组(n = 42). 健康对照组(n = 200)来源于输血科健康献血者. 收集患者血清及临床资料; 采用ELISA法检测各组患者血清ALR浓度; 瞬时弹性扫描(FibroScan)检测代偿期肝硬化患者肝脏硬度. 比较各组间ALR浓度差异, 分析ALR浓度与肝硬化及其并发症的关系.
结果: ALR浓度在代偿期肝硬化组和失代偿肝硬化组均明显高于健康对照组和慢性乙型肝炎轻度组(P<0.01). 在代偿期肝硬化患者ALR浓度(1.54 μg/L±0.53 μg/L)与肝脏FibroScan值(16.96 kPa±5.6 kPa)负相关(r2 = -0.218, F = 15.736, P<0.01). 失代偿肝硬化组中慢性肝衰竭患者ALR浓度明显高于代偿期肝硬化组(1.73 μg/L±0.23 μg/L vs 1.54 μg/L±0.53 μg/L, P = 0.012), 腹水组患者ALR浓度明显低于代偿期肝硬化组(1.32 μg/L±0.64 μg/L vs 1.54 μg/L±0.53 μg/L, P = 0.027), 原发性腹膜炎组与非原发性腹膜炎组间ALR浓度无显著性差异. ALR血清浓度与肝硬化患者腹水的发生相关, 低ALR血清浓度是肝硬化患者发生腹水的危险因素(P = 0.031, OR = 0.841).
结论: ALR在HBV相关肝硬化患者表达明显升高, 其水平与肝脏硬度及腹水发生负相关, 提示ALR在肝硬化患者增高可能是机体的一种保护机制.
核心提示: 肝再生增强因子(augmenter of liver regeneration, ALR)浓度在肝硬化患者明显升高, 代偿期肝硬化患者ALR浓度与肝脏FibroScan值负相关. 肝硬化腹水患者ALR浓度明显低于代偿期肝硬化组, 低ALR血清浓度是肝硬化患者发生腹水的危险因素.
引文著录: 陈文, 杨春, 毕义亮, 唐黎, 吴刚, 邓存良. 肝再生增强因子在HBV相关肝硬化患者中的表达及意义. 世界华人消化杂志 2014; 22(3): 434-438
Revised: December 11, 2013
Accepted: December 15, 2013
Published online: January 28, 2014
AIM: To determine serum levels of augmenter of liver regeneration (ALR) in patients with HBV-related cirrhosis and to analyze its clinical significance.
METHODS: Serum samples were collected from patients with mild chronic hepatitis B (n = 196), compensated cirrhosis (n = 69), decompensated cirrhosis (n = 148) and normal controls (n = 200). The patients with decompensated cirrhosis were divided into an ascites subgroup (n = 51), a gastrointestinal bleeding subgroup (n = 32), a hepatic encephalopathy subgroup (n = 27) and a chronic liver failure subgroup (n = 38). The patients with ascites were further divided into a spontaneous bacterial peritonitis (SBP) subgroup (n = 9) and a non-SBP group (n = 42). Serum concentrations of ALR were measured by ELISA. FibroScan was used to test the liver stiffness of patients with compensated cirrhosis. The correlation between ALR level and FibroScan score was analyzed by linear regression analysis. Unconditioned binary response logistic regression model was used to determine the correlation between ALR level and the occurrence of complications in patients with decompensated cirrhosis.
RESULTS: Serum ALR concentrations were higher in the compensated cirrhosis group and decompensated cirrhosis group than in the mild chronic hepatitis B group and normal control group (P < 0.01 for all). There was a negative correlation between serum ALR concentration and FibroScan score in patients with compensated cirrhosis (r = -0.218, F = 15.736, P < 0.01). Serum ALR concentrations in patients with chronic liver failure were higher than those in patients with compensated cirrhosis (1.73 μg/L ± 0.23 μg/L vs 1.54 μg/L ± 0.53 μg/L, P = 0.012), and ALR concentrations in patients with ascites were significantly decreased (1.32 μg/L ± 0.64 μg/L vs 1.54 μg/L ± 0.53 μg/L, P = 0.027). There was no significant difference in ALR levels between the SBP group and non-SBP group. Logistic regression analysis identified lower serum ALR level as a risk factor for the occurrence of ascites in patients with cirrhosis (P = 0.031, OR = 0.841).
CONCLUSION: Serum ALR levels are significantly increased in patients with HBV-related cirrhosis and are negatively related to the liver stiffness and occurrence of ascites, indicating that increased ALR level is a potential protective mechanism for patients with HBV-related cirrhosis.
- Citation: Chen W, Yang C, Bi YL, Tang L, Wu G, Deng CL. Clinical significance of serum levels of augmenter of liver regeneration in patients with HBV-related cirrhosis. Shijie Huaren Xiaohua Zazhi 2014; 22(3): 434-438
- URL: https://www.wjgnet.com/1009-3079/full/v22/i3/434.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i3.434
肝再生增强因子(augmenter of liver regeneration, ALR)是近来发现的一种特殊的促肝细胞分裂原, 具有强大的促进肝细胞增殖功能[1]. 近年来研究发现ALR对肝纤维化大鼠也具有保护作用[2,3], 提示其可能在肝硬化的发生发展中起重要作用. 但对ALR在肝硬化患者的表达及临床意义的研究国内外均鲜见报道. 故我们在大样本乙型肝炎病毒(hepatitis B virus, HBV)相关肝硬化患者中观察了ALR的表达变化并分析其临床意义.
选择2011-04/2013-03我科收治的HBV感染后肝硬化患者217例和慢性乙型肝炎轻度患者196例. 肝硬化患者分为代偿期肝硬化组(n = 69)和失代偿肝硬化组(n = 148); 失代偿肝硬化患者根据并发症进一步分为腹水组(n = 51)、消化系出血组(n = 32)、肝性脑病组(n = 27)和慢性肝衰竭组(n = 38), 其中腹水组分为原发性腹膜炎组(n = 9)与非原发性腹膜炎组(n = 42). 慢性乙型肝炎轻度和肝硬化诊断符合2010年版慢性乙型肝炎防治指南诊断标准[4]; 慢性肝衰竭诊断符合肝衰竭诊治指南(2012年版)诊断标准[5]; 原发性腹膜炎诊断符合2009年美国成人肝硬化腹水治疗指南诊断标准[6]. 腹水组、上消化道出血组及肝性脑病组均排除慢性肝衰竭患者. 健康对照者200例来源于我院输血科血库. 排除标准: (1)因酒精、药物、中毒及自身免疫等其他原因所致肝脏损伤; (2)合并甲型肝炎病毒(hapatitis A virus, HAV)、丙型肝炎病毒(hepatitis C virus, HCV)和人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染; (3)妊娠晚期; (4)肝癌或者其他恶性肿瘤肝转移.
1.2.1 血清标本及临床资料收集: 以患者入院或者门诊首次诊断时间为基线, 患者空腹抽取EDTA抗凝外周静脉血5 mL, 2000 r/min离心15 min, 分离血清及血细胞, 于-80 ℃保存待检. 收集基线时患者肝肾功能、HBV DNA水平、血常规、凝血全套及B超等临床指标. 所有代偿期肝硬化患者进行瞬时弹性扫描(FibroScan)检测肝脏硬度. 检测方法: FibroScan仪由法国Echosens公司生产; 患者取仰卧位, 右手置于脑后尽量伸展, 探头位置选择在右腋中线与腋前线间的7-9肋间隙, 探头与皮肤表面垂直; 根据Fibrosean仪显示的TM、A模式超声影像确定检查位置, 每例患者进行10次有效测量, 取中位数作为最终结果, 以弹性值(kPa)表示; 检查区域要求肝脏有足够厚度, 没有大血管结构, 远离肝脏边缘, 通常与肝穿刺活检的位置相同; 操作成功率<60%或偏差大于中位数1/3视为检查无效.
1.2.2 血清ALR浓度检测: 采用ELISA法检测, ELISA检测试剂盒购自美国BP公司, 严格按照试剂盒要求操作. 为了避免保存时间过长导致检测结果不准确, 肝硬化组及慢性乙型肝炎轻度组每6 mo检测1批, 健康对照组最后集中检测.
统计学处理 采用SPSS13.0软件进行数据分析. 计量资料采用mean±SD描述. 多组间均数比较采用单因素方差分析, 组间均数多重比较采SNK法, 计量资料间相关性分析采用直线回归分析, 二分类非条件Logistic回归分析ALR浓度与并发症发生的关系. P<0.05为差异有统计学意义.
各组间性别构成无显著性差异; 代偿期肝硬化组和失代偿肝硬化组年龄明显高于健康对照组和慢性乙型肝炎轻度组, 差异有统计学意义(P<0.05); 失代偿肝硬化组丙氨酸氨基转氨酶(alanine aminotransferase, ALT)及总胆红素(total bilirubin, TBil)水平明显高于其他三组, 差异有统计学意义(P<0.01); 失代偿肝硬化组ALB水平明显低于其他3组, 差异有统计学意义(P<0.01, 表1).
ALR浓度在代偿期肝硬化组和失代偿肝硬化组均明显高于健康对照组和慢性乙型肝炎轻到中度组, 差异有统计学意义(P<0.01). 在健康对照组和慢性乙型肝炎轻到中度组间ALR水平无显著性差异. 失代偿肝硬化组中慢性肝衰竭患者ALR浓度明显高于代偿期肝硬化组, 差异有统计学意义(P = 0.012); 腹水组患者ALR水平明显低于代偿期肝硬化组, 差异有统计学意义(P = 0.027), 原发性腹膜炎组与非原发性腹膜炎组间ALR水平无显著性差异(表2).
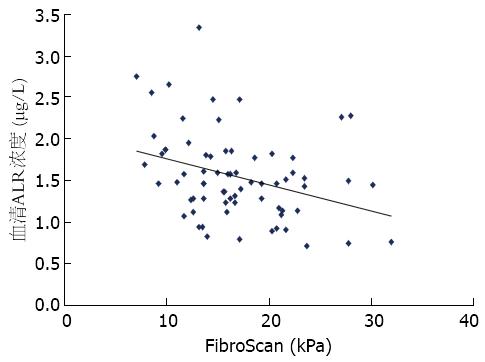
直线相关分析表明, 在代偿期肝硬化患者ALR浓度(1.54 μg/L±0.53 μg/L)与肝脏FibroScan值(16.96 kPa±5.6 kPa)负相关(r2 = -0.218, F = 15.736, P<0.01)(图1).
由于失代偿肝硬化年龄、ALT、TBil和白蛋白与代偿期肝硬化患者间有显著性差异, 故我们将上述4种因素与ALR浓度一起进行多因素二分类非条件Logistic回归分析. 结果表明ALR血清浓度与肝硬化患者腹水的发生相关, 低ALR血清浓度是肝硬化患者发生腹水的危险因素(P = 0.031, OR = 0.841). ALR浓度不是肝硬化患者发生消化系出血、肝性脑病及慢性肝衰竭的危险因素.
本研究以大样本病例对照研究观察了ALR在HBV相关肝硬化患者的表达变化. 发现血清ALR水平在代偿期和失代偿肝硬化患者均明显高于慢性乙型肝炎轻度患者和健康对照者. ALR表达于多种组织、细胞, 但在肝脏特异性表达于肝细胞, 既往对于其在肝脏疾病中的研究主要集中于促肝细胞再生方面[1]. 近年来多项研究表明ALR对肝纤维化大鼠具有保护作用[2,3]. 升高的ALR可能通过以下机制发挥抗肝纤维化作用: (1)增强基质金属蛋白酶(matrix metalloproteinases, MMPs)表达, 抑制组织金属蛋白酶抑制剂(tissue inhibitor of matrix metalloproteinases, TIMPs)的表达, 促进细胞外基质降解[7,8]; (2)通过抑制c-jun蛋白及c-fos蛋白等转化激活因子的表达而抑制肝星状细胞(hepatic stellate cell, HSC)活化[9,10]; (3)抑制HSC和枯否氏细胞表达转化生长因子-β(transforming growth factor-β, TGF-β), 减少HSC活化[11]. 肝纤维化是慢性肝炎发展至肝硬化的中间环节, 体外研究及动物模型研究均证实ALR具有抗肝纤维化作用, 我们的研究表明ALR水平在肝硬化患者升高. 由此我们推测ALR在肝硬化患者增高可能是机体的一种保护机制.
我们进一步分析了代偿期肝硬化患者ALR浓度与肝脏FibroScan值间的关系. FibroScan是一种利用切变波技术检测肝脏硬度的一种非侵入性技术, 其可以较好地反映肝脏纤维化程度[12]. 但转氨酶、胆红素和腹水等因素均可影响其检测结果的准确性[13,14]. 基线资料表明失代偿肝硬化患者ALT及TBil水平明显高于其他3组, 且其中包含有腹水及慢性肝衰竭患者. 所以我们仅对代偿期肝硬化患者进行了FibroScan检测. 直线相关分析表明在代偿期肝硬化患者ALR浓度与肝脏FibroScan值呈负相关, 提示高ALR水平患者肝脏硬度较小. 这一结果进一步证明高水平ALR对于肝硬化患者具有保护作用.
肝硬化失代偿常常表现为各种并发症, 我们对ALR在各种并发症患者的表达进行了分析. 发现慢性肝衰竭患者ALR浓度明显高于代偿期肝硬化患者. ALR具有强大的促肝细胞再生功能, 研究表明在CCl4诱导的肝衰竭大鼠, ALR血清水平明显升高, 与增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、肝细胞生长因子(hepatocyte growth factor, HGF)水平成正比, 可减轻CCl4导致的肝脏损伤, 提高急性肝衰竭大鼠的存活率, 且初期高水平ALR与较好的预后有关[15]. Yu等[16]也证实ALR在肝衰竭患者表达增高. 提示慢性肝衰竭患者ALR浓度增高可能刺激肝细胞再生, 有利于肝脏功能恢复. 而肝硬化腹水患者ALR浓度明显低于代偿期肝硬化患者, 且进一步的多因素二分类非条件Logistic回归分析表明ALR浓度与肝硬化患者腹水的发生相关, 低ALR血清浓度是发生腹水的危险因素. 肝硬化腹水发生机制复杂, 但肝脏脏硬化门静脉高压是其始动因素. 在肝硬化门静脉高压的基础上, 发生周围动脉扩张、水钠潴留以及肾脏低灌注等后续病理生理改变, 进而导致腹水的产生[17]. 肝硬化腹水患者ALR浓度降低, 且低ALR血清浓度为腹水发生的危险因素, 表明低水平ALR患者肝硬化门静脉高压程度可能更为严重. 进一步分析发现原发性腹膜炎组与非原发性腹膜炎组间ALR水平无显著性差异, 提示ALR的降低与细菌感染无明显关系. 但需注意的是我们的研究中原发性腹膜炎患者较少, 有可能影响结果的准确性, 关于ALR与原发性腹膜炎的关系尚需扩大病例数进一步分析. 在肝硬化消化系出血和肝性脑病患者ALR水平较代偿期肝硬化患者无明显变化, 这可能与这两类并发症的发生受如饮食、药物等肝外因素影响较多有关, 这一结果提示ALR可能不是肝硬化肝性脑病和消化系出血发生的主要影响因素.
总之, 本研究表明ALR在HBV相关代偿期和失代偿肝硬化患者表达明显升高, 其水平与肝脏硬度及腹水发生负相关, 表明ALR在肝硬化患者增高可能是机体的一种保护机制. 其具体作用机制尚待进一步研究.
我国目前约有2000万例慢性乙型肝炎患者, 部分患者由于肝脏炎症的持续存在将经由肝纤维化最终发展为肝硬化. 基础研究发现肝再生增强因子(augmenter of liver regeneration, ALR)具有抗肝纤维化作用, 提示其可能在肝硬化的发生发展中发挥作用. 但有关ALR在肝硬化患者的表达及临床意义的研究国内外尚鲜见报道.
刘正稳, 教授, 西安交通大学医学院第一附属医院
ALR在肝硬化患者中的表达及意义尚不清楚, 分析ALR在HBV相关肝硬化患者表达及临床意义有助于了解ALR在肝硬化发生发展中的具体作用.
体外和动物模型研究表明ALR可能通过抑制肝星状细胞(hepatic stellate cell, HSC)活化, 促进细胞外基质降解等机制发挥抗肝纤维化作用.
本研究以大样本病例对照研究观察了ALR在HBV相关肝硬化患者的表达变化, 并深入分析了ALR水平与失代偿肝硬化各种并发症的关系.
本文对理解ALR在肝纤维化和肝硬化腹水的发生中的作用有一定意义.
编辑: 田滢 电编:鲁亚静
| 1. | Gandhi CR. Augmenter of liver regeneration. Fibrogenesis Tissue Repair. 2012;5:10. [PubMed] [DOI] |
| 2. | Song M, Yi X, Chen W, Yuan Y, Zhang X, Li J, Tong M, Liu G, You S, Kong X. Augmenter of liver regeneration (ALR) gene therapy attenuates CCl4-induced liver injury and fibrosis in rats. Biochem Biophys Res Commun. 2011;415:152-156. [PubMed] [DOI] |
| 3. | 王 晓东, 林 镯, 陈 永平, 卢 明芹, 潘 陈为, 金 益辉, 张 友才. 肝细胞生长因子与肝再生增强因子重组表达质粒对大鼠肝纤维化的影响. 中华传染病杂志. 2010;28:321-325. |
| 6. | Runyon BA. Management of adult patients with ascites due to cirrhosis: an update. Hepatology. 2009;49:2087-2107. [PubMed] [DOI] |
| 8. | 王 爱民, 杨 晓明, 王 文犀, 左 凤亭, 王 清明, 贺 福初. 重组人肝再生增强因子对肝纤维化大鼠金属蛋白酶组织抑制因子-1基因表达的影响. 中华医学杂志. 2002;82:610-612. |
| 9. | 王 爱民, 向 英, 耿 焱, 杨 晓明, 马 志杰, 楚 瑞珏, 王 宝恩. 重组人肝再生增强因子可抑制大鼠肝星状细胞c-fos基因的表达. 中华实验外科杂志. 2009;26:900-901. |
| 10. | 王 爱民, 陈 淑娥, 古 彩拮, 张 莉, 贾 树杰, 楚 瑞珏, 王 宝恩. 重组人肝再生增强因子抑制大鼠肝星状细胞c-jun基因表达的研究. 中华实验外科杂志. 2004;21:1058-1059. |
| 12. | Loustaud-Ratti VR, Cypierre A, Rousseau A, Yagoubi F, Abraham J, Fauchais AL, Carrier P, Lefebvre A, Bordessoule D, Vidal E. Non-invasive detection of hepatic amyloidosis: FibroScan, a new tool. Amyloid. 2011;18:19-24. [PubMed] [DOI] |
| 13. | Kim SU, Kim JK, Park YN, Han KH. Discordance between liver biopsy and Fibroscan® in assessing liver fibrosis in chronic hepatitis b: risk factors and influence of necroinflammation. PLoS One. 2012;7:e32233. [PubMed] [DOI] |
| 14. | Kim SU, Seo YS, Cheong JY, Kim MY, Kim JK, Um SH, Cho SW, Paik SK, Lee KS, Han KH. Factors that affect the diagnostic accuracy of liver fibrosis measurement by Fibroscan in patients with chronic hepatitis B. Aliment Pharmacol Ther. 2010;32:498-505. [PubMed] [DOI] |
| 15. | Hongbo S, Yu C, Ming K, Honglin S, Ping HY, Ping DZ. Augmenter of liver regeneration may be a candidate for prognosis of HBV related acute-on-chronic liver failure as a regenerative marker. Hepatogastroenterology. 2012;59:1933-1938. [PubMed] [DOI] |
| 16. | Yu HY, Xiang DR, Huang HJ, Li J, Sheng JF. Expression level of augmenter of liver regeneration in patients with hepatic failure and hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2010;9:492-498. [PubMed] |