修回日期: 2013-10-28
接受日期: 2013-12-04
在线出版日期: 2014-01-28
目的: 研究抗结核药物肝毒性(anti-tuberculosis drug-induced hepatotoxicity, ATDH)与非ATDH患者化疗前血浆差异性表达的miRNA分子, 为ATDH易感者筛检提供新的生物学指标.
方法: 采用miRNA芯片检测ATDH及对照患者化疗前血浆标本. 对存在差异表达趋势的25种miRNA分子, 采用高通量实时荧光定量PCR进行分析验证. 应用互联网上miRNA靶基因预测软件对表达上调的miRNA进行靶基因预测, 并采用PANTHER tool查找靶蛋白GO功能分类.
结果: 与对照组相比, ATDH患者化疗前血浆中共检出7个差异性表达的miRNA分子, 其中表达上调的miRNA有4个, 包括miR-4284、miR-3620、miR-652-5p和miR-4800-5p; 表达下调的miRNA有3个, 包括miR-338-3p、miR-424-5p和miR-194-5p.
结论: ATDH患者化疗前血浆内存在差异性表达的miRNA分子, 其中表达上调的miRNA分子(特别是miR-4284)可能作为ATDH易感者筛检的生物学指标.
核心提示: 本文进行了抗结核药物肝损伤或肝毒性(anti-tuberculosis drug-induced hepatotoxicity, ATDH)与非ATDH患者化疗前血浆miRNA分子高通量微阵列检测, 探讨了存在差异性表达的miRNA分子在ATDH发病中可能的作用, 为ATDH易感患者筛查提供了可资评估的客观生物学指标.
引文著录: 叶长根, 孙水林, 白茹, 朱伟星, 陈彩萍, 谢平, 赵晖, 涂文娟, 高得勇, 刘亮明. 抗结核药物肝损伤与无肝损伤患者化疗前血循环miRNA分子的差异性表达. 世界华人消化杂志 2014; 22(3): 415-422
Revised: October 28, 2013
Accepted: December 4, 2013
Published online: January 28, 2014
AIM: To investigate differential expression profile of microRNAs (miRNAs) in plasma of pretreated patients with/without anti-tuberculosis drug-induced hepatotoxicity (ATDH).
METHODS: Plasma samples were collected from patients with/without ATDH before anti-tuberculosis treatment and subjected to miRNA microarray analysis. Twenty-five miRNAs were tested using high-flux real-time quantitative PCR. The target genes of miRNAs were predicted using the Internet software, and the GO functional classification of target proteins was analyzed using the PANTHER tool.
RESULTS: Compared with patients without ATDH, there were 7 miRNAs differentially expressed in patients with ATDH before anti-tuberculosis drug therapy, 4 of which were up-regulated, including miR-4284, miR-3620, miR-652-5p and miR-4800-5p, and 3 down-regulated, including miR-338-3p, miR-424-5p and miR-194-5p.
CONCLUSION: There are differentially expressed miRNAs in the circulation of patients with ATDH before anti-tuberculosis drug therapy, and the up-regulated miRNAs (esp. miR-4284) may be new biological markers for screening ATDH susceptible population.
- Citation: Ye CG, Sun SL, Bai R, Zhu WX, Chen CP, Xie P, Zhao H, Tu WJ, Gao DY, Liu LM. Differentially expressed microRNAs in plasma of pretreated patients with/without anti-tuberculosis drugs-induced hepatotoxicity. Shijie Huaren Xiaohua Zazhi 2014; 22(3): 415-422
- URL: https://www.wjgnet.com/1009-3079/full/v22/i3/415.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i3.415
结核病是一类可引起全球流行的感染性疾病. 据WHO统计, 2010年全球新增了880万例活动性结核患者, 死亡110万例[1]. 中国已成为全球第2大结核病负担最重的国家, 世界上12%的结核病患者生活在中国[1]. 抗结核标准短程化疗方案主要由INH、RIF、PZA和EMB 4种药物组成. 肝损伤是这些药物联合治疗期间最常出现的不良反应之一[2]. 其发生率各地报道不一, 在1%-47%之间[3]. 抗结核药物肝损伤或肝毒性(anti-tuberculosis drug-induced hepatotoxicity, ATDH)也是结核病治疗期间最严重的不良反应. ATDH的出现, 不仅增加患者身心痛苦和经济负担, 而且会造成治疗中断使疗效丧失和诱导细菌耐药, 严重者可能引起肝衰竭造成患者死亡[4]. 药物本身的毒性[5]及代谢中间产物[6]被认为在ATDH的发生中起了关键作用. 但是, 抗结核化疗患者是否出现肝毒性反应, 个体间的差异很大, 即ATDH的发生存在明显的遗传易感性[7]. 将这部分易感人群方便有效地筛选出来, 可能有助于减少甚至杜绝ATDH的发生. 为此, 我们进行了抗结核药物肝损伤和无肝损伤患者化疗前血标本miRNA芯片检测分析, 以期筛选出某个或某些差异性表达的miRNA分子, 为将来抗结核药物治疗前筛查ATDH易感者提供敏感而特异的生物学指标.
2011-08/2012-05上海交通大学附属第一人民医院松江分院感染科收治的活动性肺结核患者. 诊断标准依据2001年的《肺结核诊断和治疗指南》[8]. 所有研究对象均为抗结核初治患者, 无合并症或并发症. 治疗前均无基础肝脏疾病并排除乙型肝炎、丙型肝炎等嗜肝病毒感染和脂肪性及自身免疫性肝病等, 腹部B超显示正常, 且治疗过程中未预防性使用过护肝降酶药物. 抗结核治疗采用标准的6 mo短程化疗方案: 2HREZ/4HR. 所有患者每周至少进行一次肝功能检测.
1.2.1 标本采集: 所有患者均于抗结核药物治疗前留取血标本. ATDH的诊断标准依据文献[9]: 服药过程中, 患者血清ALT超过2倍正常上限. 随机选取3例ATDH和3例非ATDH患者治疗前血标本进行miRNA芯片检测. 其中, 男性2例, 女性1例, 年龄15-33岁之间. 另20例ATDH和非ATDH患者治疗前血标本用于证实芯片检测结果. 研究符合国家卫生部医学伦理学要求, 并经患者知情同意, 说明所采集的标本仅用于医学研究目的.
1.2.2 分离血浆: 外周血2 mL置EDTA抗凝管中, 混匀. 4 ℃, 8200 g离心10 min; 上清液移至无菌1.5 mL离心管中, 16000 g, 4℃离心10 min, 小心吸取上清到新的1.5 mL离心管中, 置-80 ℃冰箱中贮存备用.
1.2.3 总RNA抽提: 采用mirVanaTM PARISTM kit(Ambion, Austin, TX, US), 按照试剂盒说明书进行总RNA抽提. 简要操作方法如下: 625 μL血浆样品与等体积2×Denaturing Solution混匀后, 加入1.25体积无水乙醇室温下充分混匀. 将混合液加入置于收集管内的滤筒中, 离心30 s, 弃滤过液. 滤筒内加入700 μL miRNA Wash Solution 1(工作液内加有乙醇), 离心15 s, 弃滤过液. 用500 μL Wash Solution 2/3洗滤筒两次后, 离心1 min以清除滤筒内残留的液体, 更换收集管. 加入预热(95 ℃)无酶水至滤筒中心, 离心30 s. 收集洗脱液(含RNA), 贮存于-20 ℃. 采用Agilent Bioanalyzer 2100(Agilent technologies, Santa Clara, CA, US)对总RNA进行电泳质量检测.
1.2.4 miRNA标记: 采用Agilent miRNA芯片配套的试剂盒miRNA Complete Labeling and Hyb Kit(Agilent technologies, Santa Clara, CA, US), 按照说明书对样品中的miRNA分子进行荧光标记. 简要操作步骤如下: 100 ng总RNA经牛肠磷酸酶作用去磷酸化后, 加入100%DMSO使样品变性. 利用T4 RNA连接酶进行Cy3荧光标记. 反应结束后, 将样品置于真空浓缩仪中完全抽干备用.
1.2.5 miRNA芯片杂交: miRNA芯片采用Agilent技术公司提供的Agilent human miRNA(8×60 k) v18.0. 该芯片共覆盖人类成熟的miRNA 1887个, 对应探针4530个; 此外芯片还包含了7种人类病毒(HBV、HHV1、HHV4、HHV5、HHV8、HIV及HSV-2)的140个miRNA, 对应探针数417个. 每个miRNA对应的探针总重复次数30次. 数据来源于Sanger miRBase release 18.0. 杂交实验采用Agilent miRNA芯片配套的试剂盒miRNA Complete Labeling and Hyb Kit的杂交部分, 按说明书进行. 简要操作步骤为: 抽干并经标记的miRNA样品用无核酸酶水重新溶解, 加入封闭试剂. 然后, 加入杂交缓冲液并混匀. 100 ℃金属浴中加热5 min后, 冰水浴中冷却5 min, 离心收集反应液. 将45 μL反应液吸至置于Agilent SureHyb chamber底座的盖片上. 将芯片点样面(带有"Agilent"字样面)朝下缓慢放置在盖片上, 组装SureHyb chamber, 并拧紧. 将SureHyb chamber置于杂交炉, 温度55 ℃, 转速20 r/min, 滚动杂交20 h. 杂交完成后在洗缸staining dishes(Thermo Shandon, Waltham, MA, US)中洗片, 洗片所用的试剂为 Gene Expression Wash Buffer Kit (Agilent technologies, Santa Clara, CA, US).
1.2.6 芯片扫描及数据处理: 芯片结果采用Agilent Microarray Scanner(Agilent technologies, Santa Clara, CA, US)进行扫描, 用Feature Extraction software 10.7(Agilent technologies, Santa Clara, CA, US)读取数据, 软件设置Scan resolution = 5 μm, PMT 100%, 5%. 最后采用Gene Spring Software 11.0(Agilent technologies, Santa Clara, CA, US)进行归一化处理, 所用的算法为Quantile.
1.2.7 实时定量RT-PCR: 采用Sharpvue™ miRNA Assay(Biovue Technology Ltd, USA)试剂(该试剂具有经实验验证确认的All-in-One™ qPCR Primer, 可用于从一个合成反应的cDNA中检测多种miRNAs), 依据操作说明书进行. 0.05 μg总RNA, 用miRNA RT kit逆转录为第一链cDNA. 以第一链cDNA为模板, 加入qPCR Master Mix进行PCR扩增. 扩增温度设定为: 95 ℃预变性2 min, (96 ℃/5 s, 58 ℃/1 min)×3 cycles, (96 ℃/5 s, 60 ℃/30 s)×37 cycles.
1.2.8 生物信息学分析: 应用互联网上miRNA靶基因预测软件. 进入miRNA靶基因预测和功能研究数据库MiRDB(采用的预测工具为MirTarget2软件)主页(http://mirdb.org/miRDB/). 在Target Mining页面, 选择参数为靶基因预测积分(target score)超过60分. 利用各个靶基因的识别码(基因ID), 采用PANTHER tool(http://www.pantherdb.org/)查找各个靶蛋白的GO功能分类.
统计学处理 归一化后的数据输入significant analysis of microarray软件, 进行SAM分析. P<0.05且各组信号差异倍数Log2值绝对值>1(相对于原始信号之比>2倍或<0.5倍)为差异性表达的miRNA.
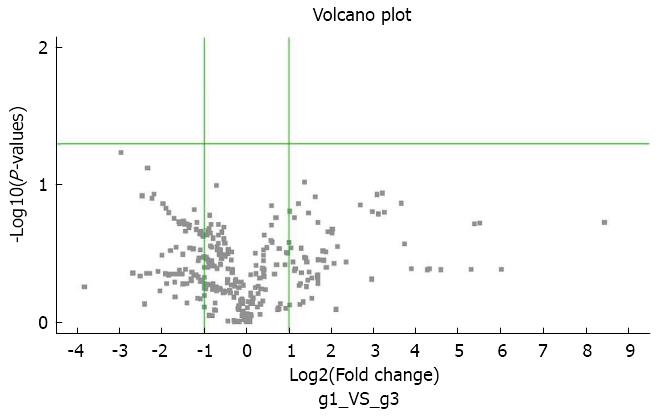
对ATDH与非ATDH患者化疗前血浆进行miRNA芯片检测, 数据采用SAM分析, 结果并未发现两者之间存在显著统计学差异的表达上调或下调的miRNA分子(差异性表达火山图如图1). 我们考虑芯片检测获得阴性结果的原因可能与检测病例数过少(仅3例)有关. 为在更大样本中进行分析检测, 我们选取了火山图中表达水平差异倍数较大且趋近左上或右上象限的miRNA分子共25个进行下一步分析检测.
对芯片检测中存在上调或下调趋势的25种miRNA分子进一步采用高通量实时荧光定量PCR分析. 结果发现, 与非ATDH患者相比, ATDH患者表达上调的miRNA有4个, 包括: miR-4284、miR-3620、miR-652-5p和miR-4800-5p; 表达下调的miRNA有3个, 包括: miR-338-3p、miR-424-5p和miR-194-5p(表1).
| No. | miRNA name | △△Ct | 2-△△Ct | Regulation |
| 1 | hsa-miR-4284 | -1.9 | 3.66 | Up |
| 2 | hsa-miR-3620 | -1.6 | 3.09 | Up |
| 3 | hsa-miR-652-5p | -1.3 | 2.50 | Up |
| 4 | hsa-miR-4800-5p | -1.1 | 2.08 | Up |
| 5 | hsa-miR-1249 | -0.9 | 1.92 | N |
| 6 | hsa-miR-3937 | -0.9 | 1.85 | N |
| 7 | hsa-miR-584-5p | -0.8 | 1.77 | N |
| 8 | hsa-miR-1226-5p | -0.8 | 1.75 | N |
| 9 | hsa-miR-4298 | -0.8 | 1.69 | N |
| 10 | hsa-miR-4655-3p | -0.6 | 1.57 | N |
| 11 | hsa-miR-1260a | -0.6 | 1.50 | N |
| 12 | hsa-miR-1224-5p | -0.6 | 1.48 | N |
| 13 | hsa-miR-577 | -0.4 | 1.29 | N |
| 14 | hsa-miR-378i | -0.2 | 1.14 | N |
| 15 | hsa-miR-663a | 0.0 | 1.03 | N |
| 16 | hsa-miR-4286 | 0.1 | 0.92 | N |
| 17 | hsa-miR-7-5p | 0.4 | 0.75 | N |
| 18 | hsa-miR-34a-5p | 0.6 | 0.66 | N |
| 19 | hsa-miR-454-3p | 0.6 | 0.65 | N |
| 20 | hsa-miR-125b-5p | 0.7 | 0.63 | N |
| 21 | hsa-miR-32-5p | 0.7 | 0.62 | N |
| 22 | hsa-miR-144-5p | 0.7 | 0.61 | N |
| 23 | hsa-miR-338-3p | 1.1 | 0.48 | Down |
| 24 | hsa-miR-424-5p | 1.1 | 0.47 | Down |
| 25 | hsa-miR-194-5p | 1.3 | 0.39 | Down |
表达上调的miRNA分子进靶基因预测. 将miR-4284、miR-3620、miR-652-5p和miR-4800-5p同时输入搜寻框内, 下拉菜单选择"human". 结果显示, 靶基因预测积分超过60分者共有264个基因. 其中, 积分超过80分的靶基因共33个(表2). 利用每个靶基因的身份识别码(基因ID), 用PANTHER tool查找各个靶蛋白的GO功能分类(表2).
| 序号 | miRNA | 积分 | 靶基因 | 基因全称 | GO生物学功能 |
| 1 | hsa-miR-4800-5p | 100 | ITGB1BP1 | integrin beta 1 binding protein 1 | 整合素结合蛋白, 细胞黏附功能 |
| 2 | hsa-miR-4284 | 99 | GNG13 | guanine nucleotide binding protein (G protein), gamma 13 | 水解酶; G蛋白耦联受体蛋白 |
| 3 | hsa-miR-4284 | 98 | VPS53 | vacuolar protein sorting 53 homolog (S. cerevisiae) | 线粒体内膜蛋白, 参与脂质代谢过程 |
| 4 | hsa-miR-4284 | 98 | MAVS | mitochondrial antiviral signaling protein | 线粒体信号蛋白 |
| 5 | hsa-miR-4284 | 97 | ORAI2 | ORAI calcium release-activated calcium modulator 2 | 钙释放激活钙调素 |
| 6 | hsa-miR-652-5p | 94 | SEC14L1 | SEC14-like 1 (S. cerevisiae) | 胆固醇代谢转运/携带蛋白 |
| 7 | hsa-miR-4284 | 93 | SPN | sialophorin | 炎细胞表面糖蛋白, 负调控免疫应答 |
| 8 | hsa-miR-4284 | 91 | LOC100653346 | uncharacterized LOC100653346 | 功能不清 |
| 9 | hsa-miR-4284 | 91 | TMEM120B | transmembrane protein 120B | 物质代谢过程 |
| 10 | hsa-miR-4284 | 90 | CYP20A1 | cytochrome P450, family 20, subfamily A, polypeptide 1 | 氧化酶 |
| 11 | hsa-miR-4284 | 89 | OPA3 | optic atrophy 3 (autosomal recessive, with chorea and spastic paraplegia) | 线粒体外膜蛋白 |
| 12 | hsa-miR-4284 | 89 | CDK17 | cyclin-dependent kinase 17 | 非受体丝/苏氨酸蛋白激酶 |
| 13 | hsa-miR-4284 | 89 | RAB3B | RAB3B, member RAS oncogene family | 小分子GTP结合蛋白, RAB家族成员 |
| 14 | hsa-miR-652-5p | 88 | SLC25A24 | solute carrier family 25 (mitochondrial carrier; phosphate carrier), member 24 | 线粒体携带因子 |
| 15 | hsa-miR-4284 | 88 | PLA2R1 | phospholipase A2 receptor 1, 180 kDa | 磷酯酶A2受体 |
| 16 | hsa-miR-3620 | 88 | USP46 | ubiquitin specific peptidase 46 | 丝氨酸蛋白酶; 泛素-蛋白质连接酶 |
| 17 | hsa-miR-3620 | 87 | PUM1 | pumilio homolog 1 (Drosophila) | 翻译因子 |
| 18 | hsa-miR-4800-5p | 87 | DTL | denticleless homolog (Drosophila) | 核基质相关蛋白 |
| 19 | hsa-miR-4284 | 86 | ZNF292 | zinc finger protein 292 | 核酸酶; 转录因子 |
| 20 | hsa-miR-4284 | 86 | PLIN5 | perilipin 5 | 脂质转运/携带蛋白 |
| 21 | hsa-miR-4284 | 86 | ENAH | Enabled homolog (Drosophila) | 细胞骨架结构成份 |
| 22 | hsa-miR-4284 | 85 | RAB3IP | RAB3A interacting protein (rabin3) | 鸟苷酸交换因子; 信号转导 |
| 23 | hsa-miR-3620 | 85 | ACPP | acid phosphatase, prostate | 磷酯酶 |
| 24 | hsa-miR-652-5p | 83 | TLR7 | toll-like receptor 7 | Toll受体信号通路 |
| 25 | hsa-miR-652-5p | 83 | RRAS2 | related RAS viral (r-ras) oncogene homolog 2 | 小GTP酶 |
| 26 | hsa-miR-3620 | 83 | GPBP1L1 | GC-rich promoter binding protein 1-like 1 | 功能不清 |
| 27 | hsa-miR-4284 | 82 | RLIM | ring finger protein, LIM domain interacting | E3泛素蛋白连接酶, 可调控细胞迁移 |
| 28 | hsa-miR-3620 | 82 | INSIG2 | insulin induced gene 2 | 胆固醇代谢过程 |
| 29 | hsa-miR-4284 | 82 | ZFR2 | zinc finger RNA binding protein 2 | RNA结合蛋白 |
| 30 | hsa-miR-652-5p | 81 | UTS2D | urotensin 2 domain containing | 功能不清 |
| 31 | hsa-miR-652-5p | 81 | PRKCA | protein kinase C, alpha | 非受体丝/苏氨酸蛋白激酶 |
| 32 | hsa-miR-3620 | 81 | TSPAN9 | tetraspanin 9 | 膜结合信号分子; 受体; 细胞黏附分子 |
| 33 | hsa-miR-4284 | 80 | AAK1 | AP2 associated kinase 1 | 非受体丝/苏氨酸蛋白激酶 |
抗结核药物肝毒性是结核病临床治疗过程中十分常见且严重的药物毒副反应. 近二十余年来, 结核病研究人员一直在致力于ATDH易感人群的研究, 期望能从中寻找到某个或某些特异性的预测因子. 这项工作在临床工作中的重要意义显而易见, 因为抗结核治疗前对易感人群的预测, 有助于减少甚至避免ATDH的发生. 药物代谢酶基因或其相关基因多态性的研究是近年ATDH易感者筛查的主要方向. N-乙酰转移酶(N-acetyl-transferase, NAT2)和细胞色素P450酶(如CYP2E1)基因多态性的研究较多. 研究显示, NAT2多态性(慢乙酰化状态)与ATDH易感性间有密切的相关性[10]. 对于NAT2慢乙酰化型患者, 异烟肼可经由另一条通路, 即CYP2E1通路进行代谢, 产生毒性代谢产物, 引起ATDH[11], 但另一项研究并未发现NAT2慢乙酰化状态与ATDH易感性之间的相关关系[12]. CYP2E1多态性, 即c1/c1基因型与ATDH易感性之间是否相关, 也存在争论[10]. 由于谷胱甘肽S-转移酶(glutathione S-transferase, GST)在清除氧自由基和细胞保护方面的重要作用, 对GST两种亚型GSTT1和GSTM1多态性的研究曾一度成为关注的焦点. 文献显示, GSTTM1 *0/*0 (null)或GSTT1 null基因型的患者易发生ATDH[13,14], 但最近的一项研究指出, GSTM1 *0/*0或GSTT1 *0/*0甚或两个等位基因同时缺失的患者, 其ATDH的发生率也无明显增加[15]. 因此, 目前仍缺少预测ATDH易感者的检测指标.
已知, 在细胞功能与代谢酶基因的调控中, microRNA(miRNA)分子起了关键作用[16,17]. 因此, 在本项目中, 我们对服用抗结核药物后发生肝损伤和未发生肝损伤的肺结核患者化疗前血浆进行了miRNA高通量微阵列分析. 芯片检测结果并未筛查出两者间存在差异性表达升高/降低的miRNA. 我们对实验结果进行了认真仔细的分析和讨论, 认为芯片得出阴性结果可能与病例数过少(各3例患者), 难以获得有统计学价值的数据有关. 我们进一步对实验结果进行了比对, 对其中存在上调/下调趋势的25个miRNA分子在较大的样本中(各20例患者)采用高通量实时荧光定量PCR进行分析验证. 我们发现, 肝损伤与无肝损伤患者之间有7个miRNA分子存在差异性表达. 其中, miR-4284、miR-3620、miR-652-5p和miR-4800-5p在ATDH患者表达上调, miR-338-3p、miR-424-5p和miR-194-5p在ATDH患者表达下调.
对在ATDH患者化疗前表达上调的miR-4284、miR-3620、miR-652-5p和miR-4800-5p进行靶基因预测和GO生学物功能分析显示, 4种miRNA分子主要调控的蛋白质有以下几类: (1)脂质/胆固醇转运和物质代谢相关蛋白质: EC14L1、TMEM120B、PLIN5、INSIG2. 其中PLIN5是细胞内脂滴包被蛋白, 可运载脂滴至线粒体内完成脂肪酸氧化[18]; INSIG2是内质网蛋白, 参与脂肪酸调控和胆固醇合成[19]; (2)线粒体功能相关蛋白: VPS53、MAVS、OPA3、SLC25A24. 其中, MAVS是产生抗病毒信号的重要接头分子, 参与固有免疫反应, 可诱导I型干扰素生成[20]; OPA3是线粒体外膜蛋白, 其变异蛋白(G93S)高表达可诱导线粒体碎裂[21]; SLC25A24是着床于线粒体内膜的运载蛋白, 在新陈代谢中发挥着重要作用[22]; (3)各种酶类: GNG13、CYP20A1、USP46、ZNF292、ACPP、RRAS2、RLIM、PRKCA、AAK1. 其中, CYP20A1是细胞色素P450超家族, 为单氧化物酶, 主要催化药物代谢、胆固醇、类固醇和脂质等的合成反应[23]; USP46属于丝氨酸蛋白酶家族, 主要起去泛素化酶的作用[24]; RRAS2是Ras样小GTP酶的R-Ras超家族的成员, 主要结合于浆膜起信号转导的作用. 已证实其在激活调控细胞增殖的信号转导通路中起关键作用[25,26]; PPKCA是蛋白激酶C(protein kinase C, PKC)家族的一员, 已证实其在许多不同细胞效应过程, 包括细胞黏附、细胞转化、细胞周期检查点和细胞体积调控等中起重要作用[27]; (4)细胞表面糖蛋白和黏附分子: ITGB1B1、SPN、TSPAN9. 其中, ITGB1B1可特异性地结合于beta1-整合素的胞浆结构域, 对beta1-整合素的亲合作用起负调控作用, 从而在细胞黏附中起关键作用[28]; SPN又称CD43, 是淋巴细胞、单核细胞、胸腺细胞和粒细胞表面的涎酸糖蛋白, 在获得性免疫应答过程中起负调控作用[29,30]; (5)细胞表面受体: PLA2R1、TLR7. 其中, TLR7是Toll样受体家族的成员, 该家族在病原体识别和固有免疫激活方面有重要作用, 能识别病原体相关分子模式(pathogen-associated molecular patterns, PAMPs), 介导细胞因子产生. TLR7可被Ⅰ型干扰素诱导表达, 调控炎症反应和促进免疫反应[31]; (6)细胞骨架成分: ENAH. 总之, 这些靶蛋白在脂质/胆固醇代谢和转运、线粒体能量供给、细胞形态维持、信号转导以及炎性细胞黏附和免疫应答调控等方面有重要影响. 上述4种miRNA分子对这些靶蛋白的调控作用, 有可能促进了肺结核患者对ATDH的易感性. 因此, 通过检测血浆miR-4284、miR-3620、miR-652-5p和miR-4800-5p(特别是miR-4284)可能对拟联合化疗的肺结核患者肝毒性的产生进行预测. 对上述4种或其中一种miRNA分子(特别是miR-4284)表达升高者, 需调整化疗药物剂量或改变化疗方案, 以减少或避免ATDH的发生.
另外, 在ATDH患者表达下调的miR-338-3p、miR-424-5p和miR-194-5p有可能是一些肝保护性因子. 其表达的下调, 可能进一步增强了肺结核患者对ATDH的易感性. 将来, 通过补充这些下调的miRNA分子, 可望预防ATDH的发生, 甚至可能作为一种治疗手段, 促进ATDH患者损伤肝组织的修复.
抗结核药物肝毒性(anti-tuberculosis drug-induced hepatotoxicity, ATDH)是结核病治疗期间最常见且严重的不良反应, 其不仅增加患者身心痛苦和经济负担, 而且会造成治疗中断使疗效丧失和诱导细菌耐药, 严重者可能引起肝衰竭造成患者死亡. 近二十余年来, 结核病研究人员一直在致力于ATDH易感人群的研究, 期望能从中寻找到某个或某些特异性的预测因子, 以减少甚至避免ATDH的发生. 药物代谢酶基因或其相关基因多态性的研究是近年ATDH易感者筛查的主要方向. 但不同的研究者得出了不同甚至相反的结论. 因此, 目前仍缺少ATDH易感性的预测指标. miRNA分子是细胞功能与代谢酶基因调控的关键分子, 其在血循环中差异性的表达可能有助于ATDH易感染人群的筛查.
戴朝六, 教授, 中国医科大学第二临床学院(盛京医院)肝胆外科; 张占卿, 主任医师, 上海市(复旦大学)公共卫生中心(肝脏病学, 传染病学)
ATDH发生的病理生理学机制及其易感人群识别和筛查研究是结核病治疗研究焦点和前沿.
研究成果可应用于ATDH易感患者筛查、ATDH治疗及其病理生理学机制的探讨.
本文反映了目前ATDH领域研究的新进展, 有较为重要的学术价值.
编辑: 田滢 电编:鲁亚静
| 1. | World Health Organization. Global tuberculosis control: World Health Organization Report 2011. ANZJPH. 2012;36:497-498. [DOI] |
| 2. | Senousy BE, Belal SI, Draganov PV. Hepatotoxic effects of therapies for tuberculosis. Nat Rev Gastroenterol Hepatol. 2010;7:543-556. [PubMed] [DOI] |
| 3. | Wang PY, Xie SY, Hao Q, Zhang C, Jiang BF. NAT2 polymorphisms and susceptibility to anti-tuberculosis drug-induced liver injury: a meta-analysis. Int J Tuberc Lung Dis. 2012;16:589-595. [PubMed] [DOI] |
| 4. | Tost JR, Vidal R, Caylà J, Díaz-Cabanela D, Jiménez A, Broquetas JM. Severe hepatotoxicity due to anti-tuberculosis drugs in Spain. Int J Tuberc Lung Dis. 2005;9:534-540. [PubMed] |
| 5. | Hein DW. Molecular genetics and function of NAT1 and NAT2: role in aromatic amine metabolism and carcinogenesis. Mutat Res. 2002;506-507:65-77. [PubMed] |
| 6. | Sunahara S. Genetical and geographic studies on isoniazid inactivation. Science. 1961;134:1530-1531. [PubMed] |
| 7. | Li C, Long J, Hu X, Zhou Y. GSTM1 and GSTT1 genetic polymorphisms and risk of anti-tuberculosis drug-induced hepatotoxicity: an updated meta-analysis. Eur J Clin Microbiol Infect Dis. 2013;32:859-868. [PubMed] [DOI] |
| 9. | Bénichou C. Criteria of drug-induced liver disorders. Report of an international consensus meeting. J Hepatol. 1990;11:272-276. [PubMed] |
| 10. | Cho HJ, Koh WJ, Ryu YJ, Ki CS, Nam MH, Kim JW, Lee SY. Genetic polymorphisms of NAT2 and CYP2E1 associated with antituberculosis drug-induced hepatotoxicity in Korean patients with pulmonary tuberculosis. Tuberculosis (Edinb). 2007;87:551-556. [PubMed] |
| 11. | Huang YS, Chern HD, Su WJ, Wu JC, Chang SC, Chiang CH, Chang FY, Lee SD. Cytochrome P450 2E1 genotype and the susceptibility to antituberculosis drug-induced hepatitis. Hepatology. 2003;37:924-930. [PubMed] |
| 12. | Vuilleumier N, Rossier MF, Chiappe A, Degoumois F, Dayer P, Mermillod B, Nicod L, Desmeules J, Hochstrasser D. CYP2E1 genotype and isoniazid-induced hepatotoxicity in patients treated for latent tuberculosis. Eur J Clin Pharmacol. 2006;62:423-429. [PubMed] |
| 13. | Huang YS, Su WJ, Huang YH, Chen CY, Chang FY, Lin HC, Lee SD. Genetic polymorphisms of manganese superoxide dismutase, NAD(P)H: quinone oxidoreductase, glutathione S-transferase M1 and T1, and the susceptibility to drug-induced liver injury. J Hepatol. 2007;47:128-134. [PubMed] |
| 14. | Leiro V, Fernández-Villar A, Valverde D, Constenla L, Vázquez R, Piñeiro L, González-Quintela A. Influence of glutathione S-transferase M1 and T1 homozygous null mutations on the risk of antituberculosis drug-induced hepatotoxicity in a Caucasian population. Liver Int. 2008;28:835-839. [PubMed] [DOI] |
| 15. | Chatterjee S, Lyle N, Mandal A, Kundu S. GSTT1 and GSTM1 gene deletions are not associated with hepatotoxicity caused by antitubercular drugs. J Clin Pharm Ther. 2010;35:465-470. [PubMed] |
| 16. | Whittaker R, Loy PA, Sisman E, Suyama E, Aza-Blanc P, Ingermanson RS, Price JH, McDonough PM. Identification of MicroRNAs that control lipid droplet formation and growth in hepatocytes via high-content screening. J Biomol Screen. 2010;15:798-805. [PubMed] [DOI] |
| 17. | Chen X, Murad M, Cui YY, Yao LJ, Venugopal SK, Dawson K, Wu J. miRNA regulation of liver growth after 50% partial hepatectomy and small size grafts in rats. Transplantation. 2011;91:293-299. [PubMed] [DOI] |
| 18. | Bosma M, Minnaard R, Sparks LM, Schaart G, Losen M, de Baets MH, Duimel H, Kersten S, Bickel PE, Schrauwen P. The lipid droplet coat protein perilipin 5 also localizes to muscle mitochondria. Histochem Cell Biol. 2012;137:205-216. [PubMed] [DOI] |
| 19. | Hubáček JA, Suchánek P, Lánská V, Piťha J, Adámková V. INSIG2 G-102A promoter variant exhibits context-dependent effect on HDL-cholesterol levels but not on BMI in Caucasians. Folia Biol (Praha). 2011;57:170-172. [PubMed] |
| 20. | Xing F, Matsumiya T, Onomoto K, Hayakari R, Imaizumi T, Yoshida H, Yoneyama M, Fujita T, Satoh K. Foreign RNA induces the degradation of mitochondrial antiviral signaling protein (MAVS): the role of intracellular antiviral factors. PLoS One. 2012;7:e45136. [PubMed] [DOI] |
| 21. | Ryu SW, Jeong HJ, Choi M, Karbowski M, Choi C. Optic atrophy 3 as a protein of the mitochondrial outer membrane induces mitochondrial fragmentation. Cell Mol Life Sci. 2010;67:2839-2850. [PubMed] [DOI] |
| 22. | Palmieri F. The mitochondrial transporter family SLC25: identification, properties and physiopathology. Mol Aspects Med. 2013;34:465-484. [PubMed] [DOI] |
| 23. | Werck-Reichhart D, Feyereisen R. Cytochromes P450: a success story. Genome Biol. 2000;1:REVIEWS3003. [PubMed] |
| 24. | Cohn MA, Kee Y, Haas W, Gygi SP, D'Andrea AD. UAF1 is a subunit of multiple deubiquitinating enzyme complexes. J Biol Chem. 2009;284:5343-5351. [PubMed] [DOI] |
| 25. | Delgado P, Cubelos B, Calleja E, Martínez-Martín N, Ciprés A, Mérida I, Bellas C, Bustelo XR, Alarcón B. Essential function for the GTPase TC21 in homeostatic antigen receptor signaling. Nat Immunol. 2009;10:880-888. [PubMed] [DOI] |
| 26. | Rong R, He Q, Liu Y, Sheikh MS, Huang Y. TC21 mediates transformation and cell survival via activation of phosphatidylinositol 3-kinase/Akt and NF-kappaB signaling pathway. Oncogene. 2002;21:1062-1070. [PubMed] |
| 27. | Kang JH, Mori T, Kitazaki H, Niidome T, Takayama K, Nakanishi Y, Katayama Y. Kinase activity of protein kinase cα in serum as a diagnostic biomarker of human lung cancer. Anticancer Res. 2013;33:485-488. [PubMed] |
| 28. | Bouvard D, Vignoud L, Dupé-Manet S, Abed N, Fournier HN, Vincent-Monegat C, Retta SF, Fassler R, Block MR. Disruption of focal adhesions by integrin cytoplasmic domain-associated protein-1 alpha. J Biol Chem. 2003;278:6567-6574. [PubMed] |
| 29. | Miki Y, Oguri E, Hirano K, Beppu M. Macrophage recognition of cells with elevated calcium is mediated by carbohydrate chains of CD43. Cell Struct Funct. 2013;38:43-54. [PubMed] |
| 30. | Oguri E, Miki Y, Hirano K, Yamanaka M, Beppu M. Clearance of CD43-capped cells by macrophages: capping alone leads to phagocytosis. Biol Pharm Bull. 2012;35:551-558. [PubMed] |
| 31. | Khoo JJ, Forster S, Mansell A. Toll-like receptors as interferon-regulated genes and their role in disease. J Interferon Cytokine Res. 2011;31:13-25. [PubMed] [DOI] |